Sarcopenia, Obesidad Sarcopénica y Papel del Ejercicio Físico
Juan Ramón Heredia Elvar, Felipe Isidro Donate, Fernando Mata, Guillermo Peña García-Orea, Victor Segarra Nunez, Susana Moral0 Instituto Internacional de Ciencias Ejercicio Físico, la Salud y el Fitness (ICEFSF).
Resumen
El envejecimiento se relaciona con cambios en la composición corporal, y uno de estos cambios es la sarcopenia. La sarcopenia, es considerada la pérdida de masa muscular esquelética que se produce con la edad, siendo uno de los principales factores que inducen un deteriodo en la calidad de vida de los individuos afectados, que además incidirá en la creación de un círculo negativo que provoca una inactividad física progresiva y acelerará la pérdida de músculo. Actualmente en la propia definición de este proceso se considera también la pérdida de fuerza (dinapenia) y la disminución de la capacidad de rendimiento físico. Parece incluso, actualmente, que las evidencias muestran la importancia de la pérdida de fuerza como, incluso, más relevante que la propia pérdida de masa muscular. El principio de reversibilidad (“se utiliza o se pierde”) definitivamente se aplica en el contexto de la sarcopenia. Si bien, la pérdida de tejido muscular es una consecuencia normal del envejecimiento, la reducción en la actividad física puede acelerar esta pérdida. Además, existen evidencias que parecen apuntar hacia una cierta “relación” entre sarcopénia y obesidad. Es por ello que en este artículo se expondrán los fundamentos relacionados con estos procesos, su posible relación y la importancia del entrenamiento de fuerza adecuado para lograr intervenir sobre los mismos.
Palabras Clave: Fuerza, masa muscular, tejido adiposo
INTRODUCCIÓN
Tras alcanzar la edad adulta, los seres humanos y la mayoría de los mamíferos sufren un declive progresivo de la fuerza y masa muscular a medida que transcurre el tiempo (Beas-Jiménez et al., 2011). Dicho declive comienza progresivamente alrededor de los 30 años de edad, con una pérdida especialmente acelerada después de los 60 años (Rantanen et al., 1998; Bassey, 1998; Frontera et al., 2000). Esta situación es acompañada por una pérdida de capacidad funcional y un aumento de la grasa en el músculo. Todos esto factores tienen substanciales repercusiones negativas en la calidad de vida de las personas mayores, siendo causa de debilidad, dependencia y un aumento de la morbi-mortalidad (Walsh et al., 2006; Abate et al., 2007; Liu-Ambrose et al., 2009).
Este progresivo proceso degenerativo de la función muscular, en su estructura y función, es conocido como sarcopenia (del griego sarco: músculo, y penia: pérdida). Los principales puntos de corte usados en la mayoría de los estudios para definir la sarcopenia vienen determinados por Baumgartner et al. (1998) y Janssen et al. (2002). Baumgartner definió la sarcopenia como la masa muscular esquelética apendicular dividida por la altura al cuadrado en metros (índice de masa muscular) dos desviaciones estándar o más por debajo de los valores de referencia para individuos jóvenes y saludables, medida con absorciometría fotónica dual de rayos X (DXA). Por su parte, Janssen propuso convertir la masa muscular esquelética absoluta (kg) en porcentaje del peso (masa muscular/masa corporal x 100) y definir sarcopenia como más de una desviación estándar por debajo de los valores de referencia para individuos jóvenes y saludables determinada mediante impedancia bioeléctrica. El hecho de que todavía no exista un consenso en el nivel de masa muscular por debajo del cual diagnosticar la sarcopenia, hace que la prevalencia de esta patología pueda tener grandes variaciones entre estudios.
Sin embargo, la tendencia actual incluye en el cuadro sarcopénico, no sólo la pérdida de masa muscular por debajo de unos valores de referencia de sujetos jóvenes sanos, sino también otros parámetros relacionados con la fuerza, la capacidad funcional y la cantidad de grasa corporal (Bouchard et al., 2009; Jensen y Hsiao, 2010). Así, esta concepción más amplia del deterioro progresivo que supone la sarcopenia, distingue entre un proceso dependiente de la edad (sarcopenia primaria) y un proceso patológico (sarcopenia secundaria) ((Beas-Jiménez et al., 2011, Pahor et al., 2009; Rolland et al., 2008).
ETIOLOGÍA DE LA SARCOPENIA EN LAS PERSONAS MAYORES
Está sobradamente documentado que la masa muscular alcanza su máxima cantidad, por el desarrollo madurativo natural, alrededor de los 30 años, y que a partir de ahí, su ritmo de declive ronda los 3-8% por década de vida. Dicho declive se acelera especialmente a partir de los 50-60 años, llegando a suponer el 12-15% o incluso más por década (Serra, 2006; Burgos, 2006; Rolland et al., 2008), afectando más a las mujeres postmenopáusicas que a los hombres. Paralelamente a este declive estructural de masa magra se da un declive proporcional de la capacidad de producir fuerza por fibra muscular (Serra, 2006; Morse et al., 2004), lo que sin duda será causa de debilidad y pérdida de capacidad funcional. Igualmente, si comparamos las mujeres con una densidad mineral ósea normal, con aquellas que sufren de osteopenia u osteoporosis en la misma franja de edad, es fácil comprobar cómo en estas últimas es más frecuente que también sufran de sarcopenia (Walsh et al., 2006). Esta relación entre pérdida de masa ósea, masa muscular, incluso fuerza, se debe probablemente a mecanismos etiológicos relacionados (Perrini et al., 2010). Dicho esto, podemos especular que mediante la práctica regular de ejercicio físico capaz de mantener o aumentar la masa muscular u ósea podemos mantener o aumentar la masa ósea o muscular en personas mayores con osteopenia u osteoporosis.
La sarcopenia asociada a la edad parece depender del proceso de inflamación crónica que afecta a la mayoría de personas mayores, agravado por la infiltración de grasa en el músculo y la obesidad sarcopénica (Adamo et al., 2006; Nicklas y Brinkley, 2009). Los dos mecanismos implicados en el descenso de la masa muscular en los seres humanos son la pérdida/reducción del número de fibras musculares y la reducción en el área de sección transversal de las fibras restantes.
Sobre el primer mecanismo sabemos que, además, el paso de los años no afecta por igual a todo los tipos de fibras, siendo las fibras tipo II las que más se ven afectadas. Este hecho conlleva en consecuencia una importante incapacidad funcional por la mayor capacidad de este tipo de fibras de producir fuerza explosiva y potencia (Adamo et al., 2006; Verdijk et al., 2007). Esto es debido a la menor resistencia de este tipo de fibras a la denervación, a las deficiencias en la expresión genética de miosina tipo II, y a la menor resistencia frente al estrés oxidativo (Balagopal et al., 2001; Jones et al., 2009). Todos estos mecanismos podrían estar relacionados con un déficit de testosterona encontrado en las personadas mayores (Verdijk et al., 2007).
La reducción en la cantidad de fibras musculares es debido también a factores intrínsecos en los miocitos (Beas-Jiménez et al., 2011). Igualmente, en las personas mayores la disfunción de la mitocondrias musculares está acelerada. Dicho efecto perjudicial es causado por la acumulación de daño al ADN, que a su vez, afecta negativamente al ritmo metabólico, la síntesis proteica y la producción de ATP. Todos estos efectos culminan en la muerte de la fibra muscular (Waters et al., 2003; Rolland et al., 2008). Además, los mecanismos reparadores de la fibra muscular también están comprometidos en las personas mayores debido a la menor actividad de las células satélite, la inflamación crónica, el estrés oxidativo, y la respuesta anormal de la microADN oxidativo (Jones et al., 2009; Dargelos et al., 2008; Peake et al., 2010).
Por otro lado, sabemos que el músculo envejecido sufre un retraso en el pico de contracción muscular, un incremento en el tiempo de relajación muscular, una disminución en la producción de fuerza y una reducción de la capacidad metabólica oxidativa (Ishiguro et al., 2006).
Como se ha podido ver, todas estas causas esgrimidas permiten afirmar la etiología multifactorial de la sarcopenia (factores neuronales, musculares, genéticos, nutricionales, endocrinos, de estilo de vida, etc.).
LA OBESIDAD SARCOPÉNICA
El descenso de la masa muscular que acontece a lo largo del proceso de envejecimiento no es un fenómeno aislado, sino que está fuertemente ligado a un paralelo aumento de la masa grasa (Gallaghe et al., 2000). De hecho, hay una buena razón para sospechar que la sarcopenia y la obesidad se refuerzan mutuamente a distintos niveles, tanto en lo comportamental como en lo biológico (Roubenoff, 2000). A medida que la persona envejece, sus niveles de actividad física se reducen, disminuyéndose así el efecto trófico más importante sobre el músculo, mientras que simultáneamente se predispone a las personas a tener un balance calórico positivo y por tanto ganar peso graso. A parte de esto, la pérdida de tejido muscular reduce la musculatura disponible receptora donde la insulina pueda actuar, facilitando el desarrollo de la resistencia insulínica, y lo que en última instancia, puede incluso promover a desarrollar el síndrome metabólico y la obesidad (Reaven, 1998).
Debido a esta actuación sinérgica del tejido graso y muscular, en personas mayores aparece un nuevo concepto de vital importancia desde el punto de vista de la salud y su relación con el grado de dependencia que tendrán las personas mayores: la obesidad sarcopénica. Debido a la relativa novedad de este concepto, todavía no existe un consenso en cuanto a su cálculo y por ello actualmente existen diferentes definiciones de la misma, que pueden hacer variar los resultados encontrados entre estudios (Gomez-Cabello et al., 2012). A pesar de que la primera mención que se encuentra en la literatura científica del término obesidad sarcopénica parece ser un trabajo publicado por Heber et al. (1996), no sería hasta años posteriores cuando otros autores la definieran de forma más precisa. Según Baumgartner et al. (1998), la obesidad sarcopénica se define como la presencia simultánea de una masa muscular esquelética 2 desviaciones estándar por debajo de la media para población joven (< 7,26 kg/m2 en hombres y < 5,45 kg/m2 en mujeres) y un porcentaje de grasa corporal mayor que la mediana (>27% en hombres y > 38% en mujeres).
Un estudio más reciente realizado por Kim et al. (2009) desarrolló una nueva fórmula para definir la obesidad sarcopénica usando la definición previa de Janssen para determinar la sarcopenia (porcentaje de masa muscular menor del 35,7% y 30,7% del peso total, hombres y mujeres respectivamente) y la de Davison para determinar la obesidad (porcentaje de masa grasa superior al 20,1% en hombres y 31,7% en mujeres).
Al igual que ocurre con la sarcopenia, la incidencia de este nuevo concepto depende en gran medida de la ecuación utilizada (Kim et al., 2009), pudiendo variar entre un 3 y un 17,7% entre diferentes estudios (Stenholm et al., 200).
CONSECUENCIAS DE LA OBESIDAD SARCOPÉNICA O SÍNDROME DE OBESIDAD-DISFUNCIÓN MUSCULAR
Las evidencias disponibles indican que cuando la obesidad y la disfunción muscular coexisten actúan sinérgicamente sobre el riesgo de desarrollar múltiples problemas de salud relacionados (Stenholm et al., 2008a). Parece lógico pensar que aquellos sujetos con una fuerza muscular proporcionalmente baja a su masa corporal tengan mayor riesgo de desarrollar discapacidad física en el futuro, ya que ante la misma carga de trabajo, el gasto calórico, el consumo de oxígeno y la fuerza muscular requerida por un obeso es mayor que aquella requerida por una persona con normopeso, lo que potencialmente puede limitar su rendimiento físico (Hulens et al., 2001).
Sin embargo, son pocos los estudios que hayan considerado el efecto combinado de obesidad y pobre masa muscular o fuerza en personas mayores sobre su capacidad funcional. Por ejemplo, Baumgarther et al. (2004) vieron que los sujetos mayores participantes de su estudio con obesidad sarcopénica al inicio del programa tuvieron 2 veces más de riesgo de presentar discapacidad/limitación funcional en las actividades de la vida cotidiana de tipo instrumental que aquellos que no presentaban obesidad sarcopénica al inicio. No obstante, algunos otros estudios transversales con muestras de mujeres mayores no encontraron tal relación entre obesidad sarcopénica y limitación funcional (Zoico et al., 2004), sino que sólo entre obesidad a solas (sin sarcopenia) y declive funcional.
El uso de la masa muscular como indicador de sarcopenia, en vez de una baja fuerza muscular o capacidad contráctil, podría explicar parcialmente por qué algunos estudios de este tipo no encuentran una asociación negativa entre obesidad sarcopénica y rendimiento físico (Stenholm et al., 2008a). Sólo algunos pocos estudios han tratado el efecto combinado de obesidad y baja fuerza muscular como marcador de sarcopenia - en vez de la masa muscular - sobre distintas actividades físicas cotidianas. Stenholm et al. (2008b) encontraron que aquellos sujetos que presentaban ambas enfermedades poseían mayores limitaciones en la marcha que los que sólo presentaban un alto grado de grasa corporal o de baja fuerza muscular. Por su parte, Rantanen et al. (2000) encontraron un mayor riesgo de mortalidad asociado a sujetos obesos (IMC>30) que a su vez tenían poca fuerza muscular de prensión manual. Estos autores vieron que aquellos sujetos con sobrepeso/obesidad y con menor fuerza prensora tenían un riesgo de mortalidad 1.39 veces mayor que aquellos con normopeso y con mayor fuerza prensora.
EL EJERCICIO FÍSICO COMO MEDIDA PREVENTIVA Y PALIATIVA DE LA SARCOPENIA EN PERSONAS MAYORES
Tanto el ejercicio físico, como la nutrición y los tratamientos farmacológicos han sido propuestos como los mecanismos de prevención y tratamiento de la sarcopenia (Beas-Jiménez et al., 2011). Sin embargo, hasta la fecha, los procedimientos farmacológicos no han demostrado ser eficaces en la prevención de la sarcopenia en seres humanos ((Beas-Jiménez et al., 2011, Visvanathan y Chapman, 2010). Por el contrario, las medidas preventivas consistentes en la práctica regular de ejercicio físico y una dieta equilibrada durante toda la vida de las personas parecen ser los únicos medios de enlentecer y paliar el deterioro muscular y funcional que supone la sarcopenia.
Se han visto incrementos de masa muscular (hipertrofia muscular), fuerza y capacidad funcional tras la realización de programas de ejercicio con diferentes protocolos (Rolland et al., 2008; Abellan et al., 2009; Jones et al., 2009; Waters et al., 2003; Liu et al., 2009; Hunter et al., 2004; Macaluso y De vito, 2004; Marini et al., 2008). Así, el ejercicio de mayor intensidad está generalmente considerado como el enfoque preferido para contrarrestar el declive muscular asociado con la edad, frente a las modalidades de actividades físicas de baja a moderada intensidad como el andar. Este hecho es particularmente relevante para preservar la capacidad funcional de las extremidades inferiores. Concretamente, la debilidad muscular en las extremidades inferiores es un colaborador primario independiente de la reducción de la velocidad de la marcha (Buchner et al., 1997), las caídas (Wolfson et al., 1995), la discapacidad funcional (Janssen et. al., 2002), y la debilidad en las personas mayores (Vanitallie, 2003).
Dicho esto, es en especial el ejercicio de fuerza o contra resistencias el que ha demostrado mayor eficacia en el tratamiento y prevención de la sarcopenia, y al que mayor atención se está prestando desde la comunidad científica en los últimos años. Puesto que la fuerza muscular y la masa magra son predictores de invalidez y déficit funcional (Janssen et. al., 2002), el entrenamiento de fuerza está considerado habitualmente como la mejor modalidad de ejercicio para preservar la capacidad funcional del sistema muscular, sin menospreciar los beneficios emanados del entrenamiento de otros componentes (resistencia aeróbica, equilibrio, flexibilidad). De hecho, hay una fuerte asociación entre el déficit de fuerza y la capacidad de rendimiento reducida (Bassey y Harries, 1993). Y es que el entrenamiento de fuerza no sólo ha demostrado ser particularmente efectivo para aumentar la fuerza y el tejido muscular magro sino que también seguro para el adulto mayor (Frontera et al., 1988; Hakkinen et al., 1998, 2001). Distintas investigaciones han informado que incluso después de cortas exposiciones al entrenamiento de fuerza, el ritmo de la síntesis proteica en sujetos mayores se ve incrementado y la respuesta adaptativa neuromuscular es similar a la de sujetos jóvenes (Yarasheski et al., 1993; Newton et al., 2002).
CONSIDERACIONES SOBRE LA PRESCRIPCIÓN DEL EJERCICIO DE FUERZA PARA PERSONAS MAYORES
En realidad ha venido existiendo poco consenso científico sobre la apropiada estrategia de prescripción y/o progresión de la dosis de entrenamiento de fuerza para el adulto mayor. Así hemos podido presenciar unas recomendaciones respecto de la dosis de entrenamiento demasiado generales y conservadoras desde que en 1998 el Colegio Americano de Medicina Deportiva (ACSM) reconociera la importancia del entrenamiento de la fuerza como una modalidad de ejercicio para mejorar o mantener el “fitness muscular” de adultos sanos y estableciera las primeras pautas de prescripción (sin diferenciar entre adultos y personas mayores). A pesar de que estas primeras recomendaciones ofrecieran una propuesta de prescripción inicial básica que hayan podido servir como punto de partida para muchos especialistas del campo de las ciencias de la actividad física, hoy día existe una gran base de datos de estudios científicos con información actualizada que confirma que los modelos de progresión del entrenamiento de fuerza no son sólo muy efectivos para mejorar el fitness muscular y el tejido magro del adulto mayor sino que también son seguros y factibles incluso a bajas dosis de entrenamiento (bajo volumen e intensidad), aun no siendo periodizados.
Actualmente, las recomendaciones publicadas sobre actividad física son sustancialmente diferentes para jóvenes y adultos de mediana edad (ACSM, 2009; Kraemer et al., 2002), que para aquellas poblaciones de personas mayores (Chodzko-Zajko et al., 2009), muy particularmente en lo que a prescripción del ejercicio de fuerza se refieren. También, hoy se defiende que la dosis de entrenamiento de los adultos mayores debe progresar en el tiempo al igual que lo debe hacer con los sujetos jóvenes y adultos, de modo que los modelos periodizados del entrenamiento pueden ayudar a que las adaptaciones conseguidas a la largo plazo –en términos de fuerza, resistencia muscular, hipertrofia y producción de potencia- sean mayores que si sólo si se mantuvieran modelos de entrenamiento no periodizados. Este enfoque más desarrollado de entrenamiento de fuerza en progresión (incremento progresivo de la carga de entrenamiento) implica una manipulación sistemática de todos los componentes de la dosis de ejercicio: volumen, intensidad, frecuencia de entrenamiento, intervalo de recuperación, velocidad de ejecución, tipo de ejercicio, etc. (ACSM, 2009).
De todos esos componentes o variables de la dosis del entrenamiento de la fuerza, es la intensidad (en términos de velocidad y %1RM) la que mayores consecuencias o efectos puede generar en la salud y capacidad funcional de la persona mayor al aplicar modelos periodizados de entrenamiento.
A continuación exponemos una propuesta de prescripción de ejercicio de fuerza para la persona mayor donde se recogen las variables más importantes a considerar y manipular de la dosis del entrenamiento de fuerza, atendiendo a las recomendaciones más actualizadas emanadas de distintas instituciones con responsabilidades en materia de prescripción de ejercicio y salud (ACSM, 2009; NSCA: Baechle & Earle, 2008) (tabla 1). No obstante, es probable, que volúmenes y frecuencias de entrenamiento mayores de las propuestas pudieran conseguir mayores beneficios para la salud y capacidad funcional del adulto mayor, siempre y cuando fueran inteligentemente periodizadas en el tiempo.
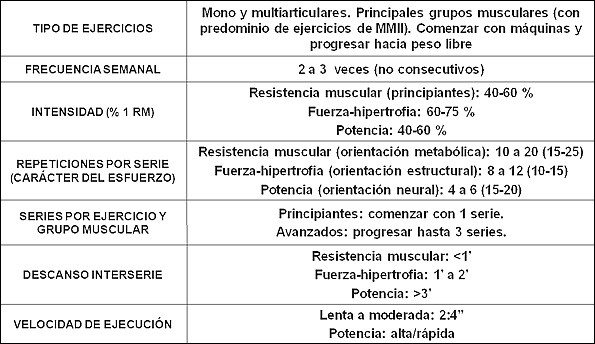
Tabla 1. Propuesta de prescripción del ejercicio de fuerza para el adulto mayor
CONCLUSIONES
Una población con una esperanza de vida cada vez mayor y un estilo de vida cada vez más sedentario conlleva unos cambios asociados en las personas de edad avanzada de, entre muchos otros aspectos, la composición corporal (incremento de la masa grasa y pérdida de tejido muscular y capacidad contráctil) y la masa ósea (disminución de la densidad mineral ósea). Estos cambios pueden conllevar el desarrollo de diversas enfermedades como la obesidad, la sarcopenia y la osteoporosis, asociadas a una disminución de la calidad de vida,un mayor grado de dependencia y un riesgo aumentado de mortalidad en este grupo de población.
Sabemos que la prevalencia de la sarcopenia incrementa rápidamente después de los 65 años de edad, y que está asociada a una limitación funcional y discapacidad física. Asimismo, el término “obesidad sarcopénica” trata de poder definir y diagnosticar a aquellas personas que de forma simultánea presentan un exceso de grasa corporal y una significativa pérdida de masa muscular y fuerza. La combinación de esta doble problemática puede resultar particularmente perjudicial por su posible asociación con un estado proinflamatorio (Schrager et al., 2007). Los adipocitos segregan activamente leptina y citocinas proinflamatorias, ambos de los cuales estimulan el catabolismo muscular, y por tanto se activa un círculo vicioso que conduce a acelerar la sarcopenia, a ganar peso en forma de grasa, y en última instancia, a provocar discapacidad física (Schrager et al., 2007).
Respecto de la prescripción de ejercicio físico para la mejora de la función muscular y mantenimiento de la masa muscular magra, existen muchas evidencias científicas que corroboran un potencial de respuesta adaptativa similar entre sujetos mayores y adultos jóvenes. Por ello, el entrenamiento de fuerza está irguiéndose como una estrategia cada vez más apoyada por la comunidad científica para la prevención y tratamiento de la sarcopenia, debilidad, y déficit funcional del adulto mayor. La prescripción del ejercicio de fuerza para el adulto mayor debería responder a la sistemática manipulación de todas las variables que lo componen, aspecto el cual debe ser monitorizado y controlado por personal especializado en ciencias del ejercicio físico y salud.
Referencias
1. ACSM. American College of Sports Medicine (1988). Position Stand. The recommended quantity and quality of exercise for developing and maintaining cardiorespiratory and muscular fitness, and flexibility in healthy adults. Med Sci Sports Exerc 30: 975–991
2. ACSM. American College of Sports Medicine (2009). Position stand. Progression models in resistance training for healthy adults. Med Sci Sports Exerc 41: 687–708
3. Abate M, Di Iorio A, Di Renzo D, Paganelli R, Saggini R, Abate G (2007). Frailty in elderly: the physical dimension. Eura Medicophys; 43:407-15
4. Abellan Van Kan G, Andre E, Bischoff-Ferrari HA, Boirie Y, Onder G, et al (2009). Carla task force on sarcopenia: propositions for clinical trials. J Nutr Health Aging; 13:700-7
5. Adamo ML, Farrar RP (2006). Resistance training, and IGF involvement in the maintenance of muscle mass Turing the aging process. Ageing Res Rev; 5:310-31
6. Baechle, T., & Earle, R (2008). Essentials of strength and conditioning (3rd ed.). Champaign, IL. Human Kinetics
7. Balagopal P, Schimke JC, Ades P, Adey D, Nair KS (2001). Age effect on transcript levels and synthesis rate muscle MHC and response to resistance exercise. Am J Physiol Endocrinol Metab; 280:E203-8
8. Bassey EJ and Harries UJ (1993). Normal values for handgrip strength in 920 men and women aged over 65 years, and longitudinal changes over 4 years in 620 survivors. Clin Sci (Lond) 84: 331–337
9. Bassey EJ (1998). Longitudinal changes in selected physical capabilities: muscle strength, flexibility and body size. Age Ageing; 27:12–16
10. Baumgartner RN, Koehler KM, Gallagher D, Romero L, Heymsfield SB, Ross RR, Garry PJ, Lindeman RD (1998). Epidemiology of sarcopenia among the elderly in New Mexico. Am J Epidemiol; 147: 755-63
11. Baumgartner RN, Wayne SJ, Waters DL, et al (2004). Sarcopenic obesity predicts instrumental activities of daily living disability in the elderly. Obes Res; 12:1995–2004
12. Beas-Jiménez, J. de D. ; Lopez-Lluch, G.,Sanchez-Martinez a, I.; Muro-Jimenez, A., Rodriguez-Bies, E. and Navas, P (2011). Sarcopenia: implicaciones del ejercicio físico en su fisiopatología, prevención y tratamiento. Rev Andal Med Deporte; 4(4):158-166
13. Bouchard DR, Dionne IJ, Brochu M (2009). Sarcopenic/Obesity and physical capacity in older men and women: data from the nutrition as a determinant of successful aging (NuAge) The Quebec Longitudinal Study. Obesity; 17:2082-8
14. Buchner DM, Cress ME, de Lateur BJ, Esselman PC, Margherita AJ, Price R, and Wagner EH (1997). The effect of strength and endurance training on gait, balance, fall risk, and health services use in community-living older adults. J Gerontol A Biol Sci Med Sci 52: M218–M224
15. Burgos R (2006). Enfoque terapeutico global de la sarcopenia. Nutr Hosp; 21(Supl 3):51-60
16. Chodzko-Zajko WJ, Proctor DN, Fiatarone SinghMA, Minson CT, NiggCR, Salem GJ, and Skinner JS (2009). American College of Sports Medicine position stand. Exercise and physical activity for older adults. Med Sci Sports Exerc 41: 1510–1530
17. Dargelos E, Poussard S, Brule C, Daury L, Cottin P (2008). Calcium-dependent proteolytic system and muscle dysfunctions: A possible role of calpains in sarcopenia. Biochimie; 90:359-68
18. Frontera WR, Meredith CN, O’Reilly KP, Knuttgen HG, and Evans WJ (1998). Strength conditioning in older men: Skeletal muscle hypertrophy and improved function. J Appl Physiol 64: 1038–1044
19. Frontera WR, Hughes VA, Fielding RA, et al (2000). Aging of skeletal muscle: a 12-yr longitudinal study. J Appl Physiol; 88:1321–1326
20. Gomez-Cabello, A., Rodriguez, V., Vila-Maldonado, S., Casajus, J. A. y Ara. I (2012). Revision. Envejecimiento y composicion corporal: la obesidad sarcopenica en Espana. Nutr Hosp; 27(1):22-30
21. Gallagher D, Ruts E, Visser M, Heshka S, Baumgartner RN, Wang J, Pierson RN, Pi-Sunyer FX, Heymsfield SB (2000). Weight stability masks sarcopenia in elderly men and women. Am J Physiol Endocrinol Metab; 279: E366-75
22. Hakkinen K, Newton RU, Gordon SE, McCormick M, Volek JS, Nindl BC, Gotshalk LA, Campbell WW, Evans WJ, Hakkinen A, Humphries BJ, and Kraemer WJ (1998). Changes in muscle morphology, electromyographic activity, and force production characteristics during progressive strength training in young and older men. J Gerontol A Biol Sci Med Sci 53: B415–B423
23. Hakkinen K, Pakarinen A, Kraemer WJ, Hakkinen A, Valkeinen H, and Alen M (2001). Selective muscle hypertrophy, changes in EMG and force, and serum hormones during strength training in older women. J Appl Physiol 91: 569–580
24. Heber D, Ingles S, Ashley JM, Maxwell MH, Lyons RF, Elashoff RM (1996). Clinical detection of sarcopenic obesity by bioelectrical impedance analysis. Am J Clin Nutr; 64: 472S-77S
25. Hunter GR, McCarthy JP, Bamman M (2004). Effects of resistance training on older adults. Sports Med; 34:329-48
26. Hulens M, Vansant G, Lysens R, et al (2001). Exercise capacity in lean versus obese women. Scand J Med Sci Sports;11:305–309
27. Ishiguro N, Kanehisa H, Miyatani M, Masuo Y, Fukunaga T (2006). Applicability of segmental bioelectrical impedance analysis for predicting trunk skeletal muscle volume. J Appl Physiol; 100:572-8
28. Janssen I, Heymsfield SB, Ross R (2002). Low relative skeletal muscle mass (sarcopenia) in older persons is associated with functional impairment and physical disability. J Am Geriatr Soc; 50: 889-96
29. Jensen GL, Hsiao PY (2010). Obesity in older adults: relationship to functional limitation. Curr Opin Clin Nutr Metab Care; 13:46-51
30. Jones T, Stephenson KW, King JG, Knight KR, Marshall TL, Scott WB (2009). Sarcopenia mechanisms and treatments. J Geriat Phys Ther; 32:39-45
31. Kraemer WJ, Adams K, Cafarelli E, Dudley GA, Dooly C, Feigenbaum MS, Fleck SJ, Franklin B, Fry AC, Hoffman JR, Newton RU, Potteiger J, Stone MH, Ratamess NA, and Triplett-McBride T (2002). American College of Sports Medicine position stand. Progression models in resistance training for healthy adults. Med Sci Sports Exerc 34: 364–380
32. Kim TN, Yang SJ, Yoo HJ, Lim KI, Kang HJ, Song W, Seo JA, Kim SG, Kim NH, Baik SH, Choi DS, Choi KM (2009). Prevalence of sarcopenia and sarcopenic obesity in Korean adults: the Korean sarcopenic obesity study. Int J Obes (Lond); 33: 885-92
33. Liu-Ambrose T, Donalson MG (2009). Exercise and cognition in older adults: is there a role for resistance training programmes? . Br J Sports Med; 43:25-7
34. Liu C, Latham NK (2009). Progressive resistance strength training for improving physical function in older adults. Cochrane Database of Systematic Reviews; Issue 3. Art. No.: CD002759
35. Macaluso A, De Vito G (2004). Muscle strength, power and adaptations to resistance training in older people. Eur J Appl Physiol; 91:450-72
36. Marini M, Sarchielli E, Brogi L, Lazzeri R, Salerno R, Sgambati E, et al (2008). Role of adapted physical activity to prevent the adverse effects of the sarcopenia. A pilot study. It J Anat Embryol; 113:217-26
37. Morse CI, Thom JM, Davis MG, Fox KR, Birch KM, Narici MV (2004). Reduced plantarflexor specific torque in the ederly is associated with a lower activation capacity. Eur J Appl Physiol; 92:219-26
38. Newton RU, Hakkinen K, Hakkinen A, McCormick M, Volek J, and Kraemer WJ (2002). Mixed-methods resistance training increases power and strength of young and older men. Med Sci Sports Exerc 34: 1367–1375
39. Nicklas BJ, Brinkley TE (2009). Exercise training as a treatment for chronic inflammation in the elderly. Exerc Sport Sci Rev; 37:165-70
40. Pahor M, Manini T, Cesari M (2009). Sarcopenia: clinical evaluation, biological markers and other evaluation tools. J Nutr Health Aging; 13:724-8
41. Peake J, Della Gatta P, Cameron-Smith D (2010). Aging and its effects on inflammation in skeletal muscle at rest and following exercise-induced muscle injury. Am J Physiol Regul Integr Comp Physiol; 298:R1485-95
42. Perrini S, Laviola L, Carreira MC, Cignarelli A, Natalicchio A (2010). The GH/IGF1 axis and signaling pathways in the muscle and bone: mechanisms underlying age-related skeletal muscle wasting and osteoporosis. J Endocrinol; 205:201-10
43. Rantanen T, Masaki KT, Foley D, et al (1998). Grip strength changes over 27 yr in Japanese-American men. J Appl Physiol; 85:2047–2053
44. Rantanen T, Harris T, Leveille SG, et al (2000). Muscle Strength and Body Mass Index as Long-Term Predictors of Mortality in Initially Healthy Men. J Gerontol A Biol Sci Med Sci; 55A:M168–M173
45. Reaven, G. M (1988). Role of insulin resistance in human disease. Diabetes; 37:1595–7
46. Rolland Y, Czerwinski S, Abellan Van Kan G, Morley JE, Cesari M, et al (2008). Sarcopenia: its assessment, etiology, pathogenesis, consequences and future perspectives. J Nutr Health Aging; 12:433-50
47. Roubenoff, R (2000). Sarcopenic obesity: does muscle loss cause fat gain?. Ann N Y Acad Sci; 904:553–7
48. Serra JA (2006). Consecuencias clinicas de la sarcopenia. Nutr Hosp; 21(Supl 3):46-50
49. Schrager, M.A.; Metter, E.J., Simonsick, E., Ble, A., Bandinelli, S., Lauretani, F. and Ferrucci. L (2007). Sarcopenic obesity and inflammation in the InCHIANTI study. J Appl Physiol; 102: 919–925
50. Stenholm S, Harris TB, Rantanen T, Visser M, Kritchevsky SB, Ferrucci L (2008). Sarcopenic obesity: definition, cause and consequences. Curr Opin Clin Nutr Metab Care; 11: 693-700
51. Stenholm S, Rantanen T, Heliövaara M, Koskinen S (2008). The mediating role of C-reactive protein and handgrip strength between obesity and walking limitation. J Am Geriatr Soc; 56:462–469
52. Vanitallie TB (2003). Frailty in the elderly: Contributions of sarcopenia and visceral protein depletion. Metabolism 52: 22–26
53. Verdijk LB, Koopman R, Schaart G, Meijer K, Savelberg HH, Van Loon LJ (2007). Satellite cell content is specifically reduced in type II skeletal muscle fibres in the elderly. Am J Physiol Endocrinol Metab; 292:E151-7
54. Visvanathan R, Chapman I (2010). Preventig sarcopenia in older people. Maturitas; 66:383-8
55. Walsh MC, Hunter GR, Livingstone MB (2006). Sarcopenia in premenopausal and postmenopausal women with osteopenia, osteoporosis and normal bone mineral density. Osteoporos Int.; 17:61-7
56. Waters DL, Brooks WM, Qualls CR, Baumgartner BN (2003). Skeletal muscle mitocondrialfunction and lean body mass in healthy exercising elderly. Mech Ageing Dev; 124:301-9
57. Wolfson L, Judge J, Whipple R, and King M (1995). Strength is a major factor in balance, gait, and the occurrence of falls. J Gerontol A Biol Sci Med Sci 50(Spec no): 64–67
58. Yarasheski KE, Zachwieja JJ, and Bier DM (1993). Acute effects of resistance exercise on muscle protein synthesis rate in young and elderly men and women. Am J Physiol 265: E210–E214
59. Zoico E, Di Francesco V, Guralnik JM, et al (2004). Physical disability and muscular strength in relation to obesity and different body composition indexes in a sample of healthy elderly women. Int J Obes Relat Metab Disord; 28:234–241
Cita en PubliCE
Juan Ramón Heredia Elvar, Felipe Isidro Donate, Fernando Mata, Guillermo Peña García-Orea, Victor Segarra Nunez Susana Moral (2013). Sarcopenia, Obesidad Sarcopénica y Papel del Ejercicio Físico. .https://g-se.com/sarcopenia-obesidad-sarcopenica-y-papel-del-ejercicio-fisico-1481-sa-k57cfb2721c162
