Recomendaciones Prácticas Relevantes para el Uso del Entrenamiento de la Fuerza para Sobrevivientes de COVID-19
Paulo Gentil1,2, Claudio Andre Barbosa de Lira1, Victor Coswig3, Weimar Kunz Sebba Barroso2, Priscila Valverde de Oliveira Vitorino2,4, Rodrigo Ramirez-Campillo5,6, Wagner Martins7, Daniel Souza11 College of Physical Education and Dance, Federal University of Goiás, Goiânia, Brazil
2 Hypertension League, Federal University of Goiás, Goiânia, Brazil
3 College of Physical Education, Federal University of Pará, Castanhal, Brazil
4 Social Sciences and Health School, Pontifical Catholic University of Goiás, Goiânia, Brazil
5 Laboratory of Human Performance, Quality of Life and Wellness Research Group, Department of Physical Activity Sciences, Universidad de Los Lagos, Osorno, Chile
6 Centro de Investigación en Fisiología del Ejercicio, Facultad de Ciencias, Universidad Mayor, Santiago, Chile
7 Physiotherapy College, University of Brasília, Brasília, Brazil
Resumen
La nueva enfermedad por coronavirus (COVID-19) surgió a finales de 2019 y provocó una pandemia mundial. La enfermedad afecta predominantemente al sistema respiratorio; sin embargo, existe evidencia de que es una enfermedad multisistémica que también afecta el sistema cardiovascular. Aunque las consecuencias a largo plazo de COVID-19 no son bien conocidas, la evidencia de enfermedades similares alerta sobre la posibilidad de una función física deteriorada a largo plazo y una calidad de vida reducida, especialmente en aquellos que requieren cuidados intensivos. Por lo tanto, se necesitan estrategias de rehabilitación para mejorar los resultados en los sobrevivientes de COVID-19. Entre las posibles estrategias, el entrenamiento de la fuerza (EF) puede ser de especial interés, ya que se ha demostrado que aumenta la capacidad funcional tanto en condiciones respiratorias agudas y crónicas como en pacientes cardíacos. El presente artículo tiene como objetivo proponer sugerencias prácticas y basadas en la evidencia para la prescripción de EF para personas que han sido diagnosticadas con COVID-19 con un enfoque especial en los sistemas inmunológico, respiratorio y cardiovascular. Con base en la literatura actual, presentamos el EF como una posible actividad segura y factible que puede ser eficiente en el tiempo y fácil de implementar en diferentes entornos.
Palabras Clave: recomendaciones, fuerza, ejercicio, supervivientes, COVID-19
Abstract
The novel coronavirus disease (COVID-19) has emerged at the end of 2019 and caused a global pandemic. The disease predominantly affects the respiratory system; however, there is evidence that it is a multisystem disease that also impacts the cardiovascular system. Although the long-term consequences of COVID-19 are not well-known, evidence from similar diseases alerts for the possibility of long-term impaired physical function and reduced quality of life, especially in those requiring critical care. Therefore, rehabilitation strategies are needed to improve outcomes in COVID-19 survivors. Among the possible strategies, resistance training (RT) might be particularly interesting, since it has been shown to increase functional capacity both in acute and chronic respiratory conditions and in cardiac patients. The present article aims to propose evidence-based and practical suggestions for RT prescription for people who have been diagnosed with COVID-19 with a special focus on immune, respiratory, and cardiovascular systems. Based on the current literature, we present RT as a possible safe and feasible activity that can be time-efficient and easy to be implemented in different settings.
Keywords: recommendations, strength, exercise, survivors, COVID-19
El Problema
La pandemia de la enfermedad del nuevo coronavirus (COVID-19) ha supuesto una gran amenaza para la salud pública y la seguridad (Wu y cols., 2020; Zu y cols., 2020). Causado por el síndrome respiratorio agudo coronavirus 2 (o SARS-CoV-2), el COVID-19 se caracteriza por dificultad respiratoria y enfermedad multisistémica, que con frecuencia es grave y puede provocar la muerte (Kreutz y cols., 2020). Muchos sobrevivientes de COVID-19 que requirieron cuidados críticos pueden desarrollar discapacidades psicológicas, físicas y cognitivas (Barker-Davies y cols., 2020). Existe evidencia de que los coronavirus pueden inducir alteraciones neurológicas al invadir el sistema nervioso central y algunos pacientes pueden tener síntomas como dolor muscular severo (Li Y.C. y cols., 2020). El COVID produce una morbilidad relevante durante 3 a 6 meses (fase intermedia), y es posible que se necesiten servicios de rehabilitación y atención médica durante más de 12 meses (fase crónica) (Barker-Davies y cols., 2020).
Estudios previos demostraron que los sobrevivientes de enfermedades respiratorias agudas pueden tener discapacidad funcional persistente y síntomas psicológicos hasta por lo menos 1 año después del alta (Herridge y cols., 2003; Tansey y cols., 2007), y la mayoría de ellos presenta afecciones extrapulmonares, con la atrofia muscular y la debilidad siendo las más frecuentes (Herridge y cols., 2003). Además, muchos pacientes con COVID-19 necesitaron estar en unidades de cuidados intensivos, lo que se asocia con síntomas como disnea, ansiedad, depresión, deterioro de la función física y mala calidad de vida hasta 12 meses después del alta (Oeyen y cols., 2010; Denehy y Elliott, 2012; Jackson y cols., 2012). Entre ellos, la función física es uno de los factores con menor probabilidad de recuperar los valores normales, ya que se ve muy afectada por enfermedades críticas (Gerth y cols., 2019). Las manifestaciones cardinales incluyen debilidad de los músculos de las extremidades, atrofia muscular y alteraciones de los reflejos tendinosos profundos (Li Z. y cols., 2020). La debilidad neuromuscular en las unidades de cuidados intensivos puede prolongar el tiempo de ventilación mecánica y la hospitalización del paciente. Por tanto, la rehabilitación debe iniciarse en el ámbito de cuidados críticos, ya que el ejercicio temprano previene las complicaciones neuromusculares y mejora el estado funcional en la enfermedad crítica, considerándose eficaz, seguro y factible (Sosnowski y cols., 2015; Barker-Davies y cols., 2020). Además, los programas de rehabilitación que se inician en la fase post-aguda (<30 días) parecen aportar los mayores beneficios (Barker-Davies y cols., 2020).
Además de todo el conocimiento sobre el manejo y la recuperación de cuidados intensivos, hay una escasez de recomendaciones basadas en la evidencia con respecto a la rehabilitación después del COVID-19. Entre las posibles estrategias para la rehabilitación de pacientes sobrevivientes de COVID-19, el entrenamiento de la fuerza (EF) que convencionalmente consiste en las contracciones musculares voluntarias contra algún tipo de resistencia externa puede ser particularmente interesante, ya que se ha demostrado que es una estrategia segura y factible para aumentar capacidad funcional tanto en condiciones respiratorias agudas como crónicas (Troosters y cols., 2010; Liao y cols., 2015; Li y cols., 2019; Rice y cols., 2020). En base en la evidencia científica actual, el EF puede ser seguro, eficiente en el tiempo y fácil de implementar en casi cualquier lugar y con recursos mínimos (Gentil y cols., 2020b; Souza y cols., 2020). Por lo tanto, el presente artículo tiene como objetivo proponer sugerencias prácticas y basadas en la evidencia para el uso del EF en personas a las que se les ha diagnosticado COVID-19 durante diferentes fases de la enfermedad, con especial énfasis en los sistemas inmunológico, respiratorio y cardiovascular.
Sistema inmunológico
El sistema inmunológico trabaja a través de funciones coordinadas de muchas células para proteger al organismo contra las infecciones oportunas (Pedersen y Hoffman-Goetz, 2000). Por lo tanto, preservar o mejorar su función es importante para las personas afectadas por COVID-19. Existen evidencias de vigilancia inmunológica o inmunodepresión en respuesta al ejercicio (Pedersen y cols., 1998; Peake y cols., 2017; Nieman y Wentz, 2019); sin embargo, los efectos específicos del EF sobre la función inmunitaria no se han estudiado de forma exhaustiva (Freidenreich y Volek, 2012). Curiosamente, las personas involucradas en el entrenamiento de la resistencia son más comúnmente afectadas por la inmunodepresión y la enfermedad (Nieman, 2007) en comparación con los deportes de fuerza y potencia (Alonso y cols., 2010, 2012; Horn y cols., 2010; Timpka y cols., 2017), lo que podría ser un punto favorable para el EF (Natale y cols., 2003; Gentil y cols., 2020b). En general, la asociación entre el ejercicio y las defensas inmunológicas corporales sigue una curva en forma de 'J' (Pedersen y cols., 1998; Peake y cols., 2017; Nieman y Wentz, 2019), mejorando con cantidades moderadas de ejercicio físico y disminuyendo con cantidades excesivas, o poca cantidad de ejercicio (Pedersen y cols., 1998; Peake y cols., 2017; Nieman y Wentz, 2019). Esta compleja relación está influenciada negativamente por muchos factores, como un mayor gasto energético (Spence y cols., 2007; Rama y cols., 2013), un mayor volumen de ejercicio (Peters y Bateman, 1983; Gleeson y cols., 2013; Siedlik y cols., 2016) y un estrés metabólico (Pedersen y Hoffman-Goetz, 2000). En este sentido, una serie aguda de ejercicio podría inducir un efecto supresor sobre las respuestas proliferativas de linfocitos, con ejercicio de larga duración (más de 1 h) y de alta intensidad exhibiendo un efecto supresor moderado (Siedlik y cols., 2016).
Un estudio de Davis y cols. (1997) analizaron los efectos del ejercicio físico sobre la susceptibilidad a infecciones respiratorias mediante el uso de un modelo murino (roedores). El diseño del ejercicio se compuso de tres grupos: ningún ejercicio, ejercicio moderado de corto plazo (30 min) y ejercicio prolongado hasta la fatiga voluntaria (2.5 a 3.5 hs). Según los resultados, el ejercicio hasta la fatiga resultó en una mayor tasa de mortalidad (41%) que no hacer ejercicio o el ejercicio moderado de corto plazo. Aunque la tasa de mortalidad tendió a ser más baja después del ejercicio moderado de corto plazo (9%) que sin ejercicio (16%), no hubo diferencias significativas entre las condiciones. Los resultados también mostraron una disminución de la resistencia a los antivirales después de un ejercicio intenso dentro de los pulmones, junto con una mayor susceptibilidad a las infecciones respiratorias in vivo. Aunque hay escasez de datos que relacionen la inmunosupresión transitoria después de un ejercicio extenuante con el deterioro crónico del sistema inmunológico y, posteriormente, el riesgo de infección (Nieman y Wentz, 2019), es razonable sugerir que la inmunosupresión inducida por el ejercicio puede afectar la eliminación del patógeno en pacientes agudos con enfermedad COVID-19. Por lo tanto, incluso después de la fase aguda de la enfermedad, el ejercicio físico debe garantizar la restauración adecuada de las defensas inmunológicas.
Por estas razones, podría ser aconsejable evitar las actividades extenuantes y adoptar un volumen/duración de entrenamiento total de EF reducido (<45 min) para preservar la función inmunológica y disminuir el riesgo de complicaciones, particularmente cuando la respuesta inmune aún está comprometida (Gleeson y cols., 2013; Peake y cols., 2017). Teniendo esto en cuenta, se debe recomendar un EF de bajo volumen. Aquí, es importante señalar que se han sugerido sesiones de entrenamiento que duran unos minutos para promover ganancias de fuerza y tamaño muscular en diferentes poblaciones (Fisher J. y cols., 2017; Souza y cols., 2020). Desde un punto de vista práctico, estudios previos demostraron que los adultos jóvenes y mayores no entrenados pueden obtener muchos beneficios para la salud (por ejemplo, mayor funcionalidad y mejoras cardiovasculares) a partir de protocolos de dosis mínimas de EF que involucren dos series de tres a cuatro ejercicios básicos con una frecuencia de entrenamiento de una o dos sesiones semanales (Fisher y cols., 2014; de Barbalho y cols., 2017; Seguro y cols., 2019; Souza y cols., 2019; Dias y cols., 2020).
Es importante considerar que los aumentos de adrenalina, cortisol y modulación simpática parecen estar relacionados con la inmunosupresión inducida por el ejercicio (Pedersen y Hoffman-Goetz, 2000; Nieman y Wentz, 2019). Al respecto, estudios previos han demostrado una asociación entre el estrés metabólico elevado, niveles de cortisol e inmunosupresión en respuesta al EF (Miles y cols., 2003; Ramel y cols., 2003; Krüger y cols., 2011). Por lo tanto, podría ser interesante evitar tales respuestas en sobrevivientes de COVID-19 en su rehabilitación. Según estudios previos, los protocolos de EF con un número reducido de repeticiones (≤6 repeticiones) y largos intervalos de descanso entre series (≥3 min) dan como resultado aumentos menos pronunciados en los niveles de actividad simpática, de cortisol y de lactato (Kraemer y cols., 1990; Smilios y cols., 2003, 2007; Vale y cols., 2018). Además, el EF de bajo volumen con pocas repeticiones es menos glucolítico (Knuiman y cols., 2015). Por tanto, podría evitarse la concurrencia del sustrato energético y la posterior inmunosupresión, ya que la glucosa es el principal sustrato de las células inmunológicas (Palmer y cols., 2015).
En cuanto a la hora del día, los estudios que involucraron actividades de resistencia mostraron que los aumentos agudos de leucocitos fueron mayores cuando el ejercicio se realizó durante la noche (6 PM) en comparación con la mañana (9 AM), y se mantuvo alto durante 1 h después del ejercicio en una clima cálido y húmedo (Boukelia y cols., 2018). Al comparar el ejercicio durante la mañana y la tarde (9 AM vs 4 PM) en un ambiente frío, Boukelia y cols. (2017) encontraron una función inmunológica más alta y menos inflamación pulmonar durante el ejercicio de la tarde. No pudimos encontrar estudios específicos con el EF; sin embargo, se ha demostrado previamente que los niveles plasmáticos de cortisol aumentan durante la mañana (Hayes y cols., 2010), lo que podría sugerir una función inmunológica deteriorada. Por lo tanto, la sugerencia es entrenar por la tarde o temprano en la noche.
La base de la patogénesis del COVID-19 se asocia con una respuesta antiviral retardada seguida de una sobrerreacción inmunológica que resulta en un estado proinflamatorio excesivo (Castelli y cols., 2020). Los niveles de inflamación sistémica podrían explicar la gravedad de la enfermedad, ya que los pacientes más afectados presentan niveles séricos más altos de citocinas proinflamatorias, así como un recuento reducido de linfocitos T (Chen y cols., 2020). El linfocito T regulador (Treg) también se reduce en pacientes gravemente enfermos y parece jugar un papel importante en la patogénesis del COVID-19, ya que se asocia con el control de la respuesta autoinmune y proinflamatoria (Gladstone y cols., 2020; Stephen-Victor y cols., 2020). En este contexto, el EF pueden contribuir al control del estado proinflamatorio (Chupel y cols., 2017; Santiago y cols., 2018; Lammers y cols., 2020). A pesar de que los estudios que investigan el efecto del EF sobre las células Treg son escasos (Dorneles y cols., 2020), un estudio previo en modelo de roedores mostró que el EF puede sobrerregular este marcador inmunológico (Souza y cols., 2017). Además, la práctica regular de EF aumenta los niveles de interleucina-10, una citoquina antiinflamatoria que es producida principalmente por las células Treg (Chupel y cols., 2017; Lammers y cols., 2020).
Sistema respiratorio
Los altos niveles de mediadores de la proinflamación y los cambios histopatológicos en los pulmones en respuesta al SARS-CoV-2 podrían inducir la apoptosis en las células endoteliales y epiteliales pulmonares, lo que conduce a una función respiratoria deteriorada, como dificultad respiratoria aguda (Castelli y cols., 2020). Además, el estado proinflamatorio persistente en pacientes con COVID-19 grave se asocia con la proliferación de fibroblastos en el tabique alveolar, lo que resulta en fibrosis intersticial pulmonar (Zhang y cols., 2020). Las enfermedades pulmonares se asocian comúnmente con la pérdida de masa y función muscular (Steiner, 2007; Bone y cols., 2017). El análisis de brotes previos de síndrome respiratorio agudo severo (SARS) reveló que 6-20% de los pacientes presentaban una función pulmonar restrictiva leve o moderada compatible con una debilidad muscular 6-8 semanas después del alta hospitalaria (Chan y cols., 2003). Esto parece persistir durante un período aún más prolongado, ya que el 37% de los pacientes presentaba un deterioro persistente de la función pulmonar después de la recuperación del SARS y su estado de salud también era significativamente peor en comparación con los sujetos sanos (Ong y cols., 2005). Los resultados de un estudio de cohorte mostraron un deterioro significativo de la capacidad pulmonar en el 23.7% de los sobrevivientes del SARS 1 año después del inicio de la enfermedad (Hui y cols., 2005). Además, el estado de salud y la capacidad de ejercicio fueron notablemente más bajos que los encontrados en la población normal (Hui y cols., 2005).
Estudios previos demostraron que, en personas con enfermedades pulmonares, la baja fuerza muscular se asocia con la inactividad física (Osthoff y cols., 2013) y es un predictor independiente de morbilidad y mortalidad, independiente del grado de limitación respiratoria (Swallow y cols., 2007). En consecuencia, el objetivo clave en la rehabilitación de enfermedades pulmonares debería ser mejorar la estructura y función del músculo locomotor, ya que el ejercicio reduce los beneficios sobre la ventilación de esfuerzo, los volúmenes pulmonares operativos y el rendimiento de los músculos respiratorios (Marillier y cols., 2020). Además, se aconseja la realización de ejercicio físico como tratamiento no farmacológico adjunto durante la rehabilitación de la fibrosis pulmonar (Spruit y cols., 2009).
El EF ha sido sugerido como una estrategia exitosa para la rehabilitación pulmonar, ya sea realizada sola o en conjunto con el entrenamiento aeróbico, ya que trae importantes incrementos en la capacidad funcional (Liao y cols., 2015; José y Dal Corso, 2016; Li y cols., 2019). También es importante destacar que el entrenamiento físico durante la hospitalización por afecciones respiratorias agudas parece traer importantes beneficios funcionales y de salud, es bien tolerado y los eventos adversos son poco frecuentes (Troosters y cols., 2010; Rice y cols., 2020). El EF se puede realizar con éxito como una estrategia de ejercicio independiente, sin aumentar los eventos adversos en pacientes con enfermedad pulmonar obstructiva crónica en la rehabilitación pulmonar (Liao y cols., 2015).
Teniendo en cuenta que la mayoría de las personas infectadas con SARS-CoV-2 podrían experimentar dificultades respiratorias, se recomienda controlar las respuestas respiratorias al ejercicio. Una ventaja del EF es que podría promover menos estrés cardiorrespiratorio (es decir, consumo de oxígeno y ventilación pulmonar) que el ejercicio aeróbico, incluso durante una prueba de esfuerzo máximo (Houchen-Wolloff y cols., 2014; Garnacho-Castaño y cols., 2015; Albesa -Albiol y cols., 2019). La manipulación de las variables del EF podría reducir aún más el estrés respiratorio. La ventilación pulmonar y el consumo de oxígeno aumentan con mayor volumen/duración (Haddock y Wilkin, 2006; Mookerjee y cols., 2016; Garnacho-Castaño y cols., 2018), menores intervalos de descanso (Ratamess y cols., 2007; Farinatti y Castinheiras Net , 2011), mayores velocidades de movimiento (Mazzetti y cols., 2011; Mukaimoto y Ohno, 2012; Buitrago y cols., 2014), y un mayor número de repeticiones (Scott y cols., 2011; Ratamess y cols., 2014). Por lo tanto, se podría recomendar un entrenamiento con menor número de repeticiones, mayor intervalo de pausa entre las series y una velocidad de movimiento controlada (Buitrago y cols., 2013).
Sistema cardiovascular
Al igual que otras infecciones por coronavirus, el COVID-19 se asocia con complicaciones cardíacas, especialmente arritmias, insuficiencia cardíaca y lesión miocárdica (Kochi y cols., 2020; Madjid y cols., 2020; Wang y cols., 2020). La lesión cardíaca aguda es mayor en aquellos con mayor mortalidad, con enfermedad grave y que requieren soporte ventilatorio (Kochi y cols., 2020; Madjid y cols., 2020). Se ha sugerido que las complicaciones cardíacas son multifactoriales. Puede ser causada por hipoxia, lesión miocárdica viral, hipotensión, subregulación del receptor ACE2, toxicidad por fármacos o inflamación sistémica elevada (Kochi y cols., 2020). Los mediadores proinflamatorios asociados con el COVID-19 pueden resultar en inflamación vascular, miocarditis y complicaciones arrítmicas (Kochi y cols., 2020; Madjid y cols., 2020). Otra complicación con respecto al sistema cardiovascular es el aumento del riesgo de tromboembolismo como consecuencia de la coagulopatía y disfunción vascular endotelial en pacientes con enfermedad crítica COVID-19 (Goshua y cols., 2020).
Los pacientes diagnosticados con COVID-19 deben ser evaluados por completo y, si es necesario, las investigaciones adicionales pueden incluir electrocardiograma en reposo (ECG), exámenes de sangre, ECG de 24 h, examen cardiopulmonar, ecocardiograma, resonancia magnética cardiovascular y pruebas de esfuerzo con la participación de un cardiólogo. (Barker-Davies y cols., 2020). En caso de miocarditis, puede ser necesario un período de 3 a 6 meses de descanso completo debido al ejercicio intenso, según la gravedad clínica y la duración de la enfermedad (Pelliccia y cols., 2019; Schellhorn y cols., 2020). Después de regresar, es recomendable realizar reevaluaciones periódicas en los primeros 2 años debido a un mayor riesgo de progresión clínica silenciosa (Pelliccia y cols., 2019).
Se ha demostrado que el EF es seguro y eficaz para distintos pacientes cardíacos de diferentes enfermedades cardíacas y se ha recomendado como un componente central de la rehabilitación cardíaca durante muchas décadas (McKelvie y McCartney, 1990; Verrill y cols., 1992; Yamamoto y cols., 2016). Algunos estudios sugirieron que el EF podría ser incluso más seguro que el ejercicio aeróbico, ya que produce menos estrés miocárdico y respuestas hemodinámicas reducidas en pacientes con enfermedades cardíacas como insuficiencia cardíaca controlada (Karlsdottir y cols., 2002; Levinger y cols., 2005), enfermedad coronaria arterial (Karlsdottir y cols., 2002), y miocardiopatía isquémica (McKelvie y cols., 1995) y en pacientes en rehabilitación cardíaca tras infarto de miocardio e intervención coronaria percutánea (Adams y cols., 2010). Además, el EF conduce a mejoras en el control autónomo cardíaco de individuos enfermos (Bhati y cols., 2019).
El estrés cardiovascular puede estar más relacionado con la duración del ejercicio que con la carga utilizada, lo que garantiza el uso de mayores cargas y un menor número de repeticiones. Al respecto, Lamotte y cols. (2005) informaron niveles más altos de presión arterial y frecuencia cardíaca en respuesta a EF usando cargas externas más bajas y repeticiones más altas [4 series de 17 repeticiones al 40% de la fuerza máxima de una repetición (1MR)] en comparación con cargas externas más altas y repeticiones más bajas (4 series de 10 repeticiones al 70% de 1MR) en 14 pacientes que participaban en un programa de rehabilitación (por ej., cirugía de bypass, angioplastia coronaria percutánea o cirugía valvular). Del mismo modo, Gjøvaag y cols. (2016) informaron niveles más altos de presión arterial y frecuencia cardíaca en pacientes con enfermedad arterial coronaria después de realizar 15MR con cargas externas más bajas que realizar 4MR con cargas externas más altas. Respecto a la modulación autonómica, Vale y cols. (2018) mostraron que las mujeres hipertensas que entrenaban con menores repeticiones y mayores cargas externas (6MR) mostraron menor activación simpática y mayor activación parasimpática en comparación con el entrenamiento con menores cargas externas y más repeticiones (15MR). Por lo tanto, para reducir el estrés cardiovascular durante el ejercicio, el programa de EF recomendado debe implicar un menor número de repeticiones independientemente de la carga utilizada.
Una característica importante en estudios previos es que la presión arterial y la frecuencia cardíaca aumentan progresivamente a lo largo de las series, especialmente cuando el descanso entre series es más corto (Gotshall y cols., 1999; Lamotte y cols., 2005; Gjøvaag y cols., 2016). Esto sugiere que uno debería considerar realizar un número menor de series (una o dos) y usar un mayor descanso entre series (≥3 min). Otras estrategias adicionales para reducir el estrés cardiovascular es dar pausas cortas (es decir, 5 seg) en medio de las series (da Silva y cols., 2007; Rúa-Alonso y cols., 2020), evitar realizar repeticiones hasta el fallo muscular (MacDougall y cols., 1992), y el ejercicio durante la tarde, ya que la reactividad cardíaca es menor (Jones y cols., 2006; Boukelia y cols., 2018) y hay un mejor control de la presión arterial (Jones y cols., 2008) en este período del día.
Recomendaciones prácticas
El EF puede realizarse en muchos entornos, incluidos los ambientes de hospitalización aguda y rehabilitación. Estudios previos han demostrado que el EF realizado durante las unidades de cuidados intensivos pueden aportar importantes beneficios ya sea por sí solas (Morris y cols., 2016; Barbalho y cols., 2019; Veldema y cols., 2019) o en combinación con otras actividades (Eggmann y cols., 2018). Curiosamente, los beneficios del EF en pacientes de unidad de cuidados intensivos se han informado incluso en presencia de ventilación mecánica (Eggmann y cols., 2018).
Otra preocupación importante con el COVID-19 son las secuelas neuropsiquiátricas. Además de la angustia psicológica asociada a la pandemia, los efectos directos e indirectos del coronavirus en el sistema nervioso central humano podrían estar relacionados con trastornos neuropsiquiátricos como cambios de humor, trastornos del sueño, depresión y ansiedad (Khatoon y cols., 2020; Steardo y cols., 2020; Troyer y cols., 2020). Los estudios que investigaron a los pacientes con COVID-19 encontraron un alto nivel de estrés postraumático y síntomas depresivos en comparación con las personas no infectadas (Vindegaard y Eriksen Benros, 2020). Al respecto, existe evidencia consistente de que el EF se asocia con mejorías en la depresión (Gordon y cols., 2018), la ansiedad (Gordon y cols., 2017) y los trastornos del sueño (Kovacevic y cols., 2018), incluidos los pacientes con enfermedades crónicas (Ferreira y cols., 2020) y durante la rehabilitación (McCartney, 1998; Vincent y Vincent, 2012; Chan y Cheema, 2016; Andrade y cols., 2018; Seguro y cols., 2019). Los posibles beneficios del EF para los pacientes con COVID-19 se ilustran en la Figura 1.
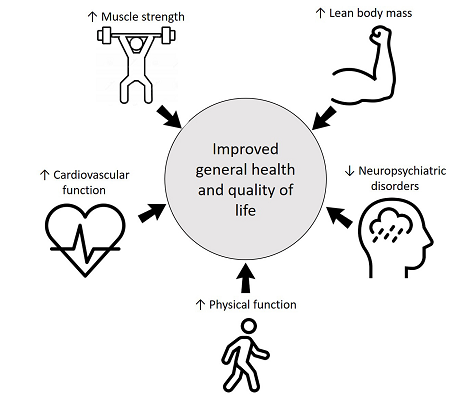
Figura 1. Beneficios multisistémicos del entrenamiento de la fuerza.
Los programas de EF comúnmente involucran muchos ejercicios con la adición de ejercicios aislados para músculos específicos, lo que puede llevar demasiado tiempo. Sin embargo, los ejercicios multiarticulares parecen ser suficientes para mejorar la fuerza muscular y la hipertrofia de los músculos involucrados en los ejercicios (Gentil y cols., 2015, 2017b; Paoli y cols., 2017; Barbalho y cols., 2020a, b) y no existen beneficios adicionales en el uso de ejercicios de articulación única (Gentil y cols., 2013; de França y cols., 2015; Barbalho y cols., 2020b). Esto permite el uso de ejercicios multiarticulares combinados con programas de bajo volumen, aumentando la viabilidad y la seguridad para la mayoría de los pacientes afectados por COVID-19, hospitalizados o no, incluidos los individuos con enfermedades cardiometabólicas y ancianos frágiles. Los pacientes con COVID-19 que presenten dolores corporales intensos, dolor de garganta, dificultad para respirar, dolor en el pecho, fatiga general, tos o fiebre deben evitar los ejercicios entre 2 y 3 semanas después de la desaparición de estos síntomas. También se recomienda evitar el ejercicio prolongado, exhaustivo o de alta intensidad. Estas restricciones actuales a la práctica del EF podrían revisarse después de la cesación de los síntomas. Los pacientes con COVID-19 que están asintomáticos deben continuar haciendo ejercicio, como lo harían normalmente. Se debe combinar un enfoque de rehabilitación pulmonar en el caso de regreso de una enfermedad COVID-19 leve/moderada (Barker-Davies y cols., 2020).
El EF que utiliza equipos no tradicionales, como dispositivos elásticos, que son de bajo costo y portátiles, y que se pueden realizar en casi cualquier lugar, podría contribuir a aumentar las posibilidades de rendimiento del EF en muchos entornos diferentes, incluidas las unidades de cuidados intensivos. Estudios previos informaron que el EF usando bandas o tubos elásticos resultó en activación muscular y estrés mecánico similares (Aboodarda y cols., 2011, 2016), ganancias de fuerza (Martins y cols., 2013) y mejoras en la capacidad funcional (Colado y cols., 2010; Souza y cols., 2019) en comparación con un EF tradicional. Además, el EF también se puede realizar mediante ejercicios con el peso corporal, ya que promueve ganancias en la fuerza muscular, la hipertrofia y la composición corporal similar al EF tradicional para muchas poblaciones diferentes, como las personas de mediana edad con enfermedad del hígado graso no alcohólicos (Takahashi y cols., 2015, 2017), ancianos (Tsuzuku y cols., 2017), e incluso jóvenes practicantes entrenados (Calatayud y cols., 2015; Kikuchi y Nakazato, 2017).
Otra posible limitación en entornos de rehabilitación es la creencia de que el EF debe realizarse con cargas de moderadas a altas (ACSM, 2009; Kraemer y cols., 2002), ya que comúnmente se sugiere que sería necesario utilizar cargas ≥60% de 1MR para ganancias óptimas de fuerza y masa muscular (McDonagh y Davies, 1984; ACSM, 2009). Sin embargo, estudios previos han demostrado que el EF de baja carga externa podría traer aumentos en el fitness muscular y la hipertrofia que son similares a los métodos convencionales, cuando el esfuerzo es alto (Fisher J. P. y cols., 2017; Steele y cols., 2019). Estudios previos en personas entrenadas (Morton y cols., 2016) y no entrenadas (Mitchell y cols., 2012; Assunção y cols., 2016) informaron que el EF con baja carga externa resultó en un aumento similar en la fuerza muscular y la hipertrofia en comparación con alta carga externa. Esto es particularmente evidente cuando las pruebas de fuerza no son similares a las situaciones entrenadas (Fisher J. P. y cols., 2017). Las advertencias para usar una carga externa baja son que requeriría un mayor número de repeticiones y tiempos de ejercicio más prolongados, lo que puede resultar en un impacto más negativo en el sistema inmunológico y un mayor estrés en los sistemas respiratorio y cardiovascular, como se sugirió anteriormente. Por lo tanto, el costo-beneficio de tales adaptaciones podría analizarse individualmente.
También se puede obtener un estímulo fisiológico significativo con contracciones musculares voluntarias máximas o casi máximas realizadas sin carga externa. Al respecto, estudios previos reportaron altos niveles de activación muscular al realizar EF con la intención de contraer al máximo los músculos y sin carga externa (Gentil y cols., 2017a; Alves y cols., 2020). Un estudio anterior informó ganancias equivalentes en la hipertrofia de los músculos del brazo después de un EF tradicional y sin carga externa en hombres y mujeres jóvenes, utilizando un diseño de entrenamiento contralateral (Counts y cols., 2016). También se han reportado resultados positivos en términos de hipertrofia y funcionalidad en pacientes de unidades de cuidados intensivos (Barbalho y cols., 2019).
Particularmente en personas de edad avanzada, la realización de un EF de alta velocidad podría considerarse como una estrategia alternativa cuando la realización del EF de carga externa alta o baja con alto esfuerzo no es posible o recomendable (Fragala y cols., 2019). El EF de alta velocidad puede proporcionar incrementos superiores en la capacidad funcional en comparación con un EF convencional (Bottaro y cols., 2007; Nogueira y cols., 2009; Ramírez-Campillo y cols., 2014). Un estudio anterior sugirió que el EF de alta velocidad podría ser una estrategia factible y segura para revertir o prevenir el deterioro funcional durante la hospitalización aguda (Martínez-Velilla y cols., 2019). Por lo tanto, la realización de pocas repeticiones utilizando una acción muscular concéntrica de alta velocidad combinada con largos intervalos de descanso y/o pausas breves dentro de una serie podría proporcionar ganancias significativas en la funcionalidad al tiempo que previene un mayor estrés cardiovascular (Lamotte y cols., 2010; Dias y cols., 2020). Teniendo en cuenta que se recomienda el uso de cargas ligeras a moderadas (por ej., 30-60% de 1MR) para optimizar la potencia muscular (Fragala y cols., 2019), esto podría lograrse fácilmente con pequeños implementos como mancuernas ligeras o dispositivos elásticos. Por lo tanto, los equipos e implementos no deben ser una barrera para implementar programas de EF durante la rehabilitación del COVID-19.
La progresión del EF debe basarse en un análisis individual, considerando los parámetros de rendimiento y los síntomas clínicos. Inicialmente, se recomienda que la progresión se realice mediante aumentos de carga, ya que un mayor número de series y repeticiones y menores intervalos de descanso pueden imponer riesgos no deseados. Por lo tanto, la recomendación es establecer un margen de repetición (es decir, 4-6MR) y aumentar la carga cuando el participante alcance un límite superior. Cuando el paciente alcanza la capacidad física pre-COVID, sería interesante reexaminar la posibilidad de restaurar su rutina normal (Phelan y cols., 2020).
Consideraciones finales
Es importante observar algunas precauciones generales para volver al ejercicio post-COVID-19, como monitorear la temperatura antes del entrenamiento, comenzar con un programa de fortalecimiento muscular previo al trabajo cardiovascular, mantener el distanciamiento social, observar la higiene, la ventilación adecuada y el uso de mascarillas, cuando sea necesario (So y cols., 2004; Gentil y cols., 2020a). Otro punto relevante es la necesidad de evaluar cuidadosamente el estado clínico y supervisar a los pacientes que han sido diagnosticados de COVID-19, especialmente personas con lesiones cardíacas (Barker-Davies y cols., 2020), destacando la necesidad de un abordaje multidisciplinario. Puede haber una lesión miocárdica subclínica después de la recuperación clínica de infecciones leves, incluso sin síntomas cardíacos o ingreso hospitalario. Si bien el presente artículo trata sobre el EF con fines de rehabilitación, se requiere autorización médica. Por tanto, se recomienda una evaluación médica para descartar enfermedades subclínicas antes de retomar el entrenamiento o competición de alta intensidad, eventualmente con exámenes como ecocardiograma transtorácico, prueba de esfuerzo máximo y monitorización Holter de 24 h (Dores y Cardim, 2020; Wilson y cols., 2020).
Considerando la posibilidad insignificante de secuelas cardíacas después de una infección asintomática o síntomas locales de COVID-19, no es necesario realizar un cribado previo a la participación si una evaluación crítica de los signos y síntomas es negativa y muestra una recuperación completa (Verwoert y cols., 2020; Wilson y cols., 2020). Sin embargo, se puede considerar una evaluación previa a la participación y una consulta con el cardiólogo para grupos específicos, que incluyen, entre otros, personas con enfermedades cardiovasculares preexistentes, atletas de élite y aquellos con una recuperación deteriorada de la capacidad de ejercicio.
Para aquellos con síntomas regionales o que no requieran hospitalización, se recomienda encarecidamente realizar un cribado previo a la participación que incluya examen físico, evaluación crítica de los síntomas y un ECG de 12 derivaciones (Verwoert y cols., 2020; Wilson y cols., 2020). Se debe consultar a un cardiólogo con experiencia en lectura del ECG de atletas para diferenciar entre los cambios del ECG debido a la adaptación al ejercicio y las anomalías del ECG que sugieran una enfermedad cardíaca. Esto es necesario porque el ECG de 12 derivaciones no es el estándar de oro para la detección de miocarditis. También se recomienda utilizar biomarcadores cardíacos para detectar miocarditis (Verwoert y cols., 2020; Wilson y cols., 2020). Sin embargo, se debe tener precaución al usar esta estrategia porque la mayoría de las personas no tienen mediciones de referencia documentadas previamente para comparar, y el ejercicio podría elevar los niveles de estos biomarcadores, sin implicaciones clínicas claras (Verwoert y cols., 2020). El EF puede realizarse después de una miocarditis si los biomarcadores séricos de lesión miocárdica y función sistólica del ventrículo izquierdo son normales y si la monitorización del ECG de 24 hs o la prueba de esfuerzo descarta arritmias relevantes (Barker-Davies y cols., 2020).
Cabe señalar que la mayoría de estas recomendaciones de cribado se refieren a deportistas competitivos y actividades de alta intensidad (Dores y Cardim, 2020; Verwoert y cols., 2020; Wilson y cols., 2020). Por lo tanto, las limitaciones específicas para realizar EF deben analizarse individualmente y considerar las especificidades de cada protocolo. En este contexto, el EF podría diseñarse para ser especialmente segura para las personas a las que se les ha diagnosticado COVID-19, en diferentes etapas de la enfermedad y recuperación, al disminuir el riesgo de inmunosupresión y reducir el estrés respiratorio y el riesgo cardiovascular. Curiosamente, al combinar la evidencia en los sistemas inmunológico, pulmonar y cardiovascular, el uso de métodos de bajo volumen/duración y la manipulación de las variables de entrenamiento (cargas moderadas a altas, duración de series cortas, cantidad baja de series, elección de ejercicios, intervalos de descanso altos, y/o descanso dentro de la serie) pueden ser particularmente seguros (Figura 2). El EF también puede ser conveniente, ya que se puede realizar con diferentes implementos (máquinas tradicionales, dispositivos elásticos, ejercicios con el peso corporal o sin carga externa) y entornos (en el hospital, instalaciones de ejercicio o en el hogar), lo que aumenta su viabilidad.
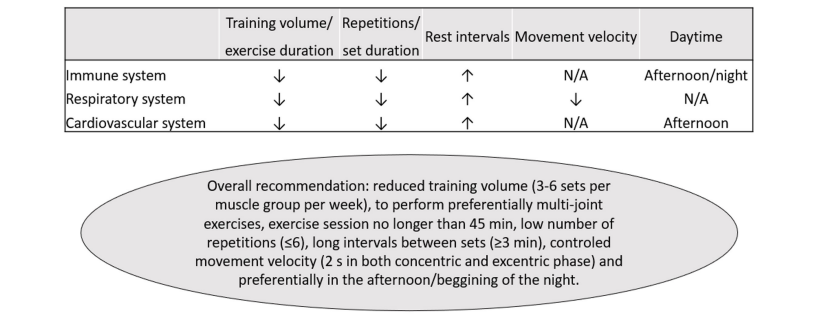
Figura 2. Recomendaciones prácticas para el entrenamiento de la fuerza en sobrevivientes de COVID-19. ↑, más alto; ↓, más bajo. N/A, no disponible.
Finalmente, el FE como un método de tratamiento rehabilitador debe individualizarse según la necesidad del paciente, teniendo en cuenta sus comorbilidades, síntomas de disnea y malestar psicológico.
Declaración de disponibilidad de datos
Los datos en bruto que respaldan las conclusiones de este artículo son puestos a disposición por los autores, sin reservas indebidas.
Financiamiento
El autor PG recibe una beca de investigación del CNPq (304435/2018-0).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
El editor responsable declaró una coautoría pasada con uno de los autores PG.
Material suplementario
El material complementario de este artículo se puede encontrar en: https://www.frontiersin.org/articles/10.3389/fphys.2021.637590/full#supplementary-material
Referencias
1. Aboodarda, S. J., George, J., Mokhtar, A. H., and Thompson, M. (2011). Muscle strength and damage following two modes of variable resistance training. J. Sport. Sci. Med. 10, 635–642.
2. Aboodarda, S. J., Page, P. A., and Behm, D. G. (2016). Muscle activation comparisons between elastic and isoinertial resistance: a meta-analysis. Clin. Biomech. 39, 52–61.
3. ACSM. (2009). American college of sports medicine position stand. progression models in resistance training for healthy adults. Med. Sci. Sport. Exerc. 41, 687–708.
4. Adams, J., Hubbard, M., McCullough-Shock, T., Simms, K., Cheng, D., Hartman, J., y cols. (2010). Myocardial work during endurance training and resistance training: a daily comparison, from workout session 1 through completion of cardiac rehabilitation. Proc (Bayl Univ Med Cent) 23, 126–129.
5. Albesa-Albiol, L., Serra-Payá, N., Garnacho-Castaño, M. A., Cano, L. G., Cobo, E. P., Maté-Muñoz, J. L., y cols. (2019). Ventilatory efficiency during constant-load test at lactate threshold intensity: endurance versus resistance exercises. PLoS One 14:e0216824.
6. Alonso, J. M., Edouard, P., Fischetto, G., Adams, B., Depiesse, F., and Mountjoy, M. (2012). Determination of future prevention strategies in elite track and field: analysis of Daegu 2011 IAAF Championships injuries and illnesses surveillance. Br. J. Sports Med. 46, 505–514.
7. Alonso, J. M., Tscholl, P. M., Engebretsen, L., Mountjoy, M., Dvorak, J., and Junge, A. (2010). Occurrence of injuries and illnesses during the 2009 IAAF world athletics championships. Br. J. Sports Med. 44, 1100–1105.
8. Alves, R. R., Vieira, C. A., Bottaro, M., de Araújo, M. A. S., Souza, D. C., Gomes, B. C., y cols. (2020). NO LOAD” resistance training promotes high levels of knee extensor muscles activation—a pilot study. Diagnostics 10:526.
9. Andrade, A., de Azevedo Klumb Steffens, R., Sieczkowska, S. M., Peyré Tartaruga, L. A., and Torres Vilarino, G. (2018). A systematic review of the effects of strength training in patients with fibromyalgia: clinical outcomes and design considerations. Adv. Rheumatol. 58:36.
10. Assunção, A. R., Bottaro, M., Ferreira-Junior, J. B., Izquierdo, M., Cadore, E. L., and Gentil, P. (2016). The chronic effects of low- and high-intensity resistance training on muscular fitness in adolescents. PLoS One 11:e0160650.
11. Barbalho, M., Coswig, V. S., Bottaro, M., De Lira, C. A. B., Campos, M. H., Vieira, C. A., et al. (2019). “nO LOAD” resistance training increases functional capacity and muscle size in hospitalized female patients: a pilot study. Eur. J. Transl. Myol. 29, 302–306.
12. Barbalho, M., Coswig, V., Souza, D., Serrão, J. C., Campos, M. H., and Gentil, P. (2020a). Back squat vs. hip thrust resistance-training programs in well-trained women. Int. J. Sports Med. 41, 306–310.
13. Barbalho, M., Souza, D., Coswig, V., Steele, J., Fisher, J., Abrahin, O., et al. (2020b). The effects of resistance exercise selection on muscle size and strength in trained women. Int. J. Sports Med.
14. Barker-Davies, R. M., O’Sullivan, O., Senaratne, K. P. P., Baker, P., Cranley, M., Dharm-Datta, S., et al. (2020). The stanford hall consensus statement for post-COVID-19 rehabilitation. Br. J. Sports Med. 54, 949–959.
15. Bhati, P., Moiz, J. A., Menon, G. R., and Hussain, M. E. (2019). Does resistance training modulate cardiac autonomic control? a systematic review and meta-analysis. Clin. Auton. Res. 29, 75–103.
16. Bone, A. E., Hepgul, N., Kon, S., and Maddocks, M. (2017). Sarcopenia and frailty in chronic respiratory disease: lessons from gerontology. Chron. Respir. Dis. 14, 85–99.
17. Bottaro, M., Machado, S. N., Nogueira, W., Scales, R., and Veloso, J. (2007). Effect of high versus low-velocity resistance training on muscular fitness and functional performance in older men. Eur. J. Appl. Physiol. 99, 257–264.
18. Boukelia, B., Fogarty, M. C., Davison, R. C. R., and Florida-James, G. D. (2017). Diurnal physiological and immunological responses to a 10-km run in highly trained athletes in an environmentally controlled condition of 6°C. Eur. J. Appl. Physiol. 117, 1–6.
19. Boukelia, B., Gomes, E. C., and Florida-James, G. D. (2018). Diurnal variation in physiological and immune responses to endurance sport in highly trained runners in a hot and humid environment. Oxid. Med. Cell. Longev. 2018:3402143.
20. Buitrago, S., Wirtz, N., Flenker, U., and Kleinöder, H. (2014). Physiological and metabolic responses as function of the mechanical load in resistance exercise. Appl. Physiol. Nutr. Metab. 39, 345–350.
21. Buitrago, S., Wirtz, N., Yue, Z., Kleinöder, H., and Mester, J. (2013). Mechanical load and physiological responses of four different resistance training methods in bench press exercise. J. Strength Cond. Res. 27, 1091–1100.
22. Calatayud, J., Borreani, S., Colado, J. C., Martin, F., Tella, V., and Andersen, L. L. (2015). Bench press and push-up at comparable levels of muscle activity results in similar strength gains. J. Strength Cond. Res. 29, 246–253.
23. Castelli, V., Cimini, A., and Ferri, C. (2020). Cytokine storm in COVID-19: “when you come out of the storm, you won’t be the same person who walked in. ”. Front. Immunol. 11:2132.
24. Chan, D., and Cheema, B. S. (2016). Progressive resistance training in end-stage renal disease: systematic review. Am. J. Nephrol. 44, 32–45.
25. Chan, K. S., Zheng, J. P., Mok, Y. W., Li, Y. M., Liu, Y. N., Chu, C. M., et al. (2003). SARS: prognosis, outcome and sequelae. Respirology 8, S36–S40.
26. Chen, G., Wu, D., Guo, W., Cao, Y., Huang, D., Wang, H., et al. (2020). Clinical and immunological features of severe and moderate coronavirus disease 2019. J. Clin. Invest. 130, 2620–2629.
27. Chupel, M. U., Direito, F., Furtado, G. E., Minuzzi, L. G., Pedrosa, F. M., Colado, J. C., et al. (2017). Strength training decreases inflammation and increases cognition and physical fitness in older women with cognitive impairment. Front. Physiol. 8:377.
28. Colado, J. C., Garcia-Masso, X., Pellicer, M., Alakhdar, Y., Benavent, J., and Cabeza-Ruiz, R. (2010). A comparison of elastic tubing and isotonic resistance exercises. Int. J. Sports Med. 31, 810–817.
29. Counts, B. R., Buckner, S. L., Dankel, S. J., Jessee, M. B., Mattocks, K. T., Mouser, J. G., et al. (2016). The acute and chronic effects of “NO LOAD” resistance training. Physiol. Behav. 164, 345–352.
30. da Silva, R. P., Novaes, J., Oliveira, R. J., Gentil, P., Wagner, D., and Bottaro, M. (2007). High-velocity resistance exercise protocols in older women?: effects on cardio- vascular response. J. Sport. Sci. Med. 6, 560–567.
31. Davis, J. M., Kohut, M. L., Colbert, L. H., Jackson, D. A., Ghaffar, A., and Mayer, E. P. (1997). Exercise, alveolar macrophage function, and susceptibility to respiratory infection. J. Appl. Physiol. 83, 1461–1466.
32. de Barbalho, M. D. S., Gentil, P., Izquierdo, M., Fisher, J., Steele, J., Raiol, R., et al. (2017). There are no no-responders to low or high resistance training volumes among older women. Exp. Gerontol. 99, 18–26.
33. de França, H. S., Branco, P. A. N., Guedes Junior, D. P., Gentil, P., Steele, J., and Teixeira, C. V. L. S. (2015). The effects of adding single-joint exercises to a multi-joint exercise resistance training program on upper body muscle strength and size in trained men. Appl. Physiol. Nutr. Metab. 826:150409143403004.
34. Denehy, L., and Elliott, D. (2012). Strategies for post ICU rehabilitation. Curr. Opin. Crit. Care 18, 503–508.
35. Dias, R. K. N., Penna, E. M., Noronha, A. S. N., de Azevedo, A. B. C., Barbalho, M., Gentil, P. V., et al. (2020). Cluster-sets resistance training induce similar functional and strength improvements than the traditional method in postmenopausal and elderly women. Exp. Gerontol. 138:111011.
36. Dores, H., and Cardim, N. (2020). Return to play after COVID-19: a sport cardiologist’s view. Br. J. Sports Med. 54, 1132–1133.
37. Dorneles, G. P., dos Passos, A. A. Z., Romão, P. R. T., and Peres, A. (2020). New insights about regulatory t cells distribution and function with exercise: the role of immunometabolism. Curr. Pharm. Des. 26, 979–990.
38. Eggmann, S., Verra, M. L., Luder, G., Takala, J., and Jakob, S. M. (2018). Effects of early, combined endurance and resistance training in mechanically ventilated, critically ill patients: a randomised controlled trial. PLoS One 13:e0207428.
39. Farinatti, P. T. V., and Castinheiras Net, A. G. (2011). The effect of between-set rest intervals on the oxygen uptake during and after resistance exercise sessions performed with large-and small-muscle mass. J. Strength Cond. Res. 25, 3181–3190.
40. Ferreira, T. L., Ribeiro, H. S., Ribeiro, A. L. A., Bonini-Rocha, A. C., Lucena, J. M. S., de Oliveira, P. A., et al. (2020). Exercise interventions improve depression and anxiety in chronic kidney disease patients: a systematic review and meta-analysis. Int. Urol. Nephrol.
41. Fisher, J. P., Steele, J., Gentil, P., Giessing, J., and Westcott, W. L. (2017). A minimal dose approach to resistance training for the older adult; the prophylactic for aging. Exp. Gerontol. 99, 80–86.
42. Fisher, J., Steele, J., and Smith, D. (2017). High- and low-load resistance training: interpretation and practical application of current research findings. Sport. Med. 47, 393–400.
43. Fisher, J., Steele, J., McKinnon, P., and McKinnon, S. (2014). Strength gains as a result of brief, infrequent resistance exercise in older adults. J. Sport. Med. 2014:731890.
44. Fragala, M. S., Cadore, E. L., Dorgo, S., Izquierdo, M., Kraemer, W. J., Peterson, M. D., et al. (2019). Resistance training for older adults: position statement from the national strength and conditioning association. J. Strength Cond. Res. 33, 2019–2052.
45. Freidenreich, D. J., and Volek, J. S. (2012). Immune responses to resistance exercise. Exerc. Immunol. Rev. 18, 8–41.
46. Garnacho-Castaño, M. V., Albesa-Albiol, L., Serra-Payá, N., Gomis Bataller, M., Pleguezuelos Cobo, E., Guirao Cano, L., et al. (2018). Oxygen uptake slow component and the efficiency of resistance exercises. J. Strength Cond. Res.
47. Garnacho-Castaño, M. V., Dominguez, R., and Maté-Muñoz, J. L. (2015). Understanding the meaning of lactate threshold in resistance exercises. Int. J. Sports Med. 36, 371–377.
48. Gentil, P., Bottaro, M., Noll, M., Werner, S., Vasconcelos, J. C., Seffrin, A., et al. (2017a). Muscle activation during resistance training with no external load - effects of training status, movement velocity, dominance, and visual feedback. Physiol. Behav. 179, 148–152.
49. Gentil, P., de Lira, C. A. B., Souza, D., Jimenez, A., Mayo, X., and de Fátima Pinho et al. (2020a). Resistance training safety during and after the SARS-Cov-2 outbreak: practical recommendations. Biomed Res. Int. 2020:3292916.
50. Gentil, P., Fisher, J., and Steele, J. (2017b). A review of the acute effects and long-term adaptations of single- and multi-joint exercises during resistance training. Sport Med. 47, 843–855.
51. Gentil, P., Ramirez-Campillo, R., and Souza, D. C. (2020b). Resistance training in face of the coronavirus outbreak: time to think outside the box. Front. Physiol. 11:859.
52. Gentil, P., Soares, S. R., Pereira, M. C., Cunha, R. R., Martorelli, S. S., Martorelli, A. S., et al. (2013). Effect of adding single-joint exercises to a multi-joint exercise resistance-training program on strength and hypertrophy in untrained subjects. Appl. Physiol. Nutr. Metab. 38, 341–344.
53. Gentil, P., Soares, S., and Bottaro, M. (2015). Single vs. multi-joint resistance exercises: effects on muscle strength and hypertrophy. Asian J. Sport. Med. 6:e24057.
54. Gerth, A. M. J., Hatch, R. A., Young, J. D., and Watkinson, P. J. (2019). Changes in health-related quality of life after discharge from an intensive care unit: a systematic review. Anaesthesia 74, 100–108.
55. Gjøvaag, T. F., Mirtaheri, P., Simon, K., Berdal, G., Tuchel, I., Westlie, T., et al. (2016). Hemodynamic responses to resistance exercise in patients with coronary artery disease. Med. Sci. Sports Exerc. 48, 581–588.
56. Gladstone, D. E., Kim, B. S., Mooney, K., Karaba, A. H., and D’Alessio, F. R. (2020). Regulatory T cells for treating patients with COVID-19 and acute respiratory distress syndrome: two case reports. Ann. Intern. Med. 173, 852–853.
57. Gleeson, M., Bishop, N., Oliveira, M., and Tauler, P. (2013). Influence of training load on upper respiratory tract infection incidence and antigen-stimulated cytokine production. Scand. J. Med. Sci. Sports 23, 451–457.
58. Gordon, B. R., McDowell, C. P., Hallgren, M., Meyer, J. D., Lyons, M., and Herring, M. P. (2018). Association of efficacy of resistance exercise training with depressive symptoms meta-analysis and meta-regression: analysis of randomized clinical trials. JAMA Psychiatry 75, 566–576.
59. Gordon, B. R., McDowell, C. P., Lyons, M., and Herring, M. P. (2017). The effects of resistance exercise training on anxiety: a meta-analysis and meta-regression analysis of randomized controlled trials. Sports Med. 47, 2521–2532.
60. Goshua, G., Pine, A. B., Meizlish, M. L., Chang, C.-H., Zhang, H., Bahel, P., et al. (2020). Endotheliopathy in COVID-19-associated coagulopathy: evidence from a single-centre, cross-sectional study. Lancet Haematol. 7, e575–e582.
61. Gotshall, R., Gootman, J., Byrnes, W., Fleck, S., and Valovich, T. (1999). Noninvasive characterization of the blood pressure response to double–leg press exercise. JEPonline 2, 1–6.
62. Haddock, B. L., and Wilkin, L. D. (2006). Resistance training volume and post exercise energy expenditure. Int. J. Sports Med. 27, 143–148.
63. Hayes, L. D., Bickerstaff, G. F., and Baker, J. S. (2010). Interactions of cortisol, testosterone, and resistance training: influence of circadian rhythms. Chronobiol. Int. 27, 675–705.
64. Herridge, M. S., Cheung, A. M., Tansey, C. M., Matte-Martyn, A., Diaz-Granados, N., Al-Saidi, F., et al. (2003). One-year outcomes in survivors of the acute respiratory distress syndrome. N. Engl. J. Med. 348, 683–693.
65. Horn, P. L., Pyne, D. B., Hopkins, W. G., and Barnes, C. J. (2010). Lower white blood cell counts in elite athletes training for highly aerobic sports. Eur. J. Appl. Physiol. 110, 925–932.
66. Houchen-Wolloff, L., Sandland, C. J., Harrison, S. L., Menon, M. K., Morgan, M. D., Steiner, M. C., et al. (2014). Ventilatory requirements of quadriceps resistance training in people with COPD and healthy controls. Int. J. Copd 9, 589–595.
67. Hui, D. S., Wong, K. T., Ko, F. W., Tam, L. S., Chan, D. P., Woo, J., et al. (2005). The 1-year impact of severe acute respiratory syndrome on pulmonary function, exercise capacity, and quality of life in a cohort of survivors. Chest 128, 2247–2261.
68. Jackson, J. C., Ely, E. W., Morey, M. C., Anderson, V. M., Denne, L. B., Clune, J., et al. (2012). Cognitive and physical rehabilitation of intensive care unit survivors: results of the return randomized controlled pilot investigation. Crit. Care Med. 40, 1088–1097.
69. Jones, H., Atkinson, G., Leary, A., George, K., Murphy, M., and Waterhouse, J. (2006). Reactivity of ambulatory blood pressure to physical activity varies with time of day. Hypertension 47, 778–784.
70. Jones, H., Pritchard, C., George, K., Edwards, B., and Atkinson, G. (2008). The acute post-exercise response of blood pressure varies with time of day. Eur. J. Appl. Physiol. 104, 481–489.
71. José, A., and Dal Corso, S. (2016). Inpatient rehabilitation improves functional capacity, peripheral muscle strength and quality of life in patients with community-acquired pneumonia: a randomised trial. J. Physiother. 62, 96–102.
72. Karlsdottir, A. E., Foster, C., Porcari, J. P., Palmer-McLean, K., White-Kube, R., and Backes, R. C. (2002). Hemodynamic responses during aerobic and resistance exercise. J. Cardiopulm. Rehabil. 22, 170–177.
73. Khatoon, F., Prasad, K., and Kumar, V. (2020). Neurological manifestations of COVID-19: available evidences and a new paradigm. J. Neurovirol.
74. Kikuchi, N., and Nakazato, K. (2017). Low-load bench press and push-up induce similar muscle hypertrophy and strength gain. J. Exerc. Sci. Fit. 15, 37–42.
75. Knuiman, P., Hopman, M. T. E., and Mensink, M. (2015). Glycogen availability and skeletal muscle adaptations with endurance and resistance exercise. Nutr. Metab. 12:59.
76. Kochi, A. N., Tagliari, A. P., Forleo, G. B., Fassini, G. M., and Tondo, C. (2020). Cardiac and arrhythmic complications in patients with COVID-19. J. Cardiovasc. Electrophysiol. 31, 1003–1008.
77. Kovacevic, A., Mavros, Y., Heisz, J. J., and Fiatarone Singh, M. A. (2018). The effect of resistance exercise on sleep: a systematic review of randomized controlled trials. Sleep Med. Rev. 39, 52–68.
78. Kraemer, W. J., Adams, K., Cafarelli, E., Dudley, G. A., Dooly, C., Feigenbaum, M. S., et al. (2002). American college of sports medicine position stand. progression models in resistance training for healthy adults. Med. Sci. Sport. Exerc. 34, 364–380.
79. Kraemer, W. J., Marchitelli, L., Gordon, S. E., Harman, E., Dziados, J. E., Mello, R., et al. (1990). Hormonal and growth factor responses to heavy resistance exercise protocols. J. Appl. Physiol. 69, 1442–1450.
80. Kreutz, R., Algharably, E. A. E. H., Azizi, M., Dobrowolski, P., Guzik, T., Januszewicz, A., et al. (2020). Hypertension, the renin-angiotensin system, and the risk of lower respiratory tract infections and lung injury: implications for covid-19. Cardiovasc. Res. 116, 1688–1699.
81. Krüger, K., Agnischock, S., Lechtermann, A., Tiwari, S., Mishra, M., Pilat, C., et al. (2011). Intensive resistance exercise induces lymphocyte apoptosis via cortisol and glucocorticoid receptor-dependent pathways. J. Appl. Physiol. 110, 1226–1232.
82. Lammers, M. D., Anéli, N. M., de Oliveira, G. G., de Oliveira Maciel, S. F. V., Zanini, D., Mânica, A., et al. (2020). The anti-inflammatory effect of resistance training in hypertensive women. J. Hypertens. 38, 2490–2500.
83. Lamotte, M., Fleury, F., Pirard, M., Jamon, A., and van de Borne, P. (2010). Acute cardiovascular response to resistance training during cardiac rehabilitation: effect of repetition speed and rest periods. Eur. J. Prev. Cardiol. 17, 329–336.
84. Lamotte, M., Niset, G., and van de Borne, P. (2005). The effect of different intensity modalities of resistance training on beat-to-beat blood pressure in cardiac patients. Eur. J. Cardiovasc. Prev. Rehabil. 12, 12–17.
85. Levinger, I., Bronks, R., Cody, D. V., Linton, I., and Davie, A. (2005). Resistance training for chronic heart failure patients on beta blocker medications. Int. J. Cardiol. 102, 493–499.
86. Li, N., Li, P., Lu, Y., Wang, Z., Li, J., Liu, X., et al. (2019). Effects of resistance training on exercise capacity in elderly patients with chronic obstructive pulmonary disease: a meta-analysis and systematic review. Aging Clin. Exp. Res. 32, 1911–1922.
87. Li, Y. C., Bai, W. Z., and Hashikawa, T. (2020). The neuroinvasive potential of SARS-CoV2 may play a role in the respiratory failure of COVID-19 patients. J. Med. Virol. 92, 552–555.
88. Li, Z., Cai, Y., Zhang, Q., Zhang, P., Sun, R., Jiang, H., et al. (2020). Intensive care unit acquired weakness. Medicine 99:e21926.
89. Liao, W. H., Chen, J. W., Chen, X., Lin, L., Yan, H. Y., Zhou, Y. Q., et al. (2015). Impact of resistance training in subjects with COPD: a systematic review and meta-analysis. Respir. Care 60, 1130–1145.
90. MacDougall, J. D., McKelvie, R. S., Moroz, D. E., Sale, D. G., McCartney, N., and Buick, F. (1992). Factors affecting blood pressure during heavy weight lifting and static contractions. J. Appl. Physiol. 73, 1590–1597.
91. Madjid, M., Safavi-Naeini, P., Solomon, S. D., and Vardeny, O. (2020). Potential effects of coronaviruses on the cardiovascular system: a review. JAMA Cardiol. 5, 831–840.
92. Marillier, M., Bernard, A. C., Vergès, S., and Neder, J. A. (2020). Locomotor muscles in COPD: the rationale for rehabilitative exercise training. Front. Physiol. 10:1590.
93. Martínez-Velilla, N., Casas-Herrero, A., Zambom-Ferraresi, F., Sáez, de Asteasu, M. L., Lucia, A., et al. (2019). Effect of exercise intervention on functional decline in very elderly patients during acute hospitalization. JAMA Intern. Med. 179, 28–36.
94. Martins, W. R., de Oliveira, R. J., Carvalho, R. S., de Oliveira Damasceno, V., da Silva, V. Z. M., and Silva, M. S. (2013). Elastic resistance training to increase muscle strength in elderly: a systematic review with meta-analysis. Arch. Gerontol. Geriatr. 57, 8–15.
95. Mazzetti, S., Wolff, C., Yocum, A., Reidy, P., Douglass, M., and Cochran, M. (2011). Effect of maximal and slow versus recreational muscle contractions on energy expenditure in trained and untrained men. J. Sport Med. Phys. Fit. 51, 381–392.
96. McCartney, N. (1998). Role of resistance training in heart disease. Med. Sci. Sports Exerc. 30, S396–S402.
97. McDonagh, M. J., and Davies, C. T. (1984). Adaptive response of mammalian skeletal muscle to exercise with high loads. Eur. J. Appl. Physiol. Occup. Physiol. 52, 139–155.
98. McKelvie, R. S., and McCartney, N. (1990). Weightlifting training in cardiac patients: considerations. Sport Med. 10, 355–364.
99. McKelvie, R. S., McCartney, N., Tomlinson, C., Bauer, R., and MacDougall, J. D. (1995). Comparison of hemodynamic responses to cycling and resistance exercise in congestive heart failure secondary to ischemic cardiomyopathy. Am. J. Cardiol. 76, 977–979.
100. Miles, M. P., Kraemer, W. J., Nindl, B. C., Grove, D. S., Leach, S. K., Dohi, K., et al. (2003). Strength, workload, anaerobic intensity and the immune response to resistance exercise in women. Acta Physiol. Scand. 178, 155–163.
101. Mitchell, C. J., Churchward-Venne, T. A., West, D. W. D., Burd, N. A., Breen, L., Baker, S. K., et al. (2012). Resistance exercise load does not determine training-mediated hypertrophic gains in young men. J. Appl. Physiol. 113, 71–77.
102. Mookerjee, S., Welikonich, M. J., and Ratamess, N. A. (2016). Comparison of energy expenditure during single-set vs. multiple-set resistance exercise. J. Strength Cond. Res. 30, 1447–1452.
103. Morris, P. E., Berry, M. J., Files, D. C., Thompson, J. C., Hauser, J., Flores, L., et al. (2016). Standardized rehabilitation and hospital length of stay among patients with acute respiratory failure a randomized clinical trial. J. Am. Med. Assoc. 315, 2694–2702.
104. Morton, R. W., Oikawa, S. Y., Wavell, C. G., Mazara, N., McGlory, C., Quadrilatero, J., et al. (2016). Neither load nor systemic hormones determine resistance training-mediated hypertrophy or strength gains in resistance-trained young men. J. Appl. Physiol. 121, 129–138.
105. Mukaimoto, T., and Ohno, M. (2012). Effects of circuit low-intensity resistance exercise with slow movement on oxygen consumption during and after exercise. J. Sports Sci. 30, 79–90.
106. Natale, V. M., Brenner, I. K., Moldoveanu, A. I., Vasiliou, P., Shek, P., and Shepard, R. J. (2003). Effects of three different types of exercise on blood leukocyte count during and following exercise. Sao Paulo Med. J. 121, 9–14.
107. Nieman, D. C. (2007). Marathon training and immune function. Sports Med. 37, 412–415.
108. Nieman, D. C., and Wentz, L. M. (2019). The compelling link between physical activity and the body’s defense system. J. Sport Heal. Sci. 8, 201–217.
109. Nogueira, W., Gentil, P., Mello, S. N. M., Oliveira, R. J., Bezerra, A. J. C., and Bottaro, M. (2009). Effects of power training on muscle thickness of older men. Int. J. Sport Med. 30, 200–204.
110. Oeyen, S. G., Vandijck, D. M., Benoit, D. D., Annemans, L., and Decruyenaere, J. M. (2010). Quality of life after intensive care: a systematic review of the literature. Crit. Care Med. 38, 2386–2400.
111. Ong, K. C., Ng, A. W. K., Lee, L. S. U., Kaw, G., Kwek, S. K., Leow, M. K. S., et al. (2005). 1-Year pulmonary function and health status in survivors of severe acute respiratory syndrome. Chest 128, 1393–1400.
112. Osthoff, A. K. R., Taeymans, J., Kool, J., Marcar, V., and Van Gestel, A. J. R. (2013). Association between peripheral muscle strength and daily physical activity in patients with COPD: a systematic literature review and meta-analysis. J. Cardiopulm. Rehabil. Prev. 33, 351–359.
113. Palmer, C. S., Ostrowski, M., Balderson, B., Christian, N., and Crowe, S. M. (2015). Glucose metabolism regulates T cell activation, differentiation, and functions. Front. Immunol. 6:1.
114. Paoli, A., Gentil, P., Moro, T., Marcolin, G., and Bianco, A. (2017). Resistance training with single vs. multi-joint exercises at equal total load volume: effects on body composition, cardiorespiratory fitness, and muscle strength. Front. Physiol. 8:1105.
115. Peake, J. M., Neubauer, O., Walsh, N. P., and Simpson, R. J. (2017). Recovery of the immune system after exercise. J. Appl. Physiol. 122, 1077–1087.
116. Pedersen, B. K., and Hoffman-Goetz, L. (2000). Exercise and the immune system: regulation, integration, and adaptation. Physiol. Rev. 80, 1055–1081.
117. Pedersen, B. K., Rohde, T., and Ostrowski, K. (1998). Recovery of the immune system after exercise. Acta Physiol. Scand. 162, 325–332.
118. Pelliccia, A., Solberg, E. E., Papadakis, M., Adami, P. E., Biffi, A., Caselli, S., et al. (2019). Recommendations for participation in competitive and leisure time sport in athletes with cardiomyopathies, myocarditis, and pericarditis: position statement of the sport cardiology section of the european association of preventive cardiology (EAPC). Eur. Heart J. 40, 19–33.
119. Peters, E. M., and Bateman, E. D. (1983). Ultramarathon running and upper respiratory tract infections. an epidemiological survey. S. Afr. Med. J. 64, 582–584.
120. Phelan, D., Kim, J. H., and Chung, E. H. (2020). A game plan for the resumption of sport and exercise after coronavirus disease 2019 (COVID-19) infection. JAMA Cardiol. 5, 1085–1086.
121. Rama, L., Teixeira, A. M., Matos, A., Borges, G., Henriques, A., Gleeson, M., et al. (2013). Changes in natural killer cell subpopulations over a winter training season in elite swimmers. Eur. J. Appl. Physiol. 113, 859–868.
122. Ramel, A., Wagner, K. H., and Elmadfa, I. (2003). Acute impact of submaximal resistance exercise on immunological and hormonal parameters in young men. J. Sports Sci. 21, 1001–1008.
123. Ramírez-Campillo, R., Castillo, A., de la Fuente, C. I., Campos-Jara, C., Andrade, D. C., Álvarez, C., et al. (2014). High-speed resistance training is more effective than low-speed resistance training to increase functional capacity and muscle performance in older women. Exp. Gerontol. 58, 51–57.
124. Ratamess, N. A., Falvo, M. J., Mangine, G. T., Hoffman, J. R., Faigenbaum, A. D., and Kang, J. (2007). The effect of rest interval length on metabolic responses to the bench press exercise. Eur. J. Appl. Physiol. 100, 1–17.
125. Ratamess, N. A., Rosenberg, J. G., Kang, J., Sundberg, S., Izer, K. A., Levowsky, J., et al. (2014). Acute oxygen uptake and resistance exercise performance using different rest interval lengths: the influence of maximal aerobic capacity and exercise sequence. J. Strength Cond. Res. 28, 1875–1888.
126. Rice, H., Harrold, M., Fowler, R., Watson, C., Waterer, G., and Hill, K. (2020). Exercise training for adults hospitalized with an acute respiratory condition: a systematic scoping review. Clin. Rehabil. 34, 45–55.
127. Rúa-Alonso, M., Mayo, X., Mota, J., Kingsley, J. D., and Iglesias-Soler, E. (2020). A short set configuration attenuates the cardiac parasympathetic withdrawal after a whole-body resistance training session. Eur. J. Appl. Physiol. 120, 1905–1919.
128. Santiago, L., Ǎngelo, M., Neto, L. G. L., Pereira, G. B., Leite, R. D., Mostarda, C. T., et al. (2018). Effects of resistance training on immunoinflammatory response, TNF-alpha gene expression, and body composition in elderly women. J. Aging Res. 2018:1467025.
129. Schellhorn, P., Klingel, K., and Burgstahler, C. (2020). Return to sports after COVID-19 infection. Eur. Heart J. 41, 4382–4384.
130. Scott, C. B., Leighton, B. H., Ahearn, K. J., and McManus, J. J. (2011). Aerobic, anaerobic, and excess postexercise oxygen consumption energy expenditure of muscular endurance and strength: 1-set of bench press to muscular fatigue. J. Strength Cond. Res. 25, 903–908.
131. Seguro, C., Viana, R., Lima, G., Galvão, L., Silva, L., Jardim, T., et al. (2019). Improvements in health parameters of a diabetic and hypertensive patient with only 40 minutes of exercise per week: a case study. Disabil. Rehabil. 42, 3119–3125.
132. Siedlik, J. A., Benedict, S. H., Landes, E. J., Weir, J. P., Vardiman, J. P., and Gallagher, P. M. (2016). Acute bouts of exercise induce a suppressive effect on lymphocyte proliferation in human subjects: a meta-analysis. Brain. Behav. Immun. 56, 343–351.
133. Smilios, I., Pilianidis, T., Karamouzis, M., and Tokmakidis, S. P. (2003). Hormonal responses after various resistance exercise protocols. Med. Sci. Sport Exerc. 35, 644–654.
134. Smilios, I., Pilianidis, T., Karamouzis, M., Parlavantzas, A., and Tokmakidis, S. P. (2007). Hormonal responses after a strength endurance resistance exercise protocol in young and elderly males. Int. J. Sports Med. 28, 401–406.
135. So, R. C. H., Ko, J., Yuan, Y. W. Y., Lam, J. J., and Louie, L. (2004). Severe acute respiratory syndrome and sport: facts and fallacies. Sport Med. 34, 1023–1033.
136. Sosnowski, K., Lin, F., Mitchell, M. L., and White, H. (2015). Early rehabilitation in the intensive care unit: an integrative literature review. Aust. Crit. Care 28, 216–225.
137. Souza, D., Barbalho, M., and Gentil, P. (2020). The role of resistance training volume on muscle size and lean body mass: to infinity and beyond? Hum. Mov. 21, 18–29.
138. Souza, D., Barbalho, M., Vieira, C. A., Martins, W. R., Cadore, E. L., and Gentil, P. (2019). Minimal dose resistance training with elastic tubes promotes functional and cardiovascular benefits to older women. Exp. Gerontol. 115, 132–138.
139. Souza, P. S., Gonçalves, E. D., Pedroso, G. S., Farias, H. R., Junqueira, S. C., Marcon, R., et al. (2017). Physical exercise attenuates experimental autoimmune encephalomyelitis by inhibiting peripheral immune response and blood-brain barrier disruption. Mol. Neurobiol. 54, 4723–4737.
140. Spence, L., Brown, W. J., Pyne, D. B., Nissen, M. D., Sloots, T. P., Mccormack, J. G., et al. (2007). Incidence, etiology, and symptomatology of upper respiratory illness in elite athletes. Med. Sci. Sports Exerc. 39, 577–586.
141. Spruit, M. A., Janssen, D. J. A., Franssen, F. M. E., and Wouters, E. F. M. (2009). Rehabilitation and palliative care in lung fibrosis. Respirology 14, 781–787.
142. Steardo, L., Steardo, L., and Verkhratsky, A. (2020). Psychiatric face of COVID-19. Transl. Psychiatry 10:261.
143. Steele, J., Androulakis-Korakakis, P., Perrin, C., Fisher, J. P., Gentil, P., Scott, C., et al. (2019). Comparisons of resistance training and ‘cardio’ exercise modalities as countermeasures to microgravity induced physical deconditioning: new perspectives and lessons learned from terrestrial studies. Front. Physiol. 10:1150.
144. Steiner, M. C. (2007). Sarcopaenia in chronic obstructive pulmonary disease. Thorax 62, 101–103.
145. Stephen-Victor, E., Das, M., Karnam, A., Pitard, B., Gautier, J. F., and Bayry, J. (2020). Potential of regulatory T-cell-based therapies in the management of severe COVID-19. Eur. Respir. J. 56:2002182.
146. Swallow, E. B., Reyes, D., Hopkinson, N. S., Man, W. D. C., Porcher, R., Cetti, E. J., et al. (2007). Quadriceps strength predicts mortality in patients with moderate to severe chronic obstructive pulmonary disease. Thorax 62, 115–120.
147. Takahashi, A., Abe, K., Usami, K., Imaizumi, H., Hayashi, M., Okai, K., et al. (2015). Simple resistance exercise helps patients with non-alcoholic fatty liver disease. Int. J. Sports Med. 36, 848–852.
148. Takahashi, A., Imaizumi, H., Hayashi, M., Okai, K., Abe, K., Usami, K., et al. (2017). Simple resistance exercise for 24 weeks decreases alanine aminotransferase levels in patients with non-alcoholic fatty liver disease. Sport Med. Int. Open 01, E2–E7.
149. Tansey, C. M., Louie, M., Loeb, M., Gold, W. L., Muller, M. P., De Jager, J. A., et al. (2007). One-year outcomes and health care utilization in survivors of severe acute respiratory syndrome. Arch. Intern. Med. 167, 1312–1320.
150. Timpka, T., Jacobsson, J., Bargoria, V., Périard, J. D., Racinais, S., Ronsen, O., et al. (2017). Preparticipation predictors for championship injury and illness: cohort study at the Beijing 2015 international association of athletics federations world championships. Br. J. Sports Med. 51, 272–277.
151. Troosters, T., Probst, V. S., Crul, T., Pitta, F., Gayan-Ramirez, G., Decramer, M., et al. (2010). Resistance training prevents deterioration in quadriceps muscle function during acute exacerbations of chronic obstructive pulmonary disease. Am. J. Respir. Crit. Care Med. 181, 1072–1077.
152. Troyer, E. A., Kohn, J. N., and Hong, S. (2020). Are we facing a crashing wave of neuropsychiatric sequelae of COVID-19? neuropsychiatric symptoms and potential immunologic mechanisms. Brain Behav. Immun. 87, 34–39.
153. Tsuzuku, S., Kajioka, T., Sakakibara, H., and Shimaoka, K. (2017). Slow movement resistance training using body weight improves muscle mass in the elderly: a randomized controlled trial. Scand. J. Med. Sci. Sports 28, 1339–1344.
154. Vale, A. F., Carneiro, J. A., Jardim, P. C. V., Jardim, T. V., Steele, J., Fisher, J. P., et al. (2018). Acute effects of different resistance training loads on cardiac autonomic modulation in hypertensive postmenopausal women. J. Transl. Med. 16:240.
155. Veldema, J., Bösl, K., Kugler, P., Ponfick, M., Gdynia, H. J., and Nowak, D. A. (2019). Cycle ergometer training vs resistance training in ICU-acquired weakness. Acta Neurol. Scand. 140, 62–71.
156. Verrill, D., Shoup, E., McElveen, G., Witt, K., and Bergey, D. (1992). Resistive exercise training in cardiac patients: recommendations. Sport Med. 13, 171–193.
157. Verwoert, G. C., de Vries, S. T., Bijsterveld, N., Willems, A. R., vd Borgh, R., Jongman, J. K., et al. (2020). Return to sports after COVID-19: a position paper from the dutch sports cardiology section of the netherlands society of cardiology. Neth. Heart. J. 28, 391–395.
158. Vincent, K. R., and Vincent, H. K. (2012). Resistance exercise for knee osteoarthritis. PM R 4, S45–S52.
159. Vindegaard, N., and Eriksen Benros, M. (2020). COVID-19 pandemic and mental health consequences: systematic review of the current evidence. Brain Behav. Immun. 89, 531–542.
160. Wang, D., Hu, B., Hu, C., Zhu, F., Liu, X., Zhang, J., et al. (2020). Clinical Characteristics of 138 hospitalized patients with 2019 novel coronavirus-infected pneumonia in wuhan, China. J. Am. Med. Assoc. 323, 1061–1069.
161. Wilson, M. G., Hull, J. H., Rogers, J., Pollock, N., Dodd, M., Haines, J., et al. (2020). Cardiorespiratory considerations for return-to-play in elite athletes after COVID-19 infection: a practical guide for sport and exercise medicine physicians. Br. J. Sports Med. 54, 1157–1161.
162. Wu, Y. C., Chen, C. S., and Chan, Y. J. (2020). The outbreak of COVID-19: an overview. J. Chin. Med. Assoc. 83, 217–220.
163. Yamamoto, S., Hotta, K., Ota, E., Mori, R., and Matsunaga, A. (2016). Effects of resistance training on muscle strength, exercise capacity, and mobility in middle-aged and elderly patients with coronary artery disease: a meta-analysis. J. Cardiol. 68, 125–134.
164. Zhang, C., Wu, Z., Li, J. W., Tan, K., Yang, W., Zhao, H., et al. (2020). Discharge may not be the end of treatment: pay attention to pulmonary fibrosis caused by severe COVID-19. J. Med. Virol. 93, 1378–1386.
165. Zu, Z. Y., Jiang, M., Di, Xu, P. P., Chen, W., Ni, Q. Q., et al. (2020). Coronavirus disease 2019 (COVID-19): a perspective from China. Radiology 296, E15–E25.
Cita Original
Paulo Gentil, Claudio Andre Barbosa de Lira, Victor Coswig, Weimar Kunz Sebba Barroso, Priscila Valverde de Oliveira Vitorino, Rodrigo Ramirez-Campillo, Wagner Martins, Daniel Souza (2021). (2021). Practical recommendations relevant to the use of resistance training for COVID-19 survivors. Frontiers in physiology, 12, 142. https://doi.org/10.3389/fphys.2021.637590
Cita en Rev Edu Fís
Paulo Gentil, Claudio Andre Barbosa de Lira, Victor Coswig, Weimar Kunz Sebba Barroso, Priscila Valverde de Oliveira Vitorino, Rodrigo Ramirez-Campillo, Wagner Martins Daniel Souza (2021). Recomendaciones Prácticas Relevantes para el Uso del Entrenamiento de la Fuerza para Sobrevivientes de COVID-19. . (163).https://g-se.com/recomendaciones-practicas-relevantes-para-el-uso-del-entrenamiento-de-la-fuerza-para-sobrevivientes-de-covid-19-2855-sa-i607dd8c9d9024
