Posible Relación entre la Suplementación con Ácido Fólico y la Mejora en la Dilatación Mediada por el Flujo en Mujeres Deportistas Pre Menopáusicas y Eumenorreicas
Anne Z Hoch1, Nicholas M Pajewski2, Raymond G Hoffmann2, Jane E Schimke3, David D Gutterman41 Departments of Orthopaedic Surgery/Cardiovascular Center.
2 Division of Biostatistics/Department of Population Health/ General Clinical Research Center.
3 Orthopaedic Surgery.
4 Cardiovascular Center, Medical College of Wisconsin, Milwaukee, WI, USA.
Resumen
El propósito de este estudio fue determinar si la suplementación con ácido fólico en un período de seis semanas podría mejorar la dilatación mediada por el flujo endotelial de la arteria braquial en mujeres corredoras eumenorreicas con niveles previos normales de folato en suero. Este fue un estudio piloto prospectivo, con diseño aleatorio doble ciego, y con una muestra por conveniencia. Dieciséis mujeres eumenorreicas quienes no estaban tomando anticonceptivos y que corrían por lo menos 20 millas/semana, realizaron aleatoriamente un protocolo de suplementación con ácido fólico o placebo de 10 mg/día durante por lo menos 6 semanas. Los niveles de folato en suero y las mediciones de la arteria braquial fueron realizados durante la fase folicular temprana del ciclo menstrual, en estado sedentario, seguido de un ayuno de 8 horas; utilizando una técnica de ultrasonido estándar. En estado basal, la respuesta del vasodilatador de la arteria braquial a la hiperemia reactiva fue similar entre el grupo que consumió el ácido fólico (6.6% ± 0.8%, media ± EE) y el grupo que consumió el placebo (6.5% ± 0.7%). Después de 6 semanas, hubo un cambio significativamente mayor en la dilatación mediada por el flujo en el grupo que consumió el ácido fólico (3.5% ± 0.6%) comparado con el grupo placebo (0.1% ± 0.2%) (p = 0.01). Los niveles de folato en suero también se incrementaron significativamente en el grupo que consumió ácido fólico después de 6 semanas de suplementación. Este estudio demuestra que la dilatación mediada por el flujo de la arteria braquial mejora significativamente en mujeres corredoras eumenorreicas con niveles previos de folato en suero normales luego de 6 semanas de suplementación con ácido fólico.
Palabras Clave: pre menopausia, menstruación regular, función endotelial, folato, flujo mediado por vasodilatación
INTRODUCCION
La enfermedad cardiovascular es la causa número uno de muerte en mujeres, para las cuales el riesgo enfermedad después de la menopausia se incrementa al disminuir los niveles de estrógeno. Una deficiente función endotelial ha ganado aceptación como el evento aterogénico centinela (Celermajer, 1997; Ganz et al., 2003; Ross, 1999) en la enfermedad cardiovascular; ya que se ha observado esta condición en mujeres pre menopáusicas luego de siete días de una ovariectomía (Ohmichi et al., 2003) y después de tres meses de la menopausia (Lieberman et al., 1994). La dilatación mediada por el flujo (FMD) puede ser utilizada como un marcador tangible para cuantificar la función celular endotelial y así evaluar el riesgo cardiovascular. Diversos investigadores (Rickenlund et al., 2005a; Rickenlund et al., 2005b) han demostrado recientemente que las corredoras jóvenes con amenorrea asociada al entrenamiento exhiben una menor FMD endotelial de la arteria braquial en comparación con corredoras eumenorreicas. La magnitud de la disfunción endotelial en estas mujeres jóvenes (edad 21.9 ± 1.2 años, media ± EE) fue alarmante: con una FMD del 1.10% ± 0.96%, la cual es similar a la exhibida por mujeres de edad significativamente mayor (edad 60.0 ± 2.0 años) con enfermedad cardiovascular establecida (Celermajer et al., 1992). Además, los investigadores observaron que las corredoras eumenorreicas y oligomenorreicas en el estudio tenían la función endotelial al mínimo de lo normal a pesar de los factores de riesgo no aparentes para enfermedad cardiovascular (Hoch et al., 2003). Las consecuencias clínicas de esta observación en los grupos eumenorreicos y oligomenorreicos no son claras. No obstante, sería importante la evaluación de la etiología, tratamiento, y consecuencias futuras dado a que estos hallazgos sugieren el potencial incremento del riesgo vascular.
Estudios previos han demostrado que el estrógeno incrementa la FMD. Sin embargo, a la luz de los recientes hallazgos obtenidos por la Women’s Health Initiative (Rossouw et al., 2002), que revelaron que la utilización de estrógeno para el tratamiento puede incrementar los riesgos cardiovasculares, se deberían considerar terapias alternativas. El ácido fólico se ha convertido recientemente en un suplemento popular debido a sus potenciales beneficios relacionados con los parámetros cardiovasculares tales como la función endotelial, la rigidez arterial, la presión sanguínea y la actividad trombótica (Chambers et al., 2000; Deol et al., 2004; Mangoni et al., 2001; 2002; 2003; 2005; Schutte et al., 2004; Undas et al., 1999; van Dijk et al., 2001). Existen diversos mecanismos para explicar la efectividad de la terapia con folato. Se presume que los folatos participan en la regeneración endógena de tetrahidrobiopterina (Wever et al., 1997), un co-factor esencial para la producción de óxido por la óxido nítrico sintetasa endotelial (eNOS); y este rol podría resultar en una producción incrementada de NO luego de la suplementación. Además, el bien conocido efecto regulador del ácido fólico sobre la homocisteína podría contribuir a la mejora de la función endotelial (Pancharuniti et al., 1994; van den et al., 1995); sin embargo, esta hipótesis ha sido recientemente criticada dado que algunos estudios han demostrado que el ácido fólico mejora la función endotelial sin producir cambios significativos en la concentración de homocisteína (Mangoni et al., 2002; 2005; Verhaar et al., 1998). Por último, recientes datos in vitro señalan que el ácido fólico puede tener un efecto antioxidante directo sobre los vasos sanguíneos, incrementando así la biodisponibilidad de NO y mejorando la FMD (Bonetti et al., 2003). Estudios previos indicaron que no existen diferencias significativan en la vasodilatación independiente del endotelio entre mujeres amenorreicas, oligomenorreicas y eumenorreicas. (Hoch et al., 2003); por lo que, nos concentraremos únicamente en las diferencias de la FMD endotelio dependientes. El propósito de este estudio fue determinar si 6 semanas de suplementación con altas dosis de ácido fólico (10 mg·dia-1) podrían mejorar la FMD de la arteria braquial en corredoras eumenorreicas con niveles normales de folato sérico y con valores límites de la función endotelial.
METODOS
Sujetos y Diseño Experimental
Los sujetos fueron reclutados de equipos de cross country de la universidad local. Los criterios de inclusión fueron los siguientes: mujeres eumenorreicas entre 18-30 años de edad, saludables sin condiciones médicas, y que hubieran corrido al menos 20 millas/semana durante los últimos 12 meses. La eumenorrea fue definida como el sangrado menstrual cada 28-32 días por al menos 12 meses; la ovulación durante lo ciclos regulares no fue determinada. Los sujetos fueron excluidos del estudio si estaban embarazadas, si eran hipertensas (sístole > 160 mmHg y diástole > 90 mmHg), si estaban bajo terapias de anticonceptivos o de reemplazo hormonal, si eran fumadoras, oligomenorreicas o amenorreicas. Los sujetos fueron también excluidos si padecían de un tumor pituitario, desórdenes de tiroides, anormalidad cromosómica, estado de hipercoagulación, o historia de enfermedades cardiovasculares. Los sujetos no fueron excluidos en relación con su raza; aunque todos eran caucásicos. Dieciséis mujeres presentaron el consentimiento informado por escrito en acuerdo con nuestro Consejo de Revisión Institucional. Tres sujetos abandonaron el grupo placebo antes de la prueba inicial debido a limitaciones de tiempo. Todos los sujetos completaron un cuestionario sobre su salud y su estado menstrual y reportaron las millas corridas por semana. Ningún sujeto presentó historia de enfermedades cardiovasculares o reportó estar tomando multivitamínicos. Los sujetos fueron asignados aleatoriamente, utilizando la técnica de bloques, a un grupo que realizó la suplementación con ácido fólico (10 mg/día, n = 8) o a un grupo placebo (n = 5), utilizando un diseño doble ciego. Se utilizaron 10 mg de ácido fólico ya que esta dosis fue utilizada en otros estudios hallándose que es una dosis segura y efectiva para mejorar la dilatación mediada por flujo (Moens et al., 2007; Title et al., 2006; US Food and Drug Administration, 2008; Wilmink et al., 2000; Woo et al., 1999). Los sujetos fueron instruidos para que ingirieran la medicación al menos durante 6 semanas. Todos los sujetos fueron estudiados por la mañana luego de una noche de ayuno. Además, los sujetos fueron estudiados durante la fase folicular de su ciclo menstrual (días 4-8) dado que se sabe que la FMD varía durante el ciclo menstrual en relación a los niveles tanto de estrógeno como de progesterona (Hashimoto et al., 1995; Mather et al., 2000; Williams et al., 2001). Para los propósitos de estandarización, se les instruyó a los sujetos que consumieran los suplementos por la mañana junto con los alimentos.
Niveles Séricos de Ácido Fólico
Los niveles séricos de ácido fólico total en ayunas fueron medidos con la utilización del sistema Bayer ADVIA Centaur, antes y después de la suplementación con ácido fólico o placebo. Este análisis es un inmunoensayo competitivo que utiliza tecnología quimioluminiscente directa. El coeficiente de variación inter ensayo fue de 5-7%, el coeficiente de variación intra-ensayo fue del 4-8% y el límite inferior de sensibilidad fue de 0.35 ng·mL-1.
Función Endotelial
Trece sujetos realizaron la prueba de funcionamiento endotelial de la arteria braquial en estado basal y después de al menos seis semanas de tratamiento con 10 mg/día de ácido fólico o placebo, usando la FMD como una medida cuantificable de la función vascular dependiente endotelial. Todos los sujetos fueron evaluados por la mañana después de 8 horas de ayuno, y durante la fase folicular temprana de su ciclo menstrual (días 4-8), ya que se sabe que la FMD varía durante el ciclo menstrual en relación con los niveles de estrógenos y progesterona. La FMD de la arteria braquial fue medida utilizando la misma técnica de ultrasonido que la utilizada en estudios previos llevados a cabo en este laboratorio y en los llevados a cabo por Celermajer (Celermajer et al., Williams et al., 2001). Se ha hallado que esta técnica tiene una reproducibilidad del coeficiente de variación del 1.4% y una repetibilidad del coeficiente de variación del 2.3%. Los sujetos fueron equipados con el instrumental para el registro continuo del ECG (3 derivaciones), de la frecuencia cardíaca, la saturación capilar de oxígeno y la presión sanguínea intermitente utilizando un esfigmomanómetro automático. La FMD fue medida como sigue: en posición supina con el brazo no dominante en posición cómoda, se colocó una muñequera esfigmomanométrica alrededor del antebrazo, en forma distal con referencia a la fosa antecubital (Corretti et al., 2002; Doshi et al., 2001b). Una máquina de ultrasonido, utilizando una sonda de huella pequeña con una frecuencia linear de 10MHz (intraoperativa), fue asegurada sobre la arteria braquial. Las imágenes de la arteria braquial fueron tomadas a lo largo del eje longitudinal después de identificar un segmento >5 cm donde se delinearan claramente los límites endoteliales distal y proximal. La sonda de ultrasonido puede ser utilizada para medir el diámetro de los vasos sanguíneos y la velocidad de flujo utilizando el modo Doppler pulsátil. El ECG se registró simultáneamente con las imágenes de ultrasonido para controlar eventos en el ciclo cardíaco. En cada punto de adquisición de datos se realizó el registro del diámetro estable durante un período de 15 segundos. Todas las imágenes de la arteria braquial fueron registradas en una cinta de video súper VHS para los análisis subsiguientes. El análisis de las imágenes fue llevado a cabo en una computadora Pentium III utilizando una tarjeta Matrox millenium para la conversión A/D de imágenes análogas a imágenes de alta resolución. El diámetro fue medido a partir de imágenes digitalizadas utilizando un programa automatizado para la detección del borde arterial (Brachial Analyzer and Brachial Imager) de Medical Imaging System (Iowa City, Iowa). Se obtuvieron diez imágenes por segundo durante 10 segundos y el diámetro mínimo promedio para cada ciclo cardiaco fue utilizado en el análisis. Para minimizar la variación, un operador experimentado llevó a cabo todos los análisis (AS); también se le ocultó al operador el estado de tratamiento; control (placebo) vs suplementación. La FMD dependiente endotelial fue cuantificada como el porcentaje pico de cambio en el diámetro de la arteria braquial a partir del valor basal de reposo (al final de la diástole) a la hiperemia reactiva, donde las mediciones se llevaron a cabo en períodos de 30 segundos, un minuto y dos minutos posteriores a la liberación de una oclusión de 4.5 minutos (aumento de la presión del esfigmomanómetro a 40 mmHg por encima de la presión sistólica). La velocidad de flujo sanguíneo en la arteria braquial fue medida como la velocidad sistólica pico a partir de la señal de velocidad de la onda pulsátil, la cual fue corregida para las angulaciones de la sonda con respecto al vaso sanguíneo. La respuesta hiperémica fue medida como el porcentaje de cambio desde el valor basal hasta el punto de hiperemia reactiva máxima luego de la liberación de la presión ejercida por el esfigmomanómetro.
Análisis Estadísticos
La estadística descriptiva para cada medida al inicio y a las 6 semanas de este estudio piloto con una muestra por conveniencia se presenta como medias ± error estándar. Debido a nuestra preocupación relacionada por la distribución normal de los datos, se utilizó el test no paramétrico de Wilcoxon para comparar el grupo experimental con el grupo control al inicio y a las seis semanas y para comparar los cambios a las 6 semanas entre los grupos experimental y placebo. El propósito principal de este estudio piloto fue comparar los cambios en la respuesta vasodilatadora de la arteria braquial a la hiperemia reactiva luego de seis semanas de suplementación con ácido fólico o placebo. Para esto, se utilizó también el análisis de covarianza (ANCOVA) para ajustar las diferencias iniciales significativas entre los dos grupos. Se utilizó un nivel alfa de 0.05 para denotar significancia estadística.
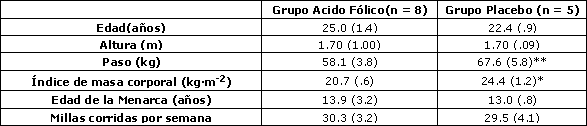
Tabla 1. Características de los sujetos. Los datos son promedios (± EE). * y ** denotan p < 0.05 y 0.01 respectivamente de acuerdo a la Prueba de Suma de Rangos de Wilcoxon.
RESULTADOS
Las características iniciales de los grupos experimental y placebo se muestran en la Tabla 1. No se observaron diferencias significativas entre los grupos con relación a la edad, la talla, la edad de la menarca, o millas corridas por semana. Debe señalarse que el grupo placebo contó inicialmente con 8 sujetos; sin embargo, tres sujetos abandonaron el estudio antes de la prueba inicial, quedando sólo 5 individuos disponibles para el análisis. El grupo que fue suplementado con ácido fólico exhibió menores valores de peso corporal (p < 0.01) y BMI (p = 0.02) al inicio del estudio.
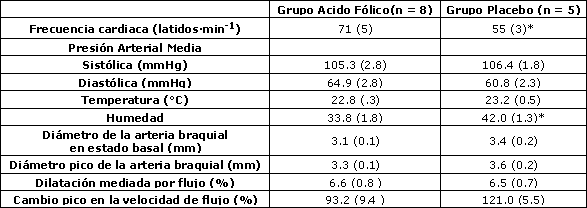
Tabla 2. Estudios de la arteria braquial antes de la suplementación. Los datos son medias (± EE). *denota p < 0.05 de acuerdo a la Prueba de Suma de Rangos de Wilcoxon.
Los valores iniciales del diámetro de la arteria braquial fueron similares entre los grupos experimental y placebo (p = 0.44), mientras que el cambio pico en la velocidad de flujo sanguíneo durante la reperfusión fue ligeramente mayor en el grupo placebo comparado con el grupo experimental, aunque la diferencia no fue estadísticamente significativa (p = 0.12) (Tabla 2). El cambio a las 6 semanas en la respuesta vasodilatadora de la arteria braquial a la hiperemia reactiva fue significativamente mayor (p<0.01) en las corredoras eumenorreicas suplementadas con ácido fólico (3.5 ± 0.6%) que en las corredoras del grupo placebo (0.1 ± 0.2%) (Figura 1 y Tabla 3). Esta diferencia persistió incluso luego de ajustar el efecto del BMI inicial utilizando el análisis de covarianza ANCOVA (p = 0.03).
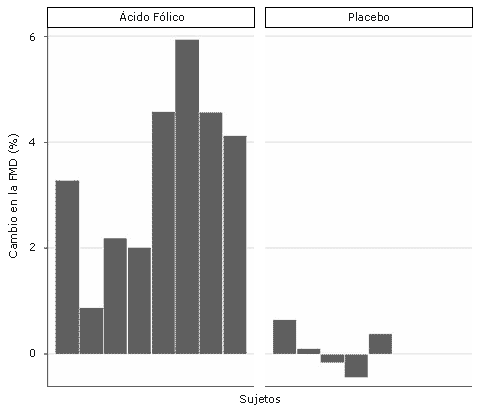
Figura 1. Cambio en seis semanas de la dilatación de la arteria braquial después de la suplementación con ácido fólico o placebo en corredoras eumenorreicas.
Los valores de las diferentes medidas post suplementación se muestran en la Tabla 4, mientras que los cambios en los parámetros de la arteria braquial a partir de la condición inicial están descriptos en la Tabla 3. Antes del período de suplementación no se observaron diferencias en los niveles séricos de folato entre los grupos (p = 0.64); mientras que, después de la suplementación, el grupo experimental mostró niveles significativamente mayores (p < 0.01) (Tabla 5), con cada miembro del grupo experimental exhibiendo un nivel de folato sérico >24 ng·mL-1. El grupo experimental exhibió un incremento de aproximadamente un 28.1% en los niveles de ácido fólico y el grupo placebo exhibió un incremento del 0.6% (p = 0.09). Esto debe interpretarse con precaución ya que nuestro laboratorio reporta valores “>24” para todos los valores mayores a 24 (i.e. 26, 28, 30, 100). Por esta razón, el porcentaje de incremento puede ser en realidad mucho mayor.
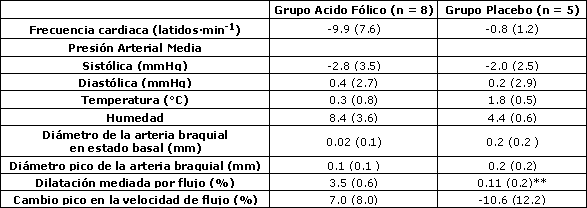
Tabla 3. Cambios en 6 semanas de las medidas de la arteria braquial después de la suplementación. Los datos son medias (± SE). ** denota p < 0.01 en concordancia a la Prueba de Suma de Rangos de Wilcoxon.
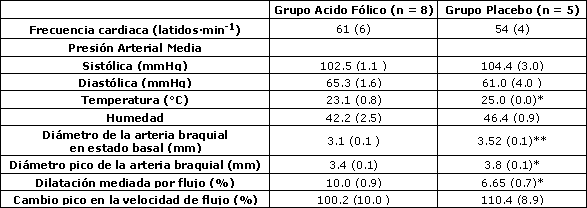
Tabla 4. Estudios de la arteria braquial después de la suplementación. Los datos son medias (± SE). * y ** denota p < 0.05 y 0.01 respectivamente en concordancia a la Prueba de Suma de Rangos de Wilcoxon.

Tabla 5. Niveles de ácido fólico. Los datos son medias (± EE). ** denota p < 0.01 en concordancia a la Prueba de Suma de Rangos de Wilcoxon.
DISCUSION
En este estudio piloto, aleatorio, doble ciego y controlado con placebo con muestreo por conveniencia, hallamos que seis semanas de terapia con ácido fólico mejoró la FMD de la arteria braquial en mujeres corredoras eumenorreicas con niveles séricos normales de folato y FMD limítrofe. En estudios previos se ha mostrado que, en diversas condiciones patológicas, la suplementación con ácido fólico mejora la función endotelial, incluyendo la hipercolesterolemia (Verhaar et al., 1998; 1999), la hipertensión (van Dijk et al., 2001), la diabetes (van Etten et al., 2002) y la enfermedad arterio coronaria (Doshi et al., 2001a; 2002). Estos datos sugieren que una ingesta mayor de ácido fólico por parte de poblaciones específicas puede tener efectos vásculo protectores. Antes de que las mujeres corredoras eumenorreicas con FMD limítrofe puedan ser adicionadas a este grupo, es necesario llevar a cabo un estudio con una mayor cohorte. Se sabe que el hipoestrogenismo tiene efectos deletéreos sobre la función endotelial y la salud cardiovascular en mujeres post menopáusicas (Lieberman et al., 1994; Mijatovic et al., 1998; Moreau et al., 2003; Ridker et al., 2000; Rosenson et al., 1998; Stevenson et al., 1993; Yen et al., 2001; Yildirir et al., 2002); y también se ha teorizado que puede contribuir, al menos parcialmente, a la disfunción endotelial en mujeres jóvenes corredoras amenorreicas (Hoch et al., 2003; Rickenlund et al., 2005b). El estrógeno desempeña un rol regulatorio importante en la función vascular a través de sus efectos sobre las células endoteliales vasculares y las células del músculo liso, las cuales expresan los dos conocidos receptores de estrógeno. Esto es importante ya que posee efectos vasodilatadores rápidos y lentos, y su acción a largo plazo inhibe las respuestas a las lesiones vasculares ayudando así a prevenir la aterosclerosis. El estrógeno incrementa la producción de óxido nítrico derivado del endotelio, provocando la vasodilatación (Cid et al., 2002; Mendelsohn, 2002; Schnaper et al., 2000), y estimula efectos genómicos a largo plazo, que resultan en un incremento de la síntesis y actividad de eNOS (Mendelsohn, 2002). Se conoce menos sobre el rol que la progesterona juega en las respuestas vasculares endoteliales dependientes tal como la FMD, especialmente en mujeres pre-menopáusicas.
Cuando se compara la supresión de estrógeno crónica en atletas amenorreicas con respecto a la fluctuación cíclica del estrógeno en atletas eumenorreicas, es más preciso valorar el estatus estrogénico y la ovulación con análisis urinarios diarios de metabolitos de estrógeno a lo largo del ciclo menstrual (O'Donnell et al., 2004). Las corredoras en el presente estudio reportaron tanto en la entrevista como en el cuestionario que habían tenido períodos menstruales normales cada 28-32 días; sin embargo, está más allá del alcance de este estudio medir los niveles séricos de estrógeno o los metabolitos diarios de estrógeno en orina. Es importante entender que la disfunción menstrual aparece a lo largo de un continuum: mujeres con ciclos anovulatorios que pueden exhibir sangrado menstrual y por lo tanto parecen eumenorreicas, pero sus niveles totales de estrógeno son menores que en mujeres con una eumenorrea ovulatoria real. Esta teoría comienza a explicar la función endotelial limítrofe observada en estudios llevados a cabo con atletas que reportaron ser oligomenorreicas y eumenorreicas (Hoch et al., 2003). Está más allá del alcance de este estudio medir los niveles de estrógeno y determinar la ovulación. Esto requiere mediciones diarias de los metabolitos urinarios cada 28-30 días. Consecuentemente, podría existir un nivel crítico de exposición al estrógeno el cual afecta la función endotelial independientemente de la presencia o ausencia del sangrado menstrual. Para ayudar en esto, Rickenlund et al. (2005b) ha demostrado recientemente que no hay diferencia en los niveles de estrógeno entre corredoras amenorrecias (29 pg·mL-1) y eumenorreicas (30 pg·mL-1) con similares programas de entrenamiento. Las mujeres sedentarias de control, por otra parte, tuvieron niveles de estrógeno significativamente mayores (38 pg·mL-1) en comparación con los grupos de corredoras. Además, se demostró que la administración de anticonceptivos por vía oral (30 μg etinilestradiol y 150 μg levonorgestrel) mejoró significativamente la FMD de la arteria braquial en corredoras jóvenes amenorreicas (Rickenlund et al., 2005b). Otros investigadores han también demostrado similares hallazgos (Hoch et al., 2005). Por lo tanto, desde una perspectiva clínica, sería lógico que si se determina una baja dilatación mediada por flujo, los médicos clínicos recomienden la ingesta diaria de ácido fólico. Sin embargo, aun debe determinarse la dosis óptima. No se han reportado efectos secundarios con la administración de 10 mg·día-1 de ácido fólico (Moens et al., 2007; Title et al., 2006; US Food and Drug Administration, 2008; Wilmink et al., 2000; Woo et al., 1999). Dosis mayores > 15 mg·día-1 pueden causar efectos secundarios como irritación estomacal, alteraciones del sueño y problemas en la piel. La RDA para el folato en mujeres cuya edad está comprendida entre 19-50 es de 400 μg·día-1 y el nivel mayor de ingesta tolerable (UL) es 1 g·día-1. Para mujeres con factores de riesgo para defectos en el tubo neural, se recomienda 4 mg. Es importante reconocer que niveles mayores de ingesta refieren a la cantidad de folato sintético (ácido fólico) consumido por día a partir de suplementos y/o alimentos fortificados. No hay riesgo de salud ni UL para fuentes naturales de folato encontradas en los alimentos. El riesgo de toxicidad a partir de la ingesta de ácido fólico a partir de suplementos y/o alimentos fortificados es baja (Hathcock, 1997). Es una vitamina soluble en agua la cual es regularmente eliminada por orina. Existe cierta evidencia que demuestra que altos niveles de ácido fólico pueden provocar ataques en pacientes que toman medicación anticonvulsiva (Herbert, 1999). Ninguno de nuestros sujetos tenía desórdenes de convulsiones. El Instituto Nacional de Salud (National Institutes of Health, 2008) también establece que, se debe tener precaución con aquellos sujetos que realizan un régimen de suplementación con ácido fólico y que padecen de deficiencia de vitamina B12 ya que esto podría ocultar la deficiencia y exacerbar la condición. Finalmente, en el presente estudio se observaron diferencias en el cambio de velocidad del flujo sanguíneo durante la reperfusión entre los grupos experimental (93%) y placebo (121%). Esto podría ser secundario a la mayor temperatura y humedad relativa registradas al momento de realizar los tests de seguimiento en este grupo. No obstante, esto amplió nuestros hallazgos ya que, aun así, el grupo experimental exhibió un incremento significativamente mayor en la FMD. Si bien estos resultados son significativos, coincidimos en el hecho que el presente estudio cuenta con diversas limitaciones. Tanto el grupo experimental como el grupo placebo fueron pequeños y a pesar de estas observaciones, se debería realizar un estudio con una cohorte mayor de individuos. Asimismo, a pesar de no contar con extensas historias dietarias, el hecho de que los niveles de folato en suero fueron significativamente mayores en el grupo experimental y que se mantuviera sin alteraciones el grupo placebo luego de las 6 semanas, probablemente confirma nuestro supuesto de que la suplementación de 10 mg·día-1 fue el factor que influenció en la cantidad de folato sérico. Finalmente, el peso y el BMI fueron significativamente menores en el grupo experimental al comienzo del estudio. No esta claro si esto jugó un rol en la FMD cuando ambos grupos estuvieron en el rango “normal” para el BMI (National Heart, 2007) así como también dentro de los 5 kg·m-2 entre cada uno (Benjamin et al., 2004). Si bien el efecto observado sobre la FMD aún persistió después del ajuste por el BMI inicial, esto y el similar desequilibrio covariado podrían aún tener el potencial de confundir nuestros resultados.
CONCLUSION
Nuestros datos indican que el tratamiento de ácido fólico por vía oral puede proveer una herramienta segura y económica para mejorar la función endotelial en corredoras eumenorreicas con FMD limítrofe y así reducir potencialmente el futuro riesgo cardiovascular. La presente observación puede tener importantes implicancias clínicas particularmente para atletas opuestos a la suplementación de estrógenos. Altas dosis de ácido fólico (10 mg·día-1) por al menos 6 semanas mejoran la FMD de la arteria braquial en corredoras eumenorreicas con niveles de folato en suero previamente normales; no obstante se requieren estudios adicionales para clarificar o aclarar el mecanismo exacto por el cual esto ocurre. Admeás, futuros estudios pueden ayudar a determinar el nivel preciso de la suplementación con ácido fólico que confiera beneficios vasculares significativos.
Puntos Clave
- El ácido folico mejora la FMD en corredoras eumenorreicas.
- El ácido fólico mejora la FMD en mujeres corredoras.
Agradecimientos
Los autores de este estudio quisieran agradecer al centro cardiovascular del Colegio Médico de Wisconsin por su apoyo continuo en nuestro estudio. También quisiéramos agradecer a Michael Widlansky, MD por revisar este manuscrito. Este estudio fue parcialmente financiado por el Centro cardiovascular del Colegio Médico de Wisconsin, Milwaukee. Este estudio también fue financiado en parte por NIH Grant 5-M01-RR00058-39.
Referencias
1. Benjamin, E.J., Larson, M.G., Keyes, M.J., Mitchell, G.F., Vasan, R.S., Keaney, J.F., Jr., Lehman, B.T., Fan, S., Osypiuk, E. and Vita, J.A (2004). Clinical correlates and heritability of flow-mediated dilation in the community: the Framingham Heart Study. Circulation 109, 613-619
2. Bonetti, P.O., Lerman, L.O. and Lerman, A (2003). Endothelial dysfunction: a marker of atherosclerotic risk. Arteriosclerosis, Thrombosis, and Vascular Biology 23, 168-175
3. Celermajer, D.S (1997). Endothelial dysfunction: does it matter? Is it reversible?. Journal of the American College of Cardiology 30, 325-333
4. Celermajer, D.S., Sorensen, K.E., Gooch, V.M., Spiegelhalter, D.J., Miller, O.I., Sullivan, I.D., Lloyd, J.K. and Deanfield, J.E (1992). Non-invasive detection of endothelial dysfunction in children and adults at risk of atherosclerosis. Lancet 340, 1111- 1115
5. Chambers, J.C., Ueland, P.M., Obeid, O.A., Wrigley, J., Refsum, H. and Kooner, J.S (2000). Improved vascular endothelial function after oral B vitamins: An effect mediated through reduced concentrations of free plasma homocysteine. Circulation 102, 2479- 2483
6. Cid, M.C., Schnaper, H. and Kleinman, H.K (2002). Estrogens and the vascular endothelium. Annals of the New York Academy of Sciences 966, 143-157
7. Corretti, M.C., Anderson, T.J., Benjamin, E.J., Celermajer, D., Charbonneau, F., Creager, M.A., Deanfield, J., Drexler, H., Gerhard- Herman, M., Herrington, D., Vallance, P., Vita, J. and Vogel, R (2002). Guidelines for the ultrasound assessment of endothelialdependent flow-mediated vasodilation of the brachial artery: a report of the International Brachial Artery Reactivity Task Force. Journal of the American College of Cardiology 39, 257- 265
8. Deol, P.S., Barnes, T.A., Dampier, K., John, P.K., Oppenheimer, C. and Pavord, S.R (2004). The effects of folic acid supplements on coagulation status in pregnancy. British Journal of Haematology 127, 204-208
9. Doshi, S.N., McDowell, I.F., Moat, S.J., Lang, D., Newcombe, R.G., Kredan, M.B., Lewis, M.J. and Goodfellow, J (2001). Folate improves endothelial function in coronary artery disease: an effect mediated by reduction of intracellular superoxide?. Arteriosclerosis, Thrombosis, and Vascular Biology 21, 1196-1202
10. Doshi, S.N., McDowell, I.F., Moat, S.J., Payne, N., Durrant, H.J., Lewis, M.J. and Goodfellow, J (2002). Folic acid improves endothelial function in coronary artery disease via mechanisms largely independent of homocysteine lowering. Circulation 105, 22-26
11. Doshi, S.N., Naka, K.K., Payne, N., Jones, C.J., Ashton, M., Lewis, M.J. and Goodfellow, J (2001). Flow-mediated dilatation following wrist and upper arm occlusion in humans: the contribution of nitric oxide. Clinical Science (London) 101, 629-635
12. Ganz, P. and Vita, J.A (2003). Testing endothelial vasomotor function: nitric oxide, a multipotent molecule. Circulation 108, 2049- 2053
13. Hashimoto, M., Akishita, M., Eto, M., Ishikawa, M., Kozaki, K., Toba, K., Sagara, Y., Taketani, Y., Orimo, H. and Ouchi, Y (1995). Modulation of endothelium-dependent flow-mediated dilatation of the brachial artery by sex and menstrual cycle. Circulation 92, 3431-3435
14. Hathcock, J.N (1997). Vitamins and minerals: efficacy and safety. Americian Journal of Clinical Nutrition 66, 427-437
15. Herbert, V (1999). Folic acid. In: Modern nutrition in health and disease. Eds: Shils, M., Olson, J., Shike, M. and Ross, AC. Baltimore: Williams & Wilkins. 433-466
16. Hoch, A.Z., Adams, B., Syed, A.Q., Syed, A.Y., Clifford, P.S. and Gutterman, D (2005). Folic acid supplementation improves endothelial function in eumenorrheic runners. Medicine & Science in Sports & Exercise 37, S52, 2005
17. Hoch, A.Z., Dempsey, R.L., Carrera, G.F., Wilson, C.R., Chen, E.H., Barnabei, V.M., Sandford, P.R., Ryan, T.A. and Gutterman, D.D (2003). Is there an association between athletic amenorrhea and endothelial cell dysfunction?. Medicine & Science in Sports & Exercise 35, 377-383
18. Lieberman, E.H., Gerhard, M.D., Uehata, A., Walsh, B.W., Selwyn, A.P., Ganz, P., Yeung, A.C. and Creager, M.A (1994). Estrogen improves endothelium-dependent, flow-mediated vasodilation in postmenopausal women. Annals of Internal Medicine 121, 936-941
19. Mangoni, A.A., Arya, R., Ford, E., Asonganyi, B., Sherwood, R.A., Ouldred, E., Swift, C.G., and Jackson, S.H (2003). Effects of folic acid and endothelial function 128 Folic acid supplementation on inflammatory and thrombogenic markers in chronic smokers. A randomised controlled trial. Thrombosis Research 110, 13-17
20. Mangoni, A.A., Ouldred, E., Swif, C.G., Jackson, S.H., Draper, R.P., Sherwood, R.A., Lambert-Hammill, M., and Wierzbicki, A.S (2001). Vascular and blood pressure effects of folic acid in older patients with cardiovascular disease. Journal of the American Geriatrics Society 49, 1003-1004
21. Mangoni, A.A., Sherwood, R.A., Asonganyi, B., Swift, C.G., Thomas, S. and Jackson, S.H (2005). Short-term oral folic acid supplementation enhances endothelial function in patients with type 2 diabetes. American Journal of Hypertension 18, 220-226
22. Mangoni, A.A., Sherwood, R.A., Swift, C.G. and Jackson, S.H (2002). Folic acid enhances endothelial function and reduces blood pressure in smokers: a randomized controlled trial. Journal of Internal Medicine 252, 497-503
23. Mather, K.J., Norman, E.G., Prior, J.C. and Elliott, T.G (2000). Preserved forearm endothelial responses with acute exposure to progesterone: A randomized cross-over trial of 17-beta estradiol, progesterone, and 17-beta estradiol with progesterone in healthy menopausal women. Journal of Clinical Endocrinology & Metabolism 85, 4644-4649
24. Mendelsohn, M.E (2002). Protective effects of estrogen on the cardiovascular system. American Journal of Cardiology 89, 12E-17E
25. Mijatovic, V., Kenemans, P., Jakobs, C., van Baal, W.M., Peters-Muller, E.R. and van der Mooren, M.J (1998). A randomized controlled study of the effects of 17beta-estradiol-dydrogesterone on plasma homocysteine in postmenopausal women. Obstetrics & Gynecology 91, 432-436
26. Moens, A.L., Claeys, M.J., Wuyts, F.L., Goovaerts, I., Van Hertbruggen, E., Wendelen, L.C., Van Hoof, V.O. and Vrints, C.J (2007). Effect of folic acid on endothelial function following acute myocardial infarction. American Journal of Cardiology 99, 476-481
27. Moreau, K.L., Donato, A.J., Tanaka, H., Jones, P.P., Gates, P.E., and Seals, D.R (2003). Basal leg blood flow in healthy women is related to age and hormone replacement therapy status. Journal of Physiology 547, 309-316
28. National Heart (2007). Calculate your body mass index. Available from URL: http://www.nhlbisupport.com/bmi/. Retrieved November 1, 2008
29. National Institutes of Health (2008). Office of dietary supplements. Dietary supplement fact sheet: Folate. Published online. Available from URL: http://ods.od.nih.gov/factsheets/folate.asp#en10. Retrieved November 13
30. O'Donnell, E. and De Souza, M. J (2004). The cardiovascular effects of chronic hypoestrogenism in amenorrhoeic athletes: a critical review. Sports Medicine 34, 601-627
31. Ohmichi, M., Kanda, Y., Hisamoto, K., Morishige, K., Takahashi, K., Sawada, K., Minekawa, R., Tasaka, K. and Murata, Y (2003). Rapid changes of flow-mediated dilatation after surgical menopause. Maturitas 44, 125-131
32. Pancharuniti, N., Lewis, C.A., Sauberlich, H.E., Perkins, L.L., Go, R.C., Alvarez, J.O., Macaluso, M., Acton, R.T., Copeland, R.B. and Cousins, A.L (1994). Plasma homocyst(e)ine, folate, and vitamin B-12 concentrations and risk for early-onset coronary artery disease. American Journal of Clinical Nutrition 59, 940-948
33. Rickenlund, A., Eriksson, M.J., Schenck-Gustafsson, K. and Hirschberg, A.L (2005). Amenorrhea in female athletes is associated with endothelial dysfunction and unfavorable lipid profile. Journal of Clinical Endocrinology & Metabolism 90, 1354-1359
34. Rickenlund, A., Eriksson, M.J., Schenck-Gustafsson, K. and Hirschberg, A.L (2005). Oral contraceptives improve endothelial function in amenorrheic athletes. Journal of Clinical Endocrinology & Metabolism 90, 3162-3167
35. Ridker, P.M., Hennekens, C.H., Buring, J.E. and Rifai, N (2000). Creactive protein and other markers of inflammation in the prediction of cardiovascular disease in women. New England Journal of Medicine 342, 836-843
36. Rosenson, R.S., Tangney, C.C. and Mosca, L.J (1998). Hormone replacement therapy improves cardiovascular risk by lowering plasma viscosity in postmenopausal women. Arteriosclerosis, Thrombosis, and Vascular Biology 18, 1902-1905
37. Ross, R (1999). Atherosclerosis--an inflammatory disease. New England Journal of Medicine 340, 115-126
38. Rossouw, J.E., Anderson, G.L., Prentice, R.L., LaCroix, A.Z., Kooperberg, C., Stefanick, M.L., Jackson, R.D., Beresford, S.A., Howard, B.V., Johnson, K.C., Kotchen, J.M. and Ockene, J (2002). Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results From the Womens Health Initiative randomized controlled trial. Journal of the American Medical Association 288, 321-333
39. Schnaper, H.W., McGuire, J., Runyan, C. and Hubchak, S.C (2000). Sex steroids and the endothelium. Current Medicinal Chemistry 7, 519-531
40. Schutte, A.E., Huisman, H.W., Oosthuizen, W., van Rooyen, J.M. and Jerling, J.C (2004). Cardiovascular effects of oral Supplementation of vitamin C, E and folic acid in young healthy males. Internacional Journal for Vitamin and Nutrition Research 74, 285-293
41. Stevenson, J.C., Crook, D. and Godsland, I.F (1993). Influence of age and menopause on serum lipids and lipoproteins in healthy women. Atherosclerosis 98, 83-90
42. Title, L.M., Ur, E., Giddens, K., McQueen, M.J. and Nassar, B.A (2006). Folic acid improves endothelial dysfunction in type 2 diabetes--an effect independent of homocysteine-lowering. Vascular Medicine 11, 101-109
43. Undas, A., Domagala, T.B., Jankowski, M. and Szczeklik, A (1999). Treatment of hyperhomocysteinemia with folic acid and vitamins B12 and B6 attenuates thrombin generation. Trombosis Research 95, 281-288
44. US Food and Drug Administration (2008). The FDA safety information and adverse event reporting program: Medical product safety information. Available from URL: http://www.fda.gov/medwatch/ SAFETY.htm. Retrieved December 8
45. Van den, B.M., Boers, G.H., Franken, D.G., Blom, H.J., Van Kamp, G.J., Jakobs, C., Rauwerda, J.A., Kluft, C. and Stehouwert, C.D (1995). Hyperhomocysteinaemia and endothelial dysfunction in young patients with peripheral arterial occlusive disease. European Journal of Clinical Investigation 25, 176-181
46. Van Dijk, R.A., Rauwerda, J.A., Steyn, M., Twisk, J.W. and Stehouwer, C.D (2001). Long-term homocysteine-lowering treatment with folic acid plus pyridoxine is associated with decreased blood pressure but not with improved brachial artery endotheliumdependent vasodilation or carotid artery stiffness. A 2-year, randomized, placebo-controlled trial. Arteriosclerosis, Thrombosis, and Vascular Biology 21, 2072-2079
47. Van Etten, R.W., de Koning, E.J., Verhaar, M.C., Gaillard, C.A. and Rabelink, T.J (2002). Impaired NO-dependent vasodilation in patients with Type II (non-insulin-dependent) diabetes mellitus is restored by acute administration of folate. Diabetologia 45, 1004-1010
48. Verhaar, M.C., Wever, R.M., Kastelein, J.J., van Dam, T., Koomans, H.A. and Rabelink, T.J (1998). 5-methyltetrahydrofolate, the active form of folic acid, restores endothelial function in familial hypercholesterolemia. Circulation 97, 237-241
49. Verhaar, M.C., Wever, R.M., Kastelein, J.J., van Loon, D., Milstien, S., Koomans, H.A. and Rabelink, T.J (1999). Effects of oral folic acid supplementation on endothelial function in familial hypercholesterolemia: A randomized placebo-controlled trial [In Process Citation]. Circulation 100, 335-338
50. Wever, R.M., van Dam, T., van Rijn, H.J., de Groot, F. and Rabelink, T.J (1997). Tetrahydrobiopterin regulates superoxide and nitric oxide generation by recombinant endothelial nitric oxide synthase. Biochemical and Biophysical Research Communications 237, 340-344
51. Williams, M.R., Westerman, R.A., Kingwell, B.A., Paige, J., Blombery, P.A., Sudhir, K. and Komesaroff, P.A (2001). Variations in endotelial function and arterial compliance during the menstrual cycle. Journal of Clinical Endocrinology & Metabolism 86, 5389-5395
52. Wilmink, H.W., Stroes, E.S., Erkelens, W.D., Gerritsen, W.B., Wever, R., Banga, J.D. and Rabelink, T.J (2000). Influence of folic acid on postprandial endothelial dysfunction. Arteriosclerosis, Thrombosis, and Vascular Biology 20, 185-188
53. Woo, K.S., Chook, P., Lolin, Y.I., Sanderson, J.E., Metreweli, C. and Celermajer, D. S (1999). Folic acid improves arterial endotelial function in adults with hyperhomocystinemia. Journal of the American College of Cardiology 34, 2002-2006
54. Yen, C.H., Hsieh, C.C., Chou, S.Y. and Lau, Y.T (2001). 17 Betaestradiol inhibits oxidized low density lipoprotein-induced generation of reactive oxygen species in endothelial cells. Life Sciences 70, 403-413
55. Yildirir, A., Aybar, F., Tokgozoglu, L., Yarali, H., Kabakci, G., Bukulmez, O., Sinici, I. and Oto, A (2002). Effects of hormona replacement therapy on plasma homocysteine and C-reactive protein levels. Gynecologic and Obstetric Investigation 53, 54- 58
Cita Original
Anne Z. Hoch, Nicholas M. Pajewski, Raymond G. Hoffmann, Jane E. Schimke and David D. Gutterman. Possible Relationship of Folic Acid Supplementation and Improved Flow-Mediated Dilation in Premenopausal, Eumenorrheic Athletic Women. Journal of Sports Science and Medicine (2009) 8, 123 - 129.
Cita en PubliCE
Anne Z Hoch, Nicholas M Pajewski, Raymond G Hoffmann, Jane E Schimke David D Gutterman (2009). Posible Relación entre la Suplementación con Ácido Fólico y la Mejora en la Dilatación Mediada por el Flujo en Mujeres Deportistas Pre Menopáusicas y Eumenorreicas. .https://g-se.com/posible-relacion-entre-la-suplementacion-con-acido-folico-y-la-mejora-en-la-dilatacion-mediada-por-el-flujo-en-mujeres-deportistas-pre-menopausicas-y-eumenorreicas-1157-sa-o57cfb271ce7ac
