Oxidación de las Grasas Durante el Ejercicio: Rol de la Lipólisis, Disponibilidad de Ácidos Grasos Libres, y Flujo Glucolítico
Edward F Coyle11 Laboratorio de Rendimiento Humano, Departamento de Kinesiología y Educación Física, Universidad de Texas en Austin, Austin, TX, EE.UU.
Resumen
Las situaciones que desplazan la oxidación de sustratos de grasas a carbohidratos, como ocurre después de ingerir alimentos ricos en carbohidratos antes del ejercicio, o aumentando la intensidad del mismo, parecen ejercer efectos bien coordinados tanto sobre el tejido adiposo como sobre el músculo esquelético. El ejercicio de alta intensidad (85 % vs. 65 % del VO2máx) reduce la movilización de AGL plasmáticos junto con una disminución directa en la oxidación de AG dentro del músculo esquelético (29). Además, la lipólisis parece limitar la oxidación de grasas cuando el ejercicio es realizado después de una comida pre-esfuerzo, más probablemente a partir de la inhibición de la lipólisis por la insulina (18). Sin embargo, el aumento de la lipólisis (a través de la infusión de intralipid y heparina), después de la ingesta de carbohidratos previo al ejercicio, sólo restaura parcialmente la oxidación de grasas hacia las condiciones de ayuno (18). El aumento en el flujo glucolítico a partir del consumo de carbohidratos antes del ejercicio también parece inhibir activa y directamente la oxidación de AG en el músculo esquelético, posiblemente inhibiendo el transporte de AG a la mitocondria (8). Aparentemente, los distintos sistemas del organismo de alguna manera actúan en concierto para minimizar la aparición de AG que no pueden ser oxidados por el músculo esquelético durante el ejercicio, cuando aumenta el flujo glucolítico.
Palabras Clave: lipólisis, oxidación de ácidos grasos, metabolismo, ejercicio, flujo glucolítico
INTRODUCCION
A pesar de ser ampliamente reconocido que las grasas y los carbohidratos son los dos sustratos principales oxidados durante el ejercicio, queda mucho por aprender acerca de los factores que regulan la oxidación de las grasas. En el músculo esquelético esta oxidación deriva predominantemente ya sea de la vasta reserva de triacilglicéridos en el tejido adiposo, o del contenido de triglicéridos directamente dentro de las fibras musculares (i.e., triacilglicéridos intramusculares; TGIM) (11). Otra fuente potencial de grasas, los triacilglicéridos plasmáticos, parece contribuir poco a la oxidación de grasas durante el ejercicio ya que la hidrólisis de quilomicrones de triacilglicéridos por la lipoproteínlipasa, y el consumo por el músculo durante la actividad, parecen ser relativamente bajos (24, 26). Sin embargo, los triacilglicéridos plasmáticos, probablemente, sirvan principalmente para reponer los TGIM después del ejercicio.
Este trabajo de revisión discutirá las condiciones durante las cuales el aporte de ácidos grasos (AG) a la mitocondria del músculo esquelético podría limitar la oxidación de grasas, durante el ejercicio. La cantidad de AG en plasma o en el sarcoplasma es pequeña, y por lo tanto su “turnover” o recambio debe ser elevado con el fin de aportar una tasa significativa de AG a la mitocondria para su oxidación. Por ello, la hidrólisis de triglicéridos (lipólisis), teóricamente establece el límite superior para la oxidación de grasa durante una actividad física. No todos los AG liberados por la lipólisis son oxidados, debido a la reesterificación o a las limitaciones en los distintos pasos del transporte de AG. Esto incluye el transporte de AG fuera del tejido adiposo, a través de la circulación en plasma, o de los capilares a la mitocondria (38). Finalmente, el transporte de AG a través de la membrana mitocondrial podría limitar la oxidación de las grasas (8). Hay un cúmulo de evidencias que indican que este último proceso es sensible al metabolismo de los carbohidratos en general, y al flujo glucolítico en particular (8).
Este artículo respalda la idea de que la oxidación de grasas en el músculo esquelético durante el ejercicio está regulada, en gran parte, por el metabolismo de los carbohidratos. Es interesante mencionar que las situaciones que desplazan la oxidación de sustratos de grasas a carbohidratos, como ocurre con las comidas carbonatadas pre-ejercicio, y el aumento en la intensidad del mismo, parecen ejercer efectos bien coordinados, tanto sobre el tejido adiposo como sobre el músculo esquelético (8, 21, 18, 29, 34). Aparentemente, los distintos sistemas del organismo se coordinan para minimizar la aparición de AG que no pueden ser oxidados por el músculo esquelético, durante el ejercicio.
MOVILIZACION Y OXIDACION DE SUSTRATOS DURANTE EJERCICIOS DE INTENSIDAD PROGRESIVA
La Figura 1 muestra el patrón con el cual los sujetos entrenados en resistencia oxidan carbohidratos y grasas durante ejercicios de intensidades progresivas, realizados después de ayunar durante la noche (29). La infusión a una tasa constante de isótopos estables y la determinación del enriquecimiento isotópico, permite el cálculo de las tasas de aparición (TaAGL) y de desaparición (TdAGL) de Ácidos Grasos Libres (AGL) plasmáticos. La oxidación de AG, con una tasa exce siva de desaparición de AGL, se calcula que es derivada de los TGIM suponiendo que la oxidación de otras reservas de triacilglicéridos durante el ejercicio (por ej., de triacilglicéridos plasmáticos) es relativamente pequeña, y que la TdAGL es completamente oxidada. Como se muestra en la Figura 1, el "turnover" (Td) de AGL en el plasma disminuye a medida que la intensidad del ejercicio aumenta de una baja (por ej., 25 % del VO2 máx., comparable a una caminata suave), a una moderada (por ej., 65 % del VO2 máx., comparable un ritmo de carrera de sostenido por 2-4 horas), a una alta intensidad (por ej., 85 % del VO2 máx., el ritmo más elevado mantenido durante 30-60 min) (Figura 1).
Además, esta disminución en el “turnover” de AGL plasmáticos (i.e., tanto Ta como Td) estuvo directamente reflejada en la concentración de AGL plasmáticos después de 30 min de ejercicio (Figura 2). No se realizaron mediciones al 45 % del VO2máx para compararlas con el 25 % del VO2máx, y poder identificar la intensidad de ejercicio con la tasa más alta de TdAGL. Es interesante observar que la TaAGL y la concentración de AGL plasmáticos aumentaron abruptamente cuando terminó el ejercicio al 85 % del VO2máx, y en menor grado después del esfuerzo al 65 % del VO2máx, con una muy poca perturbación luego de la actividad al 25 % del VO2máx (Figura 2). Dado que influjo de AGL en el plasma luego de terminar el ejercicio, no estuvo asociado con una mayor lipólisis, ello parecería reflejar la entrada en plasma de los AG “atrapados” en el tejido adiposo durante el ejercicio, posiblemente debido a un inadecuado flujo sanguíneo en el tejido adiposo (2, 33). Si, en realidad, la magnitud del aumento post-esfuerzo en la concentración de AGL refleja la “captura” relativa de AG, esto parece estar directamente relacionado con la intensidad de ejercicio. La mayor “captura” de AG en el tejido adiposo durante esfuerzos de alta versus baja intensidad (i.e., 85 % vs. 25 % del VO2máx), a pesar de las mayores tasas de lipólisis durante ejercicios de alta intensidad (29), parece prevenir la movilización en el plasma de los AG bajo condiciones durante las cuales su oxidación a través del músculo esquelético es reducida, como se discute más adelante.
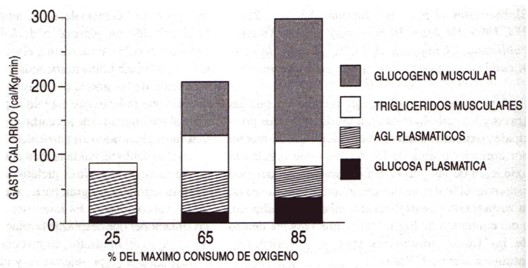
Figura 1. Contribución de los cuatro sustratos principales al gasto calórico, después de 30 min de ejercicio al 25 %, 65 % y 85% del máximo consumo de oxígeno, con ayuno previo. Reproducido con permiso de Romijn et al. (29).
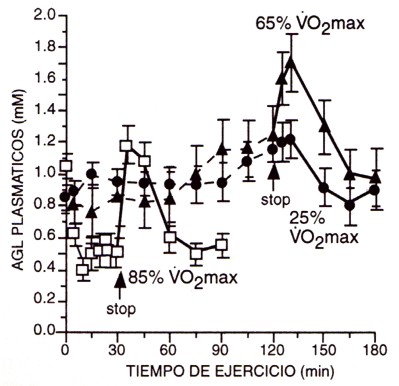
Figura 2. Concentración de AGL plasmáticos durante y después de un ejercicio al 25 %, 65 % y 85% del VO2máx, después del ayuno nocturno. Observar la magnitud del aumento en los AGL plasmáticos cuando finaliza el ejercicio, especialmente después del esfuerzo al 85 % y 65 % del máximo consumo de oxígeno. Reproducido con permiso de Romijn et al. (29).
La Figura 1 indica que el aumento en la oxidación total de grasas, cuando la intensidad de esfuerzo aumenta del 25 % al 65 % del VO2máx, parece estar derivado de la mayor oxidación de TGIM en estos sujetos entrenados en resistencia. Al 25 % del VO2máx, la oxidación total de AG es similar a la TdAGL, mientras que al 65 % del VO2máx, la TdAGL puede ser responsable de aproximadamente la mitad de la oxidación total de AG, presumiblemente con los TGIM aportando el resto. La oxidación total de grasas es menor al 85 %, en comparación con el 65% del VO2máx, asociado con grandes aumentos en el flujo glucolítico que, como se discutirá más adelante, podría ser el mecanismo por el cual el metabolismo de los carbohidratos regula de manera activa la oxidación de AG.
LIPOLISIS DURANTE EL EJERCICIO
En reposo, el “ciclo de sustratos triacilglicéridos-AG” es alto apareciendo en el plasma sólo cerca del 30 % de los AG resultantes de la lipólisis, mientras que el resto es reesterificado (40). Por lo tanto, la lipólisis en reposo excede ampliamente la TaAGL y la oxidación total de AG (3, 20, 40). Sin embargo, durante el ejercicio la reesterificación es notoriamente reducida y, por lo tanto, será menor la diferencia entre la lipólisis y la oxidación de grasas (40). Durante el ejercicio en estado de ayuno, la lipólisis excede la oxidación de grasas en un 10-30 %, de acuerdo a la intensidad de ejercicio y a la capacidad oxidativa de los sujetos (18, 22).
La lipólisis en el tejido adiposo, así como en los TGIM, está controlada por la lipasa hormona sensible, la cual es activada por estimulación de los receptores beta-adrenérgicos durante el ejercicio, en gran parte a través de la acción de las catecolaminas en general, particularmente de la epinefrina (1, 6). La lipólisis de los TGIM también podría estar influida por procesos metabólicos dentro de las fibras musculares contráctiles (26, 36). Estos procesos podrían ser responsables del aparente incremento en la oxidación de TGIM durante ejercicios al 65 %, en comparación con el 25 % del VO2máx (Figura 1). La insulina es, por lejos, la hormona antilipolítica más potente (4, 6). La disminución de la insulina por debajo de los niveles básales de reposo durante el ejercicio, podría servir para liberar aún más la inhibición de la lipólisis. En reposo, la estimulación de los receptores alfa-adrenérgicos inhibe la lipólisis en el tejido adiposo, pero este sistema ejerce poca influencia sobre la lipólisis durante el ejercicio (1). Por lo tanto, en un sentido simplificado, la lipólisis durante el ejercicio parece estar activada, en gran medida, a través de las catecolaminas y del metabolismo intramuscular, e inhibida por la acción de la insulina.
LA LIPOLISIS PUEDE LIMITAR LA OXIDACION DE LAS GRASAS DURANTE EL EJERCICIO
Durante el ejercicio en estado de ayuno, el cual está acompañado por bajos niveles de insulina, la lipólisis total excede (y por lo tanto no parece limitar) la oxidación de las grasas. Los estudios que han suministrado a los sujetos ácido nicotínico, agente anti-lipolítico en el tejido adiposo, han observado una reducción en la oxidación de grasas durante el ejercicio (15). Esta observación indica que las disminuciones en la lipólisis están asociadas con una menor oxidación de grasas, pero no se establece cuantitativamente que la oxidación de grasas estuviera reducida al nivel de la lipólisis (15). Hasta hace poco, los estudios no habían medido en forma directa la lipólisis durante el ejercicio, luego de la administración de agentes anti-lipolíticos, para comparar cuantitativamente la lipólisis y la oxidación de grasas. Reconociendo que la lipólisis es muy sensible a la insulina, Horowitz et al. (18) recientemente determinaron en forma directa que la lipólisis es marcadamente menor durante el ejercicio después de una comida rica en carbohidratos, hasta el grado en donde se iguala, y por lo tanto limita, a la oxidación de las grasas. Como se muestra en la Figura 3, durante un ejercicio (44 % del VO2máx) en estado de ayuno, la lipólisis excedía la oxidación de las grasas en un 13 %. Sin embargo, cuando el ejercicio era realizado 60 min después de haber ingerido glucosa para aumentar la insulina, la oxidación de grasas se suprimió hasta el punto en donde se igualó a la lipólisis (Figura 3). Durante una tercer serie también llevada a cabo después de la ingesta de glucosa (i.e., Glucosa + Alta Lipólisis), la lipólisis fue incrementada en forma exógena a través de la infusión endovenosa de triacilglicéridos y heparina; la última libera LPL para hidrolizar el triacilglicérido infundido en el plasma. Es interesante observar que esta estimulación de lipólisis incrementó la oxidación de grasas en un 30 % durante el ejercicio, después del consumo de carbohidratos (Figura 3), sugiriendo que la lipólisis realmente limita la oxidación de las grasas. Sin embargo, debería mencionarse que el incremento en la lipólisis no restauró la oxidación de grasas a los niveles observados durante el ejercicio en estado de ayuno. Esto implica que la ingesta de carbohidratos tiene efectos adicionales sobre el músculo esquelético, los cuales reducen directamente su capacidad de oxidar grasas. Como se discute más adelante, un factor parece ser la reducción en el transporte de AG a la mitocondria
DISPONIBILIDAD DE ACIDOS GRASOS LIBRES (AGL)
Bajo condiciones en las cuales la lipólisis excede la oxidación de las grasas durante el ejercicio, esta última aún podría estar limitada por una entrada anormal de los AG liberados a la mitocondria. Como se discutió anteriormente, el ejercicio de alta intensidad parece ser un buen ejemplo de esta situación con alta lipólisis, pero muy baja TaAGL y concentración de AGL plasmáticos (9,21,30). Nosotros hemos observado a ciclistas bien entrenados oxidar AG a una tasa de 43 mmol/kg/min después de 30 min al 65 % del VO2máx, en comparación con sólo 27-30 mmol/kg/min cuando entrenaban al 85 % del VO2máx (29, 30). Dado que la restauración de la concentración de AGL plasmáticos a 1-2 mM durante el ejercicio al 85% del VO2máx incrementó la oxidación de grasas a 34 mmol/kg/min, durante el ejercicio a esa misma intensidad, aparentemente casi la mitad de la disminución normal en la oxidación de grasas cuando la intensidad aumenta del 65 al 85% del VO2máx, se debe a una disponibilidad limitada de AGL plasmáticos para la oxidación en el músculo. Sin embargo, la incapacidad de la oxidación de las grasas de alcanzar los mayores niveles posibles en el músculo (i.e., 43 mmol/kg/min al 65% del VO2máx) indica que dicha oxidación al 85 % del VO2máx no está meramente limitada por el aporte de AGL plasmáticos. Como se discute a continuación, los factores intracelulares, como el mayor flujo glucolítico, podrían perjudicar directamente la oxidación de AG en el músculo.
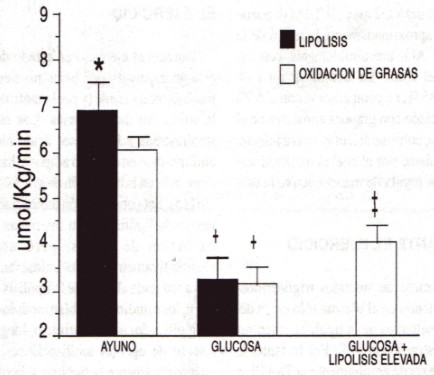
Figura 3. Comparación de la oxidación de grasas con relación a la lipólisis, después de 20-30 min de ejercicio al 44 % del VO2máx. Durante el ejercicio en estado de ayuno, la lipólisis excedió la oxidación de las grasas; (* indica p<0.05). Durante el ejercicio de 60 min, después de haber ingerido glucosa, tanto la lipólisis como la oxidación de grasas son significativamente menores (+ indica p<0.05). El aumento en la lipólisis a través de la infusión endovenosa de Intralipid y heparina, después de la ingesta de glucosa, produjo un incremento significativo en la oxidación de grasas, en comparación con la glucosa (++ indica p<0.05), pero no una restauración a los niveles de ayuno. Reproducido con permiso de Horowitz et al (18).
Durante un ejercicio, tanto al 85 % del VO2máx como al 44 % del VO2máx (después de una ingesta de glucosa), nosotros hemos observado que la restauración de la concentración de AGL plasmáticos a 1-2 mM disminuía la oxidación de carbohidratos, debido solamente al ahorro en la utilización de glucógeno muscular, sin una reducción aparente en la desaparición de glucosa sanguínea (18, 30). Este efecto de economía de glucógeno concuerda con las observaciones originales de Costill et al. (7), quienes hicieron correr a un grupo de sujetos al 70 % del VO2máx, 5-6 horas después de haber ingerido una comida rica en carbohidratos, lo cual produjo una concentración muy baja de AGL plasmáticos durante la serie control (i.e., 0.2 mM). La ingesta de crema de leche y la inyección de heparina elevaron un 32 % la oxidación de grasas, y redujeron en un 40 % la utilización de glucógeno muscular. Por lo tanto, aparentemente la oxidación de grasas se ve, de alguna manera, perjudicada y la utilización de glucógeno incrementada, durante ejercicios de intensidad moderada a alta cuando la concentración de AGL plasmáticos es de sólo 0.2-0.3 mM, y la oxidación total de grasas puede aumentarse elevando la concentración de AGL en plasma (7,9,30). Sin embargo, en estudios con AGL plasmáticos durante la serie control en el rango de 0.5-1.0 mM, aparentemente un mayor aumento no elevó la oxidación de grasas o el ahorro en la utilización de glucógeno muscular (16, 28, 30). Esto probablemente se debió a que la disponibilidad de AGL plasmáticos no limitó la oxidación total de grasas en las condiciones del grupo control.
FACTORES MITOCONDRIALES Y ENTRENAMIENTO DE RESISTENCIA
La oxidación de las grasas ocurre en la mitocondria la cual, por supuesto, tiene un gran potencial para influir en dicha oxidación durante el ejercicio. La mayor densidad mitocondrial, característica del entrenamiento de resistencia, produce un aumento en la oxidación de grasas y una reducción en el flujo glucolítico, tanto del glucógeno muscular como de la glucosa sanguínea (5, 17, 19, 35). La reducción en la glucogenólisis durante el ejercicio, a una determinada intensidad absoluta, está asociada con una menor perturbación de la homeostasis celular (i.e., menor aumento de AMP y ADP) y con una mayor oxidación de TGIM (17, 19, 25). No está claro la magnitud a la cual el entrenamiento de resistencia incrementa la oxidación de las grasas aumentando directamente la densidad mitocondrial, en oposición con el efecto indirecto del incremento de la densidad mitocondrial en la reducción del flujo glucolítico.
Durante ejercicios de baja intensidad que provocan un consumo de oxígeno de 20 mL/kg/min, los sujetos entrenados en resistencia y los desentrenados tienen niveles similares de lipólisis total, así como de Ta y Td de AGL plasmáticos (22). A pesar de esta estimulación semejante en la movilización de AG, los sujetos desentrenados presentan una menor oxidación de grasas. Por lo tanto, durante el ejercicio a esta baja intensidad, los sujetos entrenados en resistencia muestran una igualdad mayor entre la TdAGL y la oxidación total de grasas, mientras que los sujetos desentrenados tienen una menor oxidación de grasas a pesar de la alta TdAGL plasmáticos, así como de la mayor concentración de AGL. Esto sugiere que durante esfuerzos de baja intensidad en sujetos desentrenados, la disponibilidad de AG no limita la oxidación de grasas. Es probable que la misma esté limitada por factores mitocondriales. Al contrario de ejercicios de baja intensidad a una determinada intensidad absoluta, los esfuerzos al 70 % del VO2máx en sujetos entrenados en resistencia, en comparación con los sujetos desentrenados, provoca mayores tasas de lipólisis y oxidación total de grasas (23). La mayor tasa lipolítica probablemente se debe, en gran parte, a una mayor lipólisis de TGIM (19, 25, 29), y no es sorprendente que la oxidación total de grasas aumente debido a que se incrementa el metabolismo oxidativo total.
FLUJO GLUCOLITICO Y OXIDACION DE LAS GRASAS
Nosotros hemos evaluado la hipótesis de que la oxidación de las grasas está regulada por el metabolismo de los carbohidratos en general, y por el flujo glucolítico muscular en particular (8). Como herramienta para producir hiperglucemia e hiperinsulinemia y, por lo tanto, para incrementar el flujo glucolítico durante el ejercicio, se utilizaron ingestas de carbohidratos antes del ejercicio (8). Como se muestra en la Figura 4, las tasas de oxidación de AG fueron medidas durante la infusión endovenosa a tasa constante de cantidades pequeñas de un ácido graso de cadena larga (1-13C-palmitato) vs uno de cadena media (l-13C-octanoato). La oxidación de octanoato no está tan limitada por el transporte a la mitocondria como lo está la oxidación de palmitato (14, 32). Nosotros observamos que el mayor flujo glucolítico, a partir de la ingesta de glucosa, redujo significativamente la oxidación de palmitato mientras que no tuvo efecto sobre la oxidación de octanoato. Esto sugiere que el flujo glucolítico regula la oxidación de ácidos grasos de cadena larga en el músculo esquelético durante el ejercicio, posiblemente a través de inhibir su transporte a la mitocondria. Un método experimental similar, utilizando una intensidad mayor de ejercicio para elevar el flujo glucolítico, arrojó resultados similares (34).
El flujo glucolítico podría regular la oxidación de las grasas dentro del músculo esquelético activo a través de la formación de malonil-CoA (10, 39). La malonil-CoA es formada a partir de la acetil-CoA a través de la actividad de la acetil-CoA carboxilasa (ACC) y es un potente inhibidor de la carnitina palmitoil-transferasa (CPT), con mucho menos efecto sobre la carnitina octanoil-transferasa (COT) (31, 32) (Figura 4). Se formuló la hipótesis de que la concentración de malonil-CoA puede reflejar la disponibilidad de carbohidratos como sustrato con mayor flujo glucolítico produciendo más piruvato, y por lo tanto, incrementando la acetil-Co A/Co A y la malonil-CoA, por lo cual se reduce luego la oxidación de ácidos grasos a través de la disminución en el transporte de ácidos grasos de cadena larga a la mitocondria, vía inhibición de la CPT.
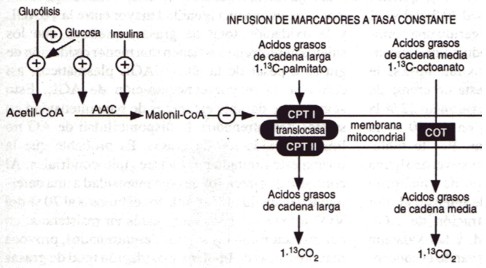
Figura 4. Esquema del método experimental utilizado por Coyle et al. (8) para determinar si la oxidación de ácidos grasos de cadena larga (i.e., palmitato) se reduce más que la oxidación de ácidos grasos de cadena media (i.e., octanoato) por las elevaciones en la glucosa plasmática y en la insulina. Se formuló la hipótesis que la formación de malonil-CoA a partir de acetil-CoA, a través de la actividad de la acetil-CoA carboxilasa (ACC) es un potente inhibidor déla carnitina palmitoil-transferasa (CPT) con mucho menos efecto sobre la carnitina octanoil-transferasa (COT).
Aparentemente, los aumentos en el flujo glucolítico incrementan la oxidación de carbohidratos mientras que, directa y activamente, reducen la oxidación de ácidos grasos. Si la reducción en la oxidación de AG, luego de la ingesta de glucosa, hubiera sido simplemente un fenómeno pasivo del aumento en el flujo glucolítico y producción de acetil-CoA a partir de la glucosa, la oxidación de palmitato vs. octanoato tendría que haber sido igual en respuesta al mayor flujo glucolítico. Esto no ocurrió así. Por lo tanto, aparentemente, la preferencia para la oxidación de carbohidratos, cuando en el músculo hay disponibilidad tanto de carbohidratos como de grasas, está mediada, en parte, por la inhibición activa de la oxidación de grasas a través de un proceso que parece involucrar al transporte de AG a la mitocondria.
Referencias
1. Arner, P., E. Kriegholm, P. Engfeldt, and J. Bolinder (1990). Adrenergic regulation of lypolysis in situ at rest and during exercise. J. Clin. Invest. 85: 893-898
2. Bulow, J (1982). Subcutaneous adipose tissue blood flow and triacylglycerol-mobilization during prolonged exercise in dogs. Pflugers Arch 392: 230-234
3. Bonadonna, R.C., L.C. Groop, K. Zych, M. Shank, and R.A. DeFronzo (1990). Dose-dependent effect of insulin on plasma free fatty acid turnover and oxidation in humans. Am. J. Physiol. 259: E736-E750
4. Campbell, P.J., M.G. Carlson, J.O. Hill, and N. Nurjhan (1992). Regulation of free fatty acid metabolism by insulin in humans: role of lipolysis and reesterification. Am. J. Physiol. 26:E1063-E 1069
5. Coggan, A.R., W.M. Kohrt, R.J. Spina, D.M. Bier, and J.O. Holloszy (1990). Endurance training decreases plasma glucose tumo ver and oxidation during moderate-intensity exercise in men. J. Appl. Physiol. 68: 990-996
6. Coppack, S.W., M.D. Jense, and J.M. Miles (1994). In vivo regulation of lipolysis in humans. J. Lipid Res. 35: 177-193
7. Costill, D. F., E.F. Coyle, G. Dalsky, W. Evans, W. Fink, and D. Hoopes (1977). Effects of elevated plasma FFA and insulin on muscle glycogen usage during exercise. J. Appl.Physiol. 43: 695-699
8. Coyle, E.F., A.E. Jeukendrup, A.J.M. Wagenmakers, and W.H.M. Saris (1997). Fatty acid oxidation is directly regulated by carbohydrate metabolism during exercise. Am. J. Physiol. 273 (Endocrinol. Metab. 36): E268-E275
9. Dyck, D.J., S.A. Peters, P.S. Wending, A. Chesley, E. Hultman, and L.L. Spriet (1996). Regulation of muscle glycogen phosphorylase activity during intense aerobic cycling with elevated FFA. Am. J. Physiol. 265 (Endocrinol. Metab. 33):E116-E125
10. Elayan,I.M., and W.W.Winder (1991). Effectof glucose infusión on muscle malony1-Co A during exercise. J. Appl. Physiol. 70(4): 1495-1499
11. Essen, B., L. Hagenfeldt and L. Kaijser (1977). Utilization of blood-borne and intramuscular substrates during continuous and intermittent exercise in man. J. Physiol. 265: 489-506
12. Garland, P.B., and P.J. Randle (1964). Regulation of glucose uptake by muscle. Biochem. J. 93: 678-687
13. Garland,P.B.,andP.J.Randle (1964). Control of pyruvate dehydrogenase in the perfused at heart by the intracellular concentration of acetyl-coenzyme A. Biochem. J. 91: 6c-7c
14. Groot, P.H. and W.C. Hulsmann (1973). The activation and oxidation of octanoate and palmitate by rat skeletal muscle mitochondria. Biochim Biophys Acta. 316(2): 124-135
15. Gollnick, P.D., B. Pernow, B. Essen, E. Jansson, and B. Saltin (1981). Availability of glycogen and plasma FFA for substrate Utilization in leg muscle of man during exercise. Clin. Physiol. 1: 27-42
16. Hargreaves, M., B. Kiens, and E.A. Richter (1991). Effect of increased plasma free fatty acid concentrations on muscle metabolism in exercising men. J. Appl. Physiol. 70(1):194-201
17. Holloszy, J.O., and E.F. Coyle (1984). Adaptations of skeletal muscle to endurance exercise and their metabolic consequences. J. Appl. Physiol. 56(4): 831-838
18. Horowitz, J.F., R. Mora-Rodriguez, L.O. Byerley, and E.F. Coyle (1997). Lipolytic suppression following carbohydrate ingestión limits fat oxidation during exercise. Am. J. Physiol. 273 (Endocrinol. Metab. 36): E768-E775
19. Hurley, B.F., P. M. Nemeth, W.H. Martin, J.M. Hagberg, G.P. Dalsky, and J.O. Holloszy (1986). Muscle triglyceride Utilization during exercise: effect of training. J. Appl. Physiol. 60: 562-567
20. Jensen, M.D., M. Caruso, V. Heiling, and J.M. Miles (1989). Insulin regulation of lipolysis in nondiabetic and IDDM subjects. Diabetes 38: 1595-1601
21. Jones, N.L., G.J.F. Heigenhauser, A. Kuksis, C.G. Matsos, J.R. Sutton, and C.J. Toews (1980). at metabolism in heavy exercise. Clin. Sci. 59: 469-478
22. Klein, S., E.F. Coyle, and R.R. Wolfe (1994). Fat metabolism during low-intensity exercise in endurance-trained and untrained men. Am. J. Physiol. 267 (Endocrinol. Metab. 30): E934-E940
23. Klein, S., J.M. Weber, E.F. Coyle, and R.R. Wolfe (1996). Effect of endurance training on glycerol kinetics during strenuous exercise in humans. Metab. 45: 357-361
24. Mackie, B.G., G.A. Dudley, H. Kaciuba-Uscilko and R.L. Terjung (1980). Uptake of chylomicron triglycerides by contracting skeletal muscle in rats. J. Appl. Physiol. 49:851 -855
25. Martin, W.H., G.P. Dalsky, B.F. Hurley, D.E. Matthews, D.M. Bier, J.O. Hagberg, and J.O. Holloszy (1993). Effect of endurance training on plasma FFA turnover and oxidation during exercise. Am. J. Physiol. 265 (Endocrinol. Metab. 28): E708-E714
26. Oasci, L.B., D.A. Essig, and W.K. Palmer (1990). Lipase regulation of muscle triglyceride hydrolysis. J. Appl Physiol69: 1571-1577
27. Randle, P.J., E.A. Newsholme, and P.B. Garland (1964). Regulation of glucose uptake by muscle. Effects of fatty acids, ketone bodies and pyruvate, and of alloxan-diabetes and starvation, on the uptake and metabolic fate of glucose in rat heart and diaphragm muscles. Biochem. J. 93: 652-664
28. Ravussin,E.,C.Bogardus,K.Scheidegger,B.LaGrange, E.D. Horton, and E. S. Horton (1986). Effect of elevated FFA on carbohydrate and lipid oxidation during prolonged exercise in humans. J. Appl. Physiol. 60: 893-900
29. Romijn, J. A., E.F. Coyle, L. Sidossis, A. Gastaldelli, J.F. Horowitz, E. Endert, R.R. Wolfe (1993). Regulation of endogenous fat and carbohydrate metabolism in relation to exercise intensity. Am. J. Physiol. 265 (Endocrino!. Metab. 28): E380-E391
30. Romijn, J.A., E.F. Coyle, L.S. Sidossis, X.J. Zhang, and R.R. Wolfe (1995). Relationship between fatty acid delivery and fatty acid oxidation during strenuous exercise. J. Appl. Physiol. 79: 1939-1945
31. Saddik, M., J. Gamble, L. A. Witters, and G.D. Lopaschuk (1993). Acety 1-Co A carboxy lase regulation of fatty acid oxidation in the heart. J. Biol. Chem. 268: 25836-25845
32. Saggerson, E.D., and C.A. Carpenter (1981). Carnitine palmitoyl-transferase and carnitine octanoyltransferase activities in liver, kidney cortex, adipocyte, lactating mammary gland, skeletal muscle and heart. FEBS Letters 129: 229-232
33. Samra, J.S., E.J. Simpson, M.L. Clark, C.D. Forster., S.M. Humphreys, LA. Macdonald, K.N. Frayn (1996). Effects of epinephrine infusión on adipose tissue: interactions between blood flow and lipid metabolism. Am. J. Physiol. 271 (5 Pt 1): E834-E839
34. Sidossis, L.S., A. Gastaldelli, S. Klein, R.R. Wolfe (1997). Regulation of plasma fatty acid oxidation during low-and high-intensity exercise. Am. J. Physipl. 272: E1065-1070
35. Spina, R.J., M.M. Chi, M.G. Hopkins, P.M. Nemeth, O.H. Lowry, J.O. Holloszy (1996). Mitochondrial enzymes increase in muscle in response to 7-10 days of cycle exercise. J. Appl. Physiol. 80(6): 2250-4
36. Spriet, L.L., GJ. Heigenhauser, and N.L. Jones (1986). Endogenous triacylglycerol utilization by rat skeletalmuscle during tetanic stimulation. J. Appl. Physiol. 60(2): 410-415
37. Terjung, R.L., B.G. Mackie, G. A. Dudley and H. Kaciuba- Uscilko (1986). Influence of exercise on chylomicron triacylglycerol metabolism: plasma turnover and muscle uptake. Med. Sci. Sports Exerc. 15: 340-347
38. Van der Vusse, G.J., and R.S. Reneman (1996). Lipid metabolism in muscle. In: Handbook of Physiology. Exercise: Regulation and Integration of Múltiple Systems. Bethesda, MD: Am. Physiol. Soc. Sect. 12, Chapt. 21, pp. 952-994
39. Winder, W.W., J. Arogyasami, R.J. Barton, I.M. Elayan, and P.R. Vehrs (1989). Muscle malonyl-CoA decreases during exercise. J. Appl. Physiol. 67(6): 2230-2233
40. Wolfe, R.R., S. Klein, F. Carraro, and J.M. Weber (1990). Role of triglyceride-fatty acid cycle in controlling fat metabolism in humans during and after exercise. Am. J. Physiol. 258 (Endocrinol. Metab. 21): E382-E389
Cita Original
Edward F. Coyle. Oxidación de las Grasas Durante el Ejercicio: Rol de la Lipólisis, Disponibilidad de Ácidos Grasos Libres, y Flujo Glucolítico. Resúmenes del VI Simposio Internacional de Actualización en Ciencias Aplicadas al Deporte Biosystem Servicio Educativo (Ed.), 145-153 (1998)
Cita en PubliCE
Edward F Coyle (1998). Oxidación de las Grasas Durante el Ejercicio: Rol de la Lipólisis, Disponibilidad de Ácidos Grasos Libres, y Flujo Glucolítico. .https://g-se.com/oxidacion-de-las-grasas-durante-el-ejercicio-rol-de-la-lipolisis-disponibilidad-de-cidos-grasos-libres-y-flujo-glucolitico-978-sa-k57cfb271a7bba
