Metabolitos y Rendimiento Muscular durante Ejercicios Intermitentes de Alta Intensidad
Mark Hargreaves1, Mark A Febbraio1, Michael J Mckenna2, David G Jenkins4, Stuart A Warmington1, Jia L Li2, Rodney J Snow31 Department of Physiology, The University of Melbourne, Parkville 3052.
2 Department of Human Movement, Recreation, and Performance.
3 Department of Human Movement Studies, The University of Queensland, Brisbane 4072, Australia.
4 Department of Human Movement Studies, The University of Queensland, Brisbane 4072, Australia.
Resumen
En la presente investigación se estudiaron a 6 hombres durante la realización de cuatro series de ejercicio “máximo” de 30 segundos de duración en un cicloergómetro frenado por aire. Las primeras tres series de ejercicio estuvieran separadas por una pausa pasiva de 4 minutos, luego de la tercera serie, los sujetos descansaron durante 4 minutos y se ejercitaron durante 30 min al 30-35% del consumo pico de O2, luego de lo cual descansaron durante 60 minutos antes de completar la cuarta serie. La potencia pico y el trabajo total se redujeron (p<0.05) durante la serie 3 [765±60 (EE) W; 15.8±1.0] en comparación con la serie 1 (1168±55 W, 23.8±1.2 kJ), pero no se observaron diferencias en el rendimiento entre las series 1 y 4 (1094±64 W, 23.2±1.4 kJ). Antes de la serie 3, las concentraciones musculares de ATP, fosfocreatina (CP) glucógeno, el pH y la absorción de Ca2+ por el retículo sarcoplasmático (SR) se redujeron, mientras que las concentraciones musculares de lactato e inosina-5’-monofosfato se incrementaron. Antes de la serie 4 las concentraciones musculares de ATP y glucógeno continuaron siendo más bajas en relación a los valores observados antes de la serie 1 (p<0.05), pero no se observaron diferencias en las concentraciones de inosina-5’-monofosfato, lactato, en el pH y en la absorción de Ca2+ por el SR. Los niveles musculares de CP antes de la serie 4 se incrementaron pon encima de los niveles de reposo. Antes de las series 3 y 4, consistentemente con la reducción en el ATP muscular hubo un incremento en los niveles de hipoxantina e inosina. La reducción en el rendimiento durante el ejercicio no parece estar relacionada con la reducción en el glucógeno muscular. En cambio, podría estar causada por la disponibilidad reducida de CP, el incremento en la concentración de H+, la desmejora en la función del SR o algún otro agente inducido por la fatiga.
Palabras Clave: fatiga muscular, metabolismo, glucógeno, fosfato de creatina, iones hidrógeno
INTRODUCCION
Durante el ejercicio de alta intensidad, las principales vías para la resíntesis de ATP son la degradación de los fosfatos de creatina (CP) y la degradación del glucógeno muscular a ácido láctico (21, 26, 32). Con series repetidas de ejercicio de alta intensidad, la contribución de estos procesos al turnover de ATP declina, y aunque hay un incremento en la contribución aeróbica al ejercicio (5, 26), se produce una declinación en la producción de potencia y en la producción total de trabajo (21, 26). La reducida disponibilidad de CP y glucógeno pueden contribuir a esta declinación en al producción de energía anaeróbica y a la reducción del rendimiento. Recientemente, se ha demostrado una estrecha relación entre la disponibilidad de CP y la producción de potencia durante la realización de ejercicios de alta intensidad (5, 6). Asimismo, el rendimiento durante la realización de extensiones de rodilla de alta intensidad en dos series separadas por 1 h se mantuvo en la pierna con elevada concentración de glucógeno muscular mientras que el rendimiento en la pierna contralateral se redujo con la reducción en el nivel de glucógeno muscular (3).
Alternativamente, es posible que la acidosis intramuscular, como consecuencia del incrementado flujo glucolítico y del cambio en los electrolitos que tiene lugar durante la realización de ejercicios de alta intensidad, sean responsables de la desmejora en el rendimiento. El incremento en la concentración de iones hidrógeno ([H+]) pueda desmejorar el desarrollo de la tensión muscular, inhibiendo la actividad de la fosfofructoquinasa y/o de la fosforilasa (26). Sin embargo, estudios recientes llevados a cabo con humanos han cuestionado los efectos inhibitorios del incremento en la acidez muscular sobre la producción de tensión (24) y sobre el rendimiento durante la realización de ejercicios intensos (2, 4). En el presente estudio, buscamos examinar la importancia relativa de la reducción en la disponibilidad de sustratos y del incremento en la [H+] sobre el rendimiento durante la realización de series repetidas de ejercicio de alta intensidad.
Además de la reducción en los niveles musculares de CP, el contenido intramuscular de nucleótidos de adenina totales (TAN), o ATP + ADP + inosina-5’-monofosfato (IMP), se reduce durante la realización de ejercicios de alta intensidad, y se produce un flujo de purinas desde los músculos esqueléticos (28). El entrenamiento con esprints de alta intensidad resulta en una reducción de los niveles de TAN de reposo (17, 28), indicando que el ejercicio intenso deriva en una pérdida substancial de purinas que no pueden ser restauradas inmediatamente mediante las vías de recuperación o de síntesis. Aunque las concentraciones de TAN no retornan a los niveles pre ejercicio hasta luego de 6 min de finalizada una serie de ejercicio máximo (6), ningún estudio previo ha examinado los efectos de la realización de series agudas de ejercicio de alta intensidad sobre el patrón de recuperación de TAN más allá de este tiempo. Por lo tanto, la recuperación de los TAN los productos de su degradación también fueron de interés en el presente estudio.
Por último, existe evidencia obtenida en estudios con animales que utilizaron fibras musculares aisladas, de que en el proceso de la fatiga están implicados la desmejora en la función del retículo sarcoplasmático (SR) y del proceso de excitación-contracción (ver Referencia 1). En el presente estudio, hemos medido la absorción de Ca2+ en el RS en homogenados de músculos de humanos, antes y después de series repetidas de ejercicio de alta intensidad.
METODOS
Sujetos
Seis hombres [26±4 (DE) años, 80.6±7.0 kg] acordaron participar en el presente estudio luego de haber sido informados acerca de los procedimientos, riesgos y del estrés que podría causar su participación y luego de haber provisto su consentimiento por escrito. El estudio fue aprobado por el Comité de Ética para la Investigación con Humanos de la Universidad de Melbourne. El consumo pico de O2 pulmonar (VO2 pico) fue medido durante una cicloergometría progresiva hasta el agotamiento; el VO2 pico promedio 4.03±0.29 L/min.
Procedimientos
Los sujetos se reportaron al laboratorio de forma tal que hubieran transcurrido al menos 6 horas desde la última ingesta de alimentos. Los sujetos fueron instruidos de abstenerse de realizar ejercicios y consumir alcohol o cafeína en las 24 horas previas. Los sujetos permanecieron recostados en posición supina sobre un sillón mientras se les insertaba un catéter en la vena antecubital y se obtenían las muestras de sangre de reposo. El catéter se mantuvo patente mediante la infusión periódica de solución salina que contenía una pequeña cantidad de heparina (10 UI/mL). Se obtuvo una muestra muscular del músculo vasto lateral utilizando la técnica de biopsia de succión con aguja percutánea. Una porción de esta muestra (20-30 mg) fue utilizada inmediatamente para determinar la tasa pico de absorción de Ca2+ en el SR. El resto de la muestra fue rápidamente congelada en N2 líquido para los posteriores análisis de [H+] y metabolitos. Luego de esto los sujetos pasaron al cicloergómetro frenado por aire (Repco, Melbourne, Australia). Luego de que los sujetos descansaran por al menos otros 5-10 min en posición de sentado y, antes que los sujetos completaran cuatro series de ciclismo “máximo” de 30 segundos, se obtuvieron muestras de sangre pre-ejercicio. Las primeras tres series estuvieron separadas por una pausa pasiva de 4 minutos. Luego de la tercera serie, los sujetos descansaron en el cicloergómetro durante 4 min, pedalearon durante 30 minutos con una carga del 30-35% del VO2 pico, y nuevamente descansaron por otros 60 min en posición supina antes de completar la cuarta serie de ejercicio máximo. Este protocolo fue seleccionado para facilitar la remoción del lactato y de H+ desde la sangre y los músculos a la vez que se minimizaba la resíntesis de glucógeno muscular (12). Durante cada serie de ejercicio se registraron la producción de potencia, que se asumió era proporcional al cubo de la frecuencia de pedaleo, y el trabajo total, para lo cual se utilizó una unidad para el monitoreo del trabajo (Repco). Se extrajeron muestras de sangre venosa inmediatamente antes y durante los últimos 5 s de cada serie de ejercicio y luego de los 4 minutos de pausa en cada serie. La sangre fue analizada para determinar la concentración de hemoglobina, el hematocrito, la [H+] plasmática y la concentración plasmática de lactato y K+([K+]). Inmediatamente antes de la tercera y cuarta serie de ejercicio se obtuvieron muestras adicionales de músculo para el análisis de la tasa pico de absorción de Ca2+ por el RS, y para la determinación de la concentración de metabolitos.
Métodos Analíticos
La concentración de hemoglobina fue medida en duplicado utilizando espectrofotometría (OSM-2 hemoximeter, Radiometer, Copenhagen), y el hematocrito fue determinado en triplicado mediante microcentrifugación, lo cual permitió la estimación de los cambios en el volumen plasmático (13). Las [H+] y [K+] fueron medidas en duplicado utilizando un analizador de gases sanguíneos/metabolitos (Ciba-Corning 865, Ciba-Corning Diagnostics Group, Medfield, MA). La concentración de lactato fue medida en duplicado utilizando extractos de plasma desproteinizados y mediante el método enzimático, espectrofotométrico (20). Para los análisis bioquímicos, las muestras musculares fueron congeladas, secadas, diseccionadas de cualquier resto visible de sangre y tejido conectivo, y pulverizadas. Una porción fue extraída (16) y analizada para determinar los contenidos de ATP, CP, creatina y lactato, utilizando los métodos enzimático y fluorométrico (20). Los nucleótidos de adenina, IMP, hipoxantina e inosina fueron medidos por HPLC (33). Una segunda porción fue extraída en 250 μL de solución de HCl 2M a 100ºC durante 2 h, neutralizada con 750 μL de solución de NaOH 0.67 M, y analizada para determinar el contenido de glucógeno (como unidades glucosil) utilizando el método enzimático (20). Los metabolitos musculares, excepto el glucógeno y el lactato, fueron ajustados al pico de creatina total para cada sujeto. Una tercera porción fue homogeneizada en solución amortiguadora (200 μL/mg) y fue analizada a 37ºC para determinar la [H+] (27) utilizando un microelectrodo MI 410 (Microelectrodes, Londonderry, NH). La absorción de Ca2+ por el RS fue medida en una muestra de músculo homogeneizado tal como se describiera previamente (31). En forma resumida, las muestras musculares (20-30 mg) fueron homogeneizadas en una solución amortiguadora (8 μL/mg) que contenía 8 mM de azida de sodio. 5 mM de oxalato, 5 μM N,N,N’,N’-tetrakis (2-pirimidilmetil)etilendiamina, 40 mM de KCl, 40 mM de HEPES y 250 mM de sucrosa. Una muestra de 100 μL fue colocada en una cubeta de cuarzo con 2 mL de solución amortiguadora que contenía 40 mM de HEPES, 40 mM de KCl, 5 mM de MgATP, 10 μM de CaCl2 {concentración libre de Ca2+ ([Ca2+]) = 1.5 μM} y 7.5 μM de fura 2, y mantenida a 37ºC. El cambio en la [Ca2+] de la cubeta, como resultado de la absorción de Ca2+ por las vesículas del SR, fue monitoreada mediante el índice de fluorescencia de fura-2 a 510 nm luego de la excitación a 340 y 380 nm (Cairn, Reino Unido). La absorción de Ca2+ fue calculada a partir de la tasa pico de cambio de la [Ca2+], la cual ocurrió dentro de los 20 s posteriores a la inyección del homogenado. Las proteínas totales del homogenado fueron medidas utilizando el método Coomassie Blue (8). Los datos fueron analizados utilizando el análisis de varianza ANOVA de una vía para medidas repetidas, con un nivel de significancia p<0.05. Todos los datos son reportados como valores medios±EE.

Tabla 1. Producción pico de potencia y producción de trabajo durante las
series de ejercicio de 30 segundos. Los datos son presentados como valores
medios±EE; n = 6 sujetos. *Significativamente diferente de la serie 1, p<0.05;
†significativamente diferente de la serie 2, p<0.05; ‡significativamente
diferente de la serie 3, p<0.05.
RESULTADOS
La producción pico de potencia y el trabajo total durante las series 2 y 3 fueron significativamente menores que los valores alcanzados durante la serie 1 (Tabla 1). En promedio, el pico de potencia y el trabajo total se redujeron en ~ 15 y 35% durante las series 2 y 3, respectivamente. En contraste, no hubo diferencias en el pico de potencia y en el trabajo total entre las series 1 y 4 (Tabla 1).
La [H+] plasmática se incrementó progresivamente luego de las series 1, 2 y 3; sin embargo, los valores obtenidos inmediatamente antes de la serie 4 no fueron diferentes de los obtenidos antes de la serie 1 (Tabla 2). La [H+] plasmática obtenida a los 4 min post-ejercicio, y los valores de lactato para las series 1 y 4 no fueron diferentes (Tabla 2).
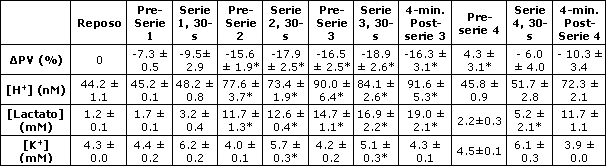
Tabla 2. Cambios en el volumen plasmático, en la [H+], [lactato] y [K+]
plasmáticas, antes, durante los últimos 5 s y a los 4 minutos posteriores de las
cuatro series de ejercicio de 30 segundos. Los datos son presentados como
valores medios±EE; n=6 sujetos. ΔPV, cambio en el volumen plasmático, [H+],
concentración de iones [H+]; [Lactato], concentración de lactato; [K+],
concentración de iones potasio. * Significativamente diferente del
correspondiente valor para la serie de ejercicio 1, p<0.05
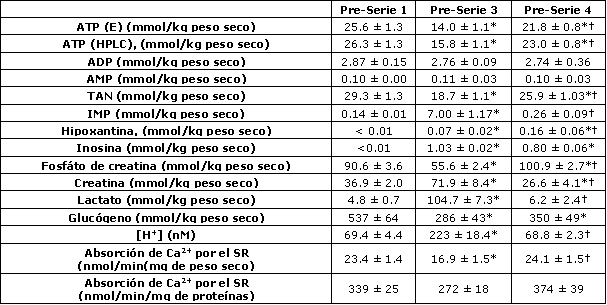
Tabla 3. Metabolitos musculares, [H+] y pico de absorción de Ca2+ por el SR
inmediatamente antes de las series de ejercicio 1, 3 y 4. Los datos son
presentados como valores medios±EE. El ATP muscular fue medido por los métodos
enzimático, fluorométrico (E) y HPLC. TAN, nucleótidos de adenina totales; IMP,
inosina-‘5-monofosfato; SR, retículo sarcoplasmático. *Significativamente
diferente del valor Pre-serie 1, p<0.05. †Significativamente diferente del valor
Pre-serie 3, p<0.05.
La [K+] plasmática se incremento durante el ejercicio en todas las series; sin embargo, la [K+] pico se redujo desde la serie 1 a la 3, paralelamente con la reducción del rendimiento en el ejercicio (Tabla 2). No se observaron diferencia en las [K+] plasmáticas entre las series 1 y 4 (Tabla 2). Las primeras dos series de ejercicio de 30 s resultaron en alteraciones significativas en los metabolitos musculares, tal que inmediatamente antes de la serie 3 los niveles musculares de ATP, TAN (ATP + ADP + IMP), CP y glucógeno estaban reducidos mientras que la [H+] (pH 6.66±0.03 vs. 7.16±0.03, p<0.05), el lactato y el IMP estaban incrementados (Tabla 3). La tasa pico de absorción de Ca2+ por el SR también fue menor durante la serie 3 cuando se expresó en forma relativa al peso muscular. Sin embargo, cuando se expresó en forma relativa a las proteínas totales, esta diferencia no fue significativa (p=0.06). Luego del período de recuperación de 90 minutos posterior a la serie 3, los valores de ATP, TAN y glucógeno previos a la serie 4 se mantuvieron más bajos que los valores obtenidos antes de la serie 1, mientras que los valores de IMP, lactato, [H+] (pH 7.16±0.02) y tasa pico de absorción de Ca2+ por el SR fueron similares a aquellos obtenidos antes de la serie 1 (Tabla 3). Los niveles musculares de CP antes de la serie 4 se incrementaron por encima de los valores de reposo (Tabla 3). El incremento en la hipoxantina y en la inosina observado antes de las series 3 y 4 fueron consistentes con la reducción en los TAN (Tabla 3).
DISCUSION
Los resultados del presente estudio sugieren que la declinación en el rendimiento durante la realización de series repetidas de ejercicio no está relacionada con la reducción en el glucógeno muscular. En lugar, esta puede ser causada por la reducción en la disponibilidad de CP, por el incremento en la [H+], por una desmejora en la función del SR o por algún otro agente inducido por la fatiga, aunque nuestro protocolo experimental no pudo determinar la importancia relativa. Esta conclusión se baja en la observación de que el rendimiento en la serie 4 no fue diferente del observado durante la serie 1 (Tabla 4), a pesar de los bajos niveles de ATP y glucógeno muscular (Tabla 3). Cabe señalar que la [H+] muscular y la absorción de Ca2+ por el SR fueron similares entre las series 1 y 4, mientras que los niveles de CP fueron en realidad mayores antes de la serie 4 (Tabla 3).
Aunque la importancia del glucógeno muscular para el rendimiento en ejercicios de resistencia está bastante aceptada, su rol en la determinación del rendimiento en ejercicios intermitentes de alta intensidad es menos claro. La declinación en el glucógeno muscular que ocurre durante ejercicios repetidos de alta intensidad puede, en teoría, contribuir a la desmejora del rendimiento durante el ejercicio a través de la reducción en los sustratos para la fosforilasa y el subsiguiente flujo glucolítico. Recientemente, se ha observado que la reducción en la ingesta dietaria de carbohidratos, y, por inferencia, la baja disponibilidad de glucógeno muscular, resultó en la reducción de la producción de trabajo durante las tres series iniciales de 30 segundos, pero no en la cuarta serie de 30 segundos de ciclismo máximo (10). Además, el rendimiento durante extensiones de rodilla de alta intensidad en dos series separadas por 1 h, pudo ser mantenido por la pierna con elevado glucógeno muscular, mientras que se vio reducido en la pierna contralateral con bajos niveles de glucógeno (3). Sin embargo, la producción de lactato y la utilización de glucógeno no estuvieron influenciadas por la disponibilidad de glucógeno pre ejercicio, y no pudo encontrarse una relación entre el contenido de glucógeno y el rendimiento durante el ejercicio (3). En el presente e4studio, el rendimiento durante el ejercicio en las series 1 y 4 fue similar, a pesar de la gran diferencia en los niveles de glucógeno muscular pre ejercicio. Además, los niveles de glucógeno muscular fueron similares antes de las series 3 y 4, pero el rendimiento durante el ejercicio fue menor durante la serie 3. Conjuntamente estos resultados sugieren que las alteraciones en la disponibilidad de glucógeno muscular, de la magnitud alcanzada en el presente estudio, no pueden explicar las diferencias en el rendimiento durante el ejercicio observadas aquí. Sin embargo, se podría argumentar que los niveles de pre ejercicio de glucógeno muscular en el presente estudio no fueron un factor limitante en ninguna etapa y que se requiere de un mayor grado de depleción de glucógeno antes de que la glucogenólisis y el rendimiento se vean afectados durante la realización de ejercicios intermitentes de alta intensidad.
Otro importante determinante del rendimiento durante ejercicios de alta intensidad es la disponibilidad de CP, ya que se han observado altas correlaciones entre la recuperación del CP muscular y el pico de rendimiento (5, 6). Por lo tanto, los reducidos niveles de CP antes de la serie 3 de ejercicio en el presente estudio pudieron probablemente haber contribuido a los menores valores de pico de potencia y posiblemente al menor trabajo total durante esta serie. Luego de los 4 min de recuperación posterior a la serie 2, los niveles musculares de CP se mantuvieron significativamente más bajo que los valores de reposo, una observación que se ha realizado previamente (5, 6, 26), lo cual sugiere una tasa relativamente baja de resíntesis de CP. Es posible que la recuperación pasiva entre las series 2 y 3 contribuyera a esta baja tasa, tal como se ha sugerido previamente (26). En contraste, inmediatamente antes de la serie 4 (i.e., luego de los 90 min de recuperación que incluyeron 30 min de ejercicio de baja intensidad), los niveles musculares de CP fueron de hecho mayores que los valores de reposo (Tabla 3). Este “sobre incremento” por encima de los valores de reposo ha sido observado previamente en fibras Tipo II luego de estimulación eléctrica intensa (25), aunque no tenemos una explicación para este fenómeno. Es posible que una incrementada actividad mitocondrial, resultara en una incrementada tasa de resíntesis de ATP, lo cual puedo a su vez resultar en un incremento en la producción de CP a través de la creatina quinasa mitocondrial durante la recuperación.
El incremento en la [H+] muscular también puede contribuir a la desmejora del rendimiento durante ejercicios de alta intensidad. Estudios llevados a cabo en fibras musculares han demostrado una inhibición en el desarrollo de la tensión debido a las condiciones de acidosis (22), aunque durante la recuperación de contracciones isométricas hasta el agotamiento en humanos, hay una recuperación de la producción de fuerza a pesar de la probabilidad de un bajo pH muscular (24). Similarmente, no se ha observado una relación entre el pH muscular y la restauración de la potencia pico durante la recuperación posterior a la realización de ejercicios dinámicos de alta intensidad (6). De mayor significancia puede ser la inhibición de la glucólisis por la acidosis, a través de los efectos de los H+ sobre la fosforilasa y la fosfofructoquinasa (26). Aunque se ha sugerido que los efectos negativos de los H+ sobre estas encimas pueden ser superados mediante el incremento en los niveles de AMP, IMP y Pi, la alcalosis inducida está asociada con un incremento en la glucólisis muscular y con la mejora del rendimiento en ejercicios de alta intensidad (29). Además, la recuperación de la resistencia a la fuerza isométrica, luego de la realización de contracciones isométricas hasta el agotamiento sigue más estrechamente los patrones de recuperación asumidos para el pH muscular (24). Estos resultados sugieren un efecto inhibitorio del incremento en la [H+] sobre los procesos de regeneración de ATP. Por lo tanto, es posible que los incrementos y reducciones en la [H+] muscular que se han observado en el presente estudio (Tabla 3) hayan contribuido a la desmejora y a la recuperación del rendimiento observada en las series 3 y 4, respectivamente (Tabla 1). El lactato muscular también estuvo elevado antes de la serie 3. Recientemente, se ha sugerido que un incremento en la [lactato], en ausencia de acidosis, puede reducir el desarrollo de tensión en músculos esqueléticos de caninos (18). Esto sugiere un rol potencial para este metabolito. Además, aunque en nuestras muestras no determinamos la concentración de Pi, es posible que las alteraciones en los niveles de este metabolito pudieran haber influenciado el rendimiento durante el ejercicio (9). Los cambios en los electrolitos, particularmente en el K+, en los músculos esqueléticos han sido implicados en los procesos asociados con la fatiga. En el presente estudio, los cambios en la [K+] plasmática reflejan las alteraciones en la producción de trabajo durante las cuatro series de ejercicio (Tabla 2); sin embargo, no pudimos valorar su rol en el desarrollo de la fatiga.
En los recientes años, se ha vuelto aparente que la reducción en la liberación de Ca2+ por el SR y la desmejora en el proceso de excitación-contracción son las mayores causas de la fatiga (para una revisión ver Referencia 1). La reducción en la disponibilidad de sustratos (i.e., ATP, glucógeno) pueden reducir la liberación de Ca2+ por el SR (11, 23) y los productos finales del metabolismo, tales como H+, lactato y Mg2+ han mostrado reducir la liberación de Ca2+ por las vesículas del SR (14), aunque el efecto del incremento en los niveles de H+ no se han observado en preparados de fibras musculares (19). Por lo tanto las alteraciones metabólicas resultantes de la realización de esprints pudieron haber desmejorado la función del SR y haber contribuido a la reducción del rendimiento durante el ejercicio que se observó en el presente estudio. En efecto, la absorción de Ca2+ por el SR estuvo reducida antes de la serie 3 (Tabla 3), sugiriendo una desmejorada función del SR luego del ejercicio intenso, tal como se ha observado previamente (15). Esto debe representar una alteración prolongada en la función del SR, ya que los análisis fueron llevados a cabo bajo condiciones óptimas de temperatura y sustratos. Una posibilidad es la alteración inducida por la temperatura en la absorción de Ca2+ por el SR y en la actividad Ca2+-ATPasa (7, 31). Se ha mostrado previamente que 30 min de recuperación luego de la realización de ejercicios intensos no son suficientes para la restauración total de la función del SR (15). Sin embargo, en el presente estudio, 90 min de recuperación resultaron en el retorno de la absorción de Ca2+ por el SR a los valores pre ejercicio (Tabla 3). En contraste, luego de ejercicios prolongados hasta el agotamiento, la absorción de Ca2+ por el SR permanece deprimida por varias horas (7).
Las primeras dos series de ejercicio resultaron en una substancial disminución de los TAN y en un incremento en los productos de su degradación, es decir IMP, hipoxantina e inosina (Tabla 3). Cabe señalar que, aunque las concentraciones de IMP retornaron a los valores de reposo antes de la serie 4 de ejercicio, el contenido de TAN todavía se mantuvo reducido. Además cuando se adicionó la suma de los productos de degradación (IMP, inosina e hipoxantina) a los TAN, el contenido fue menor al observado en reposo (Tabla 3). Estos datos indican que el ejercicio agudo de alta intensidad resulta en una pérdida substancial de purinas en los músculos esqueléticos activos. Además, debido a que la suma de los productos de degradación y los TAN resultó un déficit, en comparación con lo observado en reposo, estos datos indican que ni el ciclo de los nucleótidos de purina ni la recuperación de los mismos pudieron compensar la reducción en los TAN. En cambio, estos datos indican que la reducción en los TAN, característica de este tipo de ejercicios, requiere de la restauración mediante la síntesis de novo, la cual es una vía lenta que requiere de energía (30).
En resumen, el ejercicio intermitente de alta intensidad resulta en grandes reducciones de los niveles de ATP, CP y glucógeno, con el concomitante incremento en los niveles de H+, lactato y productos de la degradación del ATP. Esta declinación en el rendimiento de ejercicio con series repetidas no parece estar relacionada con la reducción en el glucógeno muscular. En cambio, parece ser causada por una reducción en la disponibilidad de CP, por el incremento en la [H+], por la desmejora en la función del SR o por algún otro agente que induce la fatiga, pero nuestro protocolo experimental no pudo hallar su importancia relativa.
Agradecimientos
Los autores quisieran agradecer la asistencia de Steve Fraser, Kirsten Howlett, Termboon Sangkabutra, y Simon Sostaric durante este estudio. Este estudio fue apoyado por la Comisión Australiana del Deporte.
Dirección para el Envío de Correspondencia
M. Hargreaves, School of Human Movement, Deakin University, Burwood 3125, Australia (correo electrónico: mharg@deakin.edu.au).
Referencias
1. Allen, D. G., J. Lannergren, and H. Westerblad (1995). Muscle cell function during prolonged activity: cellular mechanisms of fatigue. Exp. Physiol. 80: 497527
2. Bangsbo, J., T. Graham, L. Johansen, S. Strange, C. Christensen, and B. Saltin (1992). Elevated muscle acidity and energy production during exhaustive exercise in humans. Am. J. Physiol. 263 (Regulatory Integrative Comp. Physiol. 32): R891R899
3. Bangsbo, J., T. E. Graham, B. Kiens, and B. Saltin (1992). Elevated muscle glycogen and anaerobic energy production during exhaustive exercise in man. J. Physiol. (Lond.) 451: 205227
4. Bangsbo, J., K. Madsen, B. Kiens, and E. A. Richter (1996). Effect of muscle acidity on muscle metabolism and fatigue during intense exercise in man. J. Physiol. (Lond.) 495: 587596
5. Bogdanis, G. C., M. E. Nevill, L. H. Boobis, and H. K. A. Lakomy (1996). Contribution of phosphocreatine and aerobic metabolism to energy supply during repeated sprint exercise. J. Appl. Physiol. 80: 876884
6. Bogdanis, G. C., M. E. Nevill, L. H. Boobis, H. K. A. Lakomy, and A. M. Nevill (1995). Recovery of power output and muscle metabolites following 30 s of maximal sprint cycling in man. J. Physiol. (Lond.) 482: 467480
7. Booth, J., M. J. McKenna, P. A. Ruell, T. H. Gwinn, G. M. Davis, M. W. Thompson, A. R. Harmer, S. K. Hunter, and J. R. Sutton (1997). Impaired calcium pump function does not show relaxation in human skeletal muscle after prolonged exercise. J. Appl. Physiol. 83: 511521
8. Bradford, M. M (1976). A rapid and sensitive method for the quantitation of microgram quantities of protein, utilizing the principle of protein-dye binding. Anal. Biochem. 72: 348354
9. Bruton, J. D., H. Westerblad, A. Katz, and J. Lannergren (1996). Augmented force output in skeletal muscle fibres of Xenopus following a preceding bout of activity. J. Physiol. (Lond.) 493: 211217
10. Casey, A., A. H. Short, S. Curtis, and P. L. Greenhaff (1996). The effect of glycogen availability on power output and the metabolic response to repeated bouts of maximal, isokinetic exercise in man. Eur. J. Appl. Physiol. 72: 249255
11. Chin, E., and D. G. Allen (1997). Effects of reduced muscle glycogen concentration on force, Ca21 release and contractile protein function in intact mouse skeletal muscle. J. Physiol. (Lond.) 498:1729
12. Choi, D., K. J. Cole, B. H. Goodpaster, W. J. Fink, and D. L. Costill (1994). Effect of passive and active recovery on the resíntesis of muscle glycogen. Med. Sci. Sports Exerc. 26: 992996
13. Dill, D. B., and D. L. Costill (1974). Calculation of percentage changes in volumes of blood, plasma, and red cells in dehydration. J. Appl. Physiol. 37: 247248
14. Favero, T. G., A. C. Zable, M. B. Bowman,A. Thompson, and J. J. Abramson (1995). Metabolic end products inhibit sarcoplasmic reticulum Ca21 release and [3H] ryanodine binding. J. Appl. Physiol. 78: 16651672
15. Gollnick, P. D., P. Korge, J. Karpakka, and B. Saltin (1991). Elongation of skeletal muscle relaxation during exercise is linked to reduced calcium uptake by the sarcoplasmic reticulum in man. Acta Physiol. Scand. 142: 135136
16. Harris, R. C., E. Hultman, and L. Norsdesjo (1974). Glycogen, glycolytic intermediates and high energy phosphates determined in biopsy samples of musculis quadriceps femoris of man at rest: methods and variance of values. Scand. J. Clin. Lab. Invest. 33: 109120
17. Hellsten-Westing, Y., B. Norman, P. D. Balsom, and B. Sjodin (1993). Decreased resting levels of adenine nucleotides in human skeletal muscle after high-intensity training. J. Appl. Physiol. 74: 25232528
18. Hogan, M. C., L. B. Gladden, S. S. Kurdak, and D. C. Poole (1995). Increased [lactate] in working dog muscle reduces tension development independent of pH. Med. Sci. Sports Exerc. 27: 371377
19. Lamb, G. D., and D. G. Stephenson (1994). Effects of intracellular Ph and [Mg21] on excitation-contraction coupling in skeletal muscle fibres of the rat. J. Physiol. (Lond.) 478: 331339
20. Lowry, O. H., and J. V. Passonneau (1972). A Flexible System of Enzymatic Analysis. New York: Academic
21. McCartney, N., L. L. Spriet, G. J. F. Heigenhauser, J. M. Kowlachuk, J. R. Sutton, and N. L. Jones (1986). Muscle power and metabolism in maximal intermittent exercise. J. Appl. Physiol. 60: 11641169
22. Metzger, J. M., and R. L. Moss (1987). Greater hydrogen ion-induced depression of tension and velocity in skinned single fibres of rat fast than slow muscle. J. Physiol. (Lond.) 393: 727743
23. Owen, V. J., G. D. Lamb, and D. G. Stephenson (1996). Effect of low [ATP] on depolarisation-induced Ca2+ release in skeletal muscle fibres of the toad. J. Physiol. (Lond.) 493: 309315
24. Sahlin, K., and J. M. Ren (1989). Relationship of contraction capacity to metabolic changes during recovery from fatiguing contraction. J. Appl. Physiol. 67: 648654
25. Soderlund, K., and E. Hultman (1991). ATP and phosphocreatine changes in single muscle fibers after intense electrical stimulation. Am. J. Physiol. 261 (Endocrinol. Metab. 24): E737E741
26. Spriet, L. L., M. I. Lindinger, R. S. McKelvie, G. J. F. Heigenhauser, and N. L. Jones (1989). Muscle glycogenolysis and H1 concentration during maximal intermittent cycling. J. Appl. Physiol. 66: 813
27. Spriet, L. L., K. Soderlund, J. A. Thomson, and E. Hultman (1986). pH measurement in human skeletal muscle samples: effect of phosphagen hydrolysis. J. Appl. Physiol. 61: 19491954
28. Stathis, C. G., M. A. Febbraio, M. F. Carey, and R. J. Snow (1994). Influence of sprint training on human skeletal muscle purine nucleotide metabolism. J. Appl. Physiol. 76: 18021809
29. Sutton, J. R., N. L. Jones, and C. J. Toews (1981). Effect of pH on muscle glycolysis during exercise. Clin. Sci. (Colch.) 61: 331338
30. Tullson, P. C., and R. L. Terjung (1991). Adenine nucleotide metabolism in contracting skeletal muscle. Exerc. Sport Sci. Rev. 14: 509539
31. Warmington, S. A., M. Hargreaves, and D. A. Williams (1996). method for measuring sarcoplasmic reticulum calcium uptake in skeletal muscle using fura-2. Cell Calcium 20: 7382
32. Withers, R. T., W. M. Sherman, D. G. Clark, P. C. Esselbach, S. R. Nolan, M. H. Mackay, and M. Brinkman (1991). Muscle metabolism during 30, 60 and 90 s of maximal cycling on an air-braked ergometer. Eur. J. Appl. Physiol. 63: 354362
33. Wynants, J., and H. van Belle (1985). Single-run high performance liquid chromatography of nucleotides, nucleosides, and major purine bases and its application to different tissue extracts. Anal. Biochem. 144: 258266
Cita Original
Hargreaves, Mark, Michael J. McKenna, David G. Jenkins, Stuart A. Warmington, Jia L. Li, Rodney J. Snow, and Mark A. Febbraio. Muscle metabolites and performance during high-intensity, intermittent exercise. J. Appl. Physiol. 84(5): 16871691, 1998
Cita en PubliCE
Mark Hargreaves, Mark A Febbraio, Michael J Mckenna, David G Jenkins, Stuart A Warmington, Jia L Li Rodney J Snow (1998). Metabolitos y Rendimiento Muscular durante Ejercicios Intermitentes de Alta Intensidad. .https://g-se.com/metabolitos-y-rendimiento-muscular-durante-ejercicios-intermitentes-de-alta-intensidad-886-sa-V57cfb27198750
