Metabolismo de los Lípidos Durante el Ejercicio Físico
Matías Santa María0 Universidad Nacional de La Plata. La Plata, Argentina.
Resumen
En el presente escrito realizaré una breve revisión bibliográfica sobre el metabolismo de los lípidos. Dado que es una de las principales fuentes energéticas junto a los carbohidratos para la contracción muscular y considero de vital importancia el conocimiento para el profesional en educación física en el momento de programar el ejercicio físico en personas que necesiten bajar de peso. Se conoce que la reserva energética más grande del cuerpo humano son los lípidos, estos antes de ser metabolizados por la célula muscular y con ello utilizar la energía que la célula demande, necesita de algunos pasos previos:
- - La hidrolización de los triglicéridos dentro del adiposito (célula lipídica) para descomponer esta molécula en ácidos grasos y glicerol reacción que va a estar mediada por una gran cantidad de enzimas y hormonas a saber.
- - El transporte de estas sustancias vía torrente sanguíneo, hacia las células a través de la albúmina, y
- - Su metabolización y/o almacenamiento como triglicéridos intramusculares en las células musculares.
Palabras Clave: Lípidos, metabolismo, oxidación, ejercicio, triglicéridos, ácidos grasos, lipólisis, adiposito
INTRODUCCIÓN
Las reservas en el cuerpo humano de lípidos es mucho mayor en relación con los hidratos de carbono, pero a su vez su metabolismo es mas lento y necesita la presencia indispensable del oxígeno, por el lado de los carbohidratos su metabolización es más rápida y puede o no utilizar oxígeno, esto hace que éste, sea el sustrato dominante. Lo que lo diferencia aun más es que las grasas contienen más del doble de energía por gramo que los hidratos de carbono, 38 kj/gr (9 kcal/gr) para las grasas, frente 18 kj/gr (4 kcal/gr) para los carbohidratos. Sumado a que los carbohidratos son almacenados en presencia de agua, mientras que las grasas son almacenadas casi en forma anhidra (1 gr. de glucógeno contiene aproximadamente 2 grs. de agua), (Jeukendrup, A. et al.. 2007).
El propósito, de este artículo es poder abarcar todos los pasos del metabolismo de las grasas en el adiposito, desde la lipólisis, el transporte de los ácidos grasos, hasta la llegada a la célula muscular, para su posterior utilización o reesterificación.
Empezaré por un lado, realizando a modo de repaso y continuación con la introducción, una breve clasificación bioquímica de los lípidos, luego describiré la fisiología de la célula lipídica. Y por último, me detendré en la movilización, transporte y metabolización de las grasas por parte de la célula muscular y como el ejercicio físico puede involucrarse en este proceso.
DESARROLLO
Clasificación de los lípidos
Los lípidos tienen una gran importancia desde el punto de vista biológico, debido a sus diversas e irremplazables funciones:
- Constituyen las membranas celulares.
- Forman la principal reserva de energía, por su alto contenido calórico.
- Vehiculizan vitaminas liposolubles.
- Numerosas sustancias con diferentes actividades fisiológicas están relacionadas, como por ej: Hormonas, algunas vitaminas, ácidos biliares, etc.
Los lípidos son un grupo heterogéneo de sustancias con la característica común de ser insolubles o poco solubles en agua y solubles en solventes orgánicos. De acuerdo a la complejidad de sus moléculas pueden clasificarse en dos categorías: lípidos simples (acilgliceroles y las ceras) y lípidos complejos (fosfolípidos, glicolípidos y lipoproteínas). En casi todos estos compuestos, forman parte de la molécula ácidos orgánicos monocarboxilicos, llamados ácidos grasos. (Blanco A. 2000).
Por interés e importancia para el tema en cuestión, nos detendremos en la explicación de los ácidos grasos dejando para otra oportunidad el resto de los lípidos, debido a que van a ser una de la principal fuente energética para el metabolismo muscular, producto de la lipólisis. Los ácidos grasos de origen animal son monocarboxilicos de cadena lineal, poseen en general, un numero par de átomos de carbono (de 4 a 26 carbonos) siendo los mas abundantes en el ser humano los de 16 o 18 átomos de carbono (ácidos grasos de cadena larga).
Además, los ácidos grasos pueden ser saturados o insaturados, este último con doble ligadura entre carbono de la cadena. Los ácidos grasos con una unión doble se conocen como ácidos grasos monoinsaturados mientras que los ácidos grasos con dos o más uniones dobles son llamados poliinsaturados. (Jeukendrup, A. et al. 2007).
El adiposito
Anteriormente se pensaba que las células del tejido graso, el adiposito, tenían como única función la de cumplir como un gran reservorio de energía. En la actualidad esa visión se ha modificado, ya que las investigaciones de hoy comprobaron que funciona, como un verdadero órgano endocrino y que puede incluso liberar sustancias nocivas al torrente sanguíneo.
Como sostiene Roig, (2006): este tejido es mucho más que un depósito energético. Numerosas moléculas son secretadas por los adipositos (leptina, TNFα, angiotensina, resistina, estrógenos, etc.) lo que advierte sobre una verdadera función endocrina (y también autócrina y parácrina) ya que las mismas son capaces de actuar a distancia sobre distintos órganos blanco.
Otra de las sustancias que libera, es una hormona llamada leptina, que se produce a través de un gen denominado obeso u ob que posee la misma célula. Su función es enviarle al cerebro a través del hipotálamo (donde se encuentra el centro de la saciedad) el estado nutricional del sujeto. Esta acción se ve alterada en aquellas personas con un gran porcentaje de tejido adiposo en su composición corporal y se piensa que podría ser uno de los causantes de la obesidad.
Como sostienen, McArdle, W. et al. (2004), la leptina por si sola no determina la obesidad o explica por que algunas personas comen lo que quieren y engordan poco, mientras que otras se hacen obesas con el mismo aporte calórico. Además de la producción deficiente de leptina, los científicos proponen la posibilidad defectuosa de un receptor (a través de una molécula receptora de leptina en las células cerebrales), que aumentan la resistencia de una persona a las sustancias químicas de la saciedad, producidas por el cuerpo.
En las últimas décadas se ha observado como varias sustancias secretadas por el adiposito han sido involucradas en diferentes funciones biológicas tales como la homeostasis energética, sensibilidad a la insulina, metabolismo de los lípidos, inflamación e inmunidad, (Mahecha y Rodrigues, 2008).
A su vez, las células grasas se distribuyen en distintas partes del cuerpo, cumpliendo con diferentes funciones endocrinas según su ubicación. Diversos estudios demostraron que el tejido adiposo visceral esta relacionado con alteraciones metabólicas y con enfermedades del árbol arterial, como por ejemplo: hiperinsulinemia, disminución de la lipoproteína de alta densidad (HDL), aumento de los triglicéridos (TG), aumento de lipoproteína de baja densidad (LDL), cardiopatías, etc.
Como sostiene Roig, (2006) se sabe que la grasa intra abdominal o central está asociada a patologías de orden metabólico y cardiovascular. Los individuos con una acumulación de grasa visceral (central o profunda) serían más sensibles a la estimulación β-adrenérgica de los adipositos de esa zona, todo lo cual redundaría en una liberación acentuada de AG que se dirigen al hígado y que parecen ser los responsables de las alteraciones metabólicas hepáticas que generan hipertrigliceridemias, resistencia a la insulina, etc. Esta distribución se piensa que es la causa de la actividad aumentada de la lipoproteína lipasa (LPL), enzima limitante de almacenar los TG en los adipositos. La inclusión de TG desde la sangre hacia el adiposito depende de la hidrólisis de los mismos, tarea subordinada a la enzima lipoproteinlipasa (LPL) presente en el endotelio de los capilares del tejido adiposo.
Existe una diferencia genética sobre la acción de esta enzima que puede explicar la distribución de la grasa corporal entre el sexo masculino, donde preferentemente se acumula en la parte central (obesidad androide) y el sexo femenino, donde se acumula en la cadera y los muslos (obesidad ginecoide). La movilización de los depósitos de lípidos en las mujeres está más acentuada en la zona visceral (acumulando en la periferia subcutánea), en tanto que en los hombres dicha utilización es mayor en las grasas periféricas (concentrando más en la región central del cuerpo). De esta predominancia surge entonces el ya mencionado balance regional, donde las mujeres depositan principalmente en las zonas periféricas (con alta estimulación alfa adrenérgica) y usan más la grasa central (de elevada estimulación beta adrenérgica) y los hombres muestran una acción exactamente a la inversa, (Roig, 2006).
El aumento del tejido adiposo, se puede dar por dos formas, por el aumento del tamaño del adiposito ya existente denominado hipertrofia, o bien por un aumento en el numero de adipositos, proceso denominado hiperplasia, (McArdle, et al. 2004).
La tasa limitante de oxidación de los ácidos grasos depende según, Balucio (2005) de tres partes a tener en cuenta:
- Movilización de ácidos grasos (AG) desde el tejido adiposo.
- Transporte de AG hacia el músculo.
- Consumo de AG por parte de la célula muscular
Movilización de ácidos grasos desde el tejido adiposo
Jeukendrup, A. et al. (2007), todos estos autores sostienen que la movilización de los ácidos grasos del tejido adiposo depende de: la tasa de lipólisis; la tasa de reesterificación de los ácidos grasos dentro del adiposito; y la tasa de transporte de ácidos grasos desde el tejido adiposo hacia la sangre.
Tasa de lipólisis
Los AG son continuamente movilizados en el adiposito, los triglicéridos son transportados desde la gotita de lípidos hacia el citoplasma del adiposito, este proceso puede ser iniciado por las catecolaminas, que van a ser recibidos por unos receptores llamados beta adrenérgicos, que se encuentran en la membrana plasmática celular. La variabilidad en la tasa lipolítica en diferentes capas de tejido adiposo está relacionada con diferencias regionales en la densidad y función de receptores beta adrenérgicos (Horwitz, 2001, adaptado por Balucio, 2005).
Se reconoce en el adiposito la existencia de al menos 5 subtipos de receptores adrenérgicos diferentes, tres β-AR (β1, β2 y β3), un α2A-AR y un α1Β-AR (Lafontan M et al., 1995).
La estimulación de los β-AR presentes en las células adiposas genera AMPc mediante la activación de la adenilatociclasa. El aumento del AMPc intracelular activa la proteína quinasa A (PKA), la que estimula a la enzima lipasa hormona sensible (LHs), quien una vez activada se transloca hacia la vacuola lipídica e hidroliza los TG almacenados. (Roig, 2006).
Esta enzima esta sujeta a la respuesta hormonal, siendo el paso limitante para la lipólisis ya que esta presente en una forma activa e inactiva, la cual al ser estimulada adrenergicamente dispara una cascada de eventos conduciendo a la fosforilación de la hormona sensitiva lipasa inactiva y dando como producto dos ácidos grasos y un monoacilglicerol remanente (glicerol con un acido graso en la posición-alfa) los cuales se pueden difundir dentro de la circulación, luego este último será hidrolizado por la enzima monoaciglicerol lipasa en glicerol y otro acido graso (fig. 1).
El glicerol no puede ser reutilizado para formar triglicéridos nuevamente por el adiposito a causa de su ausencia o baja concentración de la enzima glicerolquinasa, si presente en el músculo.
El glicerol es una pequeña molécula soluble en agua que puede difundirse fácilmente a través de la membrana celular dentro de la sangre. Por lo tanto, todo el glicerol producido por la lipólisis en el adiposito es liberado a la circulación. Por esta razón la aparición de glicerol en la sangre generalmente es utilizada como medición de lipólisis. (Jeukendrup, A. et al. 2007). A diferencia del glicerol, los ácidos grasos pueden ser reesterificados para formar nuevos triglicéridos, en un proceso llamado ciclo triacilglicérido – graso.
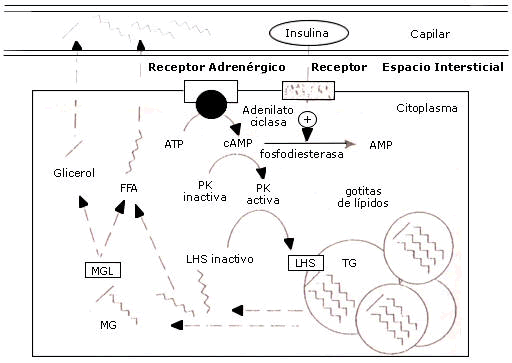
Figura 1. Movilización de ácidos grasos desde el tejido adiposo. Jeukendrup, A. et al. (2007).
Anteriormente, dijimos que el paso tasa limitante de la lipólisis es la lipasa hormona sensible (LHS), esta enzima se ve inhibida o estimulada por otras hormonas liberadas por el sistema nerviosos simpático como son las catecolaminas, podemos decir entonces que estas tienen ambos efectos sobre la tasa de lipólisis, el efecto alfa-adrenérgico inhibitorio, y el efecto beta-adrenérgico estimulante. Por otro lado, se ha demostrado que existen otras hormonas y sustancias que pueden bien estimular o inhibir la lipólisis. Estudios en adipositos humanos aislados revelaron que concentraciones fisiológicas de catecolaminas, glucocorticoides, la hormona tiroidea estimulante y la hormona de crecimiento son buenos estimulantes de la lipólisis. Por el contrario, el lactato, los cuerpos cetónicos y especialmente la insulina tienen un efecto inhibitorio sobre esta enzima. (Jeukendrup, A. et al. 2007).
Tasa de reesterificación de los ácidos grasos dentro del adiposito
La reesterificación de los ácidos grasos puede ocurrir dentro del mismo adiposito (reesterificación intracelular) o bien en otro tejido (reesterificación extracelular). Este proceso dentro del adiposito antecedido por la hidrólisis de los TG es denominado, ciclo de triacilglicérido-acido graso, y para que ello ocurra se necesita de la presencia de glicerol-3-fosfato (G-3-F), pero como el glicerol no puede ser reutilizado por la célula lipídica a causa de la ausencia o escasa actividad de la enzima glicerolquinasa, el G-3-F necesario para formar nuevamente TG a partir de los AG que permanecieron dentro del adiposito derivara de la glucosa (fig. 2).
La formación de G-3-F involucra la reducción del fosfatodihidroxiacetona, un intermediario glucolítico. Los G-3-F nuevamente formados pueden entonces ser ligados a la acil CoA para sintetizar triacilglicéridos. Con bajos niveles de glucosa en sangre, menos G-3-F se formará, y consecuentemente la tasa de reesterificación de ácidos grasos decrecerá. (Jeukendrup, A. et al. (2007).
Aunque se podría pensar que de la hidrólisis de una molécula de TG daría como resultado un glicerol más tres ácidos grasos sino no existiera la reesterificación, pero se sabe que el cociente de liberación es 1:2 respectivamente.
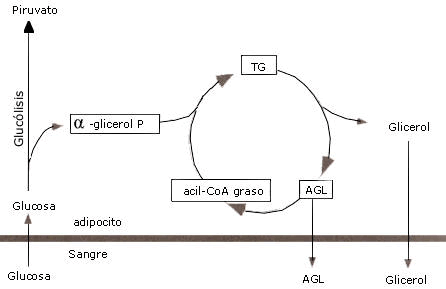
Figura 2. Ciclo triacilgliceridos-ácidos grasos. Jeukendrup, A. et al. (2007).
Transporte de AG hacia el músculo
Tasa de transporte de ácidos grasos desde el tejido adiposo hacia la sangre
Una vez hidrolizada la molécula de TG dentro del adiposito los ácidos grasos pueden traspasar la membrana celular pasivamente o asociada a una proteína ubicada en la membrana del adiposito (acido graso-translocasa o proteína transportadora de ácidos grasos). Luego en el espacio intersticial se unirán a la Albúmina, pasaran la pared del vaso sanguíneo (capilar) y nuevamente se unirán a la albúmina circulante, que será la responsable de transportar el 99,9% de ácidos grasos en plasma. Junto pero en mucho menor cantidad (0,01%), a la VLDL (lipoproteína de muy baja densidad), LDL (lipoproteína de baja densidad) y HDL (lipoproteína de alta densidad) quienes serán los encargados de transportar los AG remanentes por la sangre.
En el hígado los ácidos grasos pueden ser incorporados en las lipoproteínas (lipoproteínas de muy baja densidad, VLDL). Otras lipoproteínas también funcionan como trasportadores de ácidos grasos a través de la sangre (quilomicrones, lipoproteínas de baja densidad [LDL], lipoproteínas de alta densidad [HDL]. (Jeukendrup, A. et al. (2007).
Por lo tanto, los condicionantes del transporte de los ácidos grasos parecen ser la saturación del complejo albúmina-acido graso y la adecuada perfusión del tejido. La capacidad para acarrear AGL lejos del tejido adiposo está determinada por la concentración sanguínea de albúmina, la proporción molar de AGL/albúmina y el ritmo de perfusión a través del tejido adiposo (Hargreaves, M., 1995. Adaptado por Campillo). Como menciona Bulacio (2005), en el estudio de Mora-Rodriguez y Coyle (2000) se observó que la tasa de aparición (DA) de AGL aumentó abruptamente cuando terminó el ejercicio, realizado a un 85% del VO2 máximo; en menor grado, al realizarlo a un 65% del VO2 máximo; y fue bajo después de realizarlo a un 25% del VO2 máximo. Esto parece demostrar la entrada en plasma de AG “atrapados” en tejido adiposo durante el ejercicio, dando el indicio que el aumento de los AG en el plasma luego de terminado el ejercicio, no está asociado con una mayor lipólisis, sino que posiblemente refleje un inadecuado flujo sanguíneo en el tejido adiposo.
Cabe aclarar como sostienen, Hodgetts, V., et al., 1991; Bulow, J., Madsen, J., 1976; Bulow, J., 1982; Bulow, J., Madsen, J., 1978; McArdle, W., 2000; McArdle, W., 2002 que el flujo sanguíneo en el tejido adiposo de humanos y perros aumenta con el ejercicio, aunque no lo hace de forma localizada, pudiendo de esta forma romper con el mito que dice que: el incremento de la actividad metabólica de un grupo muscular determinado, no induciría un incremento en el flujo sanguíneo del tejido adiposo localizado en forma adyacente al grupo muscular ejercitado, lo cual impediría observar un efecto de reducción localizada de tejido adiposo a través del ejercicio físico.
Previo a la extracción por parte del músculo esquelético, los ácidos grasos tienen que ser liberados desde la albúmina debido a que la permeabilidad de las células endoteliales, que revisten la pared de los capilares musculares, es muy baja para el complejo albúmina- ácido graso.
Luego, los ácidos grasos tienen que ser transportados a través del espacio intersticial, mas probablemente unidos a la albúmina. Allí los ácidos grasos serán trasportados a través del sarcolema, tanto por difusión pasiva como facilitado por la membrana plasmática ligada a proteínas de unión de ácidos grasos (PUAG). En el citoplasma, los ácidos grasos están ligados a la PUAG citoplasmática (PUAGc), y el transporte de los mismos dentro del citoplasma ocurre ligado a esta proteína. (Jeukendrup, A. et al. 2007).
Oxidación de los ácidos grasos por la célula muscular
Una vez que los ácidos grasos entran al citoplasma de la célula muscular pueden ser tanto esterificados como almacenados en los TG intracelulares, el músculo esquelético contiene en promedio aproximadamente 12 mmol/kg ps (peso seco) de TG pero esto puede variar marcadamente debido a factores tales como el tipo de fibra, la nutrición y el ejercicio físico (Jeukendrup, A. et al. (2007). O bien el ácido graso puede ser ligado a la PUAG para el trasporte al sitio de oxidación, y activado (proceso extramitocondrial) para convertirse en acil CoA graso por la enzima acil CoA sintetasa.
La membrana mitocondrial interna es impermeable para el acil CoA (o ácido graso) de manera tal que se necesita un transportador para el desplazamiento del ácido graso activado a través de la membrana mitocondrial interna. Primero el éster acil CoA es convertido en acil-carnitina por la carnitin-acil-transferasa (CAT I) ubicada en la cara externa de la membrana mitocondrial interna y reconvertido en acil CoA graso en el lado de la matriz de la membrana mitocondrial interna por la enzima CAT II . La acil carnitina atraviesa la membrana interna en un intercambio 1:1 con una molécula libre de carnitina, un paso del transporte que es controlado por la proteína acil carnitin-translocasa (fig. 3).
Generalmente, se cree que los ácidos grasos de cadena media y corta pueden ser difundidos más libremente en la matriz mitocondrial, donde son convertidos en sus respectivos ésteres CoA. Sin embargo, al menos parte de estos ácidos grasos son transportados por proteínas transportadoras específicas acil CoA-transferasas de cadena corta o media.
En la beta-oxidación, el acil-CoA graso es degradado en gran medida a acetil-CoA y un residuo de acil-CoA acortado en dos carbonos. Las unidades de acetil-CoA pueden entrar al Ciclo de los ácidos Tricarboxílicos y seguir exactamente el mismo camino que las unidades de acetil-CoA desde el piruvato. El acil-CoA graso acortado actúa otra vez como un sustrato para el camino beta-oxidativo hasta que es completamente oxidado. Se sabe que los ácidos grasos de cadena media (AGCM) son oxidados mas rápido y completamente que los ácidos grasos de cadena larga (AGCL).
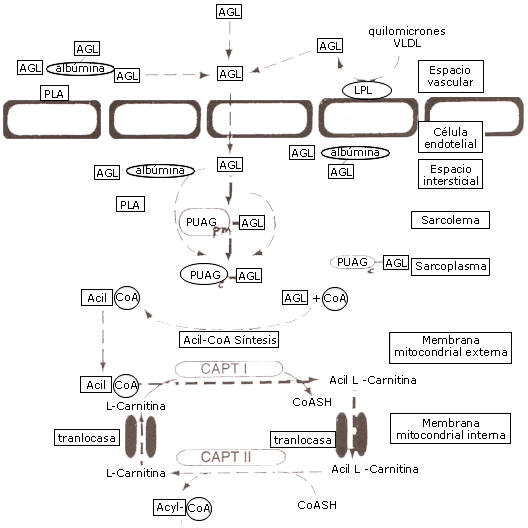
Figura 3. Transporte de ácidos grasos desde el espacio vascular en la mitocondria de la célula muscular.Jeukendrup, A. et al.( 2007).
Efectos del ejercicio sobre el metabolismo de los lípidos
La utilización de las grasas como principal fuente energética, estará condicionada a la intensidad del ejercicio realizado. Como lo demuestra el estudio realizado por Romijn y col. (1993) donde investigaron la contribución energética de distintos sustratos durante tres intensidades diferentes de ejercicio.
Ellos descubrieron que durante el ejercicio de baja intensidad (25 % VO2 máx.) los TGIM contribuyen minimamente a la provisión de energía, los ácidos grasos y la glucosa en plasma parecen ser los sustratos más importantes a esa intensidad donde las grasas son por lejos el combustible predominante. A intensidad de ejercicio moderada (65 % VO2 máx.) los sustratos en el músculo (TGIM y glucógeno) se tornan mas importantes. Los TGIM fueron oxidados a altas tasas, a esta intensidad de ejercicio, mientras que los ácidos grasos plasmáticos fueron utilizados a una tasa levemente mas baja, comparado con el ejercicio de baja intensidad. Y por ultimo, a intensidades altas (85% VO2 máx.) el sustrato que predomino fue el glucogeno muscular y se produjo un descenso de los TGIM y de los AG plasmáticos (fig. 4).
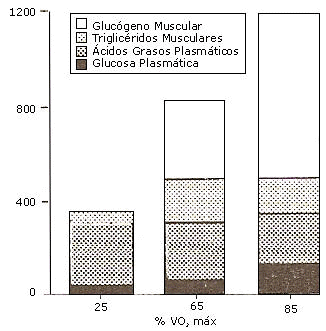
Figura 4. Utilización de sustratos a distintas intensidades de ejercicio. Datos adaptados de Romijn por Jeukendrup, A. et al. ( 2007).
Esto indica que otros factores (intramusculares) pueden reducir la oxidación de ácidos grasos durante el ejercicio de alta intensidad. Un posible mecanismo puede ser que las altas tasas de glucólisis y altas tasas de formación de acetil CoA desde la glucosa-6-fosfato, a esas intensidades de ejercicio, inhiben el transporte de ácidos grasos de cadena larga dentro de la mitocondria al nivel de CAT I, incrementando las concentraciones de Malonil CoA, la presencia de una mayor concentración de lactato, una vasoconstricción en el tejido adiposo que deja “atrapados” a los AG hidrolizados en el adiposito. Además, durante el ejercicio intenso, serán reclutadas más fibras rápidas (FT) y menos fibras lentas (ST). Dado que las fibras FT tienen una menor capacidad de oxidar ácidos grasos, la oxidación de grasas decrecerá, y concomitantemente, la oxidación de carbohidratos se incrementará cuando más de estas fibras sean reclutadas.
Consideraciones finales
La lipólisis, el proceso del cual me he referido a lo largo de este artículo, estaría regulada principalmente por el sistema neuroendocrino, en donde las catecolaminas y la insulina tendrían un rol protagónico. Estas hormonas ejercerían su influencia a través de la transducción de señales intracelulares, en donde la modificación de la actividad de enzimas como la LPL y/o LHS sería clave para poder regular la movilización de AGL de acuerdo a las necesidades metabólicas.
Además de la lipolísis, la capacidad de la sangre para transportar AGL (limitada por la concentración de albúmina sanguínea, por la relación molar AGL/albúmina y la perfusión del tejido adiposo), influiría sobre la movilización de AGL desde el tejido adiposo.
Estos conocimientos fisiológicos de la célula lipídica, nos brindan la posibilidad de programar el ejercicio de forma correcta si tratamos con población que padezca sobrepeso u obesidad, siendo el objetivo primordial de estas personas reducir el tejido adiposo.
Referencias
1. American Collage of Sports Medicine (2000). Manual de consulta para el control y la prescripción de ejercicio. Ed. Paidotribo. Barcelona
2. American Collage of Sports Medicine (2005). Manual ACSM para la valoración y prescripción del ejercicio. 2ª edición. Ed. Paidotribo. Barcelona
3. Baechle y Earle (2007). Nacional Strenth and Conditioning Association. Principios del Entrenamiento de la Fuerza y del Acondicionamiento Físico. 2ª edición. Ed. Panamericana. Madrid
4. Blanco Antonio (2000). Química Biológica. Ed. El Ateneo
5. Bulacio, Pablo (2005). Efectos del Ejercicio sobre el Metabolismo de Lípidos. PubliCE Standard. 14/11. Pid: 543
6. Costill, David; Wilmore, Jack (2007). Fisiología del esfuerzo y del deporte. Ed. Paidotribo. Barcelona
7. Edward F. Coyle Oxidación de las Grasas Durante el Ejercicio: Rol de la Lipólisis, Disponibilidad de Ácidos Grasos Libres, y Flujo Glucolítico. PubliCE Standard
8. Heredia Elvar, Juan R. Roig, Jorge L. Isidro Donate, Felipe. Chulvi Medrano, Iván. Mata, Fernando. Paredes, Jesús (2009). Planteamientos Actuales ante el Sobrepeso/Obesidad desde la Perspectiva de los Especialistas en Ejercicio Físico y Salud. PubliCE Standard. 01/06/2009. Pid: 1136
9. Heyward, V (2008). Evaluación de la aptitud física y prescripción del ejercicio. 5º edición. Ed. Panamericana
10. Heyward, V Evaluación y prescripción del ejercicio. Ed. Paidotribo. Barcelona
11. Jeukendrup, Asker. Saris, William H. Wagenmakers, Anton J (2007). Metabolismo de las Grasas Durante el Ejercicio Una Revisión. Parte I, II: Regulación del Metabolismo y los Efectos del Entrenamiento. PubliCE Standard. 16/07/2007. Pid: 842
12. Jiménez Gutierrez, A (2008). Nuevas dimensiones en el entrenamiento de la fuerza: aplicación de nuevos métodos, recursos y tecnología. Ed. Inde
13. Lopez Chicharro, J. y Lopez Mojares, L.M (2008). Fisiología Clínica del Ejercicio. Ed. Panamerica
14. Lopez Chicharro, J.; Fernandez Vaquero, A (2006). Fisiología del ejercicio. Ed. Panamericana. Madrid. 3º edición
15. Mahecha, SM; Rodrigues, VK (2008). Obesidad y Actividad Física- Prevención & Tratamient. Brasil. CELAFISCS
16. McArdle, W; Katch, F; Katch, V (2004). Fundamentos de fisiología del ejercicio. Ed. McGraw- Hill. Interamericana. Madrid. 2º edición
17. Ramírez Campillo, Rodrigo (2007). Movilización de Ácidos Grasos Libres Durante la Realización de Ejercicio Físico: Una Revisión a la Literatura. PubliCE Standard. 09/04/2007. Pid: 801
18. Ramírez Campillo, Rodrigo (2010). Algunas Preguntas Fundamentales sobre la Oxidación Lipídica durante el Ejercicio Físico. PubliCE Standard. 05/04/2010. Pid: 1236
19. Roig, Jorge L (2006). La Problemática Multifactorial de la Obesidad. Las Dificultades que se Imponen al Enmagrecimiento por Actividad Física. PubliCE Standard. 23/10 Pid: 723
20. Romijn, J. A. Coyle, Edward F. Sidossis, L. S. Gastaldelli, A. Horowitz, J. F. Endert, E. Wolfe, R. R (2004). Regulación de la Grasa Endógena y Metabolismo de los Carbohidratos en Relación a la Intensidad y Duración del Ejercicio. PubliCE Standard. 29/03/2004. Pid: 273
21. Saavedra, Carlos (2003). Prescripción de Actividad Física en la Obesidad y las Alteraciones Metabólicas. PubliCE Standard. 06/10/2003. Pid: 193
22. Serra Grima, J (2003). Prescripción de Actividad Física en la Obesidad y las Alteraciones Metabólicas. PubliCE Standard. 06/10/2003. Pid: 193
Cita en PubliCE
Matías Santa María (2013). Metabolismo de los Lípidos Durante el Ejercicio Físico. .https://g-se.com/metabolismo-de-los-lipidos-durante-el-ejercicio-fisico-1608-sa-P57cfb27234c4b
