Metabolismo de las Grasas Durante el Ejercicio: Una Revisión Parte III: Efectos de las Intervenciones Nutricionales
Asker Jeukendrup1, William H Saris1, Anton J Wagenmakers11 Nutrition Research Center, Department of Human Biology, Maastricht University, Maastricht, The Neterlands.
Resumen
Por medio de cambios en la nutrición es posible manipular la oxidación de grasas. Generalmente se teoriza que el aumento de la oxidación de grasas puede reducir la degradación de glucógeno, y en consecuencia, mejorar el rendimiento. Por lo tanto, los efectos de la alimentación con grasas en forma aguda, en el corto y largo plazo, fueron tema de investigación por muchos años. La ingesta de triacilglicéridos de cadena larga (TGCL) durante el ejercicio puede reducir la tasa de vaciamiento gástrico, y los TGCL aparecerán en el plasma solo lentamente. Los triacilglicéridos de cadena media (TGCM) no tienen estas desventajas y son rápidamente oxidados. Sin embargo, la contribución de los TGCM al gasto energético solo es pequeña debido a que estos solo pueden ser ingeridos en pequeñas cantidades, para que no causen malestar gastrointestinal. Por eso hasta el presente, la suplementación con grasas en las horas previas o durante el ejercicio (triacilglicéridos de cadena larga o media) no es recomendable. Se sugirió que las dietas altas en grasas y el ayuno incrementan la disponibilidad de ácidos grasos y ahorran glucógeno muscular, resultando en una mejora del rendimiento. Tanto el ayuno como las dietas altas en grasas, en el corto plazo, disminuyen el contenido de glucógeno muscular y reducen la resistencia a la fatiga. Las dietas altas en grasas, en forma crónica, provocan respuestas adaptativas que previenen los efectos deletéreos sobre el rendimiento del ejercicio. Sin embargo, en el presente existe poca evidencia para sostener esta hipótesis. También desde una perspectiva de la salud, se debería tener cautela al recomendar dietas altas en grasas a deportistas.
Palabras Clave: dietas altas en grasas, triacilglicéridos, ayuno, TGCM, cafeína, carnitina.
INTRODUCCION
Esta es la última de tres partes de una revisión acerca del metabolismo de las grasas durante el ejercicio. En la parte I (44) se mencionó la importancia de las grasas como sustrato durante el ejercicio, y se describió como estas son movilizadas desde el tejido adiposo, además de discutir diversos aspectos de su metabolismo. La parte II (45) focalizó en la interacción entre metabolismo de carbohidratos y grasas, y la regulación de la utilización de los sustratos. Además, se discutieron los efectos de la intensidad del ejercicio y el entrenamiento. Aquí (en la parte III) discutiremos los efectos, a corto y largo plazo, de la nutrición sobre el metabolismo de las grasas, así como también el efecto de los suplementos nutricionales sobre la utilización de grasas y el rendimiento del ejercicio.
NUTRICION Y UTILIZACION DE SUSTRATOS DURANTE EL EJERCICIO
Suplementación con Grasas
La suplementación con grasas usualmente es considerada indeseable dado que los depósitos endógenos de grasas son muy grandes, y puede no ser necesario suplementar grasas adicionales. Además de este hecho, existe el riesgo de que la ingesta de triacilglicéridos de cadena larga (TGCL) conduzca a un incremento del compartimiento del tejido adiposo e incremente el peso corporal. Los argumentos que se antepusieron en favor de la suplementación con grasas están principalmente basados en un posible “efecto de ahorro de glucógeno”, y la subsiguiente mejora del rendimiento. Los suplementos de grasas pueden ser ingeridos como triacilglicéridos de cadena larga o de cadena media TGCL o TGCM).
Ingesta de Triacilglicéridos de Cadena Larga, Durante el Ejercicio
Las grasas nutricionales incluyen triacilglicéridos, fosfolípidos y colesterol, de los cuales los triacilglicéridos, y posiblemente los fosfolípidos, pueden contribuir en algún grado a la provisión de energía durante el ejercicio (ver Parte I y II de esta revisión [44,45]). En contraste con los carbohidratos, las grasas nutricionales alcanzan la circulación solo lentamente dado que son potentes inhibidores del vaciamiento gástrico (33). Además, la digestión y absorción de las grasas en el intestino también son procesos más que lentos, comparados con la digestión y absorción de carbohidratos. Las sales biliares, producidas por el hígado y la lipasa secretada por el páncreas son necesarias para degradar los triacilglicéridos de cadena larga (TCL) en glicerol y 3 ácidos grasos de cadena larga (AGCL), o monoacilglicerol y 2 ácidos grasos. Los ácidos grasos se mueven dentro de las células de la mucosa intestinal y son reesterificados en el citoplasma para formar triacilglicéridos de cadena larga (TGCL) (2). Estos TGCL serán capturados por los sacos de proteínas (quilomicrones) para hacerlos solubles en agua (64). Estos quilomicrones son entonces liberados a través del compartimiento intersticial dentro del sistema linfático el cual, en última instancia drena, en la circulación sistémica. Las grasas exógenas entran a la circulación sistémica mucho más lento que los carbohidratos que son absorbidos como glucosa (o en menor grado como fructosa o galactosa), y entran directamente a la circulación principal a través de la vena porta. Los ácidos grasos de cadena larga en la dieta, característicamente, entran en la sangre 3-4 horas después de la ingesta (17,23).
También es importante que estos ácidos grasos de cadena larga entren a la circulación en quilomicrones, y generalmente se cree que la tasa de ruptura de los triacilglicéridos ligados a quilomicrones por el músculo es relativamente baja, y contribuye solo mínimamente al gasto de energía (49). Se sugirió que uno de los roles de estos triacilglicéridos en los quilomicrones es la restitución de los depósitos intramusculares de triacilglicéridos, luego del ejercicio (65).
En resumen: La ingesta de triacilglicéridos de cadena larga durante el ejercicio es indeseable debido a las siguientes razones: 1) Hace lento el vaciamiento gástrico; 2) los TCL solo aparecen lentamente en la circulación sistémica; y 3) Los TCL entran a la circulación sistémica en quilomicrones, los que se cree que no son el combustible principal durante el ejercicio, pero pueden servir para restituir los depósitos intramusculares de TG luego del ejercicio.
Ingesta de Triacilglicéridos de Cadena Media (TGCM)
Si bien en general las grasas son lentamente hidrolizadas y absorbidas, esto también depende de la longitud de cadena de los ácidos grasos. En contraste con los triacilglicéridos de cadena larga, los de cadena corta y media (TGCM) son absorbidos más rápidamente y no son transportados por quilomicrones, pero entran directamente a la circulación sistémica a través de la vena porta. En consecuencia, entrarán a la circulación sistémica más rápidamente.
Con la introducción de los ácidos grasos de cadena media (AGCM) en la nutrición enteral y parenteral, su posible rol en la nutrición deportiva se tornó en un tema de investigación. Los AGCM contienen 8 o 10 carbonos, mientras que los AGCL contienen 12 o más carbonos. A diferencia de la mayoría de los TGCL, los TGCM son líquidos, a temperatura ambiente. Esto es, en parte, el resultado del pequeño tamaño molecular de los TGCM. Los TGCM son más polares, y por lo tanto, más solubles en agua. Esta mayor solubilidad en agua y menor tamaño molecular tiene consecuencias a todos los niveles de metabolismo. Los TGCM son más rápidamente digeridos y absorbidos en el intestino que los TGCL. Además, los AGCM siguen el sistema venoso portal y entran al hígado directamente mientras que los AGCL siguen el lento sistema linfático (2, 30, 35). Se ha sugerido que los TGCM pueden ser una fuente valorable de energía endógena durante el ejercicio, en adición a los carbohidratos (42). También se sugirió que la ingesta de TGCM puede mejorar el rendimiento del ejercicio, elevando los niveles de ácidos grasos en plasma y ahorrando glucógeno muscular (89), dado que se observó que el incremento de la disponibilidad de ácidos grasos plasmáticos redujo la tasa de ruptura de glucógeno muscular y demoró el comienzo del agotamiento (13, 29, 34, 73, 92).
Los TGCM adicionados a las bebidas con CHO no inhiben el vaciamiento gástrico (4). De hecho, las bebidas con TGCM se vaciaron más rápido del estómago que las bebidas de CHO isocalóricas. En un estudio subsiguiente se investigaron las tasas de oxidación de los TGCM ingeridos oralmente (42). Ocho atletas bien entrenados pedalearon 4 veces durante 180 min al 50 % Wmáx (57 % VO2máx). Los sujetos ingirieron CHO, CHO + TGCM, o TGCM solamente. Durante la segunda hora (período de 60-120 min) la cantidad de TGCM oxidados fue el 72 % de la cantidad ingerida con CHO + TGCM, mientras que durante la prueba de TGCM solamente el 33% fue oxidado. Se concluyó que se oxidaron más TGCM cuando se ingirieron en combinación con CHO. Los datos confirmaron la hipótesis de que los TGCM orales pueden servir como fuente de energía adicional a la glucosa durante el ejercicio, dado que la disponibilidad metabólica de TGCM fue alta durante la última hora de ejercicio, siendo las tasas de oxidación tanto como del 70 % de la tasa de ingesta. Sin embargo, las cantidades máximas de TGCM que podrían ser toleradas en el tracto gastrointestinal son pequeñas (aprox. 30 gr), y esto limitó la contribución de los TGCM orales al gasto total de energía, a valores entre 3 y 7 %. Nosotros también investigamos la oxidación de TGCM en los suplementos de CHO + TGCM, bajo condiciones donde la demanda de sustratos sanguíneos es máxima, como es el caso de un estado de depleción de glucógeno (43). Los sujetos ejercitaron hasta el agotamiento la tarde anterior al experimento, en el cual se determinó la oxidación de TGCM durante el ejercicio a 57 % VO2máx. Si bien la oxidación total de grasas se incrementó marcadamente, la oxidación de TGCM se incrementó solo marginalmente. La contribución de los TGCM al gasto total de energía siguió siendo pequeña (aprox. 6-8 %) (43).
También se sugirió que al elevar los niveles de ácidos grasos plasmáticos mediante la infusión de “Intralipid” y heparina ahorrará glucógeno muscular, y mejorará el rendimiento durante el ejercicio (13, 92). En teoría, la ingesta de TGCM podría también ser una vía para elevar los ni veles de ácidos grasos en plasma. Sin embargo, atletas bien entrenados que ingirieron CHO + TGCM o CHO solamente, no presentaron diferencias significativas en la ruptura de glucógeno entre las pruebas, ni en el cociente de intercambio respiratorio durante el ejercicio (47). Esto puede ser atribuido a la cantidad relativamente pequeña de TGCM (aprox. 30 gr) que puede ser tolerada en el tracto gastrointestinal. Van Zeyl et al. (89) sugirieron que la cantidad de TGCM ingerida fue demasiado pequeña para ejercer efectos positivos sobre el rendimiento; por lo tanto le dieron a los sujetos 86 gr de TGCM, durante 2 horas de ejercicio, seguido de una prueba contra reloj de 40 km. Estos investigadores observaron una reducción en la ruptura de glucógeno y un incremento de el rendimiento, cuando se ingirió una bebida de CHO + TGCM. Sin embargo, recientemente, realizamos un experimento similar en el cual los sujetos recibieron 85 gr de TGCM en una bebida de TGCM (contenido único) o CHO + TGCM, durante 2 horas de ejercicio de pedaleo al 60 % VO2máx (40). La ingesta de CHO + TGCM no mejoró el rendimiento, comparada con la ingesta de CHO o placebo (46). Sin embargo, cuando se ingirieron solo TGCM, el rendimiento medido con un protocolo de prueba de tiempo confiable (41), se redujo, y esto se atribuyó a las molestias gastrointestinales reportadas por los sujetos (40). No se sabe por que los sujetos en el estudio de Van Zeyl et al. (89) no experimentaron molestias o trastornos gastrointestinales luego de la ingesta de TGCM, y en nuestro estudio los sujetos si lo hicieron (40).
En conclusión: 1) los TGCM son rápidamente vaciados del estómago, absorbidos y oxidados; 2) La oxidación de TGCM endógeno se mejoró cuando fue co-ingerida con CHO, 3) La ingesta de 30 gr de TGCM no afectó la ruptura de glucógeno muscular; 4) Contribuyó solo en un 7 % al gasto de energía; 5) La ingesta de cantidades más grandes de TGCM resultó en malestar gastrointestinal. Por ello, el TGCM no parece tener los efectos positivos que generalmente se sostiene que tienen sobre el rendimiento.
Supuesta Evidencia de Substancias que Promueven la Oxidación
Cafeína
Se ha demostrado que la cafeína estimula la movilización de ácidos grasos, indirectamente incrementando los niveles de epinefrina circulante, o directamente antagonizando los receptores de adenosina que normalmente inhiben la lipasa hormono-sensible y la oxidación de ácidos grasos. Costill et al (13, 19, 36) demostraron que la cafeína ingerida una hora previa al comienzo de un esfuerzo de ejercicio incrementó las concentraciones de ácidos grasos plasmáticos, mejorando el rendimiento. La mejoría en el rendimiento se explicó por el incremento en la disponibilidad de ácidos grasos, lo cual podría conducir a la supresión del metabolismo de carbohidratos, y consecuentemente, a una reducida utilización de glucógeno. Sin embargo, los resultados de estudios que investigan los efectos ergogénicos de la cafeína y el posible rol de los ácidos grasos, son contradictorios. Diversos estudios mostraron concentraciones de ácidos grasos aumentadas, pero no vieron ningún efecto sobre la oxidación de grasas (50,85) o el rendimiento (18, 72, 85). Otros estudios, no observaron ningún efecto sobre el metabolismo de las grasas o el rendimiento (7, 86, 95). Estudios recientes demostraron grandes mejorías en el rendimiento con altas dosis de cafeína (24, 25, 67, 81), y estas mejorías no siempre estuvieron acompañadas por cambios en los ácidos grasos plasmáticos u oxidación de los mismos. Por ejemplo, Pasman et al. (67) estudiaron a sujetos que ejercitaron al 80 % VO2máx hasta el agotamiento, con dosis de cafeína extendiéndose desde 3-9 mg/kg. El tiempo hasta el agostamiento se incrementó en 10-20 %, pero esto podría no ser explicado por el incremento en la disponibilidad de ácidos grasos. Se concluyó que, si bien la cafeína estimula la movilización de ácidos grasos, el efecto ergogénico de la misma no puede ser explicado por el aumento en la disponibilidad de ácidos grasos incrementada. Para más detalles acerca del metabolismo y los efectos ergogénicos de la cafeína, nos referimos a diversas revisiones recientes (11, 14, 78, 80, 84, 88, 94).
Carnitina
La carnitina se produce endógenamente en el tejido hepático, riñones y cerebro, pero exógenamente solo es provista con la dieta (principalmente de carnes rojas). La L-carnitina no se produce en el músculo y la concentración de carnitina en músculo depende, por lo tanto, de la síntesis endógena y de la dieta, mientras que también existe una pérdida diaria de L-carnitina a través de la orina y la materia fecal. En condiciones normales (hombres saludables) hay un balance entre excreción y síntesis, y el suministro exógeno de L-carnitina. Como se discutió en la parte I (44), el rol principal de la L-carnitina está en el transporte de ácidos grasos a través de la membrana mitocondrial interna (9). La importancia de la carnitina en el metabolismo de la energía condujo a la creencia de que los suplementos de L-carnitina pueden incrementar la oxidación de grasas, reduciendo por lo tanto la demanda a los depósitos endógenos de carbohidratos, lo cual teóricamente podría incrementar el rendimiento de resistencia. Los suplementos con L-carnitina fueron introducidos como ácidos ergogénicos luego de haberse difundido rumores de que el equipo Italiano de Fútbol, que salió Campeón del Mundo en 1982, utilizó suplementos con L-carnitina. Se observó que la ingesta de L-carnitina incrementa las concentraciones de ésta en plasma, pero el consumo de carnitina en el músculo no fue afectado por el incremento de las concentraciones en plasma (79). Esto puede ser explicado por el hecho de que la concentración de carnitina en plasma es aproximadamente 100 veces más baja que la concentración de carnitina en músculo, y por lo tanto, para captar L-carnitina lo tiene que hacer contra un gran gradiente de concentración. Aun la ingesta de una gran dosis oral de L-carnitina (3), o aun la infusión de la misma (Rademaker, Rademakers, Saris y Wagenmakers: evidencia no publicada) pueden no resultar en un cambio significativo en la concentración de L-carnitina en el músculo. Consecuentemente, no se encontraron diferencias en la concentración de L-carnitina en el músculo, luego de la ingesta de la misma (3, 91). Si bien algunas investigaciones reportaron efectos sobre la frecuencia cardíaca, máximo consumo de oxígeno y rendimiento (57), la mayoría de los estudios no pudieron demostrar ningún efecto de la L-carnitina, administrada en forma oral o endovenosa, sobre la utilización de sustratos o sobre el rendimiento (8, 27, 79, 87, 96) (para más detalles, ver revisión de [93] y [26]).
REGIMENES NUTRICIONALES Y OXIDACION DE GRASAS
Ayuno
Se propuso al ayuno como una vía para incrementar la utilización de grasas, ahorrar glucógeno muscular y mejorar el rendimiento del ejercicio. En ratas, el ayuno en cortos plazos, incrementa las concentraciones de epinefrina y norepinefrina en plasma, estimula la lipólisis y el aumento de la concentración de ácidos grasos circulantes. Esto, a cambio, incrementa la oxidación de grasas y “ahorra” glucógeno muscular conduciendo a un similar (52), o aún incrementado, tiempo de carrera hasta el agotamiento en ratas (16). En humanos, el ayuno también resulta en un aumento en la concentración de catecolaminas circulantes, un incremento de la lipólisis, aumento de la concentración de ácidos grasos en plasma (15), y una reducción en el “turnover” de glucosa (51). La concentración de glucógeno muscular no se vio afectada por el ayuno (51,56). Sin embargo, el ayuno resultó en una disminución de los depósitos de glucógeno hepático, tal como lo indicó la Ta de glucosa reducida durante el ejercicio, luego de 3.5 días de ayuno, comparado con el estado de post-absortivo (51). Si bien se reportó que el ayuno no tuvo efecto sobre la resistencia a bajas intensidades de ejercicio (45 % VO2máx), Zinker et al. (97) observaron un 38 % de reducción en el rendimiento ante el ayuno, ante un esfuerzo al 79-86 % VO2máx. Loy et al. (56) reportaron una reducción del 15-63 % en el rendimiento con el ayuno, cuando los sujetos se ejercitaron al 79-86 % VO2máx, y Gleeson et al. (22) reportaron un rendimiento menor, ante esfuerzos al 100% VO2máx, ante la presencia de ayuno (Tabla 1). Esta reducción en el rendimiento no fue reversible por la ingesta de carbohidratos durante el ejercicio (74).
Aunque, se puede argumentar que los efectos observados en la mayoría de estos estudios pueden deberse al hecho de que, en la situación de los grupos control, la última comida fue provista 3 horas antes del ejercicio hasta el agotamiento (Tabla 1), y por lo tanto pudo haber un efecto residual de la alimentación pre-ejercicio mejorando la capacidad de resistencia, en contraste con la reducción de el rendimiento durante el ayuno. Sin embargo, también los estudios que comparaban un ayuno de 12 hs. con un ayuno más prolongado mostraron disminución en el rendimiento (51, 59, 97), y por lo tanto parece justificado concluir que el ayuno decrece la capacidad de resistencia.
En resumen, el ayuno incrementa la disponibilidad de sustratos lípidos y resulta en un incremento en la oxidación de ácidos grasos en reposo, y durante el ejercicio. Sin embargo, dado que los depósitos de glucógeno no son mantenidos (por el ayuno), la resistencia a la fatiga y el rendimiento de resistencia empeoran.
Efectos de una Dieta Alta en Grasas, en el Corto Plazo
Un cambio en el contenido carbohidratos-grasas en la nutrición puede causar un cambio en la utilización de sustratos. El cociente de los sustratos que proveen energía puede ser expresado como cociente de alimentación (AQ) en analogía a RQ. Una dieta alta en grasas (AQ bajo), y concomitante dieta con bajos carbohidratos, conduce a un incremento en la contribución de los ácidos grasos al gasto total de energía. Una dieta alta en grasas puede conducir a un peor rendimiento, tal como fue demostrado en 1939 por Christensen y Hansen (10). En este primer estudio, la ingesta de una dieta alta en grasas (> 90 % de la ingesta total de energía) redujo el tiempo hasta el agotamiento en una bicicleta ergométrica en un 60 %, comparado con una dieta alta en CHO (10) (Tabla 2). Luego del consumo de una dieta alta en carbohidratos (AQ alto) se observaron valores de reposo más altos, mientras que con una dieta alta en grasas (AQ bajo) los RQ fueron más bajos. La ingesta de 100-200 gr de carbohidratos en las horas precedentes al ejercicio resultó en un incremento en la oxidación de carbohidratos a costa de la oxidación de grasas (1, 10, 62). Con la reintroducción de la técnica de biopsia muscular al final de los años sesenta, de descubrió que una dieta alta en grasas, y baja en carbohidratos, resultó en menores niveles de glucógeno muscular, y este fue el factor principal que causó falta de resistencia a la fatiga durante el ejercicio prolongado (5, 6, 31, 32). Las concentraciones de ácidos grasos en plasma son elevadas en reposo, y se incrementan más rápidamente cuando se consume una dieta baja en carbohidratos (12, 58, 60). Estos cambios en las concentraciones de ácidos grasos en plasma, así como también concentraciones incrementadas de glicerol en plasma, luego de una dieta baja en carbohidratos, son los indicadores de lipólisis aumentada (15, 16, 51, 56, 97). Jansson y Kaijser reportaron que el consumo de ácidos grasos por el músculo durante 25 min de pedaleo al 65 % VO2máx fue un 82 % más alto en sujetos que recibían una dieta alta en carbohidratos (75 %), durante 5 días. Los ácidos grasos en plasma contribuyeron en un 25 % y un 14 %, al gasto de energía, respectivamente. Las concentraciones incrementadas de ácidos grasos en la sangre, luego de un período de restricción de carbohidratos, conducirá a una cetogénesis aumentada. Luego de algunos días de alimentación alta en grasas la producción de cuerpos cetónicos se incrementó 5 veces (20). La concentración arterial de cuerpos cetónicos se puede incrementar 10-20 veces (20). En la primera fase del ejercicio suave a moderado, las concentraciones de cuerpos cetónicos usualmente declinan, y luego de 30-90 min se incrementarán otra vez (20, 52, 97). Sin embargo, las concentraciones observadas bajo esas condiciones siguen siendo más altas, luego de una dieta alta en grasas comparada con dietas bajas en grasas. Las dietas restringidas en carbohidratos también pueden conducir a una incremento en la ruptura de TG en el músculo (12, 39, 82).
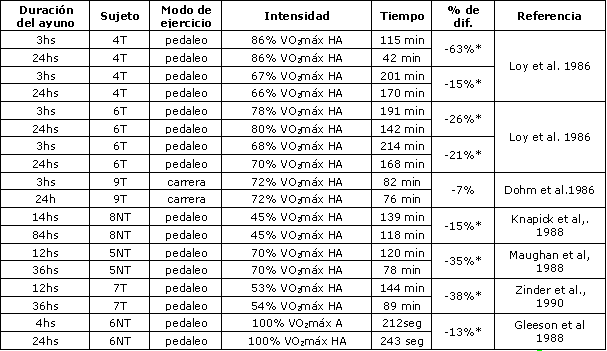
Tabla 1. Los efectos del ayuno prolongado sobre el rendimiento de resistencia en
hombres. VO2máx = consumo máximo de oxígeno, T = entrenado; NT = no
entrenado; HA = hasta el agotamiento. (*) Indica una diferencia significativa
entre condición de ayuno a corto plazo vs. largo plazo; P< 0.05.
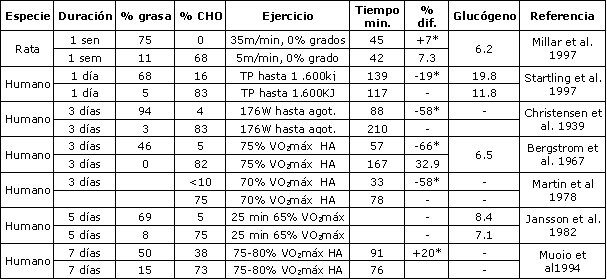
Tabla 2. Los efectos de una dieta alta en grasas, en el corto plazo (<7
días), sobre el rendimiento de resistencia. El glucógeno muscular de reposo es
expresado en mg/kg, y fue medido en el músculo soleo en ratas, y en el músculo vasto
lateral en humanos. Si era aplicable, se usó un factor de conversión de tejido
muscular seco a húmedo. VO2máx = máximo consumo de oxígeno, TP = tiempo de
pedaleo, HA = Hasta el Agotamiento: (*) Indica una diferencia significativa de
rendimiento entre la dieta alta en CHO vs. alta en grasas; p< 0.05.
En Tabla 2 se detallan los efectos de las dietas altas en grasas a corto y largo plazo sobre el rendimiento del ejercicio. Como se discutió antes, el efecto de una alimentación alta en grasas en un corto plazo (3-7 días) puede reducir el tiempo de ejercicio hasta el agotamiento (5, 10, 21, 31, 32, 58). Para nuestro conocimiento, solo hay un estudio que demostró un efecto benéfico en comer una cantidad de grasas levemente más grande. Muoio et al. (63) examinaron los efectos de tres dietas moderadas, por 7 días, en seis corredores. Los porcentajes de contribución de energía de carbohidratos, grasas y proteínas fueron 61/24/14, 50/38/12 y 73/15/12, respectivamente. Los autores concluyeron que la dieta “alta en grasas” (38% de grasas) incrementa el VO2máx y el tiempo de carrera hasta el agotamiento. Además los autores sugieren que el mecanismo por el cual el rendimiento se mejora, es a través de la beta-oxidación y la oxidación de ácidos grasos. Sin embargo, no se observaron diferencias en la oxidación de grasas (cociente respiratorio) entre las dietas. Los resultados pueden ser explicados simplemente por el hecho de que las pruebas no fueron al azar, y que fueron administradas en el orden “baja en grasas”, “moderada en grasas” y “alta en grasas”. Por eso los resultados de Muoio et al. (63) deberían ser interpretados con mucha cautela.
Un estudio interesante fue realizado recientemente por Starling et al. (83), quienes trataron de manipular los depósitos intramusculares de triacilglicéridos depletándolos parcialmente, durante un esfuerzo de pedaleo de 120 min al 65 % VO2máx, del cual se demostró que resulta en tasas relativamente altas de ruptura de triacilglicéridos (75). Cada sujeto ingirió una dieta alta en carbohidratos (83 % de energía) o una dieta alta en grasas (68 % de energía), por 12 horas, luego de este esfuerzo de ejercicio. Luego de 12 horas de ayuno los sujetos fueron biopsiados y realizaron una prueba de ejercicio (equivalente a 1.600 kJ). Las concentraciones de triacilglicéridos intramusculares, medidas por biopsias musculares, cayeron en un 6-11 % durante el esfuerzo de ejercicio, aunque este detrimento no fue estadísticamente significativo. La ingesta de una dieta alta en grasas incrementó los depósitos intramusculares de triacilglicéridos en un 21%, 24 horas después de pedalear, en tanto que siguieron bajos cuando se ingirió una dieta alta en carbohidratos. Paralelamente a estos hallazgos, las concentraciones de glucógeno muscular fueron más altas luego de una dieta alta en carbohidratos, resultando en un mejor rendimiento en la prueba por tiempo, comparada con la dieta alta en grasas.
En resumen, las dietas altas en grasas a corto plazo incrementan la disponibilidad de sustratos lípidos pero reducen el almacenamiento de glucógeno. Como resultado, si bien la oxidación de grasas se puede incrementar durante el ejercicio, la resistencia a la fatiga y el rendimiento durante el ejercicio parecen estar reducidos.
Efectos de la Dieta Alta en Grasas, en el Largo Plazo
Se ha sugerido que una alteración de 5-7 días en la composición de la dieta es un tiempo insuficiente para inducir una respuesta adaptativa a la dieta modificada. Jansson y Kaijser concluyeron que una dieta alta en grasas durante un período prolongado resultó en una menor utilización de carbohidratos, y que esta menor demanda sobre los mismos fue compensada por una contribución incrementada de las grasas al metabolismo de energía (37, 38).
En ratas se demostró que la adaptación a una dieta alta en grasas conduce a mejorías considerables de la capacidad de resistencia (61, 77). Estas adaptaciones pueden ser atribuidas al número de enzimas oxidativas y a la menor degradación de glucógeno hepático durante el ejercicio (77). Por ejemplo, se demostró que las dietas altas en grasas, en el largo plazo, incrementan las concentraciones de 3-hidroxiaciI CoA-dehidrogenasa muscular en ratas (54,61) y en humanos (48), e incrementa la concentración de triacilglicéridos intramusculares (48), mientras que la concentración de glucógeno muscular característicamente se reduce (Tabla 3). Estos resultados sugieren que luego de la adaptación a una dieta alta en grasas la capacidad de oxidar ácidos grasos en lugar de carbohidratos se incrementa, debido a una adaptación de las enzimas oxidativas en las células musculares.
Solo algunos estudios observaron el efecto de dietas altas en grasas, a largo plazo, sobre el metabolismo de las grasas y el rendimiento del ejercicio en humanos. Phinney et al (71) investigaron el rendimiento durante la realización de ejercicios en sujetos obesos, luego de 6 semanas de una dieta alta en grasas (90% de grasas). Antes y después de la dieta, la intención fue tener a los sujetos ejercitando al 75 % VO2máx hasta el agotamiento. Los sujetos pudieron ejercitar más tiempo con la dieta alta en grasas de lo que lo hicieron con su dieta normal, dado que luego de la dieta, las grasas se tornaron en el sustrato principal. Los resultados de este estudio, sin embargo, pueden haber estado influidos por el hecho de que estos sujetos no estuvieron en balance de energía y perdieron 10.6 kg de peso corporal. Por ello, aunque no hubo diferencias en el VO2máx absoluto, antes y después del período de dieta, hubo diferencias considerables en la intensidad relativa (luego de la dieta alta en grasas se realizó ejercicio al 60 % VO2máx, mientras que la intensidad de ejercicio antes de la dieta fue del 76 % VO2máx).
Las mejorías observadas en el rendimiento pueden haber sido más un
artificio que un efecto positivo del período de adaptación. Por ello, Phinney
et al (69, 70) realizaron un estudio de seguimiento en el cual se estudiaron
sujetos entrenados antes y después de una dieta alta en grasas de 4 semanas
(menos de 20 gr de CHO por día). La dieta redujo drásticamente la
concentración de glucógeno muscular pre-ejercicio (143 ± 10 versus 76 ± 4
mmol de glucosa/kg de de músculo, peso húmedo). Sin embargo, no se descubrió
diferencia alguna en el promedio de tiempo hasta el agotamiento, al 62-64 %
VO2máx, antes y después de la dieta. Sin embargo, los resultados son
difíciles de interpretar debido a la gran variabilidad de los tiempos de
rendimiento de los sujetos (tiempo hasta el agotamiento). Un sujeto ejercitó 57
% más, mientras que otros sujetos no demostraron mejorías, e incluso algunos
mostraron peores tiempos hasta el agotamiento. Además, la intensidad de
ejercicio fue relativamente baja, y la demanda de los sujetos a los
carbohidratos durante el ejercicio al 62-65 % VO2máx fue también baja. En
dicha situación, los depósitos de carbohidratos reducidos pueden no ser
limitantes. Es posible que a intensidades de ejercicio más altas, el
rendimiento pudiera verse visto más reducido. Los resultados del estudio de
Phinney et al. (69.70) pueden sostener esta visión dado que los sujetos con los
valores R más altos (tasas más altas de oxidación de CHO) demostraron una
reducción en el rendimiento, mientras que los sujetos con los valores R más
bajos presentaron un mejor tiempo de ejercicio hasta el agotamiento.
No obstante, es de remarcar que el rendimiento no se redujo en todos los sujetos
aunque los niveles de glucógeno pre-ejercicio fueron menores en casi un 50 %, y
la oxidación de grasas durante el ejercicio fue marcadamente adaptativa,
incluyendo un incremento del 44 % en la actividad de la acil
carnitín-transferasa (ACT), y una reducción del 46 % en la actividad de la
hexokinasa (70).
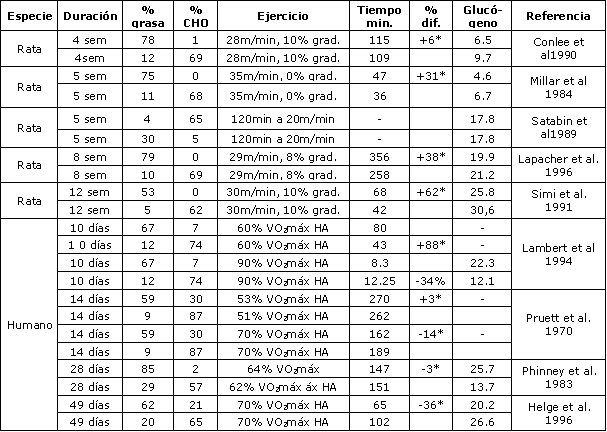
Tabla 3. Los efectos de una dieta alta en grasas, en el largo plazo (> 7
días) sobre el rendimiento de resistencia. La concentración de glucógeno
muscular en reposo está expresada en mg/gr, y fue medida en el músculo soleo en
ratas, y en el vasto lateral en humanos. Si era aplicable, se usó un factor de
conversión de tejido muscular, de seco a húmedo. VO2máx = máximo consumo de
oxigeno, HA = Hasta el Agotamiento; (*) Indica una diferencia significativa en
el rendimiento entre la dieta alta en CHO vs. dieta alta en grasas; P<0.05.
Lambert et al. (53) alimentaron a 5 ciclistas entrenados en resistencia por 14 días con dietas (de alguna manera menos extremas) altas en grasas vs. altas en carbohidratos. La dieta alta en grasas contenía 67 % de grasas y 7 % de CHO, mientras que la dieta alta en carbohidratos contenía 74 % de CHO y 12 % de grasas. Con el objeto de evaluar el rendimiento en ejercicio se realizaron tres diferentes tests de ejercicio: un test Wingate (ejercicio de velocidad), un test de tiempo de pedaleo hasta el agotamiento a alta intensidad (90 % VO2máx), y un test hasta el agotamiento a intensidad moderada (60 % VO2máx). Las concentraciones de glucógeno muscular fueron 44 % más bajas luego de las dietas altas en grasas. No se encontraron diferencias en el rendimiento en la prueba de velocidad y en el tiempo hasta el agotamiento, durante el ejercicio de alta intensidad. Sin embargo, el tiempo hasta el agotamiento durante el test de ejercicio de intensidad moderada fue significativamente mayor (80 ± 8 min versus 43 ± 7 min). La dieta alta en grasas también resultó en un incremento de las tasas de oxidación de grasas durante el ejercicio. Tanto el estudio de Lambert et al. (53), como el de Phinney et al. (70), utilizaron intensidades de ejercicio relativamente bajas (60-65 % VO2máx), lo cual está muy por debajo de las velocidades de competición. Por eso no está claro como es que éstos resultados podrían trasladarse a aplicaciones prácticas en entrenamiento y competición.
Helge et al. (28) estudiaron 20 sujetos no entrenados que pasaron por un programa de entrenamiento de resistencia, por 7 semanas, mientras ingerían una dieta alta en grasas (62 % de grasas, n= 10), o una dieta alta en carbohidratos (65 % de CHO, n= 10). El entrenamiento resultó en un 11 % de incremento en ambos grupos, luego de 7 semanas, mientras que también el tiempo hasta el agotamiento al 80 % VO2 máx fue significativamente mejorado en ambos grupos. El incremento, sin embargo, fue más pronunciado en el grupo alto en CHO que en el grupo alto en grasas. El tiempo hasta el agotamiento se incrementó de 35 min a 102 min con la dieta alta en CHO, y solo a 65 min en el grupo alto en grasas. De manera interesante, luego de siete semanas, ambos grupos recibieron una dieta alta en carbohidratos, y el rendimiento se manutuvo en el grupo alto en CHO, mientras que el grupo alto en grasas mejoró a 77 min. Esto, sin embargo, siguió siendo menos que el rendimiento del grupo alto en CHO. Los autores, por lo tanto, concluyeron que ingerir una dieta alta en grasas durante un programa de entrenamiento de resistencia va en detrimento del rendimiento. Debido a que el cambio a una dieta alta en CHO, luego de 7 semanas de una dieta alta en grasas no revierte los efectos negativos, los autores concluyeron que este efecto negativo sobre el rendimiento no es simplemente debido a la falta de carbohidratos como combustible, sino más que nada debido a adaptaciones sub-óptimas al entrenamiento. Los resultados de estos estudios se resumieron en la Tabla 3.
Desde una perspectiva de salud, el comer grandes cantidades de grasas fue asociado al desarrollo de la obesidad y la enfermedad cardiovascular. Aun no se determinó si este también es el caso en atletas. Desde nuestro conocimiento, no hay estudios disponibles hasta este momento que describan los efectos de dietas altas en grasas sobre los factores de riesgo cardiovascular en atletas entrenados. Recientemente, no se observaron cambios en los niveles de LDL, HDL y colesterol total en plasma, en corredoras/es con dietas en el rango de los 17-40 % de grasas (55,68). Si bien generalmente es aceptado que el riesgo de obesidad y de enfermedades cardiovasculares se incrementa con el consumo de dietas altas en grasas en personas sedentarias, el ejercicio regular o el entrenamiento de la resistencia parecen atenuar esos riesgos (76). La exposición a dietas altas en grasas también estuvo asociada a un incremento de resistencia a la insulina, y recientemente se la vinculó con un efecto de los “pools” de triacilglicéridos intramusculares sobre el consumo de glucosa (66). Sin embargo, esta observación se hizo en sujetos obesos, y no es claro si es que estos resultados pueden ser extrapolados a atletas, especialmente porque los atletas parecen tener depósitos intramusculares de triacilglicéridos más grandes, y mayor sensibilidad a la insulina. Adicionalmente, se asoció al consumo de dictas altas en grasas y al entrenamiento con una reducción de la función inmune. Venkatraman et al. (90), sin embargo, no pudieron encontrar ningún efecto perjudicial con una dieta de 40 % de grasas sobre diversos indicadores de la función inmune en corredores bien entrenados. Como existe poca información acerca de los efectos negativos de la dieta alta en grasas sobre los deportistas, y los efectos de esas dietas sobre el rendimiento no son claros, nosotros sugerimos tener cautela al recomendar dietas altas en grasas a los atletas competitivos
Referencias
1. Aalborg G, Bjorkman O (1987). Carbohidrate utilization by excersising muscle following pre-exercise glucose ingesta". Clin. Physiol.7:181-95
2. Bach AC, Babayan VK (1982). Médium-chain tryglicerides: an update . Am. J. Clin. Nutr.36:950-62
3. Barnett C, Costill DL, Vukovich MD, Cole KJ, Goodpaster BH, Trappe SW, Fink WL (1994). . Effect of L-carnitine supplementation on muscle and blood carnitine content and lactate accumulation during high-intensity sprint cycling. Int J Sport Nutr.4(3):280-88
4. Beckers EJ, Jeukendrup AE, Brouns F, Wagenmakers AJ, Saris WH (1992). Gastric emptying of carbohydrate--medium chain triglyceride suspensions at rest. Int J Sports Med.13(8):581-4
5. Bergstrom J, Hermansen L, Hultman E, Saltin B (1967). Diet, muscle glycogen and physical performance . Acta Physiol Scand.71(2):140-50
6. Bergstrom J, Hultman E (1966). Muscle glycogen synthesis after exercise: an enhancing factor localized to the muscle cells in man . Nature.210(5033):309-10
7. Bond V, Adams R, Balkissoon B, McRae J, Knight E, Robbins S, Banks M (1987). Effects of caffeine on cardiorespiratory function and glucose metabolism during rest and graded exercise. Phys Fitness.27(1):47-52
8. Brass EP, Hoppel CL, Hiatt WR (1994). Effect of intravenous L-carnitine on carnitine homeostasis and fuel metabolism during exercise in humans. Clin Pharmacol Ther.55(6):681-92
9. Bremer J (1983). Carnitine--metabolism and functions. Physiol Rev. 1983; 63(4):1420-80
10. Christensen EH, Hansen O (1939). Arbeitsfähigkeit und Frnährug. Scand Arch Physiol.81:160-71
11. Clarkson PM (1993). Nutritional ergogenic aids: caffeine. Int J Sport Nutr.3(1):103-11
12. Conlee RK, Hammer RL, Winder WW, Bracken ML, Nelson AG, Barnett DW (1990). Glycogen repletion and exercise endurance in rats adapted to a high fat diet. Metabolism.39(3):289-94
13. Costill DL, Coyle E, Dalsky G, Evans W, Fink W, Hoopes D (1977). Effects of elevated plasma FFA and insulin on muscle glycogen usage during exercise. J Appl Physiol.43(4):695-9
14. Dodd SL, Herb RA, Powers SK (1993). Caffeine and exercise performance. An update. Sports Med.15(1):14-23
15. Dohm GL, Beeker RT, Israel RG, Tapscott EB (1986). Metabolic responses to exercise after fasting. J Appl Physiol.61(4):1363-8
16. Dohm GL, Tapscott EB, Barakat HA, Kasperek GJ (1986). Influence of fasting on glycogen depletion in rats during exercise. J Appl Physiol.61(4):1363-8
17. Emken EA (1994). Metabolism of dietary stearic acid relative to other fatty acids in human subjects. Am J Clin Nutr.60(6 Suppl):1023S-1028S
18. Erickson MA, Schwarzkopf RJ, McKenzie RD (1987). Effects of caffeine, fructose, and glucose ingestion on muscle glycogen utilization during exercise. Med Sci Sports Exerc.19(6):579-83
19. Essig D, Costill DL, Van Handel PJ (1987). Effects of caffeine utilization during exercise. Med. Sci. Sports Exerc.19:579-83
20. Fery F, Balasse EO (1983). Ketone body turnover during and after exercise in overnight-fasted and starved humans. Am J Physiol.245(4):E318-25
21. Galbo H, Holst JJ, Christensen NJ (1979). The effect of different diets and of insulin on the hormonal response to prolonged exercise. Acta Physiol Scand.107(1):19-32
22. Gleeson M, Greenhaff PL, Maughan RJ (1988). Influence of a 24 h fast on high intensity cycle exercise performance in man. Eur J Appl Physiol Occup Physiol.57(6):653-9
23. Goodman KJ, Brenna JT (1992). High sensitivity tracer detection using high-precision gas chromatography-combustion isotope ratio mass spectrometry and highly enriched [U-13C]-labeled precursors. Anal Chem.64(10):1088-95
24. Graham TE, Pedersen PK, Saltin B (1987). Muscle and blood ammonia and lactate responses to prolonged exercise with hyperoxia. J Appl Physiol.Oct;63(4):1457-62
25. Graham TE, Spriet LL (1991). Performance and metabolic responses to a high caffeine dose during prolonged exercise. J Appl Physiol.71(6):2292-8
26. Heinonen OJ (1996). Carnitine and physical exercise. Sports Med.22(2):109-32
27. Heinonen OJ, Takala J, Kvist MH (1992). Effect of carnitine loading on long-chain fatty acid oxidation, maximal exercise capacity, and nitrogen balance. Eur J Appl Physiol Occup Physiol
28. Helge JW, Richter EA, Kiens B (1996). Interaction of training and diet on metabolism and endurance during exercise in man. J Physiol.492( Pt 1):293-306
29. Hickson RC, Rennie MJ, Conlee RK, Winder WW, Holloszy JO (1977). Effects of increased plasma fatty acids on glycogen utilization and endurance. J Appl Physiol.43(5):829-33
30. Holt PR (1968). Medium chain triglycerides: their absoption, metabolism and clinical applications. New York Progress in Gastroenterology.277-98
31. Hultman E (1967). Physiological role of muscle glycogen in man, with special reference to exercise. Clin. Res.10: E99-E114
32. Hunt JN, Knox ME (1968). Regulation of gastric emptying. Handbook of Physiology. Am. Physiol. Soc.1917-35
33. Issekutz B Jr, Miller HI, Rodahl K (1966). Lipid and carbohydrate metabolism during exercise. Fed Proc.25(4):1415-20.
34. Isselbacher KJ (1968). Mechanisms of absorption of long and medium chain triglycerides, Medium Chain Triglycerides. Phyladelphia, University of Pensilvanya Press 21-37
35. Ivy JL, Costill DL, Fink WJ, Lower RW (1979). Influence of caffeine and carbohydrate feedings on endurance performance. Med Sci Sports.11(1):6-11
36. Jansson E (1980). Diet and muscle metabolism in man with reference to fat and carbohydrate utilization and its regulation. Acta Physiol Scand Suppl.487:1-24.
37. Jansson E, Kaijser L (1982). Effect of diet on the utilization of blood-borne and intramuscular substrates during exercise in man. Acta Physiol Scand.115(1):19-30
38. Jansson E, Kaijser L (1987). Substrate utilization and enzymes in skeletal muscle of extremely endurance-trained men. J Appl Physiol.62(3):999-1005
39. Jeukendrup A (1997). Aspects of carbohydrate and fat metabolism during exercise. Harlem: Dee Vrieseborob
40. Jeukendrup A, Saris WH, Brouns F, Kester AD (1996). A new validated endurance performance test . Med Sci Sports Exerc.28(2):266-70
41. Jeukendrup AE, Saris WH, Schrauwen P, Brouns F, Wagenmakers AJ (1995). Metabolic availability of medium-chain triglycerides coingested with carbohydrates during prolonged exercise. J Appl Physiol.79(3):756-62
42. Jeukendrup AE, Saris WH, Van Diesen R, Brouns F, Wagenmakers AJ (1996). Effect of endogenous carbohydrate availability on oral medium-chain triglyceride oxidation during prolonged exercise. J Appl Physiol.80(3):949-54
43. Jeukendrup AE, Saris WH, Wagenmakers AJ (1998). Fat metabolism during exercise: a review. Part I: fatty acid mobilization and muscle metabolism. Int J Sports Med.19(4):231-44
44. Jeukendrup AE, Saris WH, Wagenmakers AJ (1998). Fat metabolism during exercise: a review--part II: regulation of metabolism and the effects of training. Int J Sports Med.19(5):293-302
45. Jeukendrup AE, Thielen JJ, Wagenmakers AJ, Brouns F, Saris WH (1998). Effect of medium-chain triacylglycerol and carbohydrate ingestion during exercise on substrate utilization and subsequent cycling performance. Am J Clin Nutr.67(3):397-404
46. Jeukendrup AE, Saris WH, Brouns F, Halliday D, Wagenmakers JM (1996). Effects of carbohydrate (CHO) and fat supplementation on CHO metabolism during prolonged exercise. Metabolism.45(7):915-21
47. Kiens B, Essen-Gustavsson B, Gad P, Lithell H (1987). Lipoprotein lipase activity and intramuscular triglyceride stores after long-term high-fat and high-carbohydrate diets in physically trained men. Clin Physiol.7(1):1-9
48. Kiens B, Lithell H (1989). Lipoprotein metabolism influenced by training-induced changes in human skeletal muscle. J Clin Invest.83(2):558-64
49. Knapik JJ, Jones BH, Toner MM, Daniels WL, Evans WJ (1983). Influence of caffeine on serum substrate changes during running in trained and untrained individuals. Bioch. Exerc.13:514-19
50. Knapik JJ, Meredith CN, Jones BH, Suek L, Young VR, Evans WJ (1988). Influence of fasting on carbohydrate and fat metabolism during rest and exercise in men. J Appl Physiol.64(5):1923-9
51. Koubi HE, Desplanches D, Gabrielle C, Cottet-Emard JM, Sempore B, Favier RJ (1991). Exercise endurance and fuel utilization: a reevaluation of the effects of fasting. J Appl Physiol.70(3):1337-43
52. Lambert EV, Speechly DP, Dennis SC, Noakes TD (1994). Enhanced endurance in trained cyclists during moderate intensity exercise following 2 weeks adaptation to a high fat diet. Eur J Appl Physiol Occup Physiol.69(4):287-93
53. Lapachet RA, Miller WC, Arnall DA (1996). Body fat and exercise endurance in trained rats adapted to a high-fat and/or high-carbohydrate diet. J Appl Physiol.80(4):1173-9
54. Leddy J, Horvath P, Rowland J, Pendergast D (1997). Effect of a high or a low fat diet on cardiovascular risk factors in male and female runners. Med Sci Sports Exerc.29(1):17-25
55. Loy SF, Conlee RK, Winder WW, Nelson AG, Arnall DA, Fisher AG (1986). Effects of 24-hour fast on cycling endurance time at two different intensities. J Appl Physiol.61(2):654-9
56. Marconi C, Sassi G, Carpinelli A, Cerretelli P (1985). Effects of L-carnitine loading on the aerobic and anaerobic performance of endurance athletes. Eur J Appl Physiol Occup Physiol. 54(2):131-5
57. Martin B, Robinson S, Robertshaw D (1978). Influence of diet on leg uptake of glucose during heavy exercise. Am J Clin Nutr.31(1):62-7
58. Maughan RJ, Gleeson M (1988). Influence of a 36 h fast followed by refeeding with glucose, glycerol or placebo on metabolism and performance during prolonged exercise in man. Eur J Appl Physiol Occup Physiol. 57(5):570-6
59. Maughan RJ, Williams C, Campbell DM, Hepburn D (1978). Fat and carbohydrate metabolism during low intensity exercise: effects of the availability of muscle glycogen. Eur J Appl Physiol Occup Physiol. 39(1):7-16
60. Miller WC, Bryce GR, Conlee RK (1984). Adaptations to a high-fat diet that increase exercise endurance in male rats. J Appl Physiol.56(1):78-83
61. Montain SJ, Hopper MK, Coggan AR, Coyle EF (1991). Exercise metabolism at different time intervals after a meal. J Appl Physiol.70(2):882-8. Links
62. Muoio DM, Leddy JJ, Horvath PJ, Awad AB, Pendergast DR (1994). Effect of dietary fat on metabolic adjustments to maximal VO2 and endurance in runners. Med Sci Sports Exerc.26(1):81-8
63. Newsholme EA, Leech AR (1990). Biochemistry for the medical sciences. Chichester: John Wiley & Sons
64. Oscai LB, Essig DA, Palmer WK (1990). Lipase regulation of muscle triglyceride hydrolysis. J Appl Physiol.69(5):1571-7
65. Pan DA, Lillioja S, Kriketos AD, Milner MR, Baur LA, Bogardus C, Jenkins AB, Storlien LH (1997). Skeletal muscle triglyceride levels are inversely related to insulin action. Diabetes.46(6):983-8
66. Pasman WJ, van Baak MA, Jeukendrup AE, de Haan A (1995). The effect of different dosages of caffeine on endurance performance time. Int J Sports Med.16(4):225-30
67. Pendergast DR, Horvath PJ, Leddy JJ, Venkatraman JT (1996). The role of dietary fat on performance, metabolism, and health. Am J Sports Med.24(6 Suppl):S53-8
68. Phinney SD, Bistrian BR, Wolfe RR, Blackburn GL (1983). The human metabolic response to chronic ketosis without caloric restriction: physical and biochemical adaptation. Metabolism.32(8):757-68
69. Phinney SD, Bistrian BR, Evans WJ, Gervino E, Blackburn GL (1983). The human metabolic response to chronic ketosis without caloric restriction: preservation of submaximal exercise capability with reduced carbohydrate oxidation. Metabolism.32(8):769-76
70. Phinney SD, Horton ES, Sims EA, Hanson JS, Danforth E Jr, LaGrange BM (1980). Capacity for moderate exercise in obese subjects after adaptation to a hypocaloric, ketogenic diet. J Clin Invest.66(5):1152-61
71. Powers SK, Byrd RJ, Tulley R, Callender T (1983). Effects of caffeine ingestion on metabolism and performance during graded exercise. Eur J Appl Physiol Occup Physiol. 50(3):301-7
72. Rennie MJ, Winder WW, Holloszy JO (1976). A sparing effect of increased plasma fatty acids on muscle and liver glycogen content in the exercising rat. Biochem J.156(3):647-55
73. Riley ML, Israel RG, Holbert D, Tapscott EB, Dohm GL (1988). Effect of carbohydrate ingestion on exercise endurance and metabolism after a 1-day fast. Int J Sports Med.9(5):320-4
74. Romijn JA, Coyle EF, Sidossis LS, Gastaldelli A, Horowitz JF, Endert E, Wolfe RR (1993). Regulation of endogenous fat and carbohydrate metabolism in relation to exercise intensity and duration. . Am J Physiol.265(3 Pt 1):E380-91
75. Sarna S, Kaprio J (1994). Life expectancy of former elite athletes. Sports Med.17(3):149-51
76. Simi B, Sempore B, Mayet MH, Favier RJ (1991). Additive effects of training and high-fat diet on energy metabolism during exercise. J Appl Physiol.71(1):197-203
77. Slavin JL, Joensen DL (1985). Caffeine and sports performance. Phys Sportmed 13:191-93
78. Spriett LL (1995). Caffeine and performance. Int. J. Sports Nutr. 1995; 5:S84-S99
79. Spriet LL, MacLean DA, Dyck DJ, Hultman E, Cederblad G, Graham TE (1992). Caffeine ingestion and muscle metabolism during prolonged exercise in humans. Am J Physiol.262(6 Pt 1):E891-8
80. Starling RD, Trappe TA, Parcell AC, Kerr CG, Fink WJ, Costill DL (1997). Effects of diet on muscle triglyceride and endurance performance. J Appl Physiol.82(4):1185-9
81. Tarnopolsky MA (1994). Caffeine and endurance performance . Sports Med.18(2):109-25
82. Tarnopolsky MA, Atkinson SA, MacDougall JD, Sale DG, Sutton JR (1989). Physiological responses to caffeine during endurance running in habitual caffeine users. Med Sci Sports Exerc.21(4):418-24
83. Toner MM, Kirkendall DT, Delio DJ, Chase JM, Cleary PA, Fox EL (1982). Metabolic and cardiovascular responses to exercise with caffeine. Ergonomics.25(12):1175-83
84. Trappe SW, Costill DL, Goodpaster B, Vukovich MD, Fink WJ (1994). The effects of L-carnitine supplementation on performance during interval swimming. Int J Sports Med.15(4):181-5
85. Van Handel P (1982). Caffeine: Ergogenic Aids in Sport. Human Kinetics Publishers
86. Van Zyl CG, Lambert EV, Hawley JA, Noakes TD, Dennis SC (1996). Effects of medium-chain triglyceride ingestion on fuel metabolism and cycling performance. J Appl Physiol.80(6):2217-25
87. Venkatraman JT, Rowland JA, Denardin E, Horvath PJ, Pendergast D (1997). Influence of the level of dietary lipid intake and maximal exercise on the immune status in runners. Med Sci Sports Exerc.29(3):333-44
88. Vukovich MD, Costill DL, Fink WJ (1994). Carnitine supplementation: effect on muscle carnitine and glycogen content during exercise. Med Sci Sports Exerc.26(9):1122-9
89. Vukovich MD, Costill DL, Hickey MS, Trappe SW, Cole KJ, Fink WJ (1993). Effect of fat emulsion infusion and fat feeding on muscle glycogen utilization during cycle exercise. J Appl Physiol.75(4):1513-8
90. Wagenmakers AJM (1991). L-carnitine supplementation and performance in man. Advances in nutrition and top soport. Basel Karger,110-27
91. Williams JH, Signorile JF, Barnes WS, Henrich TW (1988). Caffeine, maximal power output and fatigue. Br J Sports Med.22(4):132-4
92. Winder WW (1986). Effect of intravenous caffeine on liver glycogenolysis during prolonged exercise. Med Sci Sports Exerc.18(2):192-6
93. Wyss V, Ganzit GP, Rienzi A (1990). Effects of L-carnitine administration on VO2max and the aerobic-anaerobic threshold in normoxia and acute hypoxia. Eur J Appl Physiol Occup Physiol. 60(1):1-6
94. Zinker BA, Britz K, Brooks GA (1990). Effects of a 36-hour fast on human endurance and substrate utilization. J Appl Physiol.69(5):1849-55
Cita Original
Asker E. Jeukendrup, William H.M. Saris y Antón J.M. Wagentnakers. Metabolismo de las Grasas Durante el Ejercicio: Una Revisión Parte III: Efectos de las Intervenciones Nutricionales Resúmenes del Simposio Internacional de Actualización en Ciencias Aplicadas al Deporte, Biosystem, 172-181 (1999)
Cita en PubliCE
Asker Jeukendrup, William H Saris Anton J Wagenmakers (1999). Metabolismo de las Grasas Durante el Ejercicio: Una Revisión Parte III: Efectos de las Intervenciones Nutricionales. .https://g-se.com/metabolismo-de-las-grasas-durante-el-ejercicio-una-revision-parte-iii-efectos-de-las-intervenciones-nutricionales-897-sa-F57cfb2719a099
