La Norepinefrina Modula la Actividad de las Células Dendríticas a través de la Alteración en la Liberación de Quimiocinas
Alexander T Hutchison1, Stephanie Garcia2, Cassandra Huerta31 University of Texas Health Science Center at Houston, Department of Internal Medicine, Division of Infectious Diseases, Estados Unidos.
2 Department of Exercise & Sport Science/St. Mary’s University, San Antonio, Estados Unidos.
Resumen
Las células dendríticas (DC) son células presentadoras de antígenos del sistema inmunológico que maduran en los tejidos periféricos después de la exposición frente a antígenos microbianos, tales como el lipopolisacárido (LPS) bacteriano. Una vez que se activan, las DC viajan hacia los ganglios linfáticos dónde a su vez, reclutan y activan otros leucocitos a través de la liberación de quimiocinas. Específicamente, MIP-1α, MIP-1ß, y RANTES reclutan a las células natural killers (NK) a través de la unión con el receptor CCR5 de quimiocinas. El estrés fisiológico puede aumentar la concentración de células NK en la circulación. Se cree que la liberación de norepinefrina o noradrenalina (NE), la "hormona del estrés”, hacia los ganglios linfáticos inhibe la capacidad de la DC de reclutar leucocitos, permitiendo así que las células NK salgan a la circulación. Aunque observaciones previas han demostrado que la NE podría inhibir aspectos relacionados a la función de las DC, su efecto sobre la producción de MIP-1a, MIP-1ß y RANTES no ha sido establecido. El propósito de este estudio fue evaluar el efecto de la norepinefrina (NE) sobre la producción de MIP-1α, MIP-1ß, y RANTES de las células dendriticas (DC). Fueron incubadas células dendríticas junto con LPS solos o junto con LPS+NE durante 24-h. La concentración de cada quimiocina en el sobrenadante fue determinada por la técnica inmunoenzimática de ELISA. La NE inhibió significativamente la producción de MIP-1ß (-74%, P = 0,001) y de RANTES (-93%, P <0,001), pero no la de MIP-1α (-17%, P = 0,227). Estos resultados apoyan el argumento que sostiene que la inhibición de la actividad de DC mediada por NE podría desempeñar un rol en la liberación de leucocitos desde los nódulos linfáticos hacia la sangre en condiciones de estrés fisiológico.
Palabras Clave: células dendríticas, células <em>natural killers</em> (NK), quimiocinas, respuesta inmune, estrés fisiológico
INTRODUCCION
Estudios previos de nuestro y de otros laboratorios han informado un aumento dramático en la concentración en la sangre de células natural killers (NK) durante la realización de ejercicios aeróbicos de alta intensidad (>70% VO2 máx.) y larga duración (>1-hr) [1-4]. Las células NK son linfocitos granulares grandes, del sistema inmunológico innato cuya función es eliminar las células infectadas por virus y las cancerosas e inhibir la colonización de diferentes tipos de organismos patógenos [5]. Esta elevación en la cantidad de células NK circulantes es el resultado de una redistribución desde los órganos linfáticos periféricos [6, 7]. Aunque se sospecha que esta movilización de células NK está mediada por catecolaminas entre las que se incluye la norepinefrina (NE), el mecanismo exacto no ha sido aun completamente establecido [8].
Las células NK interactúan con las células dendríticas activadas (DC) durante el vaciado de los ganglios linfáticos y del bazo [9-11]. Las DC son células presentadoras de antígenos especializadas que maduran en los tejidos periféricos luego de la exposición frente a antígenos microbianos como el lipopolisacárido (LPS) [5]. Luego las DC migran hacia los órganos linfáticos periféricos dónde reclutan y activan recíprocamente otros leucocitos entre los que se incluyen las células NK [5].
Experimentos realizados en ratones han demostrado que las células NK también son reclutadas en los tumores subcutáneos del tipo melanoma B16 por las DC y que este proceso está regulado por la liberación de quimiocinas; tales como proteínas inflamatorias de macrófagos -1α (MIP-1α), MIP-1ß, y linfocito T normal expresado y secretado, regulado por activación (RANTES) [12]. Las tres quimiocinas se unen al receptor CCR5 en los granulocitos, células T, y células NK e inducen quimiotaxis al sitio de invasión microbiana e inflamación.
El estrés fisiológico como el ejercicio aeróbico de alta intensidad induce una respuesta de “lucha o huida" y durante este tiempo el sistema nervioso simpático (SNS) prepara al cuerpo para los rigores de la actividad física [13-17]. Las fibras pre-sinápticas del SNS liberan NE quien estimula numerosas respuestas fisiológicas entre las que se incluye una mayor actividad cardíaca, aumento en los niveles de glucosa sanguínea proveniente de la glucogenolisis hepática y vasodilatación de los vasos del músculo esquelético [15-17]. Los ganglios linfáticos y el bazo poseen una extensa inervación simpática [18, 19]. Se cree que la leucocitosis observada durante el ejercicio de alta intensidad es parte de la respuesta de “lucha o huida", en la cual se incrementa la concentración de glóbulos blancos en sangre (entre los que se incluyen las células NK), proporcionando así una protección adicional contra posibles infecciones debidas a una mayor ventilación, consumo de comida y agua o lesión [20, 21].
Investigaciones previas han establecido que la NE altera la producción de diferentes citoquinas por parte de las DC en células de ratón in vivo o en células humanas in vitro [22-24]. Por lo tanto, es posible que la NE pueda inhibir la liberación de MIP-1a, MIP-1ß, y RANTES por arte de las DC dentro de los órganos linfáticos periféricos, contribuyendo con los estímulos que provocan una migración de células NK de estos tejidos hacia la circulación periférica. El propósito de este estudio fue evaluar el efecto de la NE sobre la liberación de quimiocinas por parte de DC activadas por LPS in vitro.
METODOS
Incubaciones
Las células dendríticas (DC) humanas fueron adquiridas en MatTEK S.A. (Ashland, MA). En el momento de la recepción, fueron aclimatadas durante 24-h, (37º C, 5% CO2, ambiente humedecido). Todas las incubaciones se realizaron por triplicado en placas de 24 pocillos. Las DC fueron sembradas en medio completo (DCMM, MatTEK S.A., Ashland, MA) a una densidad de 1,65 x 105 células por pocillo con un volumen final de 1 mL. Todos los reactivos fueron adquiridos en Sigma-Aldrich (San Louis, Mo) a menos que se indique otra procedencia. El LPS de Escherichia coli serotipo 055:B5 (actividad específica de 1,2 x 106 unidades/µg) se utilizo en una concentración de 5 µg.mL-1. El hidrocloruro de DL-NE se utilizó en una concentración de 10-6 M. Luego de 24 hs de incubación, (37º C, 5% CO2, en condiciones ambientales húmedas), las placas fueron centrifugadas y los sobrenadantes fueron extraídos y guardados a -80 ºC hasta el momento en que se realizó la determinación de las concentraciones de MIP-1α, MIP-1ß, y RANTES por la técnica de ELISA. Debido a que disponíamos de recursos limitados, no pudimos evaluar diferentes concentraciones de estimulantes y de inhibidores. La búsqueda en la literatura relacionada reveló un estudio realizado por Goyarts et al. donde utilizaron un protocolo similar. Nosotros utilizamos aquellas concentraciones donde Goyarts et al. observaron que se producían las respuestas óptimas en DC [24].
Técnica Inmunoenzimática (ELISA)
Los equipos y reactivos fueron adquiridos en R&D Systems (Minneapolis, MN). En cada lote de muestras se incluyeron controles (ambos comercialmente disponibles y sintetizados en laboratorio) para determinar los coeficientes de variación intra y entre las determinaciones, que en todos los casos fueron inferiores a 10%.
Análisis Estadísticos
Para el análisis estadístico se utilizó el software SPSS v15,0 (SPSS, Chicago, IL). Las determinaciones de las concentraciones de MIP-1α, MIP-1ß, y RANTES fueron analizadas a través de un ANOVA de una vía.
La variable independiente fue la condición de incubación, es decir medio sólo, LPS sólo, o LPS + NE. La significancia fue fijada en p<0,05. En aquellos casos donde se observaran diferencias significativas, se utilizó el Test-t de Student con ajuste de Bonferroni para comparaciones múltiples, para establecer de donde provenían las diferencias.
También se analizaron las correlaciones bivariadas de Pearson para evaluar el grado de interacción entre las diferentes variables dependientes. Todos los valores se presentan como Media±SE.
RESULTADOS
El estímulo con LPS aumentó significativamente la producción de MIP-1α (385%, p<0,001, Figura 1), MIP-1ß (158%, p=0,002, Figura 2) y RANTES (2757%, p<0,001, Figura 3), en comparación con la condición control. NE inhibió significativamente la producción de MIP-1ß (-74%, p=0,001) y RANTES (-93%, p<0,001), pero no la de MIP-1α (-17%, P =0,227) en comparación con el estímulo de LPS solo.
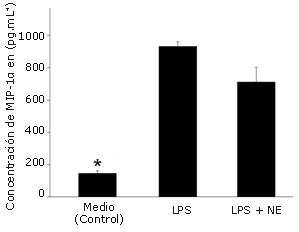
Figura 1. Efecto de la norepinefrina (NE) sobre la producción de MIP-1α en células dendríticas humanas. Las células fueron sembradas en una densidad de 1,65 x 105 células por pocillo en una placa con 24 pocillos y luego fueron incubadas durante 24 hs con LPS solo (5μg.mL-1) o con LPS+NE (10-6 M). Las determinaciones fueron realizadas por triplicado. Los valores se presentan en forma de Media±error estándar. * Presenta diferencias significativas con LPS (p=0,001) y LPS + NE (P=0,001).
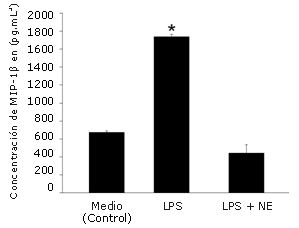
Figura 2. Efecto de la norepinefrina (NE) sobre la producción de MIP-1β en células dendríticas humanas. Las células fueron sembradas en una densidad de 1,65 x 105 células por pocillo en una placa con 24 pocillos y luego fueron incubadas durante 24 hs con LPS solo (5μg/mL) o con LPS+NE (10-6 M). Las determinaciones fueron realizadas por triplicado. Los valores se presentan en forma de Media±error estándar. * Presenta diferencias significativas con el medio (control) (P=0,002) y LPS + NE (P=0,001).
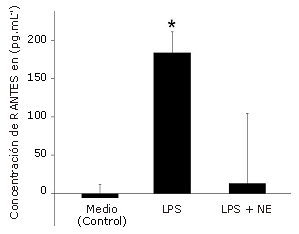
Figura 3. Efecto de la Norepinefrina (NE) sobre la producción de RANTES en células dendríticas humanas. Las células fueron sembradas en una densidad de 1,65 x 105 células por pocillo y luego fueron incubadas durante 24 hs con LPS solo (5μg.mL-1) o con LPS+NE (10-6 M). Las determinaciones fueron realizadas por triplicado. Los valores se presentan en forma de Media±error estándar. * Presenta diferencias significativas con el medio (control) (P = 0,001) y LPS + NE (P= 0,001).
DISCUSION
Nuestros resultados corroboraron parcialmente nuestra hipótesis. En las células dendríticas (DC), la NE disminuyó significativamente la producción de MIP-1ß y RANTES estimulada por LPS, pero no afectó significativamente a MIP-1α. Según nuestros conocimientos, éste es el primer estudio que demuestra que este aspecto de la actividad de las DC puede ser modificado por un neurotransmisor del sistema nervioso simpático.
MIP-1α, MIP-1ß, y RANTES fueron específicamente seleccionados debido a su capacidad para estimular de manera directa la migración de células NK hacia los tumores subcutáneos de tipo melanomas B16 en ratones. Liu et al. observaron que células dendriticas inyectadas directamente en estos tumores y estimuladas con CpG (ADN no metilado encontrado en bacterias) produjeron grandes cantidades de MIP-1α, MIP-1ß, y RANTES [12]. Dentro de las 48-hrs, se había incrementado significativamente la infiltración de células NK en los tumores. Esta respuesta se atenuó notablemente cuando el experimento se repitió con ratones CCR5-/- que no expresan el receptor común para MIP-1α, MIP-1ß y RANTES.
Investigaciones preliminares en este tema revelaron una relación entre períodos de estrés psicológico elevado y la inhibición de la actividad inmunoreguladora de DC [25-27]. Estudios mecanicistas posteriores revelaron que la NE puede inhibir diferentes aspectos de la actividad de las células dendríticias. Nuestros resultados coinciden con lo observado en tres estudios previos que utilizaron DC de ratón y humanas [22-24]. Maestroni et al. (2002) utilizando células de Langerhans de ratones (DC encontradas en la piel) estimuladas con LPS y hemocianina de lapa californiana (KLH) in vivo, determinaron que la NE inhibió la liberación de IL-12, una citoquina que tiene un papel fundamental en la estimulación de la función de las células NK [22]. De manera contraria, aumentó la liberación de IL-10, una citoquina antiinflamatoria que inhibe la migración de DC a hacia los ganglios linfáticos[22].
En otro estudio, Maestroni et al. (2003) observaron que células dendríticas de la médula ósea de ratón estimuladas con LPS, incubadas con Salbutamol, un agonista del receptor ß2 de NE, inhibieron la liberación, por parte de las DC, de quimiocinas inflamatorias CCL19 y CCL21 DC in vitro [23].
Finalmente, Goyarts et al. observaron que la liberación de varias citoquinas inflamatorias (IL-23, TNF-α, e IL-6) y de la proteína quimiotáctica IL-12p40 fue inhibida significativamente en DC humanas estimuladas por LPS, luego de la incubación con NE in vitro [24]. En la Figura 4 presentamos un mecanismo hipotético de la inhibición transitoria dirigida por el SNC, de la actividad de las DC que provoca un aumento en la concentración de células de NK en la circulación, luego de la realización de ejercicios aeróbicos de larga duración (>1-hr) y alta-intensidad (>70% VO2 máx.). En condiciones "normales", es decir en reposo y en ausencia de antígeno externo, las células NK se mueven entre los tejidos y la circulación periférica, buscando señales de invasión microbiana o de daño.
Las DC presentes en los ganglios linfáticos y en otros órganos linfáticos periféricos, liberan una concentración basal de diferentes citoquinas y quimiocinas entre las que se incluyen MIP-1α, MIP-1ß, y RANTES. Cuando un antígeno externo es secuestrado en los ganglios linfáticos por DC, la producción de estas tres quimiocinas por parte de estas células, aumenta marcadamente. Estos mediadores inducen a las células NK que se encuentran en la circulación, a que incrementen la expresión de varias moléculas de adhesión lo que permitirá la entrada en los ganglios linfáticos dónde a su vez activarán a las DC [28]. Recíprocamente, el estrés fisiológico desencadena la respuesta de "lucha-o-huida." Las fibras post-sinápticas del SNC liberan NE, lo que inhibe la liberación de MIP-1α, MIP-1ß, y RANTES por parte de las DC. La menor expresión de moléculas de adhesión induce las células NK para que emigren de los órganos linfáticos periféricos e ingresen a la sangre, proporcionando así una protección adicional inmediata contra la posible infiltración de patógenos durante el ejercicio.
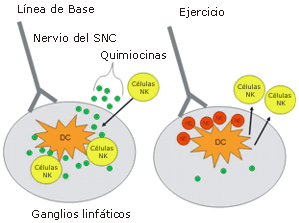
Figura 4. Mecanismo hipotético del aumento inducido por el ejercicio en las concentraciones de células NK en la circulación. Al comienzo (línea de base), las células DC y NK interactúan en los órganos linfáticos periféricos entre los que se incluyen los ganglios linfáticos. El comienzo del ejercicio induce un aumento en la actividad del SNC, en la respuesta de “lucha o huida”. Las fibras post-sinápticas liberan NE hacia los ganglios linfáticos, provocando un inhibición de la liberación de quimiocinas MIP-1α, MIP-1β y RANTES, lo que produce la migración de las células NK hacia la circulación periférica.
Si bien se observó una tendencia hacia la inhibición de la liberación de MIP-1α, (-17%) este efecto no fue significativo (P = 0,227). Aunque es posible que la NE no afecte MIP-1α de la misma manera en que afecta MIP-1ß y RANTES, esto es improbable dado que las mismas comparten el receptor y tienen vías de señalización comunes. La explicación más lógica es que esto se debería al pequeño tamaño de la muestra que utilizamos. Sólo pudimos realizar el experimento por triplicado y la variabilidad entre las muestras para este ELISA en particular fue más alta que para las otras dos quimiocinas determinadas. También es posible que la concentración umbral de NE necesaria para inhibir MIP-1ß y RANTES (10-6 M) sea menor que la necesaria para inhibir MIP-1α.
Claramente, el alcance de este estudio se limita a este aspecto particular del mecanismo hipotético que planteamos. Probablemente la vía completa sea más compleja, e incluya varias cascadas de señalización comunes, mediadas por numerosos neurotransmisores, quimiocinas, y citoquinas que actúan sobre las células dendríticas, sobre las células NK y quizás sobre otros leucocitos. Por ejemplo, Schedlowski et al. observaron que la infusión de NE y epinefrina (Epi) aumentó la actividad de las células NK en humanos durante 30-min (NE) y 60-min (Epi) post-infusión [29]. También hay evidencia que sostiene que el ejercicio de alta intensidad inhibe la expresión de varias moléculas de adhesión (CD54, CD18, y CD53), en la superficie de las células NK lo que les permitiría migrar desde los órganos linfáticos periféricos hacia la sangre [8]. Estas observaciones refuerzan el argumento que afirma que la mayor concentración de células NK en la sangre durante el ejercicio es una adaptación de protección diseñada para conducir rápidamente grandes cantidades de células NK y de otros leucocitos hacia los sitios de infección, lo que puede ocurrir durante una respuesta de "lucha-o-huida." Las futuras investigaciones deberían intentar establecer el mecanismo completo.
Conclusión
En conclusión, las DC estimuladas con LPS, incubadas durante 24-hrs con NE produjeron una cantidad de MIP-1ß y RANTES, significativamente menor, pero no disminuyeron significativamente la producción de MIP-1α in vitro. Estos datos apoyan el argumento que afirma que, un aumento de las células NK en la circulación inducido por el ejercicio, es una adaptación de protección mediada por el sistema nervioso simpático.
Agradecimientos
Los autores desean agradecer la contribución del PhD Timothy Raabe por su valiosa ayuda en este proyecto.
Dirección para Envío de Correspondencia
Hutchison AT, PhD, University of Texas Health Science Center at Houston, Department of Internal Medicine, Division of Infectious Diseases, Houston, Texas, USA, 77030. Teléfono: (713) 500-7225; correo electrónico: Alexander.T.Hutchison@uth.tmc.edu.
Referencias
1. Hutchison A. T., Lewis D. E., Bush J. A., Strohacker K., Carpenter K. C. and McFarlin B. K (2008). Four Weeks of Acupuncture Does Not Alter Natural Killer Cell Response to Exercise. J Ex Phys, 11: 38-50
2. McFarlin B. K., Hutchison A. T. and Kueht M. L (2008). Knowledge of carbohydrate consumption does not alter natural killer cell activity following an acute bout of high-intensity aerobic exercise. Appl Physiol Nutr Metab, 33: 1007-1012
3. Nieman D. C. et al (1997). Carbohydrate affects natural killer cell redistribution but not activity after running. Med Sci Sports Exerc, 1997: 29: 1318-1324
4. Pedersen B. K. et al (1988). Modulation of natural killer cell activity in peripheral blood by physical exercise. Scand J Immunol, 27: 673-678
5. Janeway C. A (2005). Immunobiology. 6 ed., New York, New York: Garland Science Publishing
6. Gabriel H. H. and Kindermann W (1998). Adhesion molecules during immune response to exercise. Can J Physiol Pharmacol, 76: 512-523
7. Hay J. B. and Andrade W. N (1998). Lymphocyte recirculation, exercise, and immune responses. Can J Physiol Pharmacol, 76: 490-496
8. Simpson R. J. et al (2006). The effects of intensive, moderate and downhill treadmill running on human blood lymphocytes expressing the adhesion/activation molecules CD54 (ICAM-1), CD18 (beta2 integrin) and CD53. Eur J App Physiol, 97: 109-121
9. Ferlazzo G. et al (2004). Distinct roles of IL-12 and IL-15 in human natural killer cell activation by dendritic cells from secondary lymphoid organs. Proc Natl Acad Sci U.S.A, 101: 16606-16611
10. Watt S. V. et al (2008). IFN-gamma-dependent recruitment of mature CD27(high) NK cells to lymph nodes primed by dendritic cells. J Immunol, 181: 5323-5330
11. Woo C. Y. et al (2006). Role of natural killer cell function in dendritic cell-based vaccines. Expert Rev Vaccines, 5: 55-65
12. Liu C. et al (2008). Plasmacytoid dendritic cells induce NK cell-dependent, tumor antigen-specific T cell cross-priming and tumor regression in mice. J Clin Invest, 118: 1165-1175
13. Marieb E (2006). Human Anatomy & Physiology. 7th ed., New York, New York: Benjamin Cummings
14. Brooks G. A (2005). Exercise Physiology: Human Bioenergetics and Its Applications. 3rd ed., New York, New York: Mayfield Publishing Company
15. Chesley A., Hultman E. and Spriet L. L (1995). Effects of epinephrine infusion on muscle glycogenolysis during intense aerobic exercise. Am J Physiol, 268: E127-134
16. Elenkov I. J. et al (2000). The sympathetic nerve--an integrative interface between two supersystems: the brain and the immune system. Pharmacol Rev, 52: 595-638
17. Kindermann W. et al (1982). Catecholamines, growth hormone, cortisol, insulin, and sex hormones in anaerobic and aerobic exercise. Eur J Appl Physiol Occup Physiol, 49: 389-399
18. Felten D. L. et al (1984). Sympathetic innervation of lymph nodes in mice. Brain Res Bull, 13: 693-699
19. Felten J. O (1987). Noradrenergic sympathetic innervation of the spleen: II. Tyrosine hydroxylase (TH)-positive nerve terminals form synapticlike contacts on lymphocytes in the splenic white pulp. p. 37-48
20. Kjaer M., Secher N. H. and Galbo H (1987). Physical stress and catecholamine release. Baillieres Clin Endocrinol Metab, 1: 279-298
21. McCarthy D. A. and Dale M. M (1988). The leucocytosis of exercise. A review and model. Sports Med, 6: 333-363
22. Maestroni G. J (2002). Short exposure of maturing, bone marrow-derived dendritic cells to norepinephrine: impact on kinetics of cytokine production and Th development. J Neuroimmunol, 129: 106-114
23. Maestroni G. J. and Mazzola P (2003). Langerhans cells beta 2-adrenoceptors: role in migration, cytokine production, Th priming and contact hypersensitivity. J Neuroimmunol, 144: 91-99
24. Goyarts E. et al (2008). Norepinephrine modulates human dendritic cell activation by altering cytokine release. Exp Dermatol, 17: 188-196
25. Dhabhar F. S. and McEwen B. S (1999). Enhancing versus suppressive effects of stress hormones on skin immune function. Proc Natl Acad Sci U.S.A, 96: 1059-1064
26. Glaser R. and Kiecolt-Glaser J. K (2005). Stress-induced immune dysfunction: implications for health. Nature Rev, 5: 243-251
27. Hosoi J. et al (1998). Modification of LC phenotype and suppression of contact hypersensitivity response by stress. J Cutan Med Surg, 3: 79-84
28. Kruger K. and Mooren F. C (2007). T cell homing and exercise. Exerc Immunol Rev, 13: 37-54
29. Schedlowski M. et al (1993). Catecholamines induce alterations of distribution and activity of human natural killer (NK) cells. J Clin Immunol, 13: 344-351
Cita Original
Hutchison A. T., Stephanie, D. G., Cassandra H. Norepinephrine Modulates Dendritic Cell Activity by Altering Chemokine Release. JEPonline; 13 (1): 33-40, 2010.
Cita en PubliCE
Alexander T Hutchison, Stephanie Garcia Cassandra Huerta (1930). La Norepinefrina Modula la Actividad de las Células Dendríticas a través de la Alteración en la Liberación de Quimiocinas. .https://g-se.com/la-norepinefrina-modula-la-actividad-de-las-celulas-dendriticas-a-traves-de-la-alteracion-en-la-liberacion-de-quimiocinas-1254-sa-q57cfb271ddf71
