La Hiperhidratación con Glicerol altera la Función Cardiovascular y Renal
Robert A Robergs4, P Montner1,2, Y Zou3, G Murata1,2, D Stark1, C Quinn1, S Wood5, D Lium1, E R Greene31 Department of Medicine, University of New Mexico School of Medicine, Albuquerque, NM, 87131.
3 School of Science and Engineering, New Mexico Highlands University, Las Vegas, NM 87143.
4 The Center for Exercise and Applied Human Physiology, University of New Mexico, Albuquerque, NM, 87131.
5 Highlands University, Las Vegas, NM, 87701.
Resumen
Seis sujetos completaron en forma aleatoria cuatro pruebas experimentales que consistieron en 2 horas de ingesta controlada de fluidos en reposo, seguidas por una cicloergometría de 110 minutos al 44±11% del VO2máx. Durante la realización del ejercicio los sujetos también consumieron fluidos, y las pruebas difirieron en la ingesta de fluidos pre-ejercicio o durante el ejercicio. La prueba de control consistió en una ingesta pre-ejercicio de 26 mL/kg de agua saborizada y 5 mL/kg cada 20 minutos de una solución al 5% de glucosa durante el ejercicio (WC). Para el resto de las pruebas experimentales las soluciones fueron 1.2 g/kg de glicerol en un total de 26 ml/kg (GH) consumido pre-ejercicio, y ya sea solución de glucosa al 5% (GC), 0.5% de glicerol en una solución de glucosa al 5% (GCGA) o 1.5% de glicerol en una solución de glucosa al 5% (GCGB) ingeridas durante el ejercicio. En comparación con WC, la ingesta de GH provocó la reducción del flujo de orina (4.7±2.2 vs. 7.6±3.7 mL/min, p<0.001) y del clearance de agua libre (-1.4±1.3 vs. 2.5±1.3 mL/min, p<0.001). Consecuentemente, la hidratación pre-ejercicio fue mayor con la ingesta de GH (0.9±0.4 vs. 0.3±0.3 L para los valores medios de GC, GCGA y GCGB vs. WC). En comparación con WC, la ingesta de GH también incrementó la osmolalidad sérica (283.3±3.3 a 281.0±2.6 vs. 284.3±0.2 a 291.0± 2.3 mOsmol/kg, p<0.01) a pesar de que no hubo diferencias en la concentración de la hormona antidiurética (ADH) (2.3±2.0 vs. 2.4±1.0 pg/mL at 120 min). Cuando se comparó la ingesta de WC con la de GCGA y GCGB, la ingesta continua de glicerol durante el ejercicio incrementó el volumen sistólico cardíaco (163.3±27.9 vs. 174.4±22.8 mL, p<0.01) y redujo la frecuencia cardíaca (128.2±19.0 vs. 122.0±14.5 latidos/min, p<0.01). La ingesta de GH incrementa la hidratación corporal reduciendo el clearance renal de agua libre por un mecanismo no mediado por la ADH. La ingesta continua de glicerol y agua durante el ejercicio incrementa los beneficios cardiovasculares de la ingesta de GH pre-ejercicio, y prolonga el estado de hiperhidratación.
Palabras Clave: osmolalidad, hormona antidiurética, clearance de agua libre,, volumen latido
INTRODUCCION
En comparación con la ingesta de un volumen igual de agua, la ingesta de glicerol y agua que provee aproximadamente 1.0 g/kg de peso corporal de glicerol en un volumen total de 20 a 26 mL/kg de peso corporal [hiperhidratación con glicerol (GH)] puede reducir significativamente al volumen de orina y provocar una retención de fluidos de entre 300 y 730 mL (1-4). La GH también ha mostrado mejorar el enfriamiento por evaporación durante el ejercicio en ambientes calurosos (2), y prolongar el tiempo hasta el agotamiento durante el ejercicio de resistencia (3). Hasta el momento nos se han estudiado los efectos de la combinación de ingesta de glicerol pre-ejercicio, seguida por la ingesta de glicerol durante el ejercicio. Sin embargo, Koenigsberg et al. (5) demostraron que en comparación con la ingesta de agua, la ingesta continua de glicerol y agua puede mantener incrementada a la hidratación corporal por hasta 40 horas. Se sabe que el incremento en el agua corporal mediante la GH se produce sin un incremento en la concentración plasmática de ADH (4), y se ha hipotetizado que resulta de un incremento en la reabsorción de agua mediado por el glicerol en los túbulos distales y conductos colectores del riñón (4, 6).
Debido a que en estudios previos (7-10) en donde se ha llevado a cabo la infusión de fluidos para expandir el volumen plasmático han hallado incrementos en el volumen sistólico y reducciones en la frecuencia cardíaca, la GH también podría proporcionar beneficios a la función cardiovascular durante el ejercicio. Por ejemplo, la ingesta de glicerol, ha mostrado reducir la frecuencia cardíaca durante el ejercicio en el calor (2), aunque existe evidencia controversial respecto de la expansión del volumen plasmático luego de la GH (1, 2, 4, 11).
Las investigaciones previas han comparado principalmente la hiperhidratación con glicerol pre-ejercicio con un volumen igual de solución salina (1), jugo de naranjas (2) o agua (3, 4). La generalización de utilizar agua como solución de control puede cuestionarse debido a la conocida superioridad de las soluciones a base de carbohidratos y electrolitos para mantener la hidratación durante el ejercicio (12) y para mejorar la rehidratación luego de la deshidratación (13).
En base a nuestro resumen de investigaciones previas, nuestro propósito fue comparar la ingesta pre-ejercicio de GH con la de agua. Debido a que la mayoría de los atletas ingieren bebidas a base de carbohidratos durante el ejercicio, nosotros también quisimos comparar la GH pre-ejercicio con la GH seguida de la ingesta de fluidos con carbohidratos durante el ejercicio. Nuestra hipótesis fue que la hiperhidratación inducida por la GH podría ser mayor que la inducida por la ingesta de agua, y que esta se mantendría mejor durante el ejercicio con la ingesta adicional de glicerol. También hipotetizamos que la GH con la posterior ingesta continua de glicerol podría mantener la hidratación y los beneficios cardiovasculares en mayor medida que la GH seguida de la ingesta de fluidos con carbohidratos durante el ejercicio. En base a los hallazgos de Freund et al. (4), también hipotetizamos que la hiperhidratación inducida por la GH podría ocurrir sin un incremento en la concentración sérica de ADH, aunque si estaría asociada con una reducción en el clearance de agua libre.
METODOS
Sujetos y Aprobación
Seis sujetos, cuatro hombres y dos mujeres, fueron voluntarios para participar en el presente estudio. Las mujeres eran eumenorreicas y fueron estudiadas en la fase folicular de su ciclo menstrual, determinada a través de una entrevista verbal y verificada por una concentración sérica de progesterona <5 ng/mL. El estudio fue aprobado pro el Comité de Revisión para la Investigación con Humanos de cada agencia involucrada en esta investigación.
Procedimientos
Los sujetos fueron en primer lugar familiarizados con el equipamiento en el cual realizarían el ejercicio, y se llevó a cabo un test de VO2máx en bicicleta ergométrica para determinar las cargas submáximas relativas para las subsiguientes pruebas de ejercicio. En todas las evaluaciones, el ejercicio fue realizado una bicicleta ergométrica semi-reclinable, y las condiciones ambientales fueron mantenidas a 23.5-24.5ºC con 25-27% de humedad y la altura fue de 1600 m sobre el nivel del mar.
Los sujetos completaron cuatro pruebas en forma aleatoria, en un diseño doble ciego. Las pruebas fueron realizadas con al menos una semana de separación, y a la misma hora del día. Los sujetos fueron admitidos en el Centro de Investigación Clínica del Instituto Nacional de Salud 48 horas antes de cada prueba. Durante este período y en cada admisión los sujetos consumieron dietas idénticas seleccionadas por ellos mismos y se les redujo las actividades de entrenamiento. Luego del desayuno en la mañana de cada prueba, los sujetos fueron transferidos a las instalaciones donde se llevaron a cabo las evaluaciones. Luego de arribar al lugar de evaluación, y una vez que hubieran vaciado sus vejigas e intestinos, se registró el peso de cada sujeto desnudo (±0.1 kg) (Pennsylvania 3000 Electronic Scale) y se obtuvieron las muestras basales de orina. Luego de esto se les colocó un catéter (calibre 18) con heparina en la vena antecubital y los sujetos se mantuvieron en reposo en posición de sentados durante 10 minutos, luego de lo cual se obtuvieron las muestras de sangre (7 mL).
Para la condición de hidratación de control (WC), los sujetos ingirieron 26 mL/kg de peso corporal de agua artificialmente endulzada y saborizada con aspartamo durante un período de 2 horas previo a la realización del ejercicio seguido de una solución al 5% de CHO (5 mL/kg de peso corporal cada 20 minutos) durante el ejercicio (Tabla 1). Para las pruebas de GH, los sujetos ingirieron 1.2 g/kg de peso corporal de glicerol en 26 mL/kg de solución durante el período de 2 horas previo al ejercicio, y cada 20 minutos durante el ejercicio ingirieron 5 mL/kg de peso corporal de una solución al 5% de CHO (GC), 5% de CHO en 0.5% de glicerol (GCGA) o 5% de CHO en 1.5% de glicerol (CGCB). Las soluciones de glucosa ingeridas durante el ejercicio también contenían 20 mEq/L de cloruro de sodio, y todas las soluciones fueron conservadas a 4ºC. La GH pre-ejercicio involucró la ingesta de un bolo concentrado de glicerol (200 g/L), que proporcionó 1.0 g de glicerol por kg de peso corporal durante los 30 minutos iniciales, tal como lo describieran en detalle Montner et al. (3). A partir de ese momento, los sujetos ingirieron agua cada 30 minutos hasta completar las dos horas, y a los 60 minutos ingirieron el resto del glicerol (0.2 g/kg). El volumen total de agua ingerida fue el balance entre los 26 mL/kg de peso corporal menos el volumen de la solución de glicerol.

Tabla 1. Constituyentes de las diferentes bebidas.
Durante el período de hidratación de 2 horas, los sujetos se mantuvieron en posición de sentados. Toda lo orina producida durante este período fue recolectada, se midió su volumen, y las muestras de reposo y de los 120 min fueron utilizadas para el análisis de creatinina y osmolalidad. Luego del período de hidratación de 2 horas pre-ejercicio, los sujetos realizaron 110 min de ejercicio en una bicicleta ergométrica en un posición semirreclinada (Model 846T, Quinton Instrument Co., Seattle WA) al 44±11% del VO2máx. Esta carga y la posición de ejercicio fueron seleccionadas para asegurar que los sujetos pudieran completar los 110 min de ejercicio, y para permitir una determinación más sencilla y precisa del volumen sistólico utilizando flujometría Doppler. Se recolectaron muestras de sangre venosa cada 40 min para realizar el análisis del estrés del arrastre del flujo sanguíneo [blood elastic yield stress (EYS)], y a los 60 y 120 minutos de reposo para la determinación de la osmolalidad y de la concentración de ADH. La concentración sérica de glicerol fue determinada en el minuto cero del período de reposo, a los 120 min del período de reposo y luego de los 110 minutos de ejercicio. Al final del período de hidratación (120 min) se realizó nuevamente el pesaje de los sujetos, lo cual volvió a llevarse a cabo luego de los 110 min de ejercicio, luego de que los sujetos se secaran con una toalla.
Procedimientos Analíticos y Cálculos
Calorimetría Indirecta
El protocolo de ejercicio utilizado para determinar el VO2máx consistió de incrementos en la carga de entre 20 y 30 watts por minuto para asegurar una duración total del tests de entre 10 y 15 minutos. El análisis de los gases espirados fue llevado a cabo utilizando un sistema automatizado con promediado por tiempo (Incarepulmobil, Erich Jaeger, Rockford, IL), midiendo el volumen con un neumotacógrafo calentado. Las fracciones espiradas de oxígeno y dióxido de carbono fueron determinadas utilizando analizadores para el oxígeno (celda de circonio) y para el dióxido de carbono (infrarrojo). Previamente a cada test, el neumotacógrafo fue calibrado con siete volúmenes de 1L de aire ATPS utilizando una jeringa calibrada, y los analizadores fueron calibrados con aire ambiente y con gases certificados médicamente (100% nitrógeno, y 15% O2, 5% CO2, balance de nitrógeno)
Hemodinámica Cardiovascular Central
El volumen sistólico fue determinado utilizando flujometría de pulso Doppler (PD) (Medsonics, Fremont, CA) y utilizando la técnica supraesternal (14-17). Este método estándar no invasivo ha sido descrito en detalle y validado en estudios previos por nuestro grupo de investigación (14, 15) y por otros investigadores (16, 17). En nuestras determinaciones, los intervalos de confianza al 95% para la precisión (cambio porcentual) y la exactitud (valores absolutos) fueron del ±7% y ±13%, respectivamente. Las mediciones fueron tomadas con un transductor de 2.0 MHz a los 0, 45 y 120 min del período pre ejercicio, y a los siguientes intervalos durante el ejercicio: 10, 30, 50, 70, 90 y 110 minutos. La frecuencia cardíaca fue determinada a partir del análisis de los intervalos de las ondeas de la PD. Los datos de la PD fueron procesados por observadores ciegos a los procedimientos que produjeron datos acerca del ángulo Doppler, diámetro aórtico y velocidad media del flujo sanguíneo. El volumen de pulso fue calculado utilizando la ecuación Doppler.
Análisis de Sangre y Orina
Las muestras de sangre y orina fueron analizadas en duplicado para la determinación de la concentración de creatinina (método colorimétrico, IL Monarch 2000, Lexington, MA, o método reflectométrico, Kodak Ecktachem 700XR, Rochester, NY), y de la osmolalidad (disminución del punto de fusión, Nichols Inst., CA). La concentración sérica de ADH fue determinada mediante radioinmunoensayo (Nichols Inst., CA) con un coeficiente de variación test-retest <5%. La concentración de glicerol fue determinada mediante espectrometría enzimática (Boehringer Diagnostics, CA), y el EYS fue cuantificado como un marcador de la viscosidad de la sangre (Vilastic 3, Vilastic Scientific, Inc).
Función Renal
El clearance de agua libre renal fue calculado como el flujo de la orina – ((osmolalidad de la orina × flujo de la orina)/omolalidad del suero). El clearance de creatinina fue calculado como ((creatinina en la orina × flujo) / creatinina en suero).
Análisis Estadísticos
Debido a preocupaciones sobre la fortaleza estadística, primero se completaron las estadísticas descriptivas con todas las variables para determinar las diferencias medias, las varianzas y los efectos del tamaño. Respecto de la variable volumen sistólico, para la cual se ha determinado la mayor dificultad para detectar significancia durante el ejercicio con 6 sujetos por grupo, la diferencia media entre WC y GCGB al minuto 50 fue 15.2 mL (162.8±26.5 vs. 178.0±16.2 mL), con un tamaño del efecto de 0.71 y un error b=0.85, determinado mediante la prueba t a una cola (Statmate, Graphpad Software, San Diego CA). Para mejorar la fortaleza estadística, decidimos llevar a cabo análisis estadísticos a partir de comparaciones específicamente planeadas luego de combinar pruebas específicas para comparar la ingesta de agua vs. GH pre-ejercicio, y la ingesta de glicerol con la ingesta de CHO durante el ejercicio (Statistica, Statsoft Inc., Tulsa OK). Debido al análisis repetido de las medias y a la protección a priori contra los errores tipo II, se realizó el ajuste de Bonferroni para la protección contra los errores tipo I, resultando en una aceptación estadística a p=0.017 (0.05/3). Esta aproximación nos permitió incrementar la fortaleza estadística, tal como lo indica la comparación de los datos del volumen sistólico de WC (n=36) con los datos combinados de GCGA y GCGB (n=60) durante el ejercicio (diferencia media=11.4 mL, tamaño del efecto=0.4, error b=0.3). Los datos se presentan como valores medios±DE.
RESULTADOS
Sujetos
Los sujetos habían estado entrenando en forma regular en ciclismo o carreras y con valores medios para la edad, masa corporal y consumo máximo de oxígeno (VO2máx) de 27±3 años, 68±6 kg y 55.0±2.8 mL. kg.-1.min-1, respectivamente.
Hidratación Pre-Ejercicio
Debido a la necesidad de realizar análisis estadísticos a priori, los datos medios para el grupo GH pre-ejercicio representan los datos combinados de las pruebas GC, GCGA y GCGB. La ingesta de agua pre-ejercicio no provocó cambios significativos en la osmolalidad sérica (de 283.3±3.3 a 281.0±2.6 mOsmol/kg). Sin embargo la GH pre-ejercicio incrementó significativamente la osmolalidad sérica a los 120 min en comparación con el minuto cero (284.3±0.2 hasta 291.0±2.3 mOsmol/kg, para las pruebas WC vs. GH, p<0.01), pero no provocó un incremento significativo de la concentración sérica de ADH (2.3±2.0 vs. 2.4±1.0 pg/mL a los 120 min para las pruebas WC vs GH). La GH pre-ejercicio incrementó significativamente la concentración sérica de glicerol a los 120 min y en comparación con el minuto cero del período de hidratación pre-ejercicio, y también en comparación con el protocolo de hidratación WC (Figura 1). El aumento en el peso corporal a los 120 min fue significativamente mayor con el protocolo GH (Figura 2), lo cual resultó en una acumulación adicional de agua de 600 mL (p=0.0015). Estos cambios en el peso corporal coincidieron con la reducción significativa en el flujo urinario y en el clearance de agua libre para GH en comparación con WC (Figura 3), sin observarse cambios en el clearance de creatinina (133±35 vs. 110±45 mL/min para las pruebas WC y GH). Los resultados del EYS no difirieron entre las pruebas, y el valor medio durante la hidratación pre-ejercicio fue de 0.12±0.02 dinas/cm2 tanto para WC como para GH.
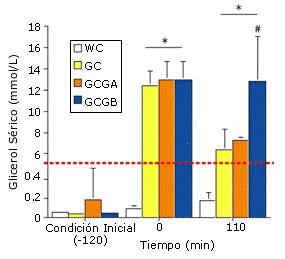
Figura 1. Cambio en la concentración sérica de glicerol durante el tiempo y
durante cada prueba. *=p<0.01 respecto de WC y del valor inicial, #=p<0.01,
respecto de GC y GCGA .
Hidratación durante el Ejercicio
Durante las pruebas GH y durante el ejercicio, el glicerol sanguíneo se mantuvo elevado por encima de los valores exhibidos en las pruebas WC. La continua ingesta de glicerol en las pruebas GCGA y GCGB no provocó un incremento detectable en la concentración sérica de glicerol hasta después de los 110 min de ejercicio, cuando la concentración sérica de glicerol en la prueba GCGB fue significativamente mayor en comparación con todas las otras pruebas (Figura 1).
La GH pre-ejercicio y la continua ingesta de glicerol y de carbohidratos líquidos durante el ejercicio (GC, GCGA y GCGB) mejoraron significativamente (p<0.01) el mantenimiento del peso corporal (retención de la hidratación a los 110 min de ejercicio en comparación con el valor inicial) en comparación con la prueba WC (Figura 2). El SV medio durante el ejercicio fue significativamente mayor para las pruebas que implicaron la ingesta continua de glicerol (GCGA y GCGB) en comparación con las pruebas WC y GC y la HR media fue significativamente menor en las pruebas GCGA y GCGB que en las pruebas WC y GC (Figuras 3 y 4)
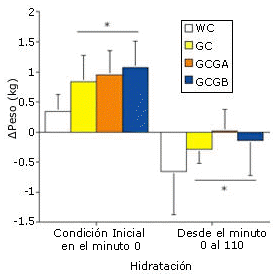
Figura 2. Cambios en el peso corporal a partir del minuto cero y hasta el
minuto 120 del período de hidratación pre-ejercicio (porcentaje de cambio en el
peso), y desde el minuto cero de ejercicio hasta los 110 minutos de ejercicio en
cada prueba. *=p<0.01 para WC vs. GC, GCGA y GCGB.
DISCUSION
Como se observara en los estudios previos llevados a cabo por Riedesel et al (1), Lyons et al (2), Montner et al (3) y Freund et al (4), nosotros observamos que la GH, en comparación con la ingesta de agua, resultó en un incremento de la retención de fluidos. Además, al igual que en el estudio de Freund et al. (4) nosotros documentamos que la GH incrementó la osmolalidad, redujo el clearance de agua libre, pero no indujo un incremento en la concentración plasmática de ADH. Por lo tanto, el glicerol parece ser un osmol inefectivo para la ADH, al igual que la urea y la glucosa (16). Murray et al. (11) hallaron que la ADH se incrementó más a partir del valor basal con la ingesta de glicerol durante el ejercicio (3.2 a 9 pg/mL) que con la ingesta de agua sola (3.2 a 6 pg/mL). Sin embargo, Murray et al. (11) no realizaron un procedimiento de GH pre-ejercicio, y por lo tanto evitaron la hiperhidratación con glicerol, lo cual ha sido demostrado que requiere un régimen de hidratación pre-ejercicio de aproximadamente 2 horas (1-4). No es claro porque el protocolo utilizado por Murray et al. (11) provocó un incremento en la concentración sanguínea de ADH.
Nosotros también reportamos que la GH pre-ejercicio y la ingesta de glicerol durante el ejercicio preservó de mejor manera la hidratación corporal durante el ejercicio en comparación con la ingesta de agua y carbohidratos (Figura 1). Este hallazgo respalda lo hallado por Lyons et al. (2), quienes documentaron que la GH proporcionaba más fluido para la producción de sudor durante el ejercicio en un ambiente caluroso y seco que la ingesta de agua/jugo de naranjas, sin comprometer las reservas de agua corporal. Al parecer, la GH permite que el cuerpo tolere mejor la pérdida de agua simplemente proveyendo más fluidos que reduciendo la pérdida de los mismos durante el ejercicio/estrés por calor.
El mecanismo causal de la ganancia de agua corporal con la GH no ha sido claramente establecido. Sin embargo, se ha hipotetizado que el mecanismo de la hiperhidratación con la GH resulta del incremento en la reabsorción de glicerol en los riñones lo cual también induce el incremento en la reabsorción de agua (4, 6, 18). Debido a las altas propiedades difusivas del glicerol, la elevación sostenida del glicerol en la sangre provoca que el glicerol y el agua se distribuyan uniformemente a través de los compartimentos de agua corporal externos a los ojos y el cerebro (18). Por lo tanto es lógico asumir que los beneficios de hidratación con el protocolo GH son la expansión de los compartimentos de agua intracelular, intersticial y vascular (18). Riedesel et al (1) hipotetizó que a medida que el glicerol es metabolizado o excretado, el incrementado volumen de agua corporal estará disponible para su uso a nivel metabólico. Esto continúa siendo una explicación viable de los beneficios eventuales de la GH respecto de la capacidad cardiovascular y de la capacidad de termorregulación durante el ejercicio.
Aunque en el presente estudio no se cuantificó el volumen plasmático, la mejora en la retención del volumen plasmático durante el ejercicio (menor hemoconcentración) es una posible explicación de los incrementos documentados aquí en el volumen sistólico. En base a esta interpretación, creemos que es importante identificar ciertas dificultades para detectar la expansión del volumen plasmático luego de la GH. A pesar del razonamiento teórico de que la GH incrementa el volumen de todos los compartimentos de agua corporal (18), existen hallazgos contradictorios respecto de la expansión del volumen plasmático luego de la ingesta con glicerol. Gleeson et al. (19) hallaron que la ingesta de 400 mL de una solución con 1 g/kg de glicerol incrementó el PV en un 10% durante la hidratación pre-ejercicio mientras que la ingesta de placebo y glucosa no produjeron este efecto. Los cambios en el PV fueron calculados a partir de los cambios en la hemoglobina y en el hematocrito tal como lo describieran Dill y Costill (20). Con la ingesta de cantidades similares de glicerol y agua durante el ejercicio, Murray et al. (11) también hallaron que el glicerol mantuvo mejor el PV que el placebo una solución a base de glucosa. A la inversa, Freund et al. (4) no hallaron diferencias en el volumen sanguíneo o plasmático luego de la ingesta de glicerol vs. agua, a pesar del incremento de 500 mL en el agua corporal total con la ingesta de glicerol.
La dificultad para detectar un incremento en el volumen plasmático luego de la GH no es algo sorprendente, ya que el mayor incremento en la retención de fluidos observado con la GH ha sido de 730 mL en un período de dos horas (3). Este marco de tiempo permite que el glicerol y el agua se distribuyan más uniformemente a través de los compartimentos de agua corporal. Debido a que el volumen plasmático es el menor de los compartimentos de agua corporal, un incremento de 730 mL en el agua corporal total distribuidos uniformemente entre todos los compartimentos de agua causaría un incremento aproximado de 45 mL en el volumen plasmático, lo cual sería difícil de detectar, dados los errores asociados con la dilución de la tinta, y el relativamente pequeño número de sujetos utilizados en las investigaciones (1-4).
Interesantemente, los hallazgos de una expansión significativa del volumen plasmático realizados por Gleeson et al (19) y Murray et al (11) pueden estar relacionados con la reducción del tiempo dado a los sujetos luego de la ingesta de glicerol (45 min y 0 min, respectivamente). Este menor período de tiempo pudo haber evitado que se alcance el equilibrio entre el agua y el glicerol en el volumen total de agua corporal, lo cual resultó en una mayor expansión del volumen plasmático.
Ningún estudio previo publicado ha medido directamente el SV luego de la GH. En el presente estudio, el SV se incrementó significativamente con la ingesta continua de glicerol durante el ejercicio y en comparación con la ingesta de CHO en solución luego de la ingesta de agua o GH pre-ejercicio (Figura 3).
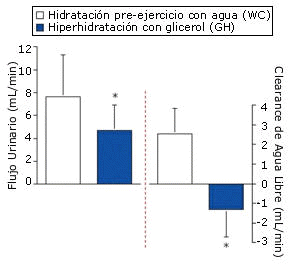
Figura 3. Reducción pre-ejercicio en el flujo de orina y en el clearance de
agua libre, promediado en las dos horas, para las pruebas WC y GH (GC, GCGA y
GCGB). *=p<0.01 para WC vs. GH.
Estos resultados coincidieron con los cambios recíprocos en al frecuencia cardíaca (Figura 4). Estas mediciones funcionales pueden ser fisiológicamente más significativas que las dificultades previamente explicadas para documentar cambios en el volumen plasmático luego de la GH. El beneficio cardiovascular de la GH pre-ejercicio puede no encontrarse en el incremento absoluto del volumen plasmático sino en el potencial para utilizar el mayor contenido de agua corporal para mantener el volumen plasmático durante el ejercicio/estrés por calor.
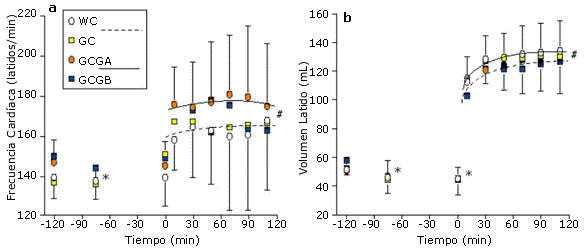
Figura 4. Cambios en la frecuencia cardíaca (HR) y en el volumen latido (SV)
durante los períodos de hidratación pre-ejercicio y de ejercicio en cada prueba.
Para HR, * = p<0.01, para todas las pruebas respecto del valor inicial (-120 min).
#=p<0.01, para todas las pruebas de ejercicio con WC y GC vs. GCGA y GCGA y GCGB.
Para SV, * = p<0.01 para todas las pruebas respecto del valor inicial (-120 min).
#=p<0.01 para todas las pruebas de ejercicio con WC y GC vs. GCGA y GCGB.
En 1982, en un estudio acerca de la expansión del volumen plasmático llevado a cabo por Kanstrup y Ekblom (10) se observó que la HR era en promedio 5 latidos/min menor que la observada en el grupo control a intensidades submáximas de ejercicio. Además, Fortney et al. (7) realizaron la infusión de 533 mL de una solución isotónica de albúmina y lactated Ringers* antes del ejercicio y hallaron que la HR durante el ejercicio fue 3-6 latidos por minuto menor que en el grupo control y que el SV fue en promedio 13 mL mayor que en el grupo control. Hopper et al (9) hallaron que durante una cicloergometría submáxima, la infusión de 403 mL de solución de dextran incrementó el SV en un 11% (14 mL), el CO (gasto cardíaco) en un 7% (1.32 L/min) y redujo la HR desde 141 a 138 latidos por minuto. Los hallazgos sobre la HR y el SV en nuestro estudio están en el rango de lo hallado en estos estudios en donde se realizó una expansión artificial del PV.
Otro hallazgo importante de este estudio fue el beneficio adicional de la ingesta de glicerol durante el ejercicio luego de realizar la GH pre-ejercicio. Sorprendentemente, la GH pre-ejercicio no reveló resultados durante el ejercicio que fueran significativamente diferentes a los observados con la ingesta de agua seguida de la ingesta de carbohidratos líquidos (Figuras 2 y 3). Estos hallazgos difieren de los hallazgos de Montner et al. (3) y Lyons et al. (2). No obstante, la intensidad de ejercicio en el estudio de Montner et al. (3) fue mayor (74% del VO2máx hasta el agotamiento), que la utilizada en el presente estudio, y los sujetos en el estudio de Lyons et al. (2) realizaron ejercicios en un ambiente caluroso (90 min al 60% del VO2máx a 45ºC). Quizás el máximo potencial para los beneficios de la GH pre-ejercicio se observen durante condiciones más severas de ejercicio y/o estrés por calor.
El beneficio de la ingesta continua de glicerol y agua durante el ejercicio es respaldado por los datos de la eliminación del glicerol luego de la GH pre-ejercicio. Robgers y Griffin (18) han calculado que la tasa de eliminación de glicerol en el cuerpo luego de la GH es de aproximadamente 30-50 g/h. por lo tanto, dos horas después de la GH más del 50% del glicerol ingerido habría sido eliminado del cuerpo a través de la excreción urinaria y del metabolismo. En base a la acción directa del glicerol sobre la reabsorción de agua en los túbulos distales, la continua retención de agua adicional requerirá de una elevación sostenida del glicerol sanguíneo. Este resultado claramente pudo observarse en los datos del glicerol sanguíneo en la prueba GCGB luego de los 110 min de ejercicio (Figura 1).
Conclusiones
La GH pre-ejercicio resultó en la retención de fluidos debido a la reducción del clearance renal de agua libre, pero a través de un mecanismo no mediado por la ADH. En comparación con la hidratación pre-ejercicio con agua o GH seguida de la ingesta de carbohidratos líquidos, la GH pre-ejercicio seguida de la ingesta continua de glicerol y agua durante el ejercicio incrementó el volumen sistólico y disminuyó la frecuencia cardíaca durante el ejercicio. Estos beneficios cardiovasculares adicionales ocurrieron con un volumen adicional de 5 g de glicerol/hora en 350 mL/hora. Sigue estando poco claro si la ingesta de mayores cantidades de glicerol durante el ejercicio podría mantener la mejora en la hidratación, y si estas respuestas durante la realización de una prueba en bicicleta ergométrica de baja intensidad y en posición semirreclinada podrían relacionarse con la mejora en el rendimiento durante ejercicios a intensidades relativamente mayores.
Agradecimientos
Este estudio fue en parte subvencionado por el National Institutes of Health General Clinical Research Center beca nro. 5M01RR00997-16, el Fondo Dedicado a la Investigación para la Salud de la Escuela de Medicina de la Universidad de Nuevo México, el Centro Médico de Asuntos de Veteranos de Guerra de Albuquerque, y el Centro de Ejercicio y Fisiología Humana Aplicada de la Universidad de Nuevo Mexico. Quisiéramos agradecer al personal del Servicio Médico del VAMC de Albuquerque y a Mary Hill del AVAMC por su asistencia para preparar este manuscrito.
Dirección para el Envió de Correspondencia
Paul Montner, M.D., M.S. AVAMC 2100 Ridgecrest Dr. SE Albuquerque, NM 87108. (505) 265-1711 x 4540 FAX (505) 256-5751
*Nota del traductor: Ringer: solución acuosa que contiene cloruros de sodio, potasio y calcio. Es isotónica con los tejidos animales; es usada para corregir la deshidratación y (en experimentos fisiológicos) como un medio para las preparaciones in vitro.
Referencias
1. Riedesel ML, Allen DY, Peake GT, Al-Qattan K (1987). Hyperhydration with glycerol solutions. J Appl Physiol. 63:2262-2268
2. Lyons TP, Riedesel M, Meuli LE, Chick TL (1990). Effects of glycerol induced hyperhydration prior to exercise in the heat on sweating and core temperature. Med Sci Sports Exerc. 22:477-483
3. Montner PK, Stark DM, Riedesel ML, Murata GA, Robergs RA, Timms M, Chick TL (1996). Pre-exercise glycerol hydration prolongs cycling endurance time. Int J Sports Med. 17:27-33
4. Freund BJ, Montain SJ, Young AJ, Sawka MN, DeLuca JP, Pandolf KB, Paleri CR (1995). Glycerol hyperhydration: hormonal, renal, and vascular fluid responses. J Appl Physiol. 79:2069-2077
5. Koenigsberg PS, Martin KK, Hlava HR (1995). Sustained hyperhydration with glycerol ingestion. Life Sci. 5:645-653
6. Kruhoffer P, Nissan OI (1963). Handling of glycerol in the kidney. Acta Physiol Scand. 59:284-294
7. Fortney SM, Wenger CB, Bove JR, Nadel ER (1983). Effect of blood volume on forearm venous and cardiac stroke volume during exercise. J Appl Physiol. 55:884-890
8. Krip B., Gledhill N, Jamnik V, Warburton D (1997). Effect of alterations in blood volume on cardiac function during maximal exercise. Med. Sc. Sports Exerc. 29:1469-1476
9. Hopper MK, Coggan AR, Coyle EF (1988). Exercise stroke volume relative to plasma-volume expansion. J Appl Physiol. 64:404-408
10. Kanstrup IL, Ekblom B (1982). Acute hypervolemia, cardiac performance, and aerobic power during exercise. J Appl Physiol. 52:1186-1191
11. Murray R, Eddy DE, Paul GL, Seifert JG, Halaby GA (1991). Physiological responses to glycerol ingestion during exercise. J Appl Physiol. 71: 144-149
12. Below PR, More-Rodriguez R, Gonzales-Alonso J, Coyle EF (1995). Fluid and carbohydrate ingestion independently improve performance during 1 h of intense exercise. Med. Sci. Sports Exerc. 27:200-210
13. Gisolfi CV, Duchman SM (1992). Guidelines for optimal replacement beverages for different athletic events. Med Sci Sports Exerc. 24:679-687
14. Loeppky JA, Greene ER, Hoekenga DE, Caprihan A, Luft UC (1981). Beat-by beat stroke volume assessment by pulsed Doppler in upright and supine exercise. J Appl Physiol. 50:1173-1182
15. Shaw JC, Johnson EC, Boyles WF, Greene ER (1985). Noninvasive Doppler determination of cardiac output during submaximal and peak exercise. J Appl Physiol. 59:722-731
16. Innes JA, Simon TD, Murphy K, Guz A (1988). The effects of exercise and subject age on pulsed Doppler measurements of left ventricular ejection in normal man. Q J Exp Physiol. 73:323-341
17. Spencer KT, Laing RM, Newman A, Barow KM, Shroff SG (1991). Doppler and electromagnetic comparisons of instantaneous aortic flow characteristics in primates. Circ Res. 68:1369-1977
18. Robergs RA, Griffin SE (1998). Glycerol ingestion: Clinical and applied applications. Sports Medicine. 26:145-167
19. Gleeson M, Maughan RJ, Greenhaff PL (1986). Comparison of the effects of pre-exercise feeding of glucose, glycerol and placebo on endurance and fuel homeostasis in man. Eur J Appl Physiol. 55:645-653
20. Dill DB, Costill DL (1974). Calculation of percentage changes in volumes of blood, plasma, and red cells in dehydration. J Appl Physiol. 37:247-248
Cita Original
P. Montner, Y. Zou, R.A. Robergs, G. Murata, D. Stark, C. Quinn, S. Wood, D. Lium, and E.R. Greene. Glycerol hyperhydration alters cardiovascular and renal function .JEPonline; Vol 2, No 1, 1999.
Cita en PubliCE
Robert A Robergs, P Montner, Y Zou, G Murata, D Stark, C Quinn, S Wood, D Lium E R Greene (1999). La Hiperhidratación con Glicerol altera la Función Cardiovascular y Renal. .https://g-se.com/la-hiperhidratacion-con-glicerol-altera-la-funcion-cardiovascular-y-renal-858-sa-157cfb27193df0
