Impacto de la Dieta, el Ejercicio y la Dieta Combinada con el Ejercicio sobre los Niveles Plasmáticos de Lipoproteínas y Adiponectina en Niñas Obesas
Zouhair Tabka1, Mohamed Amri3, Abdelkarim Zbidi1, Omar Ben Ounis1, Mohamed Elloumi1, Gerard Lac21 Laboratory of Physiology, Faculty of Medicine, Sousse, Tunisia.
2 Laboratory of Exercise Biology, University Blaise Pascal, Clermont-Ferrand, Francia.
3 Laboratory of Physiology, Faculty of Sciences, Túnez, Túnez.
Resumen
En el presente estudio se han investigado los efectos de tres intervenciones: restricción dietaria (D), el entrenamiento individualizado (E) al punto máximo de oxidación lipídica (LIPOX máx.) y dieta combinada con ejercicios (D+E), sobre la masa corporal y los niveles plasmáticos de lipoproteínas y adiponectina en niñas obesas. Se han estudiado a dieciocho adolescentes obesas de entre 12 – 14 años de edad. Se llevó a cabo una intervención longitudinal que consistió de un programa nutricional de dos meses (D; –500 kcal·día-1), un programa individualizado de ejercicio (E; 4 días/semana, 90 min·día-1) y un programa combinado de dieta y ejercicio (D+E). Antes y después del programa se midió en todas las participantes la masa corporal, el índice de masa corporal (IMC), la masa grasa corporal, la circunferencia de la cintura, el punto de cruce de sustratos (crossover point), el punto de LIPOX máx., el índice de valoración del modelo homeostático (HOMA-IR), y los niveles de lípidos y adiponectina circulante en ayunas. En las participantes del grupo D+E, la masa corporal, el IMC, la masa grasa corporal, la circunferencia de la cintura, el HOMA-IR, el nivel de lipoproteínas de baja densidad (LDL-C) y el índice colesterol total/lipoproteínas de alta densidad (TC/HDL-C) fueron significativamente más bajos, y los niveles de HDL-C y adiponectina fueron más elevados después del programa en comparación con las participantes de los grupos D o E. La dieta/ejercicio mejoró la capacidad para oxidar lípidos durante el ejercicio (punto de cruce: + 18.5 ± 3.4 de % Wmáx; p < 0.01; índice de oxidación de grasas en el LIPOX máx.: + 89.7 ± 19.7 mg·min-1; p < 0.01). En el grupo D+E se hallaron correlaciones significativas entre los cambios en la masa corporal y los niveles de adiponectina, y entre los cambios en el índice TC/HDL-C y el LIPOX máx. Estos hallazgos muestran que se requiere de un programa combinado de restricción dietaria y entrenamiento individualizado al punto de LIPOX máx para mejorar de manera simultánea la pérdida de la masa corporal, los niveles de adiponectina, así como también los parámetros metabólicos en las niñas obesas.
Palabras Clave: niñas obesas, lipoproteína, adiponectina, entrenamiento, restricción dietaria
INTRODUCCION
La obesidad es un importante factor de riesgo independiente de sufrir una enfermedad cardiovascular (Scaglione et al., 2004). El músculo esquelético está muy relacionado en el desarrollo de la obesidad (Perez-Martin et al., 2001). Además, las anormalidades musculares alteran el equilibrio de la utilización de sustratos, facilitando así la acumulación de grasa en el tejido adiposo. En contraste, el entrenamiento regular, en general recomendado para las personas obesas, inducen a cambios musculares metabólicos que pueden revertir estos efectos (Dumortier et al., 2003).
No obstante, en la actualidad está muy aceptado el concepto de que el tejido adiposo es un importante órgano endocrino que produce una diversidad de factores que regulan el metabolismo energético y la sensibilidad a la insulina (Kershaw y Flier, 2004). Una masa de tejido adiposo incrementada se asocia a la resistencia a la insulina, a la hiperglucemia y a otros componentes del síndrome metabólico (Després, 2006).
Los niveles de adiponectina disminuyen con la obesidad (Ariata et al., 1999), y la concentración baja de adiponectina está asociada a la resistencia a la insulina (Hotta et al., 2000). La reducción de la masa corporal está seguida de un incremento en la concentración plasmática de adiponectina (Esposito et al., 2003) y una disminución de varios indicadores de riesgo cardiovascular, tales como los lípidos plasmáticos (Gerhard et al., 2004).
La obesidad se caracteriza por tres anormalidades lipoprotéicas principales: incremento de las lipoproteínas ricas en triglicéridos, incremento de pequeñas partículas de lipoproteínas de baja densidad (LDL) y niveles reducidos de lipoproteínas de alta densidad (HDL) (Grundy, 1998). Además, las concentraciones de HDL-C por lo general son un reflejo de la resistencia a la insulina (Karhapaa et al., 1994).
Varios estudios han demostrado que el entrenamiento de la resistencia tiene un efecto beneficioso sobre los lípidos lipoprotéicos plasmáticos convencionales y sobre los niveles de adiponectina circulante (Kraus et al., 2002; Kriketos et al., 2004). De hecho, Kang et al. (2002) demostraron que la actividad física tenía un efecto beneficioso en el diámetro de las partículas de LDL en los adolescentes obesos. Un meta-análisis reciente reportó que la dieta combinada con ejercitación favorece a la reducción del LDL-C y los triglicéridos pero disminuye el incremento del HDL-C, cuando se lo compara con la ejercitación sola (Leon y Sanchez, 2001). Además, Kriketos et al. (2004) expusieron que los niveles de adiponectina en ayunas se incrementaron en alrededor de un 260% por encima de los valores iniciales luego de 2-3 series de ejercicios de intensidad baja a moderada.
Recientemente, varios equipos han desarrollado una calorimetría del ejercicio con el fin de enfocar de manera más minuciosa los protocolos de entrenamiento, tanto para los adultos (Dumortier et al., 2003; Perez-Martin et al., 2001) como para los adolescentes (Brandou et al., 2003) que sufren de obesidad. Por consiguiente, es importante saber cómo una dieta combinada con ejercitación modifica el equilibrio de los sustratos, como se calculó con esta técnica en los adolescentes obesos.
Por lo tanto, en el presente estudio se han investigado por separado los efectos de una dieta de dos meses, el entrenamiento individualizado al punto de máxima oxidación de grasas (LIPOX máx.) y la dieta combinada con ejercitación sobre la composición corporal, la lipoproteína plasmática, los parámetros metabólicos y los niveles circulantes de adiponectina en las niñas obesas. La hipótesis de trabajo fue que el entrenamiento combinado con una restricción dietaria disminuiría la masa corporal grasa, la resistencia a la insulina y el LDL-C e incrementaría la adiponectina y el HDL-C mediante los efectos que producía en la oxidación de grasas durante el ejercicio.
METODOS
Participantes
Se estudiaron a dieciocho adolescentes obesas de dos escuelas del centro de Túnez. Se definió a la obesidad como el índice de masa corporal (IMC; kg·m-2) mayor al percentil 97 definido por Cole et al. (2000). Un pediatra calificado evaluó la etapa de pubertad según la clasificación de Tanner (Tanner et al., 1966). Las adolescentes pre-púberes incluyeron aquellas participantes que pertenecían a la etapa I de Tanner, las adolescentes púberes las de las etapas II-III de Tanner y las adolescentes post-púberes las de las etapas IV-V de Tanner.
El criterio de participación en el presente estudio incluyó: no tener antecedentes de enfermedades cardiovasculares, no tener antecedentes de haber fumado, no tener antecedentes médicos ni realizar ejercicios con regularidad. Este estudio fue aprobado por el Comité de Ética de Investigación de la Facultad de Medicina de la Universidad Sousse, Túnez. A las participantes se las asignó al azar en 3 grupos de programa de 6 integrantes: de restricción dietaria (D), de entrenamiento individualizado (E) y de dieta/ejercitación (D+E). Las adolescentes y sus padres dieron un consentimiento por escrito para realizar el protocolo experimental.
MEDICIONES ANTROPOMETRICAS
La altura se midió con una precisión de 0.1 cm, la circunferencia de la cintura sobre la piel a la altura del ombligo con una precisión de 0.2 cm, y la masa corporal total con una precisión de 0.1 kg utilizando una balanza digital (OHAUS, Florhman Park, NJ). Para las mediciones de la masa corporal las participantes estuvieron desnudas o llevaban sólo ropa interior. El índice de masa corporal (IMC) se calculó utilizando la fórmula convencional: la masa corporal en kilogramos dividida por la altura en metros al cuadrado (kg·m-2).
El porcentaje de grasa corporal (BF%) se calculó mediante la utilización de la ecuación de Slaughter et al. (1988) para niños, utilizando los pliegues cutáneos tricipital y subescapular < 35 mm:
Niñas:
1.33 (suma de 2 pliegues cutáneos) – 0.013 (suma de 2 pliegues cutáneos2) – 2.5. BF% para niñas con pliegues cutáneos en tríceps y subescapulares > 35 mm: Niñas = 0.546 (suma de 2 pliegues cutáneos) + 9.7.
El mismo experto calificado midió dos pliegues cutáneos (tricipital y subescapular) en las participantes de los tres grupos con una precisión de 0.1 mm. Las mediciones se realizaron del lado derecho del cuerpo utilizando un calibre Harpenden. Se tomaron tres mediciones en cada lugar y se calculó el promedio las dos medidas más cercanas para utilizarlo en el análisis. Luego se utilizó la información del test-retest para calcular la precisión de todas las mediciones de la composición corporal. El mismo técnico calificado llevó a cabo cada medición antropométrica en todas las participantes, antes y después de la intervención de dos meses.
Mediciones Bioquímicas
Se midieron la adiponectina y la insulina en ayunas antes y después del programa de intervención de dos meses. La adiponectina plasmática se determinó utilizando un kit ELISA (B-Bridge international, inc). La insulina se analizó utilizando un kit de Insulina IRMA (Immunotech, Francia). Los análisis se llevaron a cabo siguiendo las instrucciones del fabricante.
Los niveles de colesterol total (TC), triglicéridos (TG), lipoproteínas de alta densidad (HDL-C) y glucosa se midieron en todas las participantes antes y después de los programas, tras 12 horas de ayuno utilizando las técnicas estandarizadas descritas por Wegge et al. (2004). Los niveles de lipoproteínas de baja densidad (LDL-C) se calcularon mediante la fórmula de Friedewald (Friedewald et al., 1972).
La evaluación del modelo homeostático (HOMA-IR) se utilizó para estimar el grado de resistencia a la insulina y se calculó mediante la fórmula: HOMA-IR = [insulina (mU·liter-1) × glucosa (mmol·liter-1)] / 22.5.
Para distinguir la sensibilidad a la insulina normal de la afectada, el límite que se empleó para las adolescentes fue HOMA-IR > 4.0, según los valores normales que proporcionaba un estudio previo (Annunzio et al., 2004). La definición del síndrome metabólico en las adolescentes se realizó según el criterio de la Organización Mundial de la Salud (Alberti y Zimmet, 1998).
Test de Ejercicio
Las participantes realizaron una prueba de ejercicio en un cicloergómetro con cupla electromagnética (Ergo-line, Bitz, Alemania) conectado a una boquilla de respiración (ZAN 600, Meβgeräte, Alemania) para mediciones del intercambio gaseoso (VO2 y VCO2). Antes de la prueba, a las participantes se les explicaron las condiciones y exigencias de la prueba de ejercicios. Durante el período del test la temperatura y la humedad relativa del laboratorio fueron entre 22-24°C y 76% respectivamente.
Se calcularon el consumo máximo de oxígeno (VO2máx) y la capacidad máxima teórica de trabajo (Wmáx.) para cada participante antes de la prueba de ejercicios mediante las ecuaciones de predicción de Wasserman et al. (1986) para niños obesos. Estas ecuaciones tienen en cuenta el sexo y las características antropométricas:
Niñas:
VO2 máx. = (52.8 × M) – 303.4
Wmáx. = (VO2 máx. – 10 (×M)) × (10.3)-1
M es la masa corporal del sujeto en kg.
La prueba consistió en un incremento progresivo de la carga de trabajo cada 6 min con 5 cargas de trabajo fijas correspondientes al 20, 30, 40, 50, y 60 % de la Wmáx. La frecuencia cardiaca se controló de manera electrocardiográfica durante toda la prueba (ZAN ECG 800, Meβgeräte, Alemania). A las participantes se las sometió a una prueba con la misma carga de trabajo relativa gradual y se las comparó con el mismo porcentaje de su Wmáx. Los resultados de esta prueba se utilizaron para determinar la intensidad de los ejercicios del entrenamiento.
Las tasas de oxidación de carbohidratos (CHO) y grasas se calcularon a partir de las mediciones de intercambio gaseoso según la técnica de cociente respiratorio no proteico (R) (Peronnet y Massicote, 1991):
Índice de Oxidación de CHO (mg·min-1) = 4.585VCO2 – 3.2255VO2
Índice de oxidación de grasas (mg·min-1) = 1.6946 VO2 – 1.7012 VCO2
El VO2 y el VCO2 se determinaron como medias de mediciones durante los minutos cuatro y seis de cada carga de trabajo, según MacRae et al. (1995). Esta técnica aportó las tasas de oxidación de CHO y lípidos en los diferentes niveles de la ejercitación.
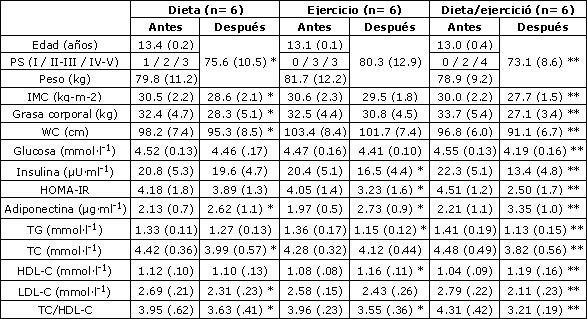
Tabla 1. Características de las participantes antes y después del programa de dos meses. Los datos son medias (± DE). PS: estado de maduración biológica, IMC: índice de masa corporal, WC: circunferencia de la cintura, HOMA-IR: índice de evaluación del modelo homeostático para la resistencia a la insulina, TG: triglicéridos, TC: colesterol total, HDL-C: lipoproteínas de alta densidad, LDL-C: lipoproteínas de baja densidad. * p < 0.05 y ** p < 0.01 antes vs después del programa.
El porcentaje de oxidación de CHO y de grasas se calculó mediante la utilización de las siguientes ecuaciones (McGilvery y Goldstein, 1983):
% CHO = ((R – 0.71) / 0.29) × 100
% Grasa = ((1 – R) / 0.29) × 100
En la cual R es el cociente respiratorio VCO2/VO2. Estas ecuaciones se basan partiendo del supuesto que el análisis de proteína contribuye poco al metabolismo energético durante el ejercicio (MacArdle et al., 1986).
Se han determinado dos parámetros representativos del equilibrio entre la utilización de grasas y CHO (Perez-Martin et al., 2001): i) punto de cruce de la oxidación de sustratos expresado como porcentaje de la Wmáx. Este punto corresponde a la potencia a la que la energía proveniente de los combustibles derivados de los CHO ejerce supremacía sobre la energía proveniente de los lípidos. Por lo tanto esta intensidad de potencia se emplea aquí como un índice estandarizado de equilibrio de sustratos durante el ejercicio, ii) el punto máximo de oxidación de grasas (LIPOX máx.), también expresado como porcentaje de la capacidad máxima de trabajo teórica, y correspondiente a la intensidad del ejercicio en la que se observó el índice más elevado de oxidación de grasas. Esta potencia se utilizó para establecer la intensidad del programa de entrenamiento.
Programa Dietario
Un especialista en nutrición estableció un programa de restricción dietaria equilibrado y personalizado luego de una valoración dietaria con el propósito de definir la cantidad total de calorías consumidas por día. Con este fin, las participantes de los grupos D y D+E registraron los horarios y las cantidades de ingesta de comida y líquido durante una semana antes del comienzo del programa.
El programa dietario se fijó en – 500 kcal/día por debajo de los registros dietarios iniciales y estuvo compuesto por 15% de proteínas, 55% de carbohidratos y 30% de lípidos. Las adolescentes registraron, en una libreta específicamente designada, la cantidad de comida y el horario en el que comieron (4 veces por semana). Las comidas se seleccionaron de acuerdo a los hábitos dietarios de las participantes. Se diseñaron presentaciones en PowerPoint, videos, juegos y guiones para juegos de roles para que los entrenadores utilicen durante el programa educativo. La dieta de cada una de las participantes se diseñó utilizando el programa Bilnut 4 (SCDA Nutrisoft, Cerelles, Francia), una base de datos que calcula el consumo y la composición de la comida del Instituto Nacional de Estadística de Túnez de 1978. La masa corporal se midió todas las semanas para evaluar el efecto inmediato de las modificaciones nutricionales.
Programa de Entrenamiento
El programa de entrenamiento se llevó a cabo en un gimnasio y fue supervisado por un profesor de educación física. Las participantes de los grupos E y D+E entrenaron durante dos meses, completaron cuatro sesiones de 90 min por semana. La intensidad de ejercicio se fijó a una frecuencia cardiaca correspondiente al punto de LIPOX máx calculado en la primera visita y se controló mediante el monitoreo de la frecuencia cardiaca con un dispositivo Sport-tester (Vantage NV, Polar Electro, Kempele, Finlandia). Con el propósito de incrementar la motivación de las adolescentes, los ejercicios prescritos fueron variados e incluyeron entrada en calor, carreras, saltos y juegos con balón. No obstante, la intensidad en el LIPOX máx. se mantuvo dentro de un escaso radio, a pesar de estas diversas actividades físicas.
ANALISIS ESTADISTICOS
Todos los análisis se realizaron con SPSS para Windows. Los resultados están expresados como medias ± desviación estándar (DE). Se utilizó la prueba t para datos apareados para llevara a cabo las comparaciones dentro de los tres grupos (D, E y D+E). Para comparar las respuestas de los diferentes grupos, en diferentes momentos de la prueba, antes y después del programa, se utilizó el análisis de varianza ANOVA para medidas repetidas. Se utilizó la prueba post-hoc de Tukey para comparar las medias. Con el propósito de evaluar la relación entre los diferentes parámetros, se llevó a cabo un análisis de correlación de Spearman. Se calcularon los coeficientes de correlación intraclase (ICC) con el fin de evaluar la confiabilidad de las todas las mediciones de la composición corporal y las estadísticas para la diferencia mínima (MD) debieron considerarse reales tal como los señalan Weir et al. (2005). Se consideró un valor de p < 0.05 para que fuera estadísticamente significativo.
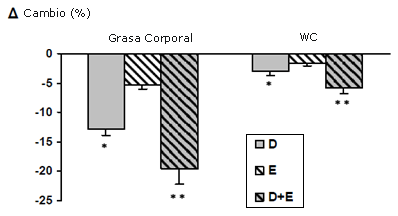
Figura 1. Cambio porcentual de la masa grasa corporal y la circunferencia de cintura (WC) entre las evaluaciones pre y post programa. *p < 0.05 y ** p < 0.01 entre pre- y post-programa. D: dieta, E: ejercicio, D+E : dieta + ejercicio.
RESULTADOS
La confiabilidad para la información sobre la composición corporal fue la siguiente: masa corporal (ICC = 0.98), altura (ICC = 0.99), IMC (ICC = 0.98), masa grasa corporal (ICC = 0.98), circunferencia de cintura (ICC=0.98) y grosor de pliegues cutáneos (ICC = 0.97).
Además, las estadísticas para la diferencia mínima (MD) de todas las mediciones de la composición corporal fueron 0.33 kg, 0.31 kg-m-2, O.Olm, 0.18 kg, 0.26 cm y 1.1 mm respectivamente para la masa corporal, el IMC, la altura, la masa grasa corporal, la circunferencia de cintura y el grosor de los pliegues cutáneos.
La Tabla 1 resume las características antropométricas y los parámetros metabólicos de los tres grupos al comienzo y al final del programa. No hubo diferencias significativas entre los grupos por edad, masa corporal, masa grasa corporal, IMC y etapa púber antes del estudio. El principal valor inicial de IMC de 30.4 ± 2.2 kg·m-2 indica que, en promedio, estas niñas eran obesas al comienzo del programa.
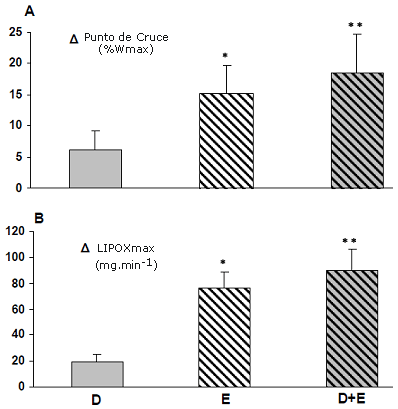
Figura 2. Comparación Delta (diferencia pre- y post- programa) en niñas obesas: (A) Punto de cruce (% Wmáx). (B) Oxidación de grasas (LIPOX máx. (mg·min-1). *p < 0.05 y ** p < 0.01 diferencia entre pre- y post-programa.
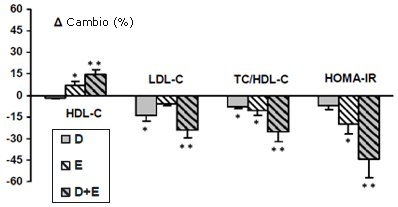
Figura 3. Cambios de porcentaje de HDL-C plasmático, LDL-C, índice TC/HDL-C y HOMA-IR en los tres grupos después del programa. *p < 0.05 y ** p < 0.01; diferencia entre pre- y post-programa.
Luego del programa de dos meses, la masa corporal, el IMC, la circunferencia de cintura y la masa grasa corporal, mostraron una reducción significativa en el grupo D (-4.2 ± 1.1 kg, -1.9 ± 0.3 kg·m-2, -2.9 ± 0.6 cm y -4.1 ± 1.4 kg; p < 0.05 respectivamente) y el grupo D+E (-5.8 ± 1.3 kg, -2.3 ± 0.4 kg·m-2, -5.7 ± 1.6 cm y -6.6 ± 2.2 kg; p < 0.01 respectivamente). No se observó ningún cambio significativo para el grupo E. El cambio de porcentaje en la masa grasa corporal y la circunferencia de cintura se presentan en la Figura 1.
La utilización de sustratos se modificó por el entrenamiento, así como también por el programa de dieta/ejercicio (Figura 2). El punto de cruce de la utilización de sustratos se incrementó de manera significativa en los grupos E y D+E después del programa de dos meses (15.2 ± 4.6%; p < 0.05 y 18.5 ± 3.4%; p < 0.01 de la Wmáx respectivamente) (Figura 2 A).
El índice de oxidación de grasas obtenido en el punto de LIPOX máx. se incrementó de manera significativa en los grupos E y D+E después del programa (77.4 ± 10.4 mg·min-1; p < 0.05 y 89.7 ± 19.7 mg·min-1; P < 0.01 respectivamente). En el grupo de dieta no hubo ningún cambio significativo en el punto de cruce ni en los puntos de LIPOX máx. (Figura 2).
Las concentraciones de glucosa plasmática e insulina y el perfil lipídico no difirieron entre los tres grupos antes del programa. Después del programa, el nivel de insulina en ayunas disminuyó de manera significativa en los grupos E (-3.9 ± 0.8 µU·ml-1; p < 0.05) y D+E (-8.9 ± 3.2 µU·ml-1; p < 0.01) (Tabla 1). Las concentraciones de insulina plasmática y de glucosa no cambiaron después del programa dietario de dos meses (Tabla 1).
El índice normal de resistencia a la insulina cambió de manera significativa después de la ejercitación sola y de la ejercitación combinada con la dieta. El HOMA-IR disminuyó de manera significativa en los grupos E y D+E (-20.2 ± 6.7%; p < 0.05, y -44.6 ± 12.4%; p < 0.01 respectivamente). En el grupo D no se halló ningún cambio (Figura 3). El perfil lipídico mejoró de manera significativa después del programa de dos meses de dieta combinada con ejercicios. El grupo de dieta/ejercitación incrementó el HDL-C en un 14.4%, y disminuyó el LDL-C y el TC/HDL-C en un 24.4% y 25.5% respectivamente (Figura 3). Los niveles de adiponectina se incrementaron de manera significativa en los grupos de D (p < 0.05), E (p < 0.05) y D+E (p < 0.01) (Figura 4). En las participantes del grupo D+E, los niveles de adiponectina exhibieron una significativa correlación negativa con la masa corporal (r = -0.41; p < 0.01) y el HOMA-IR (r = -0.59; p < 0.01). Además, el índice TC/HDL-C guardó una relación positiva con el HOMA-IR (r = 0.46; p < 0.01), la masa corporal (r = 0.35; p < 0.01) y guardó una relación negativa con el LIPOX máx. (r = -0.52; p < 0.01).
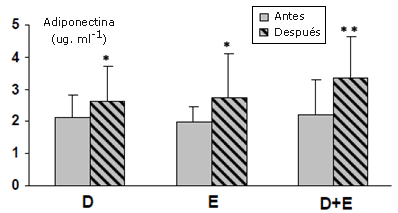
Figura 4. Niveles de adiponectina (antes y después de los programas) en niñas obesas. p < 0.05 y ** p < 0.01 comparados con las concentraciones anteriores al programa.
En el grupo E, los niveles de adiponectina guardaron una relación negativa con el HOMA-IR (r = -0.33; p < 0.05) y el índice TC/HDL-C guardó una relación positiva con el HOMA-IR (r = 0.28; p < 0.05) y una relación negativa con el LIPOX máx. (r = -0.30; p < 0.05). En el grupo D, se observaron relaciones significativas entre los niveles de adiponectina y la masa corporal (r = -0.31; p < 0.05) y entre el índice TC/HDL-C y la masa corporal (r = 0.26; p < 0.05).
DISCUSION
El presente estudio muestra que el programa de restricción dietaria de dos meses combinado con el entrenamiento a una intensidad de trabajo correspondiente al LIPOX máx. lleva a mayores mejoras en las niñas obesas que la dieta sola o el ejercicio solo.
La dieta combinada con el ejercicio induce a una pérdida sustancial de masa grasa corporal (19.6% de masa grasa corporal inicial), a una disminución en la circunferencia de cintura y a una habilidad incrementada para oxidar lípidos durante el ejercicio (el LIPOX máx. se incrementó de 0.13 a 0.22 g·min-1). Los niveles de adiponectina plasmática y HDL-C fueron más elevados, y los de LDL-C y el índice TC/HDL-C fueron más bajos al final del programa de dieta/ejercitación de dos meses.
En el presente estudio, el interés estuvo puesto en proporcionar una estimación relativa de la confiabilidad de las mediciones de composición corporal (Weir et al., 2005), y se halló una confiabilidad test-retest excelente para todas las pruebas realizadas. Las mediciones de grosor de los pliegues cutáneos y la circunferencia de la cintura mostraron una confiabilidad test-retest excelente, con la estimación ICC que excedió 0.95. Este estudio ha producido una confiabilidad excelente de cada participante durante la prueba de antropometría. Además, todas las mediciones de la composición corporal alcanzaron la diferencia mínima necesaria para considerarlas verdaderas.
Las investigaciones se basan en la técnica de calorimetría indirecta, la cual parece ser válida para las mediciones de oxidación de sustratos durante las series de ejercicios submáximos fijos. Dichas mediciones han mostrado que las personas obesas oxidan menos lípidos durante la ejercitación que los sujetos más delgados de control (Perez-Martin et al., 2001) y que el entrenamiento de baja intensidad invierte notoriamente este defecto tanto en los sujetos obesos adultos como en los adolescentes (Brandou et al., 2003; Dumortier et al., 2003).
En la población obesa, el entrenamiento de baja intensidad es preferible a los de alta intensidad debido al menor riesgo de lesiones músculo-esqueléticas y mejor cumplimiento del programa de entrenamiento (Bouchard et al., 1993). Además, la obesidad se caracteriza por una habilidad disminuida para la movilización y utilización de las grasas, por lo que el entrenamiento en el LIPOX máx. puede contrarrestar esta disfunción metabólica y prevenir la disminución de la oxidación de grasas inducida por la pérdida de masa corporal en el período de post-dieta. Este efecto se puede lograr por medio de la conservación de la sensibilidad del sistema nervioso simpático, que tiende a reducirse después de la pérdida de la masa corporal sola (Van Aggel-Leijssen et al., 2001).
Se considera que la obesidad es un importante factor de riesgo independiente de una enfermedad cardiovascular (Scaglione et al., 2004). El Programa Nacional de Educación sobre el Colesterol (NCEP) ha demostrado que la dieta sola reduce la concentración sérica de TC y LDL-C en las personas normales. No obstante, también se ha reportado frecuentemente la disminución en los niveles de HDL-C (Hellenius et al., 1997; Yancy et al., 2004). Los resultados del presente estudio demuestran que la restricción dietaria sola indujo a una mejora en los niveles de LDL-C pero no hubo ningún efecto sobre los niveles de HDL-C. Las concentraciones reducidas de HDL-C son un factor de riesgo establecido para la cardiopatía isquémica, y se ha estimado que un incremento de 1 mg.dl-1 en el HDL-C reduce el riesgo de sufrir una enfermedad cardiaca en alrededor de un 4% (Gordon et al., 1986).
Los niveles de HDL-C son más elevados en los atletas de resistencia bien entrenados (Thompson et al., 1991) y se incrementan en los sujetos sedentarios después del entrenamiento (Thompson et al., 1997).
El presente estudio muestra que los cambios en HDL-C (14.4%) y LDL-C (-24.4%) en el grupo de dieta/ejercicio fueron considerablemente mayores que los del grupo de dieta o ejercicio solo, sugiriendo una disminución en el riesgo de sufrir una enfermedad cardiaca en los sujetos del grupo D+E. Por consiguiente, Wood et al. (1991) han demostrado que un programa combinado de un año resultó más efectivo para mejorar el perfil lipoproteico que el ejercicio o la dieta solos, y se asoció con un incremento en el HDL-C y una disminución en el LDL-C.
Además, se ha demostrado que el índice TC/HDL-C es un mejor indicador de reducción de riesgo de enfermedad cardiovascular (CVD) que el valor de HDL-C, LDL-C, o TC solo (Natarajan et al., 2003). Estos resultados muestran que el ejercicio no influencia al TC ni al LDL-C. Sin embargo, el ejercicio influencia de manera favorable al HDL-C (7.4% y 14.4% en los grupos E y D+E respectivamente) y al índice TC/HDL-C (-10.6% y -25.5% en los grupos E y D+E respectivamente). Estos resultados concuerdan con los hallazgos de Varady et al. (2007), quienes mostraron que ocho semanas de ejercicios de resistencia tres veces por semana incrementaban el HDL-C en aproximadamente un 10%. Parece ser que el ejercicio solo, aunque no afecta los cambios en el TC y el LDL-C, tiene un efecto beneficioso en el índice TC/HDL-C. Asimismo, el presente estudio demuestra que la dieta combinada con el entrenamiento mejora el perfil lipídico (TC, LDL-C, HDL-C y TC/HDL-C) en las niñas obesas.
En este estudio, se ha observado un pequeño descenso de la glucosa en ayunas (7.9%), acompañado de una disminución mucho mayor en la insulina (39.9%) después del programa dieta/ejercicio. Kang et al. (2002) reportaron una mejora en la insulina en ayunas en los niños con sobrepeso después de un programa combinado de dieta/ejercicio. Del mismo modo, tres días/semana de ejercicios aeróbicos mejoraron el HOMA-IR en los sujetos con sobrepeso (Balagopal et al., 2005).
En el presente estudio, el HOMA-IR se incrementó en alrededor del 20.2% y el 44.6% respectivamente en niñas que se comprometieron con ejercitación y programas de dieta/ejercicio. El riesgo disminuido de enfermedad cardiovascular se asocia con un incremento en la oxidación de grasas en las participantes de los grupos E y D+E. De hecho, el índice TC/HDL-C guarda una relación significativamente negativa con el LIPOX máx. después de un programa de dos meses de ejercicios solamente (r = -0.30) o combinado con una dieta (r = -0.52).
El presente estudio confirma que la actividad física asociada con el consumo reducido de alimentos mejora la sensibilidad a la insulina más que el ejercicio solo o una dieta controlada por sí sola. Un efecto inmediato del ejercicio es un incremento en los transportadores de glucosa muscular, que mejora de manera secundaria la eliminación de glucosa por medio de la insulina. Al parecer, la oxidación incrementada de los ácidos grasos reduce la sobrecarga de lípidos, que también incrementa la sensibilidad a la insulina (Goodyear y Kahn, 1998).
La notable mejora que se observó en los TG séricos se debe principalmente a la combinación de la restricción dietaria y el entrenamiento en el LIPOX máx. Debido a que el consumo de carbohidratos procesados en general es más alto en los niños obesos (St-Onge et al., 2003), la transición a una dieta muy desprovista de carbohidratos refinados, junto con un régimen diario de ejercicios (Oscai et al., 1972), facilitó la reducción de TG. Además, la disminución en la insulina sérica también puede ser importante en la reducción de TG.
La obesidad es la consecuencia de balance energético positivo crónico, regulado por una compleja conexión entre el tejido endocrino y el sistema nervioso central (Cummings y Schwartz, 2003). Cada vez es más frecuente que se vea al tejido adiposo como un órgano endocrino activo con una actividad metabólica elevada. Las adiposidades producen y secretan varias proteínas que actúan como verdaderas hormonas, responsables de la regulación del consumo y gasto de la energía (Mora y Pessin, 2002).
La adiponectina puede actuar como un factor antiaterosclerótico no sólo a través de los efectos directos en las células endoteliales vasculares, sino también mejorando la resistencia a la insulina y el metabolismo lipídico (Yamamoto et al., 2002). Se ha informado que los niveles de adiponectina disminuyen en los sujetos jóvenes y adolescentes que son obesos (Zou et al., 2005). Siete meses de un entrenamiento de intensidad moderada incrementó los niveles de adiponectina en alrededor de un 42.8% en las jóvenes obesas (Kondo et al., 2006), y del mismo modo, se asoció a una pérdida de masa muscular significativa con un significativo incremento en los niveles de adiponectina en 16 niños obesos después del programa de intervención de Obeldicks (Reinehr et al., 2004). El presente estudio demostró que los niveles de adiponectina circulante se encuentran incrementados de manera significativa en las niñas obesas después del programa de intervención de dos meses; este incremento es más pronunciado en el grupo D+E (51.6%) que en los grupos E (38.5%) o D (23%).
Matsubara et al. (2002) han reportado correlaciones significativas entre los niveles de adiponectina y resistencia a la insulina. Por consiguiente, se observó una correlación significativa en las participantes entre los niveles de adiponectina y el HOMA-IR después de la ejercitación de dos meses solamente o la ejercitación combinada con el control dietario, sugiriendo que podría considerarse a la adiponectina como un factor determinante importante de la resistencia a la insulina.
La adiponectina es la primera adipocitoquina que es sabido que se reduce en la obesidad. El mecanismo de esta regulación negativa continúa siendo poco claro, ya que la adiponectina es secretada de manera exclusiva por las células grasas (Beltowski, 2003). La secreción de adiponectina disminuyó cuando se aisló al tejido adiposo visceral y se lo cultivó in vitro (Beltowski, 2003). Este efecto se redujo mediante la disminución de la cantidad de tejido cultivado por placa. Además, se previno el efecto mediante los inhibidores de transcripción y traslado. Es probable que la masa de tejido adiposo blanco en aumento en la obesidad reduzca la síntesis de la proteína adiponectina por medio de una inhibición por retroalimentación (Diez y Igleasis, 2003).
Además, la secreción de adiponectina in vitro es más baja en los adipositos viscerales, a diferencia de los periféricos, en los niños (Sabin et al., 2003), indicando una influencia en la distribución de la grasa corporal. Debido a que la insulina estimula a la adiponectina y el TNF-α la inhibe, la resistencia a la insulina y la expresión del TNF-α pueden contribuir a la hipoadiponectinemia (Beltowski, 2003). También se reportó que los glucocorticoides inhiben la expresión y la secreción génica de la adiponectina (Diez y Igleasis, 2003), sugiriendo que la producción disminuida de adiponectina podría ser importante en la resistencia a la insulina inducida por medio de los glucocorticoides.
CONCLUSION
Los resultados del presente estudio complementan los hallazgos previos ya que muestran que la incorporación de la restricción dietaria al entrenamiento de resistencia mejora de manera significativa la composición corporal, el HDL-C, el índice TC/HDL-C y la resistencia a la insulina. Por regla general, se recomienda una dieta combinada con un programa de ejercicios a fin de disminuir la masa corporal, la resistencia a la insulina y el LDL-C, e incrementar la oxidación de grasas y los niveles de HDL-C y adiponectina en las niñas obesas.
PUNTOS CLAVE
- La dieta combinada con el entrenamiento mejoró la composición corporal, los niveles de adiponectina y los parámetros metabólicos en las niñas obesas.
- La dieta sola disminuyó la masa corporal y el LDL-C, sin mejorar la oxidación de grasas ni el HDL-C.
- El entrenamiento individualizado en el punto de LIPOX máx. mejoró el HDL-C y los niveles de adiponectina circulante, sin cambios en el LDL-C y la composición corporal.
AGRADECIMIENTOS
El presente estudio fue financiado por el Ministerio de Educación Superior, Investigación Científica y Tecnología de Túnez. Asimismo se agradece a los profesores de Educación Física Emna Makni y Imen Ben Chiekh.
Referencias
1. Alberti, K.G. and Zimmet, P.Z (1998). Definition, diagnosis and classification of diabetes mellitus and its complications. Part 1: diagnosis and classification of diabetes mellitus provisional report of a WHO consultation. Diabetes Medicine 15, 539-553
2. Annunzio, G., Vanelli, M., Meschi, F., Pistorio, A., Caso, M. and Pongiglione, C (2004). The SIEDP Study Group. Valori normali di HOMA-IR in bambini e adolescenti: studio multicentrico italiano. Quad Pediatric 3, 44
3. Ariata, Y., Kihara, S., Ouchi, N., Takahaski, M., Maeda, K. and Miyagawa, J (1999). Paradoxical decrease of an adipose-specific protein, adiponectin, in obesity. Biochemical and Biophysical of Research Communications 2257, 79-83
4. Balagopal, P., George, D., Patton, N., Yarandi, H., Roberts, W.L. and Bayne, E (2005). Lifestyle-only intervention attenuates the inflammatory state associated with obesity: a randomized controlled study in adolescents. Journal de Pediatria 146, 342-348
5. Beltowski, J (2003). Adiponectin and resistin: new hormones of white adipose tissue. Medical Science Monitor 9, 55-61
6. Brandou, F., Dumortier, M., Garandeau, P., Mercier, J. and Brun, J.F (2003). Effects of two-month rehabilitation program on substrate utilization during exercise in obese adolescents. Diabetes & Metabolism 229, 20-27
7. Cole, T.J., Bellizzi, M.C., Flegal, K.M. and Dietz, W.H (2000). Establishing a standard definition for child overweight and obesity worldwide: international survey. British Medicine Journal 3320, 1-6
8. Cummings, D.E. and Schwartz, M.W (2003). Genetics and pathophysiology of human obesity. Annual Review of Medicine 54, 453-471
9. Diez, J.J. and Iglesias, P (2003). The role of the novel adipocyte-derived hormone adiponectin in human disease. European Journal of Endocrinology 148, 293-300
10. Dumortier, M., Brandou, F., Perez-Martin, A., Fedou, C., Mercier, J. and Brun, J.F (2003). Low intensity endurance exercise targeted for lipid oxidation improves body composition and insulin sensitivity in patients with the metabolic syndrome. Diabetes & Metabolism 229, 509-518
11. Esposito, K., Pontillo, A., DiPalo, C., Giugliano, G., Masella, M. and Marfella, R (2003). Effect of weight loss and lifestyle changes on vascular inflammatory markers in obese women: a randomized trial. Journal of the American Medical Association 289, 1799-1804
12. Friedlander, A., Casazza, G.R., Homing, M.A., Usaj, A. and Brooks, G.A (1999). Endurance training increases fatty acid turnover, but not fat oxidation in young men. Journal of Applied Physiology 86, 2097-2105
13. Friedwald, W.T., Lvey, R.I. and Fredrickson, D.S (1972). Estimation of the concentration of low-density lipoprotein cholesterol in plasma without use of the preparative ultracentrifuge. Clinical Chemistry 18(6), 499-502
14. Gerhard, G.T., Ahmann, A., Meeuws, K., McMurry, M.P., Duell, P.B. and Connor, WE (2004). Effects of a low-fat diet compared with those of a high-monoun saturated fat diet on body weight, plasma lipids and lipoproteins, and glycemic control in type 2 diabetes. American Journal of Clinical Nutrition 80, 668-673
15. Gordon, D.J., Knoke, J., Probstfield, J.L., Superko, R. and Tyroler, H.A (1986). High-density lipoprotein cholesterol and coronary heart disease in hypercholesterolemic men: the lipid research clinics coronary primary prevention trial. Circulation 74, 1217-1225
16. Goodyear, L.J., and Kahn, B.B (1998). Exercise, glucose transport, and insulin sensitivity. Annual Review of Medicine 49, 235-261
17. Grundy, S.M (1998). Hypertriglyceridemia, atherogenic, dyslipidemia and the metabolic syndrome. American Journal of Cardiology 81, 18-25
18. Hotta, K., Funahashi, T., Ariata, Y., Takahashi, M., Matsuda, M. and Okamoto, Y (2000). Plasma concentrations of a novel, adipose-specific protein, adiponectin, in type 2 diabetic patients. Arteriosclerosis, Thrombosis and Vascular Biology 20, 1595-1599
19. Kang, H.S., Gutin, B., Barbeau, P., Owens, S., Lemmon, C.R. and Allison, J (2002). Physical training improves insulin resistance syndrome markers in obese adolescents. Medicine & Science in Sports & Exercise 34, 1920-1927
20. Kershaw, E.E. and Flier, JS (2004). Adipose tissue as an endocrine organ. Journal of Clinical Endocrinology & Metabolism 89, 2548-2556
21. Kondo, T., Kobayashi, I. and Murakami, M (2006). Effect of exercise on circulating adipokine levels in obese young women. Endocrine Journal 53, 189-195
22. Kraus, W.E., Houmard, J.A., Duscha, B.D., Knetzger, K.J., Wharton, M.B. And McCartney, J.S (2002). Effects of the amount and intensity of exercise on plasma lipoproteins. New England Journal of Medicine 347, 1483-1492
23. Kriketos, A.D., Gan, S.K., Poynten, A.M., Furler, S.M., Chisholm, D.J. and Campbell, L.V (2004). Exercise increases adiponectin levels and insulin sensitivity in humans. Diabetes Care 27, 629-630
24. Leon, A.S. and Sanchez, O.A (2001). Response of blood lipids to exercise training alone or combined with dietary intervention. Medicine & Science in Sports & Exercise 333, 502-515
25. Matsubara, M., Maruoka, S. and Katayose, S (2002). Inverse relationship between plasma adiponectin and leptin concentrations in normal-weight and obese women. European Journal of Endocrinology 147, 173-180
26. MacArdle, W., Katch, F. and Katch, V (1986). Measurement of human energy expenditure. In: Exercise physiology textbook. Eds: MacArdle, W., Katch, F. and Katch, V. Lea & Febiger, Philadelphia. 121-130
27. MacRae, H., Noakes, T. and Dennis, S (1995). Role of decreased carbohydrate oxidation on slower rises in ventilation with increasing exercise intensity after training. European Journal of Applied Physiology and Occupational Physiology 71, 523-529
28. McGilvery, R.W. and Goldstein, G.W (1983). Biochemistry: A function approach. Philadelphia: Saunders. 810-976
29. Mora, S. and Pessin, J.E (2002). An adipocentric view of signaling and intracellular trafficking. Diabetes/Metabolism Research and Review 18, 345-356
30. Natarajan, S., Glick, H., Criqui, M., Horowitz, D., Lipsitz, S.R. and Kinosian, B (2003). Cholesterol measures to identify and treat individuals at risk for coronary heart disease. American Journal of Preventive Medicine 25, 50-57
31. Oscai, L.B., Patterson, J.A., Bogard, D.L., Beck, R.J. and Rothermel, B.L (1972). Normalization of serum triglycerides and lipoprotein electrophoretic patterns by exercise. American Journal of Cardiology 330, 775-780
32. Perez-Martin, A., Dumortier, M., Raynaud, E., Brun, J.F., Fedou, C., Bringer, J. and Mercier, J (2001). Balance of substrate oxidation during submaximal exercise in lean and obese people. Diabetes & Metabolism 27, 466-474
33. Reinehr, T., Roth, C., Menke, T. and Andler, W (2004). Adiponectin before and after weight loss in obese children. Journal of Clinical Endocrinology & Metabolism 889, 3790-3794
34. Sabin, M.A., Grohmann, M.J., Holly, J.M.P., Shield, J.P.H., Crowne, E.C.and Stewart, C.E.H (2003). All fat is not the same: variations in adiponectin secretion between subcutaneous and visceral compartments of normal-weight children. Hormone Research 60 (Suppl. 2), 12 (Abstract)
35. Scaglione, R., Argano, C., DiChiara, T. and Licata, G (2004). Obesity and cardiovascular risk: the new public health problem of worldwide proportions. Expert Review of Cardiovascular Therapy 2, 203-212
36. Slaughter, M.H., Lohman, T.G., Boileau, R.A., Horswill, C.A., Stillman, R.J. and VanLoan, M.D (1988). Skin fold equation for estimation of body fatness in children and youth. Human Biology 60, 709-723
37. St-Onge, M.P., Keller, K.L. and Heymsfield, S.B (2003). Changes in childhood food consumption patterns: a cause for concern in light of increasing body weights. American Journal of Clinical Nutrition 78, 1068-1073
38. Tanner, J.M., Whitehouse, R.H. and Takaishi, M (1966). Standards from birth to maturity for height, weight, height velocity, and weight velocity: British children. Archives of Disease in Childhood 41, 454-471
39. Thompson, P.D., Cullinane, E.M., Sady, S.P., Flynn, M.M., Chenevert, C.B. and Herbert, P.N (1991). High density lipoprotein metabolism in endurance athletes and sedentary men. Circulation 84, 140-152
40. Thompson, P.D., Yurgalevitch, S.M., Flynn, M.M., Zmuda, J.M., Spannaus-Martin, D. and Sartielle, A (1977). Effect of prolonged exercise training without weight loss on high-density lipoprotein metabolism in overweight men. Metabolism 46, 217-223
41. Van Aggel-Leijssen, D.P., Saris, W.H., Hul, G.B. and Van Baak, M.A (2001). Short-term effects of weight loss with or without low-intensity exercise training on fat metabolism in obese men. American Journal of Clinical Nutrition 773, 523-531
42. Varady, K.A., Houweling, A.H. and Jones, P.J (2007). Effect of plant sterols and exercise training on cholesterol absorption and synthesis in previously sedentary hyper-cholesterolemic subjects. Translational Research 149, 22-30
43. Wasserman, K., Hansen, J. and Whipp, B (1986). Principles of exercise testing and interpretation. Philadelphia, Lea & Febiger. 50-80
44. Wegge, J.K., Roberts, C.K., Ngo, T.H. and Bernard, R.J (2004). Effect of diet and exercise intervention on inflammatory and adhesion molecules in postmenopausal women on hormone replacement therapy and at risk for coronary artery disease. Metabolism 53, 377-381
45. Weir, J.P (2005). Quantifying test-retest reliability using the intraclass correlation coefficient and the SEM. Journal of Strength Conditioning Research 19, 231-240
46. Wood, P.D., Stefanick, M.L., William, P.T. and Haskell, W.L (1991). The effects on plasma lipoproteins of a prudent weight-reducing diet, with or without exercise, in overweight men and women. New England Journal of Medicine 325, 461-466
47. Yamamoto, Y., Hirose, H., Saito, I., Tomita, M., Taniyama, M. and Matsubara, K (2002). Correlation of the adipocyte-derived protein adiponectin with insulin resistance index and serum high-density lipoprotein-cholesterol, independent of body mass index, in the Japanese population. Clinical Science 103, 137-142
48. Yancy, W.S., Olsen, M.K., Guyton, J.R., Bakst, R.P. and Westman, E.C (2004). A low carbohydrate, ketogenic diet versus a low-fat diet to treat obesity and hyperlipidemia: a randomized, controlled trial. Annals of Internal Medicine 140, 769-777
49. Zou, C.C., Liang, L., Hong, F., Fu, J.F. and Zhao, Z.Y (2005). Serum adiponectin, resistin levels and non-alcoholic fatty liver disease in obese children. Endocrine Journal 52, 519-524
Cita Original
Omar Ben Ounis, Mohamed Elloumi, Mohamed Amri, Abdelkarim Zbidi, Zouhair Tabka and Gerard Lac. Impact of Diet, Exercise and Diet Combined With Exercise Programs on Plasma Lipoprotein and Adiponectin Levels in Obese Girls. Journal of Sports Science and Medicine (2008) 7, 437 - 445.
Cita en PubliCE
Zouhair Tabka, Mohamed Amri, Abdelkarim Zbidi, Omar Ben Ounis, Mohamed Elloumi Gerard Lac (2014). Impacto de la Dieta, el Ejercicio y la Dieta Combinada con el Ejercicio sobre los Niveles Plasmáticos de Lipoproteínas y Adiponectina en Niñas Obesas. .https://g-se.com/impacto-de-la-dieta-el-ejercicio-y-la-dieta-combinada-con-el-ejercicio-sobre-los-niveles-plasmaticos-de-lipoproteinas-y-adiponectina-en-ninas-obesas-1165-sa-Y57cfb271cfc44
