Evaluación de la Eficacia de la Ingestión Aguda de L-alanil-L-glutamina durante el Estrés Hídrico en Ejercicios de Resistencia
Nicholas A Ratamess1, Jay R Hoffman1, Jie Kang1, Linda M Yamamoto2, Stefanie L Rashti1, Neil Kelly1, Adam M Gonzalez1, Michael Stec1, Steven Anderson1, Brooke L Bailey2, Lindsay L Horn2, Brian R Kupchak21 The College of New Jersey, Department of Health and Exercise Science, Ewing NJ 08628, Estados Unidos.
2 University of Connecticut, Department of Kinesiology, Storrs CT 06269, Estados Unidos.
Resumen
Antecedentes: Se estudió el efecto de la ingestión aguda de L-alanil-L-glutamina (AG; Sustamine™) sobre los cambios en el rendimiento y sobre los marcadores de regulación de fluidos, del sistema inmune, inflamatorio, estrés oxidativo y de recuperación en respuesta al ejercicio exhaustivo de resistencia en presencia y ausencia de deshidratación. Métodos: Diez varones físicamente activos (20,8 ±0,6 años; 176,8 ± 7,2 centímetros; 77,4 ± 10,5 kg; 12,3±4,6% grasa corporal) participaron voluntariamente en este estudio. Durante la primera visita (T1) los sujetos acudieron al laboratorio en un estado de euhidratación para la extracción de sangre y la realización del test de ejercicio de intensidad máxima en la línea de base (BL). En las cuatro pruebas subsiguientes establecidas al azar, los sujetos se deshidrataron hasta ~2,5% de su masa corporal determinada al inicio. En T2, los sujetos alcanzaron el peso establecido y no fueron rehidratados. En T3 - T5, los sujetos alcanzaron el peso establecido y luego fueron rehidratados a 1,5% de su masa corporal inicial bebiendo agua (T3) o dos dosis diferentes (T4 y T5) del suplementoAG (0,05 g.kg-1 y 0,2 g.kg-1 respectivamente). Luego los sujetos realizaron ejercicio en una bicicleta ergométrica con una carga de trabajo que permitiera alcanzar el 75% de su VO2max. En los tratamientos T2 a T5 se extrajeron muestras de sangre una vez que se alcanzaba la masa corporal (DHY), inmediatamente antes del estrés por el ejercicio (RHY), e inmediatamente después de que se realizara el protocolo de ejercicio (IP). También se obtuvieron muestras de sangre después de 24 horas (24P) de descanso. En las muestras de sangre se realizó el análisis de glutamina, potasio, sodio, aldosterona, arginina vasopresina (AVP), proteína C-reactiva (CRP), interleuquina 6 (IL-6), malondialdehido (MDA), testosterona, cortisol, ACTH, hormona de crecimiento y creatinquinasa. La evaluación estadística del rendimiento, cambios hormonales y bioquímicos se realizó a través de un análisis de la varianza de mediciones repetidas. Resultados: En RHY e IP las concentraciones de glutamina en T5 fueron significativamente más altas que en T2 - T4. Cuando analizamos los cambios en rendimiento (diferencia entre T2-T5 y T1), se observaron tiempos hasta el agotamiento significativamente mayores en T4 (130,2 ± 340,2 seg.) y T5 (157,4 ± 263,1 seg.) en comparación con T2 (455,6 ± 245,0 seg.). Las concentraciones plasmáticas de sodio fueron mayores (p<0,05) en RHY e IP en T2 que en los otros tratamientos. Las concentraciones de aldosterona en RHY e IP fueron significativamente menores que las obtenidas en BL y DHY. La AVP estaba significativamente elevada en DHY, RHY e IP en comparación con los valores obtenidos en BL. No se observaron diferencias significativas entre los tratamientos en CRP, IL-6, MDA, ni en ninguna de las otras determinaciones hormonales o bioquímicas. Conclusión: Los resultados demuestran que la suplementación con AG proporcionó un beneficio ergogénico significativo, aumentando el tiempo hasta el agotamiento durante un estrés hídrico moderado. Este efecto ergogénico probablemente fue mediado por una mayor captación de fluidos y electrolitos.
Palabras Clave: deshidratación, resistencia, glutamina, inflamación, inmunidad
INTRODUCCION
Durante la deshidratación los fluidos se mueven desde el plasma hacia los espacios intracelular e extracelular y luego eventualmente vuelven a la circulación [1, 2]. Los cambios de presión que involucran fuerzas hidrostáticas, oncóticas y osmóticas controlan la dinámica de movimiento de los fluidos [1]. Esto tiene implicaciones importantes para la termorregulación y el rendimiento deportivo. Se han observado disminuciones significativas en el rendimiento con niveles de hipohidratación de sólo 2% [3]. Dado que una sensación de sed puede no desarrollarse hasta que se ha alcanzado este nivel de hipohidratación, esfundamental para los atletas rehidratarse antes de sentir la necesidad de beber.
Algunas bebidas deportivas se comercializan con la idea de que son un modo más eficaz que el agua sola para promover la rehidratación y mantener el rendimiento deportivo. Sin embargo, hay pocas investigaciones disponibles que apoyen la eficacia de estas bebidas durante el ejercicio de resistencia de duración relativamente corta (<2 h). El agua sería tan eficaz como cualquier bebida deportiva durante el ejercicio para mantener el rendimiento y la termorregulación [4]. Notablemente, adelantos recientes en los suplementos deportivos sugieren que el uso de ciertos osmolitos orgánicos como la betaína glicina puede proporcionar cierta protección al volumen de fluido intracelular[5]; sin embargo, su capacidad para afectar el rendimiento no está clara.
Las investigaciones recientes demuestran que ciertos aminoácidos también pueden promover la rehidratación, reforzando la absorción de agua y electrólitos [6]. Se ha informado que la glutamina aumentaría la absorción de electrólitos y de agua en animales y humanos que padecen infecciones intestinales [7-9], pero no en otros casos [10]. Sin embargo, las diferencias pueden estar relacionadas a aspectos de estabilidad relacionados con la glutamina. Fürst [11] sugirió que los derivados de la glutamina como la alanil glutamina pueden ser más estables que la glutamina sola, sobre todo en pH bajos. Éste podría ser un escenario potencial durante el ejercicio, donde es común el aumento en el ácido láctico. Lima y colegas [6] informaron que la alanina y la glutamina juntas son más estables que la glutamina sola para aumentar la absorción de electrólitos y agua, probablemente a través de un aumento en los transportadores de iones dentro del epitelio intestinal.
Se ha observado que, tanto la glutamina como la combinación alanina/glutamina, son eficaces para la defensa antioxidante durante las situaciones de enfermedad severa [12-14]. Además, se ha demostrado que la glutamina es un modulador efectivo de la respuesta inmune frente al ejercicio [15] y posiblemente mejore el rendimiento deportivo [16]. Sin embargo, hay una considerable discusión, en este área [17] que justifica investigaciones adicionales. Por lo tanto, el propósito de este trabajo fue estudiar la eficacia de dos dosis diferentes (0,2 g.kg-1 y 0,05 g.kg-1) del dipéptido L-Alanil-L-Glutamina sobre el rendimiento, la recuperación y la respuesta de regulación de fluidos durante un protocolo de ejercicios de resistencia exhaustivo luego de un estrés por deshidratación de 2,5%. Además, se analizó el efecto de este dipéptido L-Alanil-L-Glutamina sobre los marcadores endocrinos y bioquímicos de inflamación, de estrés oxidativo y de respuesta inmune durante el ejercicio y durante el estrés por deshidratación.
METODOS
Sujetos
Diez varones de edad universitaria (20,8 ± 0,6 años; 176,8 ± 7,2 centímetros; 77,4 ± 10,5 kg; 12,3 ± 4,6% grasa corporal) participaron voluntariamente en este estudio. Antes de participar, todos los sujetos fueron informados sobre todos los procedimientos, riesgos y beneficios, y dieron su consentimiento informado por escrito aprobado por el Comité de Revisión Institucional. Los sujetos interrumpieron el consumo de otros suplementos nutricionales durante por lo menos cuatro semanas antes del estudio. El análisis del consumo de suplementos fue realizado a través de un cuestionario de historia de salud completada durante la etapa de reclutamiento de los sujetos.
Protocolo
Antes de comenzar el estudio, los sujetos acudieron al Laboratorio de Rendimiento Humano (HPL) para la determinación de la masa corporal inicial. Estas mediciones se obtuvieron en días no consecutivos aproximadamente una semana antes del comienzo de la evaluación experimental. Durante estas visitas los sujetos fueron pesados en un estado post-absorptivo, de euhidratación para establecer el peso corporal inicial. Luego de arribar al laboratorio, los sujetos orinaron de modo de vaciar completamente la vejiga para efectuar las mediciones de osmolalidad de orina (UOsm) por disminución de punto de congelación (Model 3320; Micro-Sample Osmometer, Advanced Instruments, Inc., Norwood, MA) y de la densidad relativa de la orina (Usg) por refractometría (A300CL-E01, Atago, Tokio, Japón) para documentar la euhidratación en todos los días preliminares; Usg ≤1,020 fue definida como euhidratación [18]. Durante la primera sesión (Tl) los sujetos realizaron una prueba de esfuerzo progresiva de capacidad aeróbica (VO2max) en una bicicleta ergométrica con freno electromagnético(Ergo 800, SensorMedics, Inc., Yorba Linda, CA). El test de VO2max fue realizado para establecer las cargas de trabajo para las pruebas de resistencia subsiguientes. Se determinaron el consumo de oxígeno (VO2), la tasa de intercambio respiratorio (RER) y la ventilación por minuto (VE) (ULTIMA, MedGraphics Corporation, St. Paul, MN). Los analizadores de gases fueron calibrados utilizando gases proporcionados por la Corporación MedGraphics: 1) Gas de calibración: 5% CO2, 12% O2,N2 de equilibrio; y 2) gas de referencia: 21% O2, N2 de equilibrio. La calibración con los gases se realizó antes de cada prueba. La frecuencia cardíaca (HR) se midió mediante telemetría (Pacer, Polar CIC, Inc., Port Washington, NY).
En cuatro visitas subsecuentes (T2-T5) al HPL, los sujetos se deshidrataron aprox. 2,5% de masa corporal inicial. En la ocasión en que no se empleó un protocolo de deshidratación, los sujetos acudieron al HPL en estado de euhidratación para que se les realizara la extracción de la muestra de sangre en el inicio y realizaron el protocolo de ejercicio. Esta determinación (Tl) aportó los datos de rendimiento iniciales (línea de base) en condiciones óptimas sin estrés de hidratación. Todas las comparaciones de rendimiento se hicieron con respecto a este tratamiento. En otro tratamiento (T2) los sujetos alcanzaron su peso fijado y descansaron en una posición reclinada durante 45 minutos antes de comenzar la sesión de ejercicios. En los tres tratamientos subsiguientes los sujetos alcanzaron su peso fijado y luego se rehidrataronaprox. 1,5% de su masa corporal inicial bebiendo agua (T3) o dos dosis diferentes (T4 y T5) del suplemento alanina-glutamina (AG) (0,05 g.kg-1 y 0,2 g.kg-1, respectivamente). Durante las pruebas de hidratación (T3 - T5), el protocolo de ejercicios comenzó después de 45 minutos de la rehidratación. El orden de los tratamientos fue establecido al azar.
Protocolo de Deshidratación
En la tarde antes de las pruebas (17:00 hrs) los sujetos arribaron a HPL para que se les realizara la medición del peso y Usg para verificar la euhidratación. Se solicitó a los sujetos que no consumieran comida o bebidas hasta el próximo día cuando arribaran nuevamente al HPL (07:00 hrs). Esto produjo uncambio medio de la masa corporal de -1,03±1,3%. En la mañana de las evaluaciones T2-T5 los sujetos arribaron HPL, luego fueron pesados y posteriormente comenzaron con el protocolo de deshidratación activa para lograr la pérdida de peso deseada. El protocolo de deshidratación activa consistió en caminar en una cinta rodante con motor a 3,4 millas.h-1 con una pendiente de 2%. Los sujetos tenían el cuerpo totalmente cubierto con un traje de entrenamiento (pesados pantalones de entrenamiento largos de lanilla y algodón y top). En incrementos de 20 minutos se efectuó el control del peso corporal con los sujetos desnudos y la determinación de HR y el índice de esfuerzo percibido. Los sujetos continuaron caminando hasta que (a) perdían 2,5% de su masa corporal, (b) alcanzaban el criterio de seguridad establecido previamente, (c) mostraban señales o síntomas de enfermedad térmica inducida por el ejercicio, o (d) alcanzaban la fatiga volitiva. La deshidratación se verificó vía Usg, UOsm y osmolalidad plasmática (POSM). El tiempo total de ejercicio hasta alcanzar la hipohidratación (-2,5% pérdida de peso) fue 62,5±44,2 min. No se observaron diferencias significativas entre los tratamientos, en el tiempo necesario para alcanzar la masa corporal establecida.
Administración del Suplemento
Los sujetos se rehidrataron hasta ~1,5% de masa corporal consumiendo el suplemento o el placebo (agua) después del protocolo de deshidratación. El suplemento de L-alanil-L-glutamina (0,2 g.kg-1 o 0,05 g.kg-1 de masa corporal por litro) comercializado como "Sustamine" " (Kyowa Hakko EE.UU., Nueva York, NY) se mezclaba con agua y era indistinguible del placebo en apariencia y sabor.
Prueba de Tiempo hasta el Agotamiento
Después de las fases de deshidratación y rehidratación, los sujetos comenzaron el protocolo de ejercicios. Los sujetos realizaron los ejercicios en una bicicleta ergométrica con una carga de trabajo que permitió alcanzar el 75% de VO2max. Se brindó estímulo a los sujetos para que dieran su mejor esfuerza durante cada prueba y se los estimuló verbalmente a lo largo de cada prueba de ejercicio. Fueron medidos en forma continua el VO2, VE, RER y HR. La HR y presión arterial (BP) fueron registradas antes del ejercicio y al finalizar el mismo. El tiempo hasta el agotamiento se determinó como el tiempo que el sujeto ya no podía mantener el trabajo y/o alcanzaba el agotamiento volitivo.
Medición de los Parámetros Sanguíneos
Durante el tratamiento T1 se realizó la extracción de sangre inicial (BL). No se tomó ninguna otra muestra de sangre durante esa prueba. La muestra de sangre BL se tomó luego de un período de recuperación de15 min antes del ejercicio. Todas las muestras de sangre obtenidas en los tratamientos (DHY, RHY e IP) fueron obtenidas con una cánula de teflón de 20 gauge colocada en una vena superficial del antebrazo utilizando una llave de 3-vías con un adaptador de cerradura del luer macho. La cánula se mantuvo abierta por medio de una solución salina isotónica (con 10% de heparina). En los tratamientos T2-T5 las extracciones de sangre se realizaron una vez que se alcanzaba la masa corporal establecida (DHY), inmediatamente antes del estrés físico (RHY) e inmediatamente después el protocolo de ejercicios (IP). Las muestras de sangre de IP fueron tomadas dentro de los 15 segundos de finalización del ejercicio. Los sujetos regresaron al laboratorio 24 hs luego del ejercicio para que se les realizara una extracción de sangre adicional (24P). Todas las muestras de sangre BL y 24P fueron tomadas mediante una jeringa plástica mientras los sujetos permanecían sentados. Las muestras de sangre fueron obtenidas del brazo de una vena antecubital utilizando una aguja descartable de 20 gauge equipada con un tubo recolector Vacutainer8 (Becton Dickinson, Franklin Lakes, NJ) con el sujeto sentado. Las muestras de sangre de cada sujeto se obtuvieron en el mismo momento del día en cada sesión. Las muestras de sangre fueron colocadas en tubos libres o tratados con EDTA (Vacutainer, Becton Dickinson, Franklin Lakes, NJ). Las muestras de sangre fueron analizadas por triplicado para el hematocrito a través de la técnica de microcapilaridad y para la hemoglobina mediante el método de la cianometahemoglobina (Sigma,Diagnostics, St. Louis, MO). La sangre completa restante fue centrifugada durante 15 min a 1500g a 4°C. El plasma y suero resultante fueron divididos en alícuotas y fueron almacenados a -80°C hasta el análisis. Las muestras fueron descongeladas solo una vez.
Análisis Bioquímico y de las Hormonas
Las concentraciones de testosterona (TEST), cortisol (CORT) y hormona de crecimiento (GH) en el suero fueron determinadas mediante enzimoinmunoanálisis (EIA) y ensayo de inmunoabsorción ligado a enzimas (ELISA) (Diagnostic Systems Laboratory, Webster, TX). Las concentraciones séricas de aldosterona (ALD) e IL-6 fueron determinadas mediante un test de EIA (ALPCO Diagnostics, Salem, NH). Las concentraciones plasmáticas de arginina vasopresina (AVP) fueron determinados mediante un test de EIA (Cayman Chemical Co, Ann Arbor, MI). Las concentraciones plasmáticas de la hormona adrenocorticotrofina(ACTH, ALPCO Diagnóstics, Salem, NH), proteína C-reactiva (CRP, Diagnostic Systems Laboratory, Webster, TX) y malondialdehido (MDA, Cell Biolabs Inc.,San Diego, CA) fueron analizadas por duplicado a través de ELISA. La determinación de los valores de inmunoreactividad sérica fue realizada con un espectrofotómetro SpectraMax340 (Molecular Devices, Sunnyvale, CA). Las concentraciones de creatinquinasa en el suero (CK) fueron determinadas espectrofotómetricamente a 340 nm (Pointe Scientific, Inc, Cantón, MI). Las concentraciones plasmáticas de glutamina, glucosa y lactato (La) fueron determinadas por duplicado con un analizador automatizado (Analox GM7 analizador enzimático de metabolitos, Analox Instruments EE.UU., Lunenburg, MA). Las concentraciones plasmáticas de sodio y potasio fueron establecidas mediante electrodos ion-selectivos (EasyElectrolyte, Medica, Bedford, MA). Para eliminar la variación entre ensayo, todas las muestras fueron analizadas en la misma tanda de análisis. La variación intra-ensayo para todos los ensayos fue <10%. Los cambios en el volumen de plasma luego del entrenamiento fueron calculados mediante la fórmula de Dill & Costill [19].
Análisis Estadístico
Se evaluó y comprobó el cumplimiento de los supuestos de distribución normal, homogeneidad de varianza e independencia de la muestra para todos los datos. El análisis estadístico de rendimiento, cambios hormonales y bioquímicos fue realizado usando un análisis de de la varianza de mediciones repetidas (ANOVA). En aquellos casos donde se encontrara un valor de F significativo se aplicó el test post hoc de LSD para comparaciones pareadas. Antes de realizar el ANOVA, los cambios en el volumen de plasma, comparaciones de rendimiento y área debajo de la curva (AUC) calculada a través de la técnica trapezoidal estándar, fueron analizados mediante un ANOVA de una sola vía. La significancia se fijó en un nivel de alfa de p <0,05. Todos los datos se informan como Media ± SD.
RESULTADOS
Los valores de Usg (1,026 ± 0,004), UOsm (813 ± 299 mOsm) y POSM (297,0 ± 4,6 mOsm) fueron similares para todos los tratamientos en DHY. Estos resultados reflejaron el ayuno durante la noche y la deshidratación inducida por el ejercicio realizado antes de cada prueba. Las concentraciones plasmáticas de glutamina fueron significativamente más altas para todos los grupos en RHY e IP en comparación con BL (p = 0,002 y p = 0,000, respectivamente) y DHY (p = 0,001 y p = 0,000, respectivamente) (Figura 1). La concentración de glutamina en el tratamiento T5 fue significativamente más alta en RHY e IP que la de los tratamientos T2-T4. El análisis del área bajo de la curva (AUC) mostró una concentración de glutamina significativamente mayor para el tratamiento T5 en todos los puntos de tiempo en comparación con los otros tratamientos experimentales (Figura 2).
Figura 1. Concentraciones plasmáticas de glutamina. Se observó un efecto principal significativo de los tratamientos entre los tratamientos T2 y T5. # = efecto significativo para el tiempo entre BL y DHY; a = presenta diferencias significativas con T2, T3 y T4.
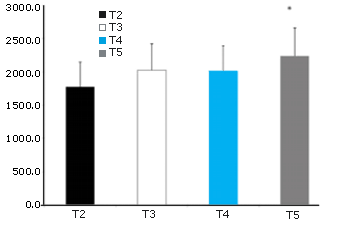
Figura 2. AUC de la Glutamina. * = Presenta diferencias significativas con T2.
El tiempo hasta el agotamiento se redujo de modo más significativo durante T2 que en cualquier otro tratamiento experimental (ver Figura 3). Al examinar los cambios en el rendimiento (Δ) (la diferencia entre cada tratamiento experimental y Tl), el tiempo hasta el agotamiento fue significativamente mayor durante T4 (130,2 ± 340,2 seg.) y T5 (157,4 ± 263,1 seg.) en comparación con T2 (455,6 ± 245,0 seg., p = 0,05 y p = 0,01, respectivamente) (Figura 4). No se observaron otras diferencias entre los tratamientos. En la Tabla 1 se muestran los cambios cardiovasculares durante el ejercicio. No se observaron diferencias significativas entre los tratamientos ni en la HR en reposo ni en la HR post-ejercicio. Además, no se observaron diferencias de la presión sanguínea (BP) en reposo entre los tratamientos, sin embargo, la BP sistólica post-ejercicio fue significativamente menor en T2 y T3 en comparación con Tl. No se observó ninguna otra diferencia en la respuesta de BP sistólica o diastólica entre los tratamientos. No se observaron cambios en RER ocurrido entre los tratamientos.

Figura 3. Tiempo hasta el agotamiento. * Presenta diferencias significativas con otros tratamientos.
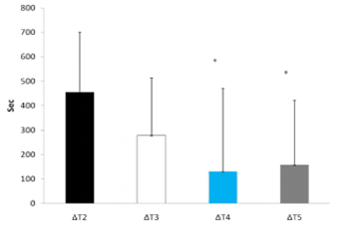
Figura 4. Variación (Δ) en el tiempo hasta el agotamiento. * = Presenta diferencias significativas con ΔT2.

Tabla 1. Cambios cardiovasculares durante el protocolo de ejercicios. IP = inmediatamente después; SBP = presión sanguínea sistólica; DBP = presión sanguínea diastólica. * = se observan diferencias significativas con T1. Todos los datos se presentan en forma de Media±DS.
Se observaron efectos principales significativos en las respuestas al protocolo de ejercicio tanto en el La- (p = 0,000) como en la GLU (p = 0,000) (Tabla 2). También se observaron aumentos significativos enIP en estas dos variables en comparación con todos los otros puntos de tiempo. Sin embargo no se observó ninguna diferencia significativa entre los tratamientos. En la osmolalidad del plasma también se observó un efecto principal del tiempo (p = 0,011). POSM en IP (300,4±16,7 mOsm) fue significativamente mayor comparado conBL (295,0±3,9 mOsm, p=0,010) y RHY (293,9±4,9 mOsm, p=0,002) pero, no con DHY (297,0 ± 4,5 mOsm, p=0,100). No se observó ninguna otra diferencia significativa. Además, tampoco se observaron diferencias en POSM entre los tratamientos. Un efecto principal significativo del tiempo (p = 0,001) también se observó en las concentraciones plasmáticas de potasio. El potasio del plasma era significativamente mayor en IP en comparación con BL (p = 000), DHY (p = 0,000) y RHY (p = 0,017). No se observaron otras diferencias y tampoco se observaron efectos entre los tratamientos. En el caso de la concentración plasmática de sodio también se observó un efecto principal significativo en el tiempo (p = 0,000). Las concentraciones plasmáticas de sodio en IP y DHY fueron significativamente mayores que las observadas en BL (p=0,000 y p=0,000, respectivamente) y RHY (p=0,000 y p=0,000, respectivamente). Si se analizan en función del tiempo,las concentraciones plasmáticas de sodio fueron significativamente mayores en T2 que en todas las otras condiciones experimentales. Las concentraciones plasmáticas de sodio también fueron significativamente mayores en T2 que en todos los otros tratamientos experimentales en RHY (p = 0,000) e IP (p=0,000). El análisis del AUC también demostró una concentración de sodio significativamente mayor en T2 que en los otros tratamientos.

Tabla 2. Respuestas del lactato, glucosa, osmolalidad y electrolitos del plasma frente al ejercicio. * = Efecto principal significativo en comparación con todos los otros puntos de tiempo. # = Efecto principal significativo comparado con BL y RHY. @ = presenta diferencias significativas con T3-T5. BL = línea de base; DHY = deshidratación; RHY = rehidratación; IP = inmediatamente post-ejercicio.
La respuesta de ALD en los tratamientos experimentales se presenta en Figura 5. Se observó un efecto principal significativo del tiempo (p=0,013). Las concentraciónes de ALD en RHY e IP fueron significativamente menores que en BL y DHY (Figura 5). No se observó ninguna otra diferencia significativa y tampoco se observó otra interacción significativa. Las respuestas de AVP en el plasma se observan en la Figura 6. También se observó un efecto principal significativo del tiempo (p = 0,000). AVP era significativamente mayor en DHY (p = 0,000), RHY (p = 0,000) e IP (p = 0,000) en comparación con los valores encontrados en BL. Además, las concentraciones de AVP en DHY fueron significativamente más altas (p = 0,05) que en IP en todos los tratamientos. No se observó ninguna diferencia significativa entre los tratamientos y ninguna interacción significativa entre tiempo y tratamiento.

Figura 5. Valores de la respuesta de la aldosterona sérica. # = se observó un efecto principal significativo del tiempo entre BL y DHY.

Figura 6. Arginina Vasopresina. # = se observó un efecto principal significativo del tiempo en BL versus DHY, RHY e IP. * = Se observó un efecto principal significativo entre DHY e IP.
No se observaron diferencias significativas entre los tratamientos en las respuestas de CRP, IL-6 yMDA frente al ejercicio y al estrés por deshidratación (Figura 7, 8 y 9, respectivamente). Se observó un efecto principal significativo en el tiempo tanto para CRP (p = 0,000) como para MDA (p = 0,000). Las concentraciones determinadas en la línea de base (BL) de estas dos variables fueron significativamente más bajas que en todos los otros puntos de tiempo. Se observó un efecto principal significativo de las pruebas para MDA entre T3 y T5 vs. T2 (p = 0,004 y p = 0,008, respectivamente) y T4 (p = 0,05 y p = 0,011, respectivamente). La evaluación de la respuesta de la IL-6 reveló un efecto principal significativo en el tiempo (p=0,000). Las concentraciones de IL-6 fueron significativamente mas altas en IP que en BL (p=0,000), DHY (p = 0,000), e 24P (p=0,000). Además las concentraciones de IL-6 en RHY eran significativamente más altas que en BL (p = 0,000) y en 24P (p = 0,006). El análisis del área bajo de la curva (AUC) para CRP, IL-6 y MDA no reveló ninguna diferencia significativa entre los tratamientos.

Figura 7. Respuesta de la Proteína C Reactiva. * = se observó un efecto principal significativo del tiempo BL.
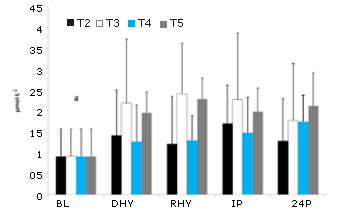
Figura 8. Respuesta de IL-6. # = efecto principal significativo para el tiempo entre BL, DHY y 24P; * efecto principal significativo del tiempo entre BL y 24P.
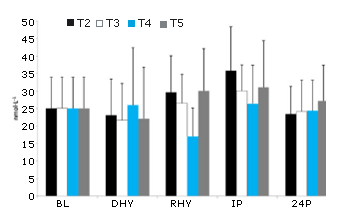
Figura 9. Respuesta del MDA. # = efecto principal significativo del tiempo entre DHY, RHY, IP, y 24P; Se observó un efecto principal significativo del tratamiento entre T3 y T5 versus T2 y T4.
No se observaron diferencias significativas en el inicio (BL) en la respuesta de la testosterona frente al ejercicio y al estrés por deshidratación en ningún tratamiento experimental (Figura 10). Se observó un efecto principal significativo del tiempo en la respuesta tanto de la ACTH (p = 0,000) como en cortisol (p = 0,000) frente al protocolo de ejercicio y de deshidratación (Figura 11 y 12, respectivamente). Cuando se efectúa la comparación entre tratamientos, se observaron aumentos significativos en las concentraciones de cortisol y de ACTH en IP y 24P en comparación con lo determinado en BL, DHY y RHY. No se observaron otras diferencias significativas y tampoco se observaron efectos entre los tratamientos. Se observó un efecto principal significativo en el tiempo (p = 0,000) en la respuesta de la hormona de crecimiento. Al comparar entre tratamientos, las concentraciones de la hormona de crecimiento eran significativamente más altas en IP que en todos los otros puntos de tiempo (Figura 13). No se observaron otras diferencias. El análisis del área debajo de la curva (AUC) para testosterona, ACTH, cortisol y hormona de crecimiento no arrojó ninguna diferencia significativa entre los tratamientos. No se observaron diferencias significativas en las concentraciones de creatinquinasa con respecto a las obtenidas en la línea de base (43,9 ± 18,7 IU) durante ningún tratamiento.
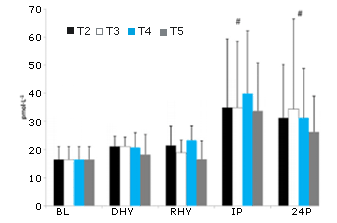
Figura 10. Respuestas de la testosterona.

Figura 11. Respuesta de la ACTH. # = se observa un efecto principal significativo para el tiempo entre BL, DHY y RHY.

Figura 12. Respuesta del Cortisol. # = se observa un efecto principal significativo para el tiempo entre BL, DHY y RHY.

Figura 13. Respuesta de la Hormona de Crecimiento. # = se observa un efecto principal significativo para el tiempo entre BL, DHY RHY y 24P.
Los volúmenes plasmáticos disminuyeron -5,45 ± 11,38% en DHY en todos los tratamientos experimentales, en RHY disminuyeron (-6,78±11,27%) en todos los tratamientos experimentales y continuaron disminuyendo en IP (-21,44 ± 10,54%). Sin embargo, las diferencias entre los tratamientos no fueron significativas. Las variables sobre parámetros sanguíneos no fueron corregidas según los cambios en el volumen plasmático, debido a la importancia de exposición molar a nivel del receptor de los tejidos.
DISCUSION
Los resultados de este estudio demostraron que cuando los sujetos tenían una hipohidratación de 2,5% de su masa corporal y realizaban ejercicios hasta el agotamiento, se producían disminuciones de rendimiento significativas. Sin embargo, cuando los sujetos ingerían el suplemento AG durante el período de rehidratación (T4 y T5), la magnitud de la disminución del rendimiento era significativamente menor en comparación con la condición de deshidratación (T2). El agua sola (T3) no pareció reducir significativamente la disminución en el rendimiento. A pesar de losaumentos significativos en el rendimiento en T4 y T5, las concentraciones de glutamina estabanelevadas de manera significativa sólo en el tratamiento T5 tanto en RHY como en IP, en comparación con los otros tratamientos. Como era de esperar, la dosis más alta de AG provocó un mayor aumento en las concentraciones plasmáticas de glutamina. La evolución en el tiempo de la aparición de la glutamina en el plasma es similar a la informada por Klassen y colegas [20]. En dicho estudio, un consumo por vía oral de 20 g (similar a la dosis alta [T5] utilizada en este estudio) produjo un aumento máximo que se observó a los 49±8 min (rango 30-120 min) luego de la ingesta de la dosis, lo que equivalía a las extracciones desangre efectuadas en RHY e IP. Aunque los patrones de dosis de 0,1 g.kg.BM-1 pueden aumentar la concentración plasmática de glutamina aproximadamente en un 50% [21], la capacidad para aumentar las concentraciones plasmáticas de glutamina con dosis menores que 0,1 g.kg.BM-1 no está clara. Sobre la base de los resultados presentes una dosis de 0,05 g.kg.BM-1 de AG no produjo un aumento significativo en las concentraciones plasmáticas de glutamina.
A pesar de la ausencia de cualquier aumento significativo en las concentraciones plasmáticas de glutamina en T4, se observaron aumentos significativos en el rendimiento en T4 y T5. Es posible que en aquellos casos dónde las concentraciones plasmáticas son normales, una muestra de un pequeño bolus sea suficiente para compensar las perturbaciones moderadas en la hidratación. El dipéptido de AG tiene un papel importante en la captación de fluidos y electrólitos en el intestino. AG aumentaría la captación de electrólitos y fluidos por parte del intestino por medio del aumento en el transporte iónico a través de una vía de señalización mejorada en las células de la mucosa intestinal [6, 22]. Más aún, también se ha demostrado que la suplementación con AG aumenta el consumo de glutamina por parte de los músculos [23]. Aunque es especulativo, es probable que un mayor consumo de glutamina por parte del músculo esquelético también provoque un mayor consumo de sodio, lo que estaría apoyado por las menores concentraciones de sodio en T4-T5 en comparación con T2. El mayor consumo de sodio por parte del músculo esquelético podría haber contribuido a una reducción en la fatiga, a través del mantenimiento de la fuerza y de la eficiencia de la contractilidad muscular [24]. Además, aunque las concentraciones plasmáticas de glucosa no fueron diferentes entre los tratamientos, la alanina es un sustrato de la gluconeogénesis y podría haber contribuido al retraso de la fatiga, a través del ahorro del glucógeno muscular [25, 26].
Las respuestas de ALD fueron significativamente menores en RHY e IP para todos los tratamientos, y no se observaron diferencias entre los tratamientos. Si bien se ha informado que la ALD responde de manera graduada frente a los niveles de hipohidratación [27, 28], la magnitud de la hipohidratación en este estudio, probablemente no fue suficiente para estimular una mayor producción de ALD y la rehidratación probablemente provocó una disminución significativa de ALD a lo largo de los tratamientos en RHY e IP. Estos resultados coinciden con la observación de que las concentraciones de ALD disminuirán cuando se provea agua o bebidas con electrolitos durante el ejercicio [29]. La similitud en la respuesta de ALD encontrada en este estudio también puede ser atribuida a cambios similares en el volumen plasmático observados entre los tratamientos [29]. Además, la ALD también es estimulada por cambios en la presión sanguínea (BP) [30]. En este estudio, la BP era significativamente menor en IP en los tratamientos T2 y T3 en comparación con Tl. Esto probablemente refleja una mayor fatiga local ocasionada por la perturbación de la hidratación, lo que contribuyó con un menor tiempo hasta el agotamiento comparado con T4 y T5 (se encontró una diferencia de 20 mmHg aproximadamente [p> 0,05] en la BP sistólica post-ejercicio en T2, T3 en comparación con T4 y T5). Las respuestas de ALD significativamente menores observadas en RHY e IP en todos los tratamientos, probablemente reflejan la falta de un único estímulo fuerte (e. g. nivel de hipohidratación) y representan los numerosos factores fisiológicos que influyen en la secreción de ALD.
Nuestros resultados también indicaron que AVP estaba significativamente elevada con respecto a BL en todos los puntos de tiempo y también, que las concentraciones de AVP en IP eran significativamente mayores que las de DHY. Sin embargo, el suplemento con AG no logró alterar la respuesta de AVP frente a este protocolo de deshidratación moderada y de ejercicios. La respuesta al protocolo de ejercicios fue similar a la obtenida en estudios anteriores, en lo que se analizó una intensidad de ejercicio similar [28]. Los cambios en las concentraciones de AVP dependen de la intensidad del ejercicio, de cambios en POSM y en el volumen de sangre [31, 32]; por lo tanto no nos sorprende no haber encontrado ninguna diferencia significativa entre los tratamientos en la respuesta de AVP considerando que no se observaron diferencias entre los tratamientos en POSM o cambios en el volumen plasmático. La deshidratación moderada y el protocolo de ejercicios no lograron provocar ninguna diferencia en la respuesta de regulación de fluidos entre los diferentes tratamientos. Estudios previos que analizaron el efecto de niveles de hipohidratación han evaluado de manera característica déficits de agua corporal de mayor magnitud (-5%) y mayores que las utilizadas en el presente estudio [28, 29].
Frecuentemente, CRP se utiliza como marcador de inflamación y daño muscular [33-35]. Estudios previos han demostrado que CRP aumenta en respuesta a la actividad física prolongada, como es el caso de triatlones [35] y maratones [33], pero no durante los ejercicios de duración más corta [34,36]. Es probable que la duración relativamente corta del tiempo hasta el agotamiento, a pesar del agregado de estrés por deshidratación moderada, no provoque una respuesta inflamatoria significativa. Muchos estudios usan la CK como un marcador de daño muscular y han sugerido que una fase aguda rápida de respuesta inflamatoria (reflejada por un aumento en CRP dentro de las 24 hs post-ejercicio durante el ejercicio excéntrico en individuos desentrenados) puede iniciar el dolor muscular de aparición retardada y la necrosis tisular adicional, que se produce 24 hs post-ejercicio, se refleja en el aumento en CK [37]. Aunque las concentraciones de CRP observadas en este estudio eran significativamente mayores con respecto a los niveles de la línea de base, no se observaron diferencias entre DHY, RHY, IP y 24P lo que sugiere que cualquier cambio podría haber sido producido por variaciones en el volumen plasmático y no por una respuesta inflamatoria. Esto se sustenta por la respuesta de CK en cada tratamiento (ningún cambio con respecto a las concentraciones obtenidas al inicio en la línea de base). Notablemente, el suplemento de AG fue incapaz de proporcionar algún indicio de una atenuación de la respuesta inflamatoria o de daño muscular frente al protocolo de ejercicio. Esto probablemente se deba a la limitada respuesta inflamatoria y a la falta de un indicador claro de daño muscular medido a través de CK.
Se observó un aumento significativo en las concentraciones séricas de IL-6 en IP en comparación con las determinadas en BL, DHY y 24P y en RHY en comparación con BL y 24P. Esta respuesta coincide con lo encontrado en estudios anteriores que demostraron aumentos significativos luego de ejercicios de resistencia [33, 35, 38] y excéntricos [34] prolongados. IL-6 se produce en el tejido esquelético activo [39] y en el sistema nervioso central [40]. El ejercicio es un potente estimulador de la producción de IL-6, y se han informado aumentos mayores a 100 veces [41]. Se piensa que los aumentos en IL-6 modulan la producción de CRP en el hígado [42] y operan de manera sinérgica para aumentar la respuesta inflamatoria frente al ejercicio. El resultado potencial de esta respuesta inflamatoria es el riesgo de daño tisular significativo y de una menor capacidad de recuperación.
Diferentes investigaciones han analizado la capacidad de la intervención nutricional para atenuar la respuesta inflamatoria post-ejercicio [43, 44]. La ingestión de carbohidratos [44] y una combinación de vitamina E y ácidos grasos omega 3 [43] ha sido exitosa para atenuar la respuesta de IL-6 frente al ejercicio. Por el contrario, se ha demostrado que la suplementación con glutamina aumenta la producción de IL-6 plasmática [38], mientras que se ha demostrado que el dipépido de AG no tiene efecto sobre la producción de citoquinas en individuos saludables [45]. Hiscock y colegas [38] sugirieron que el mayor consumo de glutamina por parte del músculo esquelético aumentaría o mantendría la producción de IL-6. Esta hipótesis puede ser más consistente con el rol antiinflamatorio que se ha sugerido para la IL-6 durante el ejercicio [46]. Se han informado consistentemente aumentos en las concentraciones de IL-6 sin el daño muscular correspondiente [46], y esto se confirma con los resultados del estudio presente. La diferencia entre este estudio y los resultados de Hiscock et al, [38] puede estar relacionada con la duración del ejercicio y la experiencia de entrenamiento de los sujetos. En el presente estudio la duración del ejercicio iba de 5 a 47 minutos aprox. 60 minutos después del protocolo de deshidratación activo, en sujetos entrenados recreacionalmente, mientras que los sujetos en el estudio de Hiscock no estaban entrenados y se les solicitó realizar una prueba contrarreloj de 2-hr utilizando la misma intensidad de ejercicio que utilizamos en este estudio. Sin embargo, esos sujetos estaban euhidratados y se les permitió beber cuanto desearan. Es improbable que la dosificación haya afectado estos resultados, por que la dosis de glutamina utilizada en el estudio de Hiscock (3,5 g) era similar a la del tratamiento con la dosis más baja (T4).
Las concentraciones de MDA fueron significativamente mayores que las encontradas en la línea de base en todos los tratamientos. Esto no es sorprendente ya que el ejercicio es un potente estimulador de la formación de las especies reactivas del oxígeno [47]. Los resultados de este estudio también son consistentes con investigaciones previas que demostraron un elevado estrés oxidativo luego de un protocolo con deshidratación moderada y ejercicio hasta el agotamiento [48]. Sin embargo, en contraste con lo observado por Paik y colegas [48] la rehidratación con agua, o agua y suplemento, fue incapaz de reducir la respuesta de MDA frente al protocolo de ejercicios. Es probable que las diferencias entre estos dos estudios reflejen los métodos utilizados para lograr la deshidratación. Paik et al., [48] utilizaron medios pasivos en condiciones de calor (exposición al sauna) para alcanzar una hipohidratación de 3% , mientras que en el presente estudio se utilizó un protocolo de deshidratación tanto pasivo como activo (ejercicio) para lograr una pérdida de peso corporal de 2,5%. Si bien es especulativo, es posible que las diferencias entre los métodos usados para la deshidratación puedan haber producido diferentes niveles de estrés oxidativo. El tiempo transcurrido para alcanzar la pérdida de peso corporal, aunque haya sido transcurrido realizando un ejercicio de baja intensidad, podría provocar aumentos significativos en las concentraciones de MDA, que no hayan sido alteradas por el agua o el agua y AG.
La respuesta anabólica y catabólica al protocolo de estudio, fue similar entre los tratamientos, lo que sugiere que el suplemento fue incapaz de proporcionar algún beneficio significativo en referencia a la mejora en la recuperación del ejercicio y estrés por hipohidratación. También es posible que estas mediciones hormonales no hayan sido lo suficientemente sensibles para evaluar la recuperación de una deshidratación moderada y protocolo de ejercicios de resistencia [49]. La concentración de testosterona (TEST) no aumentó significativamente con respecto a los niveles de la línea de base, luego del ejercicio a pesar de la reducción que se produjo en el volumen plasmático. Esto no es sorprendente ya que los sujetos experimentaronsólo un moderado estrés por hipohidratación y que el tiempo hasta el agotamiento era de 13-18 minutos. El ejercicio de duración relativamente corta (es decir 10-20 minutos) no parece aumentar la concentración de testosterona (TEST) [50, 51], incluso con una perturbación moderada en la hidratación en los individuos con buena aptitud física [52].
La respuesta del cortisol (CORT) fue consistente con la obtenida en estudios previos que demostraron que los niveles de hidratación no tienen influencia en la concentración de CORT [52, 53]. El aumento post-ejercicio en los niveles de CORT también fue consistente con el estrés metabólico asociado con niveles de ejercicio e hipohidratación moderados [53, 54]. Sin embargo los resultados de este estudio, no lograron demostrar que las respuestas de CORT pueden distinguir entre los niveles de hipohidratación, lo que contrasta con las observaciones hechas por Judelson et al., [55] y Maresh et al. [54]. Sin embargo, la capacidad de la hipohidratación de modificar la respuesta catabólica frente al ejercicio, parece ser más pertinente cuando la hipohidratación alcanza o es superior al 5%, o cuando el ejercicio se realiza en intensidades de ejercicio más altas [54, 55]. Estos resultados también sugieren que el eje pituitario-suprarrenal responde de manera similar a este ejercicio y a la perturbación de hipohidratación, ya que ACTH respondió de manera similar al CORT, sin ninguna influencia de la suplementación con AG.
Se ha demostrado que los patrones de secreción de GH son bastante sensibles a los cambios en el equilibrio ácido-base de músculo [56]. Aunque no se observó ninguna diferencia en la respuesta del La entre los tratamientos, la respuesta de GH frente al ejercicio y al estrés por hipohidratación parece ser normal. Estos resultados también concuerdan con los de Judelson et al., [55] pero, no coinciden con los de Peyreigne y colegas [57]. En este último estudio, se sugirió que un estrés por hidratación podía mitigar la respuesta de GH frente al ejercicio. Notablemente, se observó una respuesta de GH 18% y 20% mayor, (p> 0,05) en T3 y T4 versus T2, respectivamente, mientras que se observó una diferencia de 42% entre T5 y T2 (p>0,05). Aunque estas respuestas no eran significativamente diferentes, sugieren una tendencia interesante que proporciona cierto apoyo a los resultados previos [57]. No está claro si la ingestión de dosis altas de glutamina tuvo algún rol en esta respuesta. Las investigaciones previas han sugerido que las concentraciones de glutamina pueden elevar la respuesta de GH en reposo [58, 59], pero no durante el ejercicio [58]. Parecería que el estímulo más preciso para el rol de la glutamina en la estimulación de la liberación de GH se produce durante la enfermedad crítica prolongada cuando las concentraciones plasmáticas de glutamina están por debajo de los niveles normales [60]. Por lo tanto, la gran variabilidad en la respuesta de GH observada en este estudio, puede ser atribuida a las concentraciones de glutamina normales en reposo, sin embargo los mayores aumentos en GH ocurrieron durante el tratamiento (T5) donde las concentraciones de glutamina eran significativamente más altas que en T2 - T4.
En conclusión, los resultados de este estudio demuestran que la suplementación con AG proporciona un beneficio ergogénico significativo ya que aumenta el tiempo hasta el agotamiento durante un estrés hídrico moderado. Este efecto ergogénico probablemente fue mediado por una mayor incorporación de fluidos y electrólitos. Los suplementación con AG, independientemente de la dosis, no tiene influencia sobre las respuestas inmune, inflamatoria o de estrés oxidativo. Los resultados también indicaron que el suplemento de AG no tuvo influencias sobre el eje pituitario-suprarrenal-testicular durante este ejercicio y durante la perturbación por hipohidratación moderada
Agradecimientos
Este estudio fue subsidiado por Kyowa Hakko Bio Co., S.A.
Contribuciones de los Autores
JRH fue el investigador principal, obtuvo los subsidios para el proyecto, diseñó el estudio, dirigió el reclutamiento del estudio, análisis de los datos/muestras, los análisis estadísticos y la preparación del manuscrito. NAR, JK, SLR, NK, AMG, MS, SA, y ADF controlaron todos los aspectos de estudio entre los que se incluyeron el reclutamiento, análisis de los datos/muestras, y la preparación del manuscrito. BLB, LMY, LLH, BK y CMM fueron co-autores, y participaron en el análisis de los datos. Todos los autores leyeron y aprobaron el manuscrito final.
Intereses de Competencia
Kyowa Hakko EE.UU. (Nueva York, NY) aportó fondos a la Universidad de New Jersey para este proyecto. Todos los investigadores involucrados recolectaron, analizaron, e interpretaron los resultados de este estudio de manera independiente y no poseen intereses financieros sobre los resultados de esta investigación. La publicación de estos resultados no debe ser tomada como una recomendación del investigador, de la Universidad de New Jersey o del consejo del comité de redacción del Journal of International Society of Sports Nutrition
Referencias
1. Nose H, Morimoto T, Ogura K (1983). Distribution of water losses among fluid compartments of tissues under thermal dehydration in the rat. Jpn J Physiol, 33:1019-1029
2. Senay LC, Pivarnik JN (1985). Fluid shifts during exercise. Exerc Sport Sci Rev, 13:335-387
3. Hoffman JR, Stavsky H, Falk B (1995). The effect of water restriction on anaerobic power and vertical jumping height in basketball players. Int J Sports Med, 16:214-218
4. Carter JE, Gisolfi CV (1989). Fluid replacement during and after exercise in the heat. Med Sci Sports Exerc, 21:532-539
5. Armstrong LE, Casa DJ, Roti MW, Lee EC, Craig SA, Sutherland JW, Fiala KA, Maresh CM (2008). Influence of betaine consumption on strenuous running and sprinting in a hot environment. J Strength Cond Res, 22:851-860
6. Lima AA, Carvalho GH, Figueiredo AA, Gifoni AR, Soares AM, Silva EA, Guerrant RL (2002). Effects of an alanyl-glutamine-based oral rehydration and nutrition therapy solution on electrolyte and water absorption in a rat model of secretory diarrhea induced by cholera toxin. Nutrition, 18:458-462
7. Nath SK, Dechelotte P, Darmaun D, Gotteland M, Rongier M, Desjeux JF (1992). (15N) and (14C) glutamine fluxes across rabbit ileum in experimental diarrhea. Am J Physiol, 262:G312-G318
8. Silva AC, Santos-Neto MS, Soares AM, Fonteles MC, Guerrant RL, Lima AA (1998). Efficacy of a glutamine-based oral rehydration solution on the electrolyte and water absorption in a rabbit model of secretory diarrhea induced by cholera toxin. J Pediatr Gastroenterol Nutr, 26:513-519
9. van Loon FP, Banik AK, Nath SK, Patra FC, Wahed MA, Darmaun D, Desjeux JF, Mahalanabis D (1996). The effect of L-glutamine on salt and water absorption: a jejuna perfusion study in cholera in humans. Eur J Gastroenterol Hepatol, 8:443-448
10. Li Y, Xu B, Liu F, Tan L, Li J (2006). The effect of glutamine-supplemented total parenteral nutrition on nutrition and intestinal absorptive function in a rat model. Pediatr Surg Int, 22:508-513
11. Kumar HS, Anandan R (2007). Biochemical studies on the cardioprotective effect of glutamine on tissue antioxidant defense system in isoprenalineinduced myocardial infarction in rats. J Clin Biochem Nutr, 40:49-55
12. Castell LM, Newsholme EA (1998). Glutamine and the effects of exhaustive exercise upon the immune response. Can J Physiol Pharmacol, 76:524-532
13. Favano A, Santos-Silva PR, Nakano EY, Pedrinelli A, Hernandez AJ, Greve JM (2008). Peptide glutamine supplementation for tolerance of intermittent exercise in soccer players. Clinics, 63:27-32
14. Gleeson M (2008). Dosing and efficacy of glutamine supplementation in human exercise and sport training. J Nutr, 138 (suppl):2045-2049
15. Armstrong LE, Maresh CM, Castellani JW, Bergeron MF, Kenefick RW, LaGasse KE, Riebe D (1994). Urinary indices of hydration status. Int J sport Nutr, 4:265-279
16. Dill DB, Costill DL (1974). Calculation of percentage changes in volume of blood, plasma and red cells in dehydration. J Appl Physiol, 37:247-248
17. Klassen P, Mazariegos M, Solomons NW, Furst P (2000). The pharmacokinetic responses of humans to 20 g of alanyl-glutamine dipeptide differ with the dosing protocol but not with gastric acidity or in patients with acute dengue fever. J Nutr, 130:177-182
18. Ziegler TR, Benfell K, Smith RJ, Young LS, Brown E, Ferrari-Baliviera E, Lowe DK, Wilmore DW (1990). Safety and metabolic effects of L-glutamine administration in humans. J Parenter Enteral Nutr, 14:137S-146S
19. Rhoads JM, Wu G (2009). Glutamine, arginine and leucine signaling in the intestine. Amino Acids, 37:111-122
20. Rogero MM, Tirapegui J, Pedrosa RG, de Castro IA, de Olveira Pires IS, Chem B (2006). Effect of alanyl-glutamine supplementation on plasma and tissue glutamine concentrations in rats submitted to exhaustiveexercise. Nutrition, 22:564-571
21. McKenna MJ, Bangsbo J, Renaud JM (2008). Muscle K+, Na+, and Cl disturbances and Na+-K+ pump inactivation: implications for fatigue. J Appl Physiol, 104:288-295
22. Mourtzakis M, Saltin B, Graham T, Pilegaard H (2006). Carbohydrate metabolism during prolonged exercise and recovery: interactions between pyruvate dehydrogenase, fatty acids, and amino acids. J Appl Physiol, 100:1822-1830
23. Sumida KD, Donovan CM (1995). Enhanced hepatic gluconeogenic capacity for selected precursors after endurance training. J Appl Physiol, 79:1883-1888
24. Francesconi RP, Sawka MN, Pandolf KB, Hubbard RW, Young AJ, Muza S (1985). Plasma renin and aldosterone responses at graded hypohydration levels during exercise-heat stress. J Appl Physiol, 59:1855-1860
25. Montain SJ, Laird JE, Latzka WA, Sawka MN (1997). Aldosterone and vasopressin responses in the heat: hydration level and exercise intensity effects. Med Sci Sports Exerc, 29:661-668
26. Kenefick RW, Maresh CM, Armstrong LE, Riebe D, Echegaray ME, Castellani JW (2007). Rehydration with fluid of varying tonicities: effects on fluid regulatory hormones and exercise performance in the heat. J Appl Physiol, 102:1899-1905
27. Koshimizu TA, Nasa Y, Tanoue A, Oikawa R, Kawahara Y, Kiyono Y, Adachi T, Tanaka T, Kuwaki T, Mori T, Takeo S, Okamura H, Tsujimoto G (2006). V1a vasopressin receptors maintain normal blood pressure by regulating circulating blood volume and baroreflex sensitivity. Proc Natl Acad Sci, 103:7807-7812
28. Brandenberger G, Candas V, Follenius M, Libert JP, Kahn JM (1986). Vascular fluid shifts and endocrine response to exercise in the heat. Eur J Appl Physiol, 55:123-129
29. Convertino VA, Keil LC, Greenleaf JE (1983). Plasma volume, renin, and vasopressin responses to graded exercise after training. J Appl Physiol, 54:508-514
30. Castell LM, Poortmans JR, LeClercq R, Brassuer M, Duchateau J, Newsholme EA (1997). Some aspects of the acute phase response after a marathon race, and the effects of glutamine supplementation. Eur J Appl Physiol, 75:47-53
31. Miles MP, Andring JM, Pearson SD, Gordon LK, Kasper C, Depner CM, Kidd JR (2008). Diurnal variation, response to eccentric exercise, and association of inflammatory mediators with muscle damage variables. J Appl Physiol, 104:451-458
32. Neubauer O, Konig D, Wagner KH (2008). Recovery after an ironman triathlon: sustained inflammatory responses and muscular stress. Eur J Appl Physiol, 104:417-426
33. Mahm C, Sjodin B, Sjoberg B, Lenderi R, Renstrom P, Lundberg IE, Ekblom B (2004). Leukocytes, cytokines, growth factors and hormones in skeletal muscle and blood after uphill or downhill running. J Physiol, 556:983-1000
34. Gleeson M, Almey J, Brooks S, Cave R, Lewis A, Griffiths H (1995). Haematological and acute-phase responses associated with delayed-onset muscle soreness in humans. Eur J Applied Physiol Occup Physiol, 71:137-142
35. Hiscock N, Petersen EW, Krzywkowski K, Boza J, Halkjaer-Kristensen J, Pedersen BK (2003). Glutamine supplementation further enhances exerciseinduced plasma IL-6. J Appl Physiol, 95:145-148
36. Jonsdottir IH, Schjerling P, Ostrowski K, Asp S, Richter EA, Pedersen BK (2000). Muscle contractions induce interleukin-6 mRNA production in rat skeletal muscles. J Physiol, 528:157-163
37. Nybo L, Nielsen B, Pedersen BK, Moller K, Secher NH (2002). Interleukin-6 release from the human brain during prolonged exercise. J Physiol, 542:991-995
38. Pedersen BK, Steensberg A, Fischer C, Keller C, Ostrowski K, Schjerling P (2001). Exercise and cytokines with particular focus on muscle derived IL-6. Exerc Immunol Rev, 8:18-31
39. Ridker PM, Cushman M, Stampfer MJ, Tracy RP, Hennekens CH (1997). Inflammation, aspirin, and the risk of cardiovascular disease in apparently healthy men. N Eng J Med, 336:973-979
40. Phillips T, Childs AC, Dreon DM, Phinney S, Leeuwenburgh C (2003). A dietary supplement attenuates IL-6 and CRP after eccentric exercise in untrained males. Med Sci Sports Exerc, 35:2032-2037
41. Robson-Ansley P, Barwood M, Eglin C, Ansley L (2009). The effect of carbohydrate ingestion on the interleukin-6 response to a 90-minute run time trial. Int J Sports Physiol Perf, 4:186-194
42. Andreasen AS, Pedersen-Skovsgaard T, Mortensen OH, van Hall G, Moseley PL, Pedersen BK (2009). The effect of glutamine infusion on inflammatory response and HSP70 during human experimental endotoxaemia. Crit Care, 13: R7
43. Petersen AMW, Pedersen BK (2006). The role of IL-6 in mediating the anti-inflammatory effects of exercise. J Physiol Pharmacol, 57(Suppl):43-51
44. Allesio HM (1993). Exercise-induced oxidative stress. Sci Sports Exerc, 25:218-224
45. Paik IY, Jeong MH, Jin HE, Kim YI, Suh AR, Cho SY, Roh HT, Jin CH, Suh SH (2009). Fluid replacement following dehydration reduces oxidative stress during recovery. Biochem Biophys Res Comm, 383:103-107
46. Hoffman JR, Ratamess NA, Tranchina CP, Rashti SL, Kang J, Faigenbaum AD (2009). Effect of Protein Ingestion on Recovery Indices Following a Resistance Training Protocol in Strength/Power Athletes. Amino Acids
47. Bottecchia D, Bordin D, Martino R (1987). Effect of different kinds of physical exercise on the plasmatic testosterone level of normal adult males. Sports Med, 27:1-5
48. Galbo H, Hammer L, Peterson IB, Christensen NJ, Bic N (1977). Thyroid and testicular hormone responses to gradual and prolonged exercise in man. J Appl Physiol, 36:101-106
49. Hoffman JR, Maresh CM, Armstrong LE, Gabaree CL, Bergeron MF, Kenefick RW, Castellani JW, Ahlquist LE, Ward A (1994). Effects of hydration state on plasma testosterone, cortisol, and catecholamine concentrations before and during mild exercise at elevated temperature. Eur J Appl Physiol, 69:294-300
50. Brandenberger G, Candas V, Follenius M, Kahn JM (1989). The influence of initial state of hydration on endocrine responses to exercise in the heat. Eur J Appl Physiol, 58:674-679
51. Maresh CM, Whittlesey MJ, Armstrong LE, Yamamoto LM, Judelson DA, Fish KE, Casa DJ, Kavouras SA, Castracane VD (2006). Effect of hydration state on testosterone and cortisol responses to training-intensity exercise in collegiate runners. Int J Sports Med, 27:765-770
52. Judelson DA, Maresh CM, Yamamoto LM, Ferrell MJ, Armstrong LE, Kraemer WJ, Volek JS, Spiering BA, Casa DJ, Anderson JM (2008). Effect of hydration state on resistance exercise-induced endocrine markers of anabolism, catabolism, and metabolism. J Appl Physiol, 105:816-824
53. Gordon SE, Kraemer WJ, Vos NH, Lynch JM, Knuttgen HG (1994). Effect of acidbase balance on the growth hormone response to acute high-intensity cycle exercise. J Appl Physiol, 76:821-829
54. Suminski RR, Robertson RJ, Goss GL, Arsianian S, Kang J, DaSilva S, Utter AC, Metz KF (1997). Acute effect of amino acid ingestion and resistance exercise on plasma growth hormone concentration in young men. Int J Sports Nutr, 7:48-60
55. Welbourne TC (1995). Increased plasma bicarbonate and growth hormone after an oral glutamine load. Am J Clin Nutr, 61:1058-1061
56. Duska F, Fric M, Pazout J, Waldauf P, Tuma P, Pachl J (2008). Frequent intravenous pulses of growth hormone together with alanylglutamine supplementation in prolonged critical illness after multiple trauma: effects on glucose control, plasma IGF-1 and glutamine. Growth Horm IGF Res, 18:82-87
Cita Original
Hoffman Jay R, Nicholas A Ratamess , Jie Kang, Stephanie L Rashti, Neil Kelly, Adam M Gonzalez, Michael Stec, Steven Anderson, Brooke L Bailey, Linda M Yamamoto, Lindsay L Horn, Brian R Kupchak, Avery D Faigenbaum, Carl M Maresh: Examination of the efficacy of acute L-alanyl-Lglutamine ingestion during hydration stress in endurance exercise. Journal of the International Society of Sports Nutrition, 7:8. 2010.
Cita en PubliCE
Nicholas A Ratamess, Jay R Hoffman, Jie Kang, Linda M Yamamoto, Stefanie L Rashti, Neil Kelly, Adam M Gonzalez, Michael Stec, Steven Anderson, Brooke L Bailey, Lindsay L Horn Brian R Kupchak (2010). Evaluación de la Eficacia de la Ingestión Aguda de L-alanil-L-glutamina durante el Estrés Hídrico en Ejercicios de Resistencia. .https://g-se.com/evaluacion-de-la-eficacia-de-la-ingestion-aguda-de-l-alanil-l-glutamina-durante-el-estres-hidrico-en-ejercicios-de-resistencia-1338-sa-S57cfb271f3d8b
