Estudio Preliminar sobre los Efectos de la Edad y la Diabetes Tipo-2 sobre la Liberación de Interleuquina (IL)-6, IL-10, TNF-Alfa, y Cortisol en la Respuesta Aguda al Ejercicio
Petra B Schuler1, Ludmila Cosio-Lima1, Katy Reynolds1, Lemuel Taylor1, Gordon Kellog1, Jill Cerney1, Tabitha Hodges1, Paul Leblanc21 Department of Health, Leisure, and Exercise Science/University of West Florida, Pensacola, FL, Estados Unidos.
2 University of Alabama, Tuscaloosa, AL, Estados Unidos.
Resumen
La respuesta inmune al ejercicio da lugar a la liberación de marcadores inflamatorios. Este trabajo estudió los efectos de la edad y la diabetes tipo-2 sobre la respuesta de las citoquinas luego de una serie aguda de ejercicio. Cinco ancianos con diabetes tipo-2 (OD) (edad media 82±3 años), 5 ancianos no diabéticos (edad media 79±6 años), y un grupo control de cinco jóvenes saludables (YH) (26±3 años) fueron estudiados, antes y después de un test incremental submáximo en cinta rodante. Se tomaron muestras de sangre venosa inmediatamente antes y a los 5 minutos de finalizado el ejercicio, y el plasma fue analizado para valorar los niveles de interleuquina (IL)-6, IL -10, factor de necrosis tumoral alfa (TNF-a), proteína C reactiva (CRP), y cortisol. Los niveles de cortisol estuvieron significativamente elevados post-ejercicio (p<0.05) para todos los participantes que tuvieron un estímulo de ejercicio suficiente [>60% de la frecuencia cardíaca de reserva (HRR)]. Fue encontrado un efecto principal significativo para el grupo para la IL-6 (p<0.05) con la prueba post-hoc, lo cual sugiere niveles significativamente más altos para el grupo de ancianos diabéticos (OD) en comparación con el grupo control de jóvenes (YH). No fue encontrada ninguna interacción significativa de grupo por tiempo para ninguna de las variables estudiadas. Los hallazgos del presente estudio sugieren que la edad, más que la presencia de diabetes afecta los niveles plasmáticos de IL-6 de reposo. Además ni la edad ni la diabetes influenciaron la respuesta aguda de las citoquinas al ejercicio.
Palabras Clave: diabetes, ejercicio agudo, respuesta de las citoquinas, envejecimiento
INTRODUCCION
Es sabido que los mecanismos inflamatorios desempeñan un papel principal en los procesos patológicos de la enfermedad cardiovascular, la diabetes tipo 2, el derrame cerebral, y la enfermedad pulmonar obstructiva crónica (1). Los pacientes con diabetes tipo 2, síndrome metabólico, y obesidad tienen niveles elevados de citoquinas como la interleuquina-6 (IL-6) y la proteína C-reactiva (CRP) (2). Además, la ateroesclerosis y las enfermedades de las arterias coronarias (CAD) están asociadas a mayores niveles de CRP, de IL-6, y de factor de necrosis tumoral alfa (TNF- a). Se ha demostrado que el TNF-a es una pieza clave en la inflamación sistémica de bajo nivel, y está asociado a la obesidad y a diferentes enfermedades crónicas, debido a que promueve características relacionadas a la aterosclerosis, coagulanción, y cachexia (3). Un aumento en las citoquinas pro-inflamatorias también desempeña un papel en la producción de diversas proteínas involucradas en la fase aguda de la respuesta inflamatoria (por ej. CRP) (4). Por otra parte, los niveles de mediadores inflamatorios se correlacionan con otros factores de riesgo en los procesos de la enfermedad crónica, incluyendo niveles de fibrinógeno, albúmina, colesterol, presión arterial e índice de masa corporal (BMI) (3).
El envejecimiento se correlaciona con niveles aumentados de marcadores inflamatorios, los cuales son predictores de mortalidad y discapacidad (5).
También se ha sugerido que la edad avanzada, incluso en la ausencia de enfermedad, está asociada a la inmunosenescencia, que da lugar a una disminución de la capacidad fagocítica, a la reducción del tráfico de células dendríticas (DC), y a un aumento en las citoquinas pro-inflamatorias, tales como IL-6 y TNF-a (6).
La discapacidad física en los ancianos está asociada a la disminución de la fuerza y masa muscular. Esta disminución del vigor físico es causada a veces por diferentes enfermedades caracterizadas por la inflamación crónica y altos niveles IL-6 (Ej. diabetes tipo 2). No está claro si la discapacidad funcional precede o sigue al incremento en los niveles de IL -6 (7). Diferentes estudios epidemiológicos han demostrado que la actividad y el rendimiento físico están inversamente asociados a los marcadores inflamatorios. En adultos mayores físicamente activos (70-80 años de edad) se han observado una disminución de los niveles de IL-6, CRP, y TNF-a en comparación con los adultos mayores sedentarios (3, 8, 9, 10).
Por otro lado, se ha sugerido que las citoquinas antiinflamatorias, tales como IL -10, podrían estar implicadas en el enlentecimiento del proceso de envejecimiento y en la promoción de la longevidad.
La IL-10 se eleva en los ancianos sanos, pero disminuye en los ancianos débiles junto con el la función presentadora del antígeno DC (11). En 2001, Moore y colaboradores divulgaron que la IL-10 está implicada en la regulación de reacciones inmunes y las respuestas inflamatorias y la supresión de citoquinas pro-inflamatorias, tales como TNF- a, IL-6, IL -8, e IL-1ß (12).
En la actualidad no es completamente conocido el grado de interacciones entre el ejercicio aeróbico agudo, el envejecimiento, y el sistema inmunológico, pues la respuesta del sistema inmune al ejercicio depende de la frecuencia, intensidad, y duración del mismo (11). Los ancianos sanos y físicamente activos presentan niveles más bajos de marcadores inflamatorios. Sin embargo, las controversias se presentan en relación a la asociación de los niveles circulatorios de TNF-a y IL-6 durante el ejercicio en pacientes con diabetes tipo 2 (13). Mientras que algunos estudios han observado niveles elevados de TNF-a plasmático en diabéticos tipo 2, otros estudios no lo han observado (14,15). También, poco se sabe acerca de la relación de la IL-6 y la diabetes de tipo 2 durante el ejercicio. Febbraio y colaboradores (13) demostraron que el ejercicio no provoca la liberación de TNF-a en diabéticos o sujetos control, y que hay una tendencia hacia un aumento en la liberación de IL-6 inducida por el ejercicio en los diabéticos en comparación con sujetos control. Para nuestro conocimiento, ningún trabajo previo ha estudiado los efectos de la edad y de la diabetes tipo 2 sobre la liberación de citoquinas durante una respuesta aguda al ejercicio. Por lo tanto, están justificados los futuros trabajos que estudien la relación entre la diabetes, los marcadores inflamatorios y la edad. El principal propósito de este estudio preliminar fue determinar como la edad o la diabetes tipo 2, influyen sobre la respuesta de las citoquinas al ejercicio agudo.
Específicamente, estudiamos la respuesta de los niveles de IL-6 al ejercicio en ancianos saludables y con diabetes tipo 2. Particularmente, estuvimos interesados en determinar los niveles séricos de IL-6 (citoquina pro-inflamatoria) y IL-10 (citoquina anti-inflamatoria), en ancianos saludables y con diabetes tipo 2 (edades 73 a 85 años).
METODOS
Sujetos
En este estudio participaron 5 ancianos varones y mujeres con diabetes tipo 2 (OD) (varones=3, mujeres=2), edad 82±1 (media±DS), 5 ancianos que no eran diabéticos (OND) (79±6 años, varones=2, mujeres=3), y un grupo control de 5 jóvenes saludables (YH) (26±3 años, varones=3, mujeres=2).
Los ancianos fueron equiparados respecto al índice de masa corporal (BMI), perímetro de la cintura, y VO2 máx. obtenido a través del método de extrapolación desde la pendiente/velocidad alcanzados durante el test submáximo incremental en cinta rodante. Ninguna de las mujeres estaba tomando anticonceptivos orales o alguna terapia de estrógenos. Antes de participar en este estudio, todos los sujetos firmaron un consentimiento aprobado por el comité evaluador institucional de la universidad de West Florida, y completaron una detallada historia clínica que fue revisada en el lugar por un médico.
Otro requisito previo a la participación en este estudio fue la autorización médica de su médico de atención primaria. Los sujetos continuaron con su dosis habitual de medicación durante el estudio.
Todos los participantes se encontraban en buen estado de salud y sin complicaciones relacionadas a la diabetes, tales como enfermedades cardiovasculares o neuropatías. Ninguno de los sujetos diabéticos era insulino-dependiente, uno de los sujetos estaba tomando actos (pioglitazona) (45 mg diarios) y el resto tomaba drogas hipoglucémicas (metformina). Solo un participante estaba medicado con betabloqueantes (tropol). Los participantes con contraindicaciones absolutas o relativas a los tests físicos, como las descriptas por el Colegio Americano de Medicina del Deporte (2005), fueron excluidos del presente estudio (16).
Procedimientos
Muestras de Sangre y Cuestionarios
Los sujetos se presentaron al laboratorio de ciencias del ejercicio y rendimiento de la Universidad de West Florida, entre las 7:00 y 8:00 am después de 12 horas de ayuno nocturno. La dieta anterior no fue supervisada. Se dio instrucciones a los sujetos de abstenerse de realizar cualquier tipo de ejercicio 48 horas antes de los tests. Un médico del laboratorio repasó sus historias clínicas y formularios de consentimiento antes de la participación en las pruebas. Se midieron los niveles plasmáticos de glucosa en ayuno, concentración de lípidos [lipoproteínas de alta densidad (HDL), triacilglicéridos (TRIG), colesterol total (TC)] por medio de un pinchazo en el dedo (CardioCheck, Christie Clinic, Illinois). Las lipoproteínas de baja densidad (LDL) fueron determinadas a través de la fórmula [LDL = TC – HDL – (TRIG/5)]. Después de obtener esta muestra, se les dio a los sujetos una barra de reemplazo alimentario (170 kcalorías; grasa 4,5 g, proteína 20 g, carbohidratos 17 g; Pure Protein, Bayport, NY). Se utilizó la barra de alimento para reflejar mejor la respuesta a una comida típica de todos los sujetos y prevenir un aumento excesivo en el nivel de la glucosa sanguínea. Si después de la barra de reemplazo alimentario la glucosa sanguínea permanecía por debajo de 100mg.dL-1, se le daba al sujeto 4 onzas (113 g) de jugo de naranja. Se midió en cada participante, la talla (cm), el peso (kg), y el perímetro de cintura. Se calculó el Índice de Masa Corporal (BMI) de cada sujeto. Luego cada participante completó los cuestionarios de Actividad Física y Salud Nutricional. Se recolectaron muestras de sangre venosa (10 mL) inmediatamente antes de comenzar el ejercicio (pre-ejercicio) y 5 minutos después de terminado el mismo (post-ejercicio), y el plasma fue analizado para proteína C reactiva (CRP), interleuquina IL-6, IL-10, factor de necrosis tumoral alfa (TNF-a), y niveles de cortisol, usando los kits comerciales ELISA (R & D Systems, Minneapolis, MN; Diagnostic Systems Laboratories, Webster, TX, respectivamente).
Prueba de Ejercicio
Aproximadamente 15 minutos después del desayuno, y antes de que se tomaran las muestras de sangre, se obtuvo de cada participante un ECG de referencia de 12 derivaciones. Fueron realizadas mediciones de la frecuencia cardíaca de reposo (HR) y la presión arterial (BP), estando los sujetos parados y sentados, y se determinó para cada sujeto, el 85% de la frecuencia cardíaca de reserva máxima estimada a partir de la edad [((220-edad) – frecuencia cardíaca de reposo)*0,85]. Para determinar la capacidad aeróbica se utilizó el protocolo de Bruce modificado, usando una cinta rodante a motor. Durante la prueba de esfuerzo se obtuvieron cada 3 minutos registros seriales del ECG-12, para monitorear cualquier arritmia cardíaca u otra anomalía. También se registraron cada 3 minutos la presión arterial y la percepción subjetiva del esfuerzo (RPE) con la escala de Borg (6-20). Se incrementó la intensidad cada 3 minutos, y una vez alcanzado el 85% de la HRR, se redujo la velocidad y pendiente y se alentó a los participantes a caminar por un total de 20 minutos al 60% de la HRR. Durante el período de descanso, se registraron cada 3 minutos un ECG en posición de sentado, la BP y el RPE.
Análisis Sanguíneos
La sangre fue recolectada, centrifugada y almacenada a -40° C para su posterior análisis. Las concentraciones de de TNF-a, IL-6, y IL-10, fueron determinadas a través de un ensayo inmunoabsorbente de alta sensibilidad ligado a enzima (quantikine high-sensitivity enzyme-linked immunoabsorbent assay) (ELISA) (R & D Systems, Minneapolis, MN) con una apreciasión del análisis de 0,12, 0,04 ng.mL-1, y de menos de 0,5 pg.mL-1, respectivamente. Los coeficientes de variación intra- e inter-análisis para TNF-a fueron de 4,3% y 7,3%; para IL-6, 7,8% y 7,2%; y para IL-10, 8,5% y 10,2%.
Los niveles plasmáticos de cortisol. CRP e insulina se determinaron a través del método comercial ELISA (Diagnostic System Laboratories, Webster, TX). La sensibilidad para el cortisol, CRP, y la insulina fueron de 0,1 μg.dL-1, 0,6 μg.dL-1, y 0,26 μg.dL-1, respectivamente. Los coeficientes de variación intra- e inter-análisis para el cortisol fueron de 2,4% y 12%; para la CRP, 3,5% y 14%, y para la insulina 2,6% y 5,2%. Todas las muestras pre- y post-intervención fueron medidas en el mismo análisis. La sensibilidad a la insulina, como porcentajes de una población normal de referencia (%S) fue calculada a través de la ecuación de la Valoración del Modelo de Homeostasis-Resistencia a la Insulina (Homeostasis Model Assessment-Insulin Resistance) (HOMA-IR) de Tanaka y col. del año 2000 (17).
Análisis Estadísticos
Para comparar los valores pre- y post-ejercicio por grupo, se utilizó la prueba de comparaciones múltiples ANOVA, utilizando el análisis post-hoc de Tukey. Para comparar la información descriptiva entre los grupos se utilizó la prueba ANOVA de una vía. Se fijó un nivel de significancia de p<0,05. Para realizar el tratamiento estadístico se utilizó el paquete estadístico SPSS (versión 13, Chicago, IL).
RESULTADOS
En la Tabla 1 se presenta la estadística descriptiva de las características de referencia de los sujetos. No se observaron diferencias significativas en el peso, altura, BMI, resistencia a la insulina, sensibilidad a la insulina, perímetro de la cintura, y triacilglicéridos en ayuna, entre los ancianos diabéticos (OD), ancianos no diabéticos (OND), y jóvenes saludables (YH). Los niveles de colesterol total fueron más altos (p<0.01) en el grupo OND en comparación con los grupos OD y YH. La glucosa en ayunas fue más alta (p<0.02) en el grupo OD con los grupos OND y YH. El VO2 máx. fue más alto (p<0.001) en el grupo YH en comparación con los grupos OD y OND.
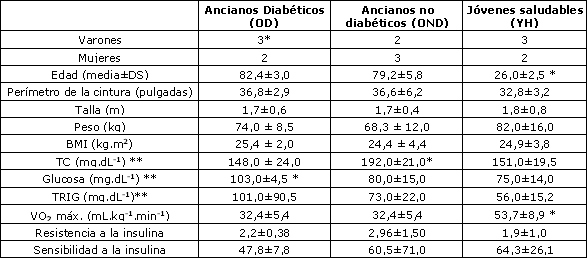
Tabla 1. Características de referencias de los sujetos.* Un participante medicado con ß-bloqueantes (actos, 45 mg.día-1). ** Muestras obtenidas luego de 12 hs. de ayuno (p<0.05).
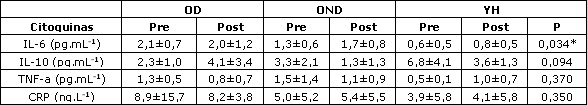
Tabla 2. Niveles medios de citoquinas entre las condiciones pre- y post-ejercicio en para los ancianos diabéticos (OD), los ancianos no diabéticos (OND) y los jóvenes Saludables (YH). * Diferencia entre los grupos media±DE, p<0,05.
La Tabla 2 presenta los datos medios de las citoquinas en las condiciones pre- y post-ejercicio para los grupos OD, OND, y YH. Fue encontrado un efecto principal significativo para el grupo en IL-6 (p<0,05) con la prueba post-hoc, lo que sugiere valores significativamente más altos en el grupo de ancianos diabéticos (OD) en comparación al grupo control de jóvenes saludables (YH). En relación a lasa interacciones temporales, ningún grupo de significancia fue encontrado para IL-10, TNF-a, o CRP. La Tabla 3 muestra los datos metabólicos pre- y post-ejercicio (insulina y cortisol) en OD, OND, y YH. Los niveles de cortisol elevaron significativamente en la condición post-ejercicio para todos los participantes, mientras que no se observaron diferencias significativas entre los participantes en los niveles de insulina pre- y post-ejercicio.
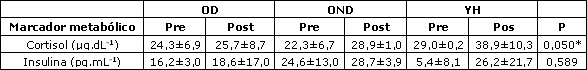
Tabla 3. Niveles metabólicos medios pre- y post ejercicio para los ancianos diabéticos (OD), los ancianos no diabéticos (OND) y los jóvenes Saludables (YH). * Diferencia entre los grupos, media±DE, p<0,05.
DISCUSION
Este estudio preliminar demuestra que los niveles de IL -6 en ancianos diabéticos (OD) fueron considerablemente más altos en reposo en comparación con los participantes jóvenes saludables (YH) y los ancianos no diabéticos (OND). Por otra parte, los niveles del cortisol fueron significativamente más altos en todos los grupos en la condición post-ejercicio. Además, en el presente estudio ni la edad ni la diabetes influyeron sobre la respuesta de las citoquinas al ejercicio agudo.
Para nuestro conocimiento, éste es el primer estudio preliminar que demuestra que la edad, más que la presencia de diabetes tipo 2 afecta los niveles de IL-6 plasmáticos de reposo. Los niveles más altos de IL-6 encontrados en los grupos OD y OND que fueron encontrados en el presente estudio coinciden con las observaciones divulgadas por Wannamethee y col. (18), donde la IL-6 fue asociada significativamente a edad y a actividad física baja. Curiosamente, los participantes del presente estudio también demostraron bajos puntajes de actividad física en el cuestionario de Actividad Física y Salud Nutricional. Wannamethee y col. (18) tampoco demostraron ninguna relación entre los niveles de IL -6 y la resistencia a la insulina cuando ajustó los datos para el BMI. Esto apoya los resultados del presente estudio que no demuestra ninguna diferencia significativa para la resistencia a la insulina, la sensibilidad a la insulina, y el BMI entre los tres grupos.
Otras investigaciones han propuesto posibles explicaciones para la relación patofisiológica que existe entre la IL-6 y el envejecimiento (19). Durante el reposo, la IL-6 es producida en un principio por monocitos y macrófagos, fibroblastos, células endoteliales vasculares, y tejido adiposo (20, 21). El incremento de la IL-6 relacionado con la edad, ha sido asociado con el desarrollo de discapacidad física (7), enfermedad (22), y mortalidad (6). Ferrucci et al. (7) sugirieron que las citquinas, particularmente la IL-6, puede estar directamente relacionada con discapacidades físicas. También sugieren que la IL-6 puede asociarse a la sarcopenia y a la debilidad. Sin embargo no está claro si es la elevación de los niveles de la IL-6 o la discapacidad física y la enfermedad, lo que se desarrolla primero.
Además de las diferencias en IL-6 de reposo en los grupos de ancianos en comparación con el de grupo YH, se observó una tendencia hacia niveles reducidos de IL-10 en los grupos OD y OND en comparación con el grupo YH. Esto sugiere que la actividad física puede jugar un rol en este hallazgo, ya que la IL-10 está influenciada por la aptitud física (3, 11). En el presente estudio, el grupo YH tuvo un VO2 max más alto en comparación con los obtenidos por los grupos OD y OND. También, los niveles de actividad física comunicados por los grupos OD y OND, fueron inferiores que los del grupo YH. La IL-10 es una potente citoquina antiinflamatoria que promueve la salud cardiovascular y neuromuscular (3). Jankard y Jemiolo (11) señalaron que el entrenamiento físico incrementa los valores de IL-10 y decrece los de IL-6. Estos autores sugieren que la actividad física regular en las poblaciones de ancianos puede reducir los efectos degenerativos del envejecimiento manteniendo niveles sanos de citoquinas favorables y antiinflamatorias.
No se observaron cambios en los niveles de insulina después del ejercicio entre los participantes del presente estudio. De acuerdo a diferentes investigaciones, no ha sido bien documentado el rol de la insulina en respuesta al ejercicio agudo en pacientes con diabetes tipo 2 (23). Debido a los apremios del tiempo de los sujetos, no pudimos obtener niveles de glucosa post-ejercicio, los cuales nos hubiera permitido calcular la sensibilidad y la resistencia a la insulina post-ejercicio. Por lo tanto, es difícil confirmar si la respuesta a la insulina post-ejercicio se debió a la resistencia a la insulina.
Aunque estadísticamente no es significativo, y está basado simplemente en el estudio-especulación de tendencias, los niveles de reposo de TNF-a de los grupos OD y OND fueron mayores que los del grupo YH. Bruunsgaard (3) estableció que el TNF-a está inversamente relacionado a la síntesis de proteínas del músculo esquelético, lo cual resulta en pérdida de masa muscular, fuerza, y capacidad funcional en los ancianos. Por otra parte, este autor presume que el bajo nivel de inflamación es causado indirectamente por la producción de TNF-a. El TNF-a, el cual está relacionado a procesos patológicos, podría explicar nuestros hallazgos de que ambos grupos de ancianos (OD y OND) presenten niveles más elevados de TNF-a que el grupo YH, lo que sugiere nuevamente, que la edad y los bajos niveles de actividad física son factores importantes que afectan las tendencias observadas en el presente estudio. El pequeño tamaño de muestra utilizado en el presente estudio necesita ser tomado en consideración como una limitación del estudio que podría haber influenciado la potencia de muestra del estudio.
Se observaron diversas tendencias interesantes en la repuesta de las citoquinas al ejercicio. Los grupos OND y YH respondieron con aumentos en la IL-6, IL-10 y disminución en CRP. El grupo OD tuvo la respuesta opuesta para los niveles de IL-6, IL-10 y CRP. Es bien sabido que la liberación de IL-6 en plasma, está relacionada a la intensidad, duración, masa de músculo esquelético reclutada y capacidad de resistencia del ejercicio (24, 25). Esta liberación de IL-6 post-ejercicio se ha observado también en ancianos no entrenados (26). El aumento de IL-6 post-ejercicio observado en los grupos OND y YH concuerda con los resultados de estudios previos, donde el incremento en los niveles de IL-6 se origina principalmente en el músculo esquelético (24). Por otro lado, el grupo OD presentó niveles disminuidos de IL-6 post-ejercicio. De acuerdo a Lyngso y col. (27) el nivel disminuido en IL-6 observado en el grupo OD está relacionado a la supresión de IL-6 del tejido adiposo y la destacada remoción por las vísceras hepatoesplénicas que resultan en niveles netos más bajos de IL-6 post-ejercicio en pacientes con diabetes tipo 2.
En conclusión, a diferencia de los grupos OND y YH, el tejido adiposo, en oposición al músculo esquelético, contribuye a la respuesta de las citoquinas post-ejercicio, observada en el grupo OD en el presente estudio. Fueron observadas disminuciones leves no significativas en los niveles de TNF-a post-ejercicio en los grupos OD y OND, mientras que en el grupo YH, los niveles de TNF-a aumentaron. Esta observación concuerda con diversos estudios (28, 29), mientras que no es apoyada por otros (14, 15). Estos resultados coinciden con los del estudio de Febbraio y col. (13), donde no se observó ninguna diferencia estadística en el TNF-a arterial, después del ejercicio ni en el grupo control ni en los grupos diabéticos de mediana edad.
Por otro lado, se ha observado que el ejercicio puede resultar en un aumento del TNF-a circulante, como resultado de la tensión provocada por la contracción muscular, como fue el caso del grupo YH (13) del presente estudio. Por lo tanto, nuestro estudio proporciona evidencias que indican que los patrones de respuesta de IL-6 e IL-10 son diferentes durante el ejercicio en ancianos en comparación ancianos diabéticos. Existen controversias en relación a los efectos del TNF-a y a la patogénesis de la diabetes tipo 2, y están justificados estudios adicionales que aborden este tema.
Es interesante que los niveles de CRP siguiera la respuesta de la IL-6, mientras que la IL-10 respondiera inversamente a la IL-6 y CRP en todos los grupos, tanto en la condición de reposo como post-ejercicio. Esto apoya a estudios previos que exponen que la CRP y la IL-6 son citoquinas pro-inflamatorias y que la IL-10 es una citoquina antiinflamatoria (3).
Limitaciones del Estudio
Nuestro estudio tiene limitaciones que autorizan la discusión. La muestra en este estudio fue pequeña, y por lo tanto no pudimos poner en juego el género o la raza. Somos conscientes de que una muestra más grande podría darnos más poder estadístico. Idealmente, nos hubiera gustado tener una muestra de mayor tamaño, sin embargo, la naturaleza de la población y las restricciones en el calendario de los sujetos hizo que el estudio fuera difícil de ejecutar.
Por otro lado, debido a las restricciones del tiempo de los sujetos, no pudimos obtener los niveles de glucosa post-ejercicio que nos hubiera permitido calcular la sensibilidad y la resistencia a la insulina post-ejercicio.
Conclusión
En conclusión, el presente estudio demuestra que la edad puede tener un efecto más profundo que la diabetes en la respuesta de las citoquinas en reposo, en individuos ancianos con bajos niveles de actividad física. De manera contraria, el presente estudio sugiere que la diabetes puede mediar la respuesta de las citoquinas post-ejercicio en individuos ancianos.
Dirección para Envío de Correspondencia
Cosio-Lima L, PhD, CSCS, Department of Health, Leisure, and Exercise Science, University of West Florida, 11000 University Parkway, Building 72, Room 220, Pensacola, FL, USA, 32514. Teléfono: (850) 473-7350; correo electrónico: lcosiolima@uwf.edu.Referencias
1. Gan W. Q., Man S. F. P., Senthilselvan A. and Sinn D. D (2004). Association between chronic obstructive pulmonary disease and systemic inflammation: a systematic review and a meta-analysis. Thorax 59: 574-580
2. Kohut M. L., McCann D. A., Russell D. W., Konopka D. N., Cunnick J. E., Franke W. D. et al (2006). Aerobic exercise, but not flexibility/resistance exercise, reduces serum IL-18, CRP, and IL-6 independent of B-blockers, BMI, and psychosocial factors in older adults. Brain Behav Immun 20:201-209
3. Bruunsgaard H (2005). Physical activity and modulation of systemic low-level inflammation. J Leukoc Biol 78: 819-835
4. Gabay C and Kushner I (1999). Acute-phase proteins and other systemic responses to inflammation. N Engl J Med 340: 448-454
5. Kritchevsky S, Cesari M and Pahor M (2005). Inflammatory markers and cardiovascular health in older adults. Cardiovasc Res 66: 265-275
6. Harris T. B., Ferrucci L., Tracy R. P., Corti M. C., Wacholder S., Ettinger W. H. Jr. et al (1999). Associations of elevated interleukin-6 and c-reactive protein levels with mortality in the elderly. Am J Med 106: 506-512
7. Ferrucci L., Harris T. B., Guralnik J. M., Tracy R. P., Cohen H. J., Penninx B. et al (1999). Serum IL -6 level and the development of disability in older persons. J Am Geriatr Soc 47: 639-646
8. Bruunsgaard H., Ladelund S., Pedersen A. N., Schroll M., Joergensen T. and Pedersen B. K (2003). Predicting death from tumor necrosis factor-alpha and interleukin-6 in 80-year-old people. Clin Exp Immunol 132: 24-31
9. Colbert L. H., Visser M., Simonsick E. M., Tracy R. P., Newman A. B., Kritchevsky S. B. et al (2004). Physical activity, exercise, and inflammatory markers in older adults: Findings from their health, aging and body composition study. J Am Geriatr Soc 52: 1098-1104
10. Reuben D. B., Judd-Hamilton L., Harris T. B., Seeman T. E. et al (2003). The associations between physical activity and inflammatory markers in high-functioning older persons: MacArthur studies of successful aging. J Am Geriatr Soc 51:1125-1130
11. Jankord R. and Jemiolo B (2004). Influence of physical activity on serum IL -6 and IL -10 levels in healthy older men. Med Sci Sports Exerc 36: 960-963
12. Febbraio M. A., Steensberg A., Starkie R. L., McConnell G. K. and Kingwell B. A (2003). Skeletal muscle interleukin-6 and tumor necrosis factor-a release in healthy subjects and patients with type 2 diabetes at rest and during exercise. Metabolism 52: 939-944
13. Kern P. A., Ranganathan S., Li C., Wood L. and Ranganathan G. (2001). Adipose tissue tumor necrosis factor and inte rleukin-6 expression in human obesity and insulin resistance. Am J Physiol Endocrinol Metab 280: E745-E751
14. Bluher M., Kratzsch J. and Paschke R (2001). Plasma levels of tumor necrosis factor-a, angiotensin II, growth hormone, and IGF-I are not elevated in ins ulin-resistant obese individuals with impaired glucose tolerance. Diabetes Care 24: 328-334
15. American College of Sports Medicine (2005). Guidelines for exercise testing and prescription. Lippincott Williams & Wilkins: 7th edition
16. Tanaka Y., Atsume Y., Matsuoka K., Onumana T. and Kawamori R (2000). Interesting insulin response to oral glucose load in young Japanese subjects with impaired glucose tolerance. Diabetes Care 23:710-712
17. Wannamethee S. G., Whincup P. H., Rumley A., Lowe G. D. et al (2007). Interrelationships of interleukin-6, cardiovascular risk factors and the metabolic syndrome among older men. J Thromb Haemost 8: 1200-12005
18. Beattie M. S., Shlipak M. G., Liu H., Browner W. S., Schiller N. B. and Whooley M. A (2003). C-reactive protein and ischemia users and nonusers of b-blockers and statins. Circulation 107: 245. 20
19. Akira S., Taga T., Kishimoto T (1993). Interleukin-6 in biology and medicine. Adv Immunol 54:1-78
20. Mohamed-Ali V., Goodrick S., Rawesh A., Katz D. R., Miles J. M., Yudkin J. S. et al (1997). Subcutaneous adipose tissue releases interleukin-6, but not tumor necrosis factor-a, in vivo. J Clin Endocrinol Metab 82:4196-4200
21. Ershler W. B. and E. Keller (2000). Age-associated increased interleukin-6 gene expression, late-life diseases, and frailty. Annu Rev Med 51: 245-270
22. Febbraio M. A. and Pedersen B. K (2002). Muscle-derived interleukin-6: mechanisms for activation and possible biological roles. FASEB J 16: 1335-1347
23. Petersen A. M. and Pedersen B. K (2005). The anti-inflammatory effect of exercise. J App Physiol 98:1154-1162
24. Pedersen B. K., Steensberg A., Fischer C., Keller C., Keller P., Plomgaard P. et al (2004). The metabolic role of IL-6 produced during exercise: is IL -6 an exercise factor?. Proc Nutr Soc 63: 263-267
25. Lyngso D., Simonsen L. and Bulow J (2002). Interleukin-6 production in human subcutaneous abdominal adipose tissue: the effect of exercise. J Physiol 543: 373-378
26. Pfeiffer A., Janott J., Mohlig M., Ristow M., Rochlitz H., Bush K. et al (1997). Circulating tumor necrosis factor alpha is elevated in male but not in female patients with type-II diabetes mellitus. Horm Metab Res 029: 111-114
27. Winkler G., Cseh K., Baranyi E., Melczer Z., Speer G., Hajos P. et al (2002). Tumor necrosis factor system in insulin resistance in gestational diabetes. Diabetes Res Clin Pract 56: 93-99
Cita Original
Cosio-Lima Ludmila, Petra Schuler, Katy Reynolds, Lemuel Taylor, Gordon Kellog, Jill Cerney, Tabitha Hodges, Paul Leblanc. Preliminary Study of the Effects of Age and Type-2 Diabetes on the Release of Interleukin (IL)-6, IL-10, TNF-Alpha, and Cortisol in Respose to Acute Exercise. JEPonline; 11 (3): 33-41, 2008.
Cita en PubliCE
Petra B Schuler, Ludmila Cosio-Lima, Katy Reynolds, Lemuel Taylor, Gordon Kellog, Jill Cerney, Tabitha Hodges Paul Leblanc (2008). Estudio Preliminar sobre los Efectos de la Edad y la Diabetes Tipo-2 sobre la Liberación de Interleuquina (IL)-6, IL-10, TNF-Alfa, y Cortisol en la Respuesta Aguda al Ejercicio. .https://g-se.com/estudio-preliminar-sobre-los-efectos-de-la-edad-y-la-diabetes-tipo-2-sobre-la-liberacion-de-interleuquina-il-6-il-10-tnf-alfa-y-cortisol-en-la-respuesta-aguda-al-ejercicio-1093-sa-a57cfb271bc05e
