El Rol de las Miocinas Inducidas por el Ejercicio en la Promoción de la Angiogénesis
Chao Qi, Xianjing Song, He Wang, Youyou Yan, Bin Liu0 Department of Cardiology, Second Hospital of Jilin University, Changchun, China
Resumen
Las enfermedades isquémicas son una de las principales causas de mortalidad o discapacidad en lo clínico. El tratamiento quirúrgico o médico a menudo tiene un efecto pobre en pacientes con isquemia de tejidos y órganos causada por estenosis difusa. La promoción de la angiogénesis es, sin duda, un método eficaz para mejorar la perfusión en tejidos y órganos isquémicos. Aunque muchos estudios clínicos o en animales intentaron utilizar el trasplante de células madre, la terapia génica o las citoquinas para promover la angiogénesis, estos métodos no pudieron aplicarse ampliamente en la clínica debido a sus resultados experimentales inconsistentes. Sin embargo, la rehabilitación con ejercicios se ha escrito en muchas guías autorizadas en el tratamiento de enfermedades isquémicas. La función del ejercicio en la promoción de la angiogénesis se basa en la regulación de la glucosa y los lípidos en la sangre, así como en las citocinas secretadas por el músculo esquelético, que se denominan miocinas, durante el ejercicio. Se ha descubierto que las miocinas, como la interleucina-6 (IL-6), las proteínas de la familia de unión de quimiocinas (CXCL), la irisina, la proteína 1 similar a la folistatina (FSTL1) y el factor de crecimiento similar a la insulina-1 (IGF-1), están estrechamente relacionadas con la expresión y función de los factores relacionados con la angiogénesis y la angiogénesis tanto en experimentos con animales como en ensayos clínicos, lo que sugiere que las miocinas pueden convertirse en un nuevo objetivo molecular para promover la angiogénesis y tratar enfermedades isquémicas. El objetivo de esta revisión es mostrar el progreso de la investigación actual con respecto al mecanismo por el cual el ejercicio y las miocinas inducidas por el ejercicio promueven la angiogénesis. Además, también se discuten la limitación y la perspectiva de las investigaciones sobre el papel de las miocinas inducidas por el ejercicio en la angiogénesis. Esperamos que esta revisión pueda proporcionar una base teórica para los futuros estudios de mecanismos y el desarrollo de nuevas estrategias para el tratamiento de enfermedades isquémicas.
INTRODUCCIÓN
Las enfermedades isquémicas, que incluyen la cardiopatía isquémica, el accidente cerebrovascular isquémico y la enfermedad arterial periférica, se caracterizan por una perfusión insuficiente de tejidos y órganos causada por estenosis vascular o incluso por oclusión. Las reacciones inflamatorias, los vasoespasmos, los tromboembolismos, los embolismos grasos y la distribución desigual de la sangre pueden provocar enfermedades isquémicas, mientras que la aterosclerosis es la causa más común. La hipertensión, la hiperglucemia y la hiperlipidemia son factores importantes que promueven la aterosclerosis. Cuando se produce una aterosclerosis difusa grave en los vasos cerebrales, las arterias coronarias o las arterias periféricas, el tratamiento quirúrgico o médico suele mostrar un efecto deficiente y los pacientes tendrían un pronóstico desfavorable. La terapia de rehabilitación con ejercicios puede mejorar significativamente los síntomas y el pronóstico de los pacientes con accidente cerebrovascular isquémico, cardiopatía isquémica y arteriopatía periférica (Treat-Jacobson y cols., 2019; MacKay-Lyons y cols., 2020; Pelliccia y cols., 2021), y ya se ha utilizado como método de tratamiento junto con medicamentos y operaciones quirúrgicas. El músculo esquelético es el principal órgano involucrado en el ejercicio, a su vez, también es el órgano de mayor reserva de glucógeno y un importante órgano endócrino. El músculo esquelético puede producir miocinas que causan una serie de efectos biológicos a través de la secreción autócrina, parácrina o remota durante el ejercicio (Giudice y Taylor, 2017). Se informa que el ejercicio puede promover la angiogénesis en el músculo esquelético, el miocardio y el cerebro (Morland y cols., 2017; Longchamp y cols., 2018; Tryfonos y cols., 2021). La neovascularización es un mecanismo importante del ejercicio para mejorar los síntomas clínicos y el pronóstico de las enfermedades isquémicas. Algunos estudios han demostrado que este efecto del ejercicio está estrechamente relacionado con las miocinas. Esta revisión se centra en el progreso de la investigación actual del mecanismo subyacente a la promoción de la angiogénesis mediada por el ejercicio a través de las miocinas (Figura 1).
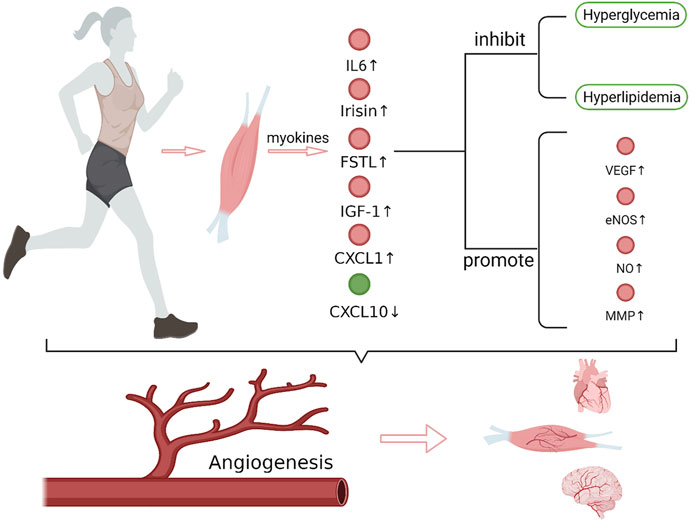
Figura 1. El ejercicio y las miocinas inducidas por el ejercicio en la promoción de la angiogénesis. Después del ejercicio, la expresión de IL-6, irisina, FSTL1, CXCL1, IGF-1 que promueven la angiogénesis aumenta en los músculos, mientras que la expresión de CXCL10, que inhibe la angiogénesis, disminuye. Estas miocinas regulan la expresión de factores relacionados con la angiogénesis, como VEGF, eNOS/NO y MMP, que desempeñan papeles importantes en la degradación de la matriz de células endoteliales, la migración de células endoteliales y la formación de lúmenes, y promueven sinérgicamente la angiogénesis. Además, las miocinas también mejoran la hiperglucemia y la hiperlipidemia. Juntos, estos efectos de las miocinas promueven la angiogénesis en el cerebro, el corazón y el tejido muscular. VEGF, factor de crecimiento del endotelio vascular; eNOS, óxido nítrico sintasa endotelial; MMP, metaloproteinasa de matriz (ver BioRender.com).
Angiogénesis y estrategias actuales para promover la angiogénesis
Mecanismos relacionados con la angiogénesis: fisiológicos y fisiopatológicos
En sentido estricto, la angiogénesis se refiere al proceso de degradación de la matriz endotelial microvascular o capilar original, la proliferación, migración y diferenciación de células endoteliales, formación de una nueva luz vascular en forma de gemación, síntesis de nueva matriz extravascular y la formación de nuevos vasos sanguíneos (Diaz-Flores y cols., 1994). Aunque en un sentido más amplio, la angiogénesis incluye el proceso de expansión, maduración o formación de arteriolas que contienen una capa muscular sobre la base de la luz vascular original. En la actualidad, se han encontrado muchas citocinas que regulan la angiogénesis, incluido el factor de crecimiento endotelial vascular (VEGF), el factor de crecimiento de fibroblastos (FGF), la angiopoyetina 1,2, factor de crecimiento transformante-β (TGF-β), eritropoyetina, factor de crecimiento epidérmico (EGF), la interleucina-6 (IL-6), la metaloproteinasa de matriz (MMP) y la óxido nítrico (NO) sintasa endotelial (eNOS) (Tabla 1). Entre ellos, el VEGF es la citoquina reguladora de la angiogénesis más crítica. Participa en muchos procesos de angiogénesis, como la proliferación y migración de células endoteliales, cambios en la permeabilidad vascular y degeneración de la matriz extracelular. La MMP también juega un papel extremadamente importante en la degradación del colágeno alrededor de los microvasos en la etapa temprana de la angiogénesis. El complejo formado por la membrana celular-MMP y la uroquinasa en los seudópodos celulares puede adherirse a las células endoteliales migratorias y mejorar la tasa de migración y la tasa de supervivencia de las células endoteliales (van Hinsbergh y cols., 2006). El FGF puede promover la migración de células endoteliales, la proliferación de células de músculo liso y la maduración gradual de la luz vascular recién formada. Las células endoteliales pueden sintetizar NO bajo la regulación de eNOS. En condiciones fisiológicas, el NO puede aumentar el nivel de cGMP en las células y afectar el proceso de transcripción del ARNm, y los efectos angiogénicos de FGF-2 y de VEGF están estrechamente relacionados con la vía de señalización del NO (Ziche y Morbidelli, 2000; Kivela y cols., 2019).
Tabla 1. Función de las citocinas relacionadas con la angiogénesis en la promoción de la angiogénesis.

Estrategias actuales para promover la angiogénesis
La angiogénesis es un método eficaz para mejorar la perfusión sanguínea en tejidos y órganos isquémicos y aliviar los síntomas isquémicos. Las estrategias actuales para promover la angiogénesis para el tratamiento de enfermedades isquémicas (incluidas las que están en desarrollo) incluyen la terapia celular, la terapia génica, la terapia con citoquinas y la rehabilitación con ejercicios (Losordo y Dimmeler, 2004a, b). Strauer y cols. (Strauer y cols., 2002) trasplantaron monocitos autólogos de médula ósea en la pared interna de los vasos sanguíneos de un paciente con infarto de miocardio a través de un catéter de intervención y encontraron que estas células de monocitos de médula ósea pueden mejorar significativamente la perfusión en el área isquémica al promover la angiogénesis. Además, el trasplante de células madre autólogas de médula ósea en el sitio isquémico en pacientes con enfermedad arterial periférica también puede mejorar los síntomas causados por la isquemia (Tateishi-Yuyama y cols., 2002). En la actualidad, los objetivos de la terapia génica y de citoquinas para promover la angiogénesis incluyen principalmente el VEGF y sus receptores, proteínas de la familia FGF y HIF-1. Entre ellos, se ha encontrado que el VEGF y el FGF promueven la perfusión miocárdica en ensayos clínicos de fase Ⅰ o fase Ⅱ en el tratamiento de pacientes con cardiopatía isquémica (Losordo y Dimmeler, 2004a). Aunque muchos experimentos con animales que utilizan terapia génica promovieron con éxito la angiogénesis periférica, los ensayos clínicos controlados aleatorios de fase Ⅱ o fase Ⅲ de terapia génica para enfermedades arteriales periféricas han mostrado resultados tanto positivos como negativos. Por lo tanto, la perspectiva de aplicación de la terapia génica para promover la angiogénesis periférica aún no está clara (Simon y cols., 2022). En comparación con estas estrategias anteriores, la rehabilitación con ejercicios se ha incorporado en muchas pautas autorizadas como un método de mejora para muchas enfermedades isquémicas (Treat-Jacobson y cols., 2019; MacKay-Lyons y cols., 2020; Pelliccia y cols., 2021). La mejora de los síntomas isquémicos mediada por el ejercicio está estrechamente relacionada con la promoción de la angiogénesis. El ensayo clínico EXCITE demostró que la rehabilitación con ejercicios puede promover el crecimiento de la circulación colateral coronaria en pacientes con angina de pecho estable (Mobius-Winkler y cols., 2016). La densidad capilar por unidad de músculo esquelético en hombres jóvenes con buena práctica de ejercicio fue significativamente mayor que la de hombres no entrenados (Hermansen y Wachtlova, 1971). Después del entrenamiento aeróbico, se encontró que los niveles de VEGF y la densidad capilar en el cerebro del ratón aumentaban significativamente (Morland y cols., 2017). Por lo tanto, la terapia con ejercicios juega un papel importante en la mejora de los síntomas y el pronóstico de las enfermedades isquémicas, una discusión profunda de la función y el mecanismo del ejercicio para promover la angiogénesis es de gran importancia para mejorar el efecto terapéutico de la terapia con ejercicios, formulando planes de tratamiento individualizados, y también descubriendo nuevos objetivos terapéuticos.
Cambios en el ambiente interno inducidos por el ejercicio en el contexto de la angiogénesis
El efecto del ejercicio sobre el metabolismo de la glucosa y los lípidos
Muchos estudios han informado que el papel del ejercicio en la promoción de la angiogénesis está relacionado con los cambios del entorno interno después del ejercicio. Por ejemplo, la hiperlipidemia y la hiperglucemia pueden dañar la función endotelial, causar reacciones inflamatorias endoteliales vasculares, promover la formación de aterosclerosis e inhibir la angiogénesis. El ejercicio puede aumentar significativamente la tasa metabólica de los lípidos y la glucosa en la sangre. La observación clínica muestra que el entrenamiento aeróbico mejora los niveles de lípidos en sangre de pacientes con hiperlipidemia (Zhao y cols., 2021). La obesidad inducida por una dieta rica en grasas también tiene un efecto negativo sobre la angiogénesis. El ejercicio aeróbico puede mejorar la obesidad y promover las expresiones de miocinas y del VEGF (Shin y cols., 2015). Además, el músculo esquelético representa la mayor parte de la utilización de la glucosa bajo estimulación con insulina, por lo que desempeña un papel importante en el control de la glucosa en sangre y la homeostasis metabólica. Durante la contracción muscular, aumenta la circulación del transportador de glucosa cuatro en la membrana celular de las células del músculo esquelético, lo que mejora la captación de glucosa y reduce la concentración de glucosa en sangre (Nedachi y cols., 2008). Además, el ejercicio puede mejorar la resistencia a la insulina en pacientes obesos y mejorar la utilización de la glucosa en el tejido muscular (Coffey y Hawley, 2007).
El efecto del ejercicio sobre las citocinas relacionadas con la angiogénesis
Excepto por el metabolismo de los lípidos y la glucosa en la sangre, el nivel de expresión y la distribución de las citocinas relacionadas con la angiogénesis también están reguladas por el ejercicio para promover la angiogénesis (Bloor, 2005). Gavin y cols. (Gavin y cols., 2004) demostraron que el nivel de proteína del VEGF en el tejido muscular disminuyó después del ejercicio, mientras que el nivel de proteína del VEGF en el suero y el miocardio aumentó (Yazdani y cols., 2020; Dastah y cols., 2021). La diferencia del nivel de proteína del VEGF en diferentes tejidos después del ejercicio puede deberse al aumento del volumen de sangre en el músculo durante el ejercicio, lo que resultó en la redistribución de la proteína del VEGF. Además, la síntesis del NO también cambia significativamente durante el ejercicio (Dyakova y cols., 2015). El NO se consideró por primera vez como un factor inflamatorio que regula la vasoconstricción. Posteriormente, se descubrió que el NO juega un papel importante en la angiogénesis. La síntesis de NO está regulada por eNOS, y el efecto de NO/eNOS está estrechamente relacionado con el VEGF. El nivel de proteína de eNOS en el miocardio aumentó después del ejercicio, lo que se correlacionó con una mayor expresión del VEGF (Iemitsu y cols., 2006). La expresión de ARNm de los receptores del VEGF (Flt-1 y Flk-1) aumentó después del ejercicio, pero este aumento podría ser inhibido por el inhibidor de la NOS, lo que indica que el NO puede estar involucrado en la regulación de la expresión del VEGF (Gavin y Wagner, 2002). Lee y cols. (Lee y cols., 2000) demostraron que el NO promueve la migración y diferenciación de células endoteliales mediante la regulación al alza de la expresión de integrina αvβ3. Si la función de la integrina αvβ3 se inhibió en las células endoteliales, incluso en presencia del VEGF, se dañó la vía de señalización descendente del VEGFR2, así como la migración y adhesión de las células endoteliales (Danilucci y cols., 2019). Ranjbar y cols. (Ranjbar y cols., 2016) demostraron que el efecto del ejercicio aeróbico sobre la neogénesis de la arteria miocárdica en ratas con infarto de miocardio también se correlacionó con una mayor expresión de TGF-β. El ejercicio aeróbico puede aumentar la expresión de TGF-β para promover la angiogénesis y proteger la función cardiovascular. Después de 8 semanas de entrenamiento aeróbico, la densidad de los vasos sanguíneos del miocardio en ratas diabéticas aumentó significativamente y la expresión de TGF-β y otras citocinas que regulan la angiogénesis en el miocardio también aumentó significativamente (Yazdani y cols., 2020).
Por lo tanto, el ejercicio puede promover la angiogénesis a través de cambios sistémicos en el entorno interno, incluidos los lípidos sanguíneos y el metabolismo de la glucosa, así como la expresión de citocinas relacionadas con la angiogénesis. Además, el efecto del ejercicio sobre el metabolismo local y la síntesis de citocinas, especialmente en el músculo esquelético, también juega un papel importante en la promoción de la angiogénesis.
Miocinas inducidas por el ejercicio en la promoción de la angiogénesis.
El mecanismo subyacente a la expresión de miocinas inducida por el ejercicio
Las miocinas son proteínas o polipéptidos producidos por el tejido muscular durante la contracción. La miocina descubierta más precozmente fue la IL-6. Desde entonces, se han ido descubriendo gradualmente miembros de la familia CXCL, irisina, FSTL1 e IGF-1 (Gomarasca y cols., 2020; Kwon y cols., 2020). Las miocinas pueden afectar la función de los músculos y otros tejidos y órganos a través de la secreción autócrina, parácrina o remota. Las miocinas mantienen la forma y la función de las células musculares, promueven la reparación de las células musculares dañadas y la proliferación de las células del músculo esquelético a través de la acción autócrina. El efecto parácrino de las miocinas juega un papel importante en la angiogénesis del músculo esquelético inducida por el ejercicio. Además, las miocinas también pueden llegar al hígado, el corazón y otros órganos a través de la secreción a larga distancia y participar en los procesos de control de la glucosa y los lípidos en sangre, así como en la angiogénesis.
La síntesis de miocina inducida por el ejercicio se ve afectada por la intensidad del ejercicio, el tipo de movimiento, la duración y la temperatura. El entrenamiento de la resistencia, el ejercicio de fuerza y el ejercicio aeróbico intermitente de alta intensidad pueden aumentar significativamente la concentración de proteína 1 similar a la folistatina (FSTL1) en circulación (Kon y cols., 2020; Xi y cols., 2020). El entrenamiento de la fuerza y de la resistencia pueden aumentar la concentración de IGF-1 en la circulación de hombres mayores sin diferencia (Arazi y cols., 2021). En adolescentes obesos, la concentración sérica de IGF-1 se reduce, 4 semanas de ejercicio moderado pueden aumentar la actividad pero no la concentración de IGF-1 (Yang y cols., 2018). Aunque la expresión del ARNm de la IL-6 en el músculo esquelético de ratas con dieta rica en grasas es más alta que en los ratones de control, podría reducirse a un nivel mucho más bajo con ejercicio aeróbico (Gopalan y cols., 2021; Shirvani y cols., 2021). Mientras que para los pacientes diabéticos, 6 meses de entrenamiento de la fuerza no tuvieron efecto sobre la concentración sérica de la IL-6 bajo la misma condición de pérdida de peso (Miller y cols., 2017). Además, la expresión de ARNm de la IL-6 en el músculo de una extremidad trasera de rata a 18°C fue significativamente menor que la de la extremidad opuesta a 37°C, mientras que la expresión de ARNm de CXCL1 fue mayor a 18°C que a 37°C (Krapf y cols., 2021). Cuando las células del músculo esquelético humano se calentaron de 18 a 37°C, la expresión de ARNm de la IL-6 y de CXCL1 aumentó significativamente.
Hasta el momento, no se ha demostrado claramente cómo la síntesis de miocinas inducida por el ejercicio. Por ejemplo, los cambios en el NO, la proteína arginina metiltransferasa 1 (PRMT1) y la histona desacetilasa 5 (HDAC5) participan en la regulación de la expresión de la IL-6 después del ejercicio. El inhibidor del NO podría reducir la expresión de ARNm de la IL-6 inducida por el ejercicio, mientras que después de la administración de nitroglicerina, que podría aumentar la concentración del NO, la expresión de ARNm de IL-6 aumentó significativamente, lo que sugiere que el NO está involucrado en la regulación de la expresión de ARNm de la IL-6 (Steensberg y cols., 2007). El efecto del NO sobre la expresión de la IL-6 puede atribuirse a su efecto sobre el aumento de la concentración de cGMP. Además, NF-κB es un factor de transcripción sensible a reacciones rédox. Algunos estudios han demostrado que la inhibición de NF-κB reduce la transcripción y la síntesis de la IL-6 inducidas por el ejercicio (Pedersen y Febbraio, 2008). Sin embargo, otros estudios en personas obesas mostraron que el ejercicio promueve la expresión de IL-6 antes de la activación de NF-κB (Tantiwong y cols., 2010). La PRMT1 es una proteasa importante implicada en la modificación postranscripcional de moléculas de señalización. Puede metilar RelA, lo que resulta en su incapacidad para unirse al ADN y, en consecuencia, afectar la activación de NF-κB (Reintjes y cols., 2016). Los niveles de expresión de proteína y ARNm de PRMT1 aumentan significativamente después del ejercicio extenuante, pero no después del ejercicio a largo plazo (van Lieshout y cols., 2019). En ratones deficientes en PRMT1, la expresión de IL-6 en el hígado disminuyó, lo que sugiere que la PRMT1 está involucrada en la regulación de la expresión de IL-6 (Zhao y cols., 2019). Klimenko y cols. (Klymenko y cols., 2020) encontraron que HDAC5 puede regular negativamente la expresión del gen de la IL-6 y luego afectar la absorción de glucosa en las células del músculo esquelético. Mediante la estimulación eléctrica de las células C2C12 para generar un modelo de contracción muscular, se descubrió que la expresión de la IL-6 en los miocitos deficientes en HDAC5 era mayor que en las células de tipo salvaje, lo que sugiere que HDAC5 también participaba en la regulación de la expresión de la IL-6 inducida por el ejercicio.
El efecto y mecanismo de las miocinas inducidas por el ejercicio en la promoción de la angiogénesis
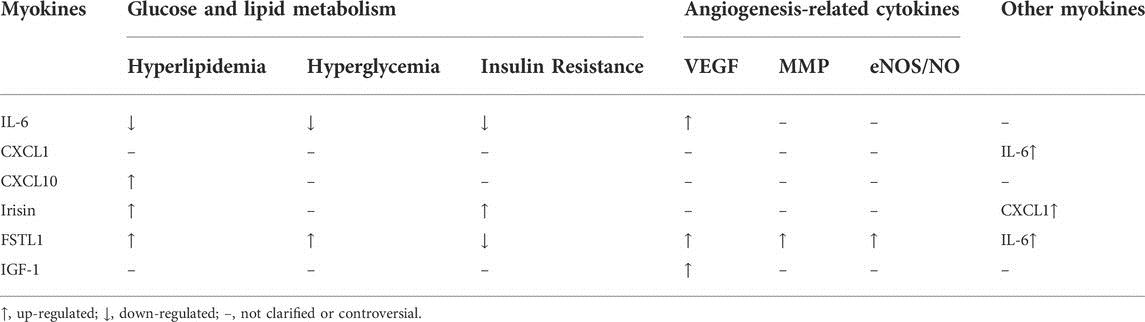
Se ha descubierto que las miocinas inducidas por el ejercicio desempeñan un papel importante en la promoción de la angiogénesis en el músculo esquelético y en la mejora de los síntomas isquémicos en todo el cuerpo (Tabla 2).
Tabla 2. Los mecanismos de las miocinas para promover la angiogénesis.
IL-6
Anteriormente se pensaba que la IL-6 era una citocina proinflamatoria secretada por los leucocitos. La IL-6 puede participar en la angiogénesis del tejido tumoral, desempeñando así un papel importante en la tumorigénesis y su desarrollo (Ancrile y cols., 2007; Lin y cols., 2012). El papel de la IL-6 en la promoción de la angiogénesis en los tejidos tumorales está estrechamente relacionado con el VEGF (Ando y cols., 2019; Xiao y cols., 2021). Del mismo modo, el ejercicio aeróbico puede promover la expresión de IL-6 y del VEGF y mejorar el estado metabólico de todo el cuerpo en personas obesas. Aparte de eso, la IL-6 también está estrechamente relacionada con el síndrome metabólico y la resistencia a la insulina (Yousefabadi y cols., 2021; El-Toukhy y cols., 2022). El tratamiento con la IL-6 puede promover la transferencia del transportador de glucosa a la superficie de la membrana celular y promover la absorción de glucosa (Carey y cols., 2006). Además, la IL-6 puede inducir la expresión del péptido 1 similar al glucagón, mejorando así la secreción de insulina y los niveles de glucosa en sangre (Ellingsgaard y cols., 2011; Ellingsgaard y cols., 2020). En las personas obesas, la IL-6 también regula el metabolismo de la glucosa y la liberación de insulina al afectar la gluconeogénesis en los hepatocitos para afectar la glucosa en sangre (Knudsen y cols., 2016; Peppler y cols., 2019). Además, se ha descubierto que la IL-6 derivada del músculo mejora la resistencia a la insulina mediante la activación de la AMPK y la inhibición de la vía de señalización p38/MAPK (Tang y cols., 2019). Por lo tanto, la IL-6 inducida por el ejercicio aeróbico puede promover la angiogénesis al aumentar la expresión del VEGF y mejorar el estado metabólico de todo el cuerpo.
Proteínas de la familia CXCL
Las proteínas de la familia CXCL se han dividido en dos categorías según sus diferentes dominios: las proteínas ELR + CXCL contienen una secuencia Glu-Leu-Arg en el N-terminal, mientras que las proteínas ELR-CXCL no la contienen. El primero incluye CXCL1-3 y CXCL5-8, que se unen a CXCR1 y/o CXCR2 para promover la angiogénesis. Estos últimos incluyen CXCL4, CXCL4L1 y CXCL9-14, que pueden unirse a CXCR3, CXCR4, CXCR5 o CXCR7 para ejercer un efecto antiangiogénico (Lee y cols., 2018). El ejercicio puede aumentar los niveles de ARNm y proteína de CXCL1 en los músculos antes que la IL-6, lo que sugiere que CXCL1 puede promover la angiogénesis al regular la expresión de IL-6 (Pedersen y cols., 2011). La CXCL10, también conocida como proteína inducible por interferón γ, es secretada por monocitos y células endoteliales y puede regular la quimiotaxis, la proliferación celular y la apoptosis (Sui y cols., 2004). Los experimentos con animales muestran que el músculo esquelético puede inhibir la expresión de CXCL10 durante la contracción, y la vía de señalización de p38/MAPK puede estar involucrada en este proceso regulador; los experimentos con células muestran que la CXCL10 puede inhibir la actividad de las células endoteliales (Ishiuchi y cols., 2018). En el modelo de ratón con obesidad inducida por una dieta rica en grasas, la expresión de CXCL10 en el músculo esquelético aumenta y la densidad capilar disminuye, mientras que después del entrenamiento aeróbico, la expresión de CXCL10 se reduce y la densidad capilar aumenta (Ishiuchi-Sato y cols., 2020). Por lo tanto, el aumento de la expresión de CXCL1 inducido por el ejercicio y la disminución de la expresión de CXCL10 en los músculos pueden desempeñar un papel sinérgico en la promoción de la angiogénesis, sin embargo, el mecanismo por el cual regulan la angiogénesis sigue siendo en gran parte desconocido.
Irisina
La irisina se deriva de la proteína 5 del dominio de la fibronectina III, que está regulada por el factor de transcripción PGC1α (Bostrom y cols., 2012). La función de la irisina está íntimamente relacionada con el metabolismo. En pacientes con diabetes mellitus gestacional, el nivel de irisina en sangre es significativamente más alto en comparación con personas sanas y se correlaciona positivamente con el nivel de insulina en ayunas (Ebert y cols., 2014). El ejercicio prenatal puede inducir la producción de irisina y promover la homeostasis de la glucosa en sangre y mejorar los trastornos metabólicos causados por el embarazo (Szumilewicz y cols., 2017). Las pacientes con síndrome de ovario poliquístico también muestran niveles más altos de irisina en suero y líquido folicular que las personas sanas, lo que se correlaciona positivamente con la resistencia a la insulina (Bousmpoula y cols., 2019). Además, también existe una correlación positiva entre el nivel de irisina y la resistencia de los islotes en personas obesas. Aunque la intervención integral y el control del peso no pudieron cambiar el nivel de irisina, las personas obesas con un nivel alto de irisina mostraron una mayor mejora en la tasa de grasa corporal, la glucosa en sangre y los triglicéridos que las personas obesas con un nivel bajo de irisina (Fukushima y cols., 2016). Sin embargo, en pacientes con diabetes tipo I, el nivel de irisina en plasma es significativamente más bajo que en personas sanas (Tentolouris y cols., 2018), por lo que se espera que la irisina sea un nuevo tratamiento para la diabetes (Leung, 2017). Esto sugirió que la irisina también podría mejorar indirectamente los síntomas de la enfermedad isquémica y promover la angiogénesis a través de la mejora del metabolismo.
De hecho, la irisina puede reparar la lesión de las células endoteliales de la vena umbilical humana (HUVEC) causada por niveles altos de glucosa a través de la vía de señalización de Notch, reducir la expresión de proteínas relacionadas con la apoptosis y aumentar la expresión del VEGFA en las HUVEC (Wang y cols., 2021). En HUVEC con lesión de lipoproteínas, la irisina promueve la angiogénesis a través de la vía de señalización Akt/mTOR/S6K1/Nrf2 (Zhang y Cao, 2019). Wu y cols. (Wu y cols., 2015) también confirman que la irisina aumenta la expresión de MMP2 y MMP9 a través de la vía de señalización ERK y promueve la angiogénesis en HUVEC y embriones del pez cebra. En el modelo animal de infarto de miocardio, el tratamiento con irisina también muestra protección del miocardio y mejor angiogénesis al borde del infarto (Liao y cols., 2019). Además, la irisina también puede estimular la secreción de CXCL1 por parte de los adipocitos y mejorar la adhesión de las células endoteliales (Shaw y cols., 2021). Juntos, estos resultados sugieren que la irisina tiene un gran valor de aplicación para promover la angiogénesis y mejorar los síntomas de las enfermedades isquémicas.
FSTL1
La FSTL1, también conocida como TSC-36 o FRP, es una glucoproteína secretora producida por células de tejido mesenquimatoso (Chaly y cols., 2014). Primero se consideró como una molécula de proteína proinflamatoria inducida por el TGF-β y puede inducir la síntesis de IL-6 (Shibanuma y cols., 1993; Miyamae y cols., 2006). La FSTL1 se expresa en muchas células y tejidos, los animales que carecen del gen FSTL1 mueren poco después del nacimiento (Geng y cols., 2011). La FSTL1 juega un papel importante en el desarrollo posnatal de vasos pulmonares, la deficiencia de FSTL1 en células endoteliales de ratón afecta la remodelación de vasos pulmonares (Tania y cols., 2017). La FSTL1 también participa en la regulación del metabolismo y su nivel está estrechamente relacionado con la resistencia a la insulina. En pacientes obesos y diabéticos, el nivel circulante de FSTL1 es significativamente más alto en comparación con personas sanas. Mientras que la expresión de FSTL1 disminuye significativamente en la hiperinsulinemia incluso con glucosa en sangre normal (Xu y cols., 2020). Se ha descubierto que la FSTL1 desempeña un papel importante en la promoción de la angiogénesis en la metástasis tumoral y en algunas enfermedades isquémicas. La FSTL1 derivada del músculo puede inducir la angiogénesis cardíaca en ratas con infarto de miocardio mediante la regulación de la vía de señalización DIP2A-SMAD2/3 (Xi y cols., 2020). La FSTL1 mejora la función de las células endoteliales vasculares en el tejido isquémico al afectar la fosforilación de eNOS, promoviendo aún más la angiogénesis (Ouchi y cols., 2008). La FSTL1 también regula la expresión génica de MMP1, MMP3 y MMP13 (Ni y cols., 2019). La deficiencia de FSTL1 disminuye el VEGF, α-SMA y otros genes relacionados con la síntesis de matriz extracelular en HUVEC, mientras que la sobreexpresión de FSTL1 aumenta la expresión de estos genes (Niu y cols., 2021). Estos resultados sugieren que la FSTL1 está estrechamente relacionada con la síntesis y degradación de la matriz extracelular. Además, la deficiencia de HDAC5 en las células endoteliales de pacientes con esclerodermia aumenta la expresión de FSTL1 y mejora la capacidad de las células endoteliales para formar túbulos en Matrigel, lo que sugiere que la promoción de la angiogénesis mediada por la FSTL1 depende de HDAC5 (Tsou y cols., 2016). Por lo tanto, la FSTL1 puede ser fundamental para promover la angiogénesis en enfermedades isquémicas al regular la glucosa en sangre, el VEGF y la síntesis de matriz celular, que pueden mejorar los síntomas y el pronóstico de las enfermedades isquémicas.
IGF-1
El IGF-1 consta de cuatro subunidades: A, B, C y D. Las estructuras de las subunidades A y B son similares a las de la insulina, la función de la subunidad C es diferente de la de la insulina y la insulina no tiene subunidad D. El IGF-1 puede promover la proliferación celular y la angiogénesis y resistir la apoptosis (Duan y cols., 2010). Aunque la secreción de IGF-1 aumenta durante el entrenamiento aeróbico de alta intensidad, la concentración sérica de su ligadura se mantuvo sin cambios (Nishida y cols., 2010). La observación clínica muestra que el nivel de expresión de IGF-1 está estrechamente relacionado con el grado de angiogénesis retiniana en pacientes diabéticos (Hellstrom y cols., 2002). En el modelo de infarto de miocardio inducido por isoproterenol, el IGF-1 promueve la angiogénesis mediante la inducción de la expresión de IL-8 (Haleagrahara y cols., 2011). El tratamiento con IGF-1 en ratas con infarto de miocardio puede promover la expresión de VEGF y mejorar el grado de isquemia miocárdica (Lisa y cols., 2011). El ejercicio y la suplementación con IGF-1 pueden reducir el grado de neuropatía inducida por la diabetes y aumentar la expresión de VEGF-A y la angiogénesis (Saboory y cols., 2020). En el modelo de ratón de lesión muscular subclínica, el IGF-1 sólo no pudo aumentar significativamente la angiogénesis, pero el IGF-1 combinado con el ejercicio podría aumentar la densidad capilar muscular y promover la regeneración muscular (Alcazar y cols., 2020). Estos estudios anteriores muestran que el efecto de promoción de la angiogénesis a partir del IGF-1 está estrechamente relacionado con la expresión del VEGF, y la suplementación con IGF-1 puede mejorar la promoción de la angiogénesis mediada por el ejercicio.
Limitación
Aunque se ha descubierto que las miocinas promueven la angiogénesis, los estudios actuales sobre el mecanismo detallado de cómo las miocinas inducidas por el ejercicio promueven la angiogénesis y mejoran los síntomas de las enfermedades isquémicas siguen siendo inadecuados. En primer lugar, el metabolismo de la glucosa y los lípidos, las citocinas están estrechamente relacionadas con la angiogénesis, por lo que se cree que las miocinas que podrían regular estos factores tienen funciones promotoras de la angiogénesis. Sin embargo, falta evidencia directa que demuestre la relación entre las miocinas y la angiogénesis durante el ejercicio. El mecanismo molecular, como el objetivo directo o los receptores y la señalización posterior de las miocinas para promover la angiogénesis, debe descubrirse en el futuro. En segundo lugar, los datos de la investigación clínica y en animales sobre el tratamiento de enfermedades isquémicas mediante el ejercicio o las miocinas, son insuficientes, probablemente debido a la falta de indicadores efectivos de la angiogénesis, excepto los marcadores metabólicos y las citocinas relacionadas. Aunque algunos estudios han utilizado el ejercicio o las miocinas en diferentes enfermedades y obtienen resultados positivos, el efecto de la gravedad de la enfermedad, los tipos de ejercicio y el nivel de miocinas sobre la angiogénesis deben demostrarse de manera mucho más clara. En tercer lugar, algunas miocinas, como las interleucinas y las quimiocinas, también son citocinas proinflamatorias que deben tenerse en cuenta con cuidado porque la inflamación también contribuye al desarrollo de enfermedades isquémicas. Aunque sus expresiones también podrían estar correlacionadas con el nivel del estado metabólico o incluso con citocinas relacionadas con la angiogénesis, es difícil definir la función principal de estas miocinas en el entorno interno. Por lo tanto, futuros estudios deberían esclarecer en profundidad el efecto del ejercicio o de las miocinas sobre aquellos factores intracelulares y extracelulares que directamente promueven la angiogénesis.
Resumen y perspectivas
Promover la angiogénesis es sin duda un método eficaz para mejorar la perfusión de tejidos y órganos, especialmente en enfermedades isquémicas que no pueden ser tratadas mediante cirugía. El beneficio y la seguridad de la rehabilitación con ejercicios para pacientes con enfermedades isquémicas han sido ampliamente reconocidos. Durante el ejercicio, aumentó la expresión de miocinas que promueven la angiogénesis, incluidas la IL-6, irisina, FSTL1, CXCL1, IGF-1, mientras que disminuyó la expresión de CXCL10, que inhibe la angiogénesis. Estas miocinas regulan los factores relacionados con la angiogénesis, como el VEGF, NOS y MMP, que desempeñan un papel importante en la degradación de la matriz de células endoteliales, la migración de células endoteliales y la formación de lúmenes, y promueven sinérgicamente la angiogénesis. Además, la mejora de la hiperglucemia y la hiperlipidemia por el ejercicio también proporciona un entorno interno favorable para la angiogénesis.
Actualmente, el efecto del tratamiento quirúrgico suele ser pobre para las enfermedades isquémicas causadas por enfermedades vasculares difusas. El tratamiento médico implica principalmente la regulación de la glucosa en sangre, los lípidos en sangre y la antiaterosclerosis, así como la prevención de la trombosis. Sin embargo, no existe ningún medicamento que pueda promover directamente la angiogénesis. Algunos estudios clínicos han confirmado que la rehabilitación con ejercicios es un tratamiento seguro y eficaz para la cardiopatía isquémica, los accidentes cerebrovasculares y las enfermedades vasculares periféricas. Debido al efecto prometedor de la rehabilitación con ejercicios sobre la angiogénesis y la perfusión tisular, su valor en el tratamiento de enfermedades isquémicas llamará cada vez más la atención en el futuro, especialmente en enfermedades isquémicas causadas por enfermedades vasculares difusas. Las miocinas generadas durante el ejercicio también han demostrado su potencial para promover la angiogénesis in vivo y se espera que sean un nuevo objetivo molecular para el tratamiento de enfermedades isquémicas. Además, el efecto de mejora del síndrome metabólico a partir de las miocinas puede hacer que beneficie a un número mucho mayor de pacientes con obesidad y diabetes. Por lo tanto, vale la pena realizar estudios más detallados sobre la función y los mecanismos del ejercicio y las miocinas para promover la angiogénesis. El estudio futuro podría centrarse en: 1) cómo el ejercicio induce las expresiones de miocinas en las células musculares, el efecto de la vía de contracción en los cambios epigenéticos de los genes relacionados con las miocinas; 2) La función directa de las miocinas en la angiogénesis, el receptor y la señalización descendente de las miocinas en las células endoteliales vasculares, así como el efecto en la angiogénesis de órganos usando evidencia visual dinámica in vivo; 3) Los datos clínicos sobre el cambio de miocinas antes y después del ejercicio en pacientes con enfermedades isquémicas, el efecto del ejercicio sobre la angiogénesis en órganos isquémicos deben recopilarse sistemáticamente y analizarse cuidadosamente teniendo en cuenta el tipo de ejercicio, la gravedad de la enfermedad y otros antecedentes de enfermedades a tener en cuenta.
Financiamiento
Este trabajo fue apoyado por subvenciones del Departamento de Finanzas de la Provincia de Jilin, China [No.2019SCZT004], el Departamento de Ciencia y Tecnología de la Provincia de Jilin, China [No.20190905002SF] y el Programa Nacional Clave de I+D de China [No.2016YFC1301100 ].
Conflicto de intereses
Los autores declaran que la investigación se realizó en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de interés.
Referencias
1. Alcazar C. A., Hu C., Rando T. A., Huang N. F., Nakayama K. H. (2020). Transplantation of insulin-like growth factor-1 laden scaffolds combined with exercise promotes neuroregeneration and angiogenesis in a preclinical muscle injury model. Biomater. Sci. 8, 5376–5389.
2. Ancrile B., Lim K. H., Counter C. M. (2007). Oncogenic Ras-induced secretion of IL6 is required for tumorigenesis. Genes. Dev. 21, 1714–1719.
3. Ando N., Hara M., Shiga K., Yanagita T., Takasu K., Nakai N., et al. (2019). Eicosapentaenoic acid suppresses angiogenesis via reducing secretion of IL6 and VEGF from colon cancerassociated fibroblasts. Oncol. Rep. 42, 339–349.
4. Arazi H., Babaei P., Moghimi M., Asadi A. (2021). Acute effects of strength and endurance exercise on serum BDNF and IGF-1 levels in older men. BMC Geriatr. 21, 50.
5. Bloor C. M. (2005). Angiogenesis during exercise and training. Angiogenesis 8, 263–271.
6. Bostrom P., Wu J., Jedrychowski M. P., Korde A., Ye L., Lo J. C., et al. (2012). A PGC1-alpha-dependent myokine that drives brown-fat-like development of white fat and thermogenesis. Nature 481, 463–468.
7. Bousmpoula A., Benidis E., Demeridou S., Kapeta-Kourkouli R., Chasiakou A., Chasiakou S., et al. (2019). Serum and follicular fluid irisin levels in women with polycystic ovaries undergoing ovarian stimulation: Correlation with insulin resistance and lipoprotein lipid profiles. Gynecol. Endocrinol. 35, 803–806.
8. Carey A. L., Steinberg G. R., Macaulay S. L., Thomas W. G., Holmes A. G., Ramm G., et al. (2006). Interleukin-6 increases insulin-stimulated glucose disposal in humans and glucose uptake and fatty acid oxidation in vitro via AMP-activated protein kinase. Diabetes 55, 2688–2697.
9. Chaly Y., Hostager B., Smith S., Hirsch R. (2014). Follistatin-like protein 1 and its role in inflammation and inflammatory diseases. Immunol. Res. 59, 266–272.
10. Coffey V. G., Hawley J. A. (2007). The molecular bases of training adaptation. Sports Med. 37, 737–763.
11. Danilucci T. M., Santos P. K., Pachane B. C., Pisani G. F. D., Lino R. L. B., Casali B. C., et al. (2019). Recombinant RGD-disintegrin DisBa-01 blocks integrin αvβ3 and impairs VEGF signaling in endothelial cells. Cell. Commun. Signal. 17, 27.
12. Dastah S., Tofighi A., Bonab S. B. (2021). The effect of aerobic exercise on the expression of mir-126 and related target genes in the endothelial tissue of the cardiac muscle of diabetic rats. Microvasc. Res. 138, 104212.
13. Diaz-Flores L., Gutierrez R., Varela H. (1994). Angiogenesis: An update. Histol. Histopathol. 9, 807–843.
14. Duan C., Ren H., Gao S. (2010). Insulin-like growth factors (IGFs), IGF receptors, and IGF-binding proteins: Roles in skeletal muscle growth and differentiation. Gen. Comp. Endocrinol. 167, 344–351.
15. Dyakova E. Y., Kapilevich L. V., Shylko V. G., Popov S. V., Anfinogenova Y. (2015). Physical exercise associated with NO production: Signaling pathways and significance in health and disease. Front. Cell. Dev. Biol. 3, 19.
16. Ebert T., Stepan H., Schrey S., Kralisch S., Hindricks J., Hopf L., et al. (2014). Serum levels of irisin in gestational diabetes mellitus during pregnancy and after delivery. Cytokine 65, 153–158.
17. El-Toukhy S. E., Ashour M. N., Mohamed N. A., Gouhar S. A., Nazeeh N. N., Youness E. R. (2022). Potential role of novel myokine in rats-induced metabolic syndrome. Biointerface Res. App 12, 3305–3315.
18. Ellingsgaard H., Hauselmann I., Schuler B., Habib A. M., Baggio L. L., Meier D. T., et al. (2011). Interleukin-6 enhances insulin secretion by increasing glucagon-like peptide-1 secretion from L cells and alpha cells. Nat. Med. 17, 1481–1489.
19. Ellingsgaard H., Seelig E., Timper K., Coslovsky M., Soederlund L., Lyngbaek M. P., et al. (2020). GLP-1 secretion is regulated by IL-6 signalling: A randomised, placebo-controlled study. Diabetologia 63, 362–373.
20. Fukushima Y., Kurose S., Shinno H., Thi Thu H. C., Takao N., Tsutsumi H., et al. (2016). Effects of body weight reduction on serum irisin and metabolic parameters in obese subjects. Diabetes Metab. J. 40, 386–395.
21. Gavin T. P., Robinson C. B., Yeager R. C., England J. A., Nifong L. W., Hickner R. C. (2004). Angiogenic growth factor response to acute systemic exercise in human skeletal muscle. J. Appl. Physiol. 96 (1985), 19–24.
22. Gavin T. P., Wagner P. D. (2002). Attenuation of the exercise-induced increase in skeletal muscle Flt-1 mRNA by nitric oxide synthase inhibition. Acta Physiol. Scand. 175, 201–209.
23. Geng Y., Dong Y., Yu M., Zhang L., Yan X., Sun J., et al. (2011). Follistatin-like 1 (Fstl1) is a bone morphogenetic protein (BMP) 4 signaling antagonist in controlling mouse lung development. Proc. Natl. Acad. Sci. U. S. A. 108, 7058–7063.
24. Giudice J., Taylor J. M. (2017). Muscle as a paracrine and endocrine organ. Curr. Opin. Pharmacol. 34, 49–55.
25. Gomarasca M., Banfi G., Lombardi G. (2020). Myokines: The endocrine coupling of skeletal muscle and bone. Adv. Clin. Chem. 94 94, 155–218.
26. Gopalan V., Yaligar J., Michael N., Kaur K., Anantharaj R., Verma S. K., et al. (2021). A 12-week aerobic exercise intervention results in improved metabolic function and lower adipose tissue and ectopic fat in high-fat diet fed rats. Biosci. Rep. 41, BSR20201707.
27. Haleagrahara N., Chakravarthi S., Mathews L. (2011). Insulin like growth factor-1 (IGF-1) Causes overproduction of IL-8, an angiogenic cytokine and stimulates neovascularization in isoproterenol-induced myocardial infarction in rats. Int. J. Mol. Sci. 12, 8562–8574.
28. Hellstrom A., Carlsson B., Niklasson A., Segnestam K., Boguszewski M., De Lacerda L., et al. (2002). IGF-I is critical for normal vascularization of the human retina. J. Clin. Endocrinol. Metab. 87, 3413–3416.
29. Hermansen L., Wachtlova M. (1971). Capillary density of skeletal muscle in well-trained and untrained men. J. Appl. Physiol. 30, 860–863.
30. Iemitsu M., Maeda S., Jesmin S., Otsuki T., Miyauchi T. (2006). Exercise training improves aging-induced downregulation of VEGF angiogenic signaling cascade in hearts. Am. J. Physiol. Heart Circ. Physiol. 291, H1290–H1298.
31. Ishiuchi Y., Sato H., Tsujimura K., Kawaguchi H., Matsuwaki T., Yamanouchi K., et al. (2018). Skeletal muscle cell contraction reduces a novel myokine, chemokine (C-X-C motif) ligand 10 (CXCL10): Potential roles in exercise-regulated angiogenesis. Biosci. Biotechnol. Biochem. 82, 97–105.
32. Ishiuchi-Sato Y., Hiraiwa E., Shinozaki A., Nedachi T. (2020). The effects of glucose and fatty acids on CXCL10 expression in skeletal muscle cells. Biosci. Biotechnol. Biochem. 84, 2448–2457.
33. Kivela R., Hemanthakumar K. A., Vaparanta K., Robciuc M., Izumiya Y., Kidoya H., et al. (2019). Endothelial cells regulate physiological cardiomyocyte growth via VEGFR2-mediated paracrine signaling. Circulation 139, 2570–2584.
34. Klymenko O., Brecklinghaus T., Dille M., Springer C., de Wendt C., Altenhofen D., et al. (2020). Histone deacetylase 5 regulates interleukin 6 secretion and insulin action in skeletal muscle. Mol. Metab. 42, 101062.
35. Knudsen J. G., Joensen E., Bertholdt L., Jessen H., van Hauen L., Hidalgo J., et al. (2016). Skeletal muscle IL-6 and regulation of liver metabolism during high-fat diet and exercise training. Physiol. Rep. 4, e12788.
36. Kon M., Tanimura Y., Yoshizato H. (2020). Effects of acute endurance exercise on follistatin-like 1 and apelin in the circulation and metabolic organs in rats. Arch. Physiol. Biochem., 1–5.
37. Krapf S., Schjolberg T., Asoawe L., Honkanen S. K., Kase E. T., Thoresen G. H., et al. (2021). Novel methods for cold exposure of skeletal muscle in vivo and in vitro show temperature-dependent myokine production. J. Therm. Biol. 98, 102930.
38. Kwon J. H., Moon K. M., Min K. W. (2020). Exercise-induced myokines can explain the importance of physical activity in the elderly: An overview. Healthc. (Basel) 8, E378.
39. Lee N. H., Nikfarjam M., He H. (2018). Functions of the CXC ligand family in the pancreatic tumor microenvironment. Pancreatology 18, 705–716.
40. Lee P. C., Kibbe M. R., Schuchert M. J., Stolz D. B., Watkins S. C., Griffith B. P., et al. (2000). Nitric oxide induces angiogenesis and upregulates alpha(v)beta(3) integrin expression on endothelial cells. Microvasc. Res. 60, 269–280.
41. Leung P. S. (2017). The potential of irisin as a therapeutic for diabetes. Future Med. Chem. 9, 529–532.
42. Liao Q., Qu S., Tang L. X., Li L. P., He D. F., Zeng C. Y., et al. (2019). Irisin exerts a therapeutic effect against myocardial infarction via promoting angiogenesis. Acta Pharmacol. Sin. 40, 1314–1321.
43. Lin Z. Y., Chuang Y. H., Chuang W. L. (2012). Cancer-associated fibroblasts up-regulate CCL2, CCL26, IL6 and LOXL2 genes related to promotion of cancer progression in hepatocellular carcinoma cells. Biomed. Pharmacother. 66, 525–529.
44. Lisa M., Haleagrahara N., Chakravarthi S. (2011). Insulin-Like Growth Factor-1 (IGF-1) Reduces ischemic changes and increases circulating angiogenic factors in experimentally - induced myocardial infarction in rats. Vasc. Cell. 3, 13.
45. Longchamp A., Mirabella T., Arduini A., MacArthur M. R., Das A., Trevino-Villarreal J. H., et al. (2018). Amino acid restriction triggers angiogenesis via GCN2/ATF4 regulation of VEGF and H2S production. Cell. 173, 117–129.
46. Losordo D. W., Dimmeler S. (2004b). Therapeutic angiogenesis and vasculogenesis for ischemic disease: Part II: Cell-based therapies. Circulation 109, 2692–2697.
47. Losordo D. W., Dimmeler S. (2004a). Therapeutic angiogenesis and vasculogenesis for ischemic disease. Part I: Angiogenic cytokines. Circulation 109, 2487–2491.
48. MacKay-Lyons M., Billinger S. A., Eng J. J., Dromerick A., Giacomantonio N., Hafer-Macko C., et al. (2020). Aerobic exercise recommendations to optimize best practices in care after stroke: AEROBICS 2019 update. Phys. Ther. 100, 149–156.
49. Miller E. G., Sethi P., Nowson C. A., Dunstan D. W., Daly R. M. (2017). Effects of progressive resistance training and weight loss versus weight loss alone on inflammatory and endothelial biomarkers in older adults with type 2 diabetes. Eur. J. Appl. Physiol. 117, 1669–1678.
50. Miyamae T., Marinov A. D., Sowders D., Wilson D. C., Devlin J., Boudreau R., et al. (2006). Follistatin-like protein-1 is a novel proinflammatory molecule. J. Immunol. 177, 4758–4762.
51. Mobius-Winkler S., Uhlemann M., Adams V., Sandri M., Erbs S., Lenk K., et al. (2016). Coronary collateral growth induced by physical exercise: Results of the impact of intensive exercise training on coronary collateral circulation in patients with stable coronary artery disease (EXCITE) trial. Circulation 133, 1438–1448.
52. Morland C., Andersson K. A., Haugen O. P., Hadzic A., Kleppa L., Gille A., et al. (2017). Exercise induces cerebral VEGF and angiogenesis via the lactate receptor HCAR1. Nat. Commun. 8, 15557.
53. Nedachi T., Fujita H., Kanzaki M. (2008). Contractile C2C12 myotube model for studying exercise-inducible responses in skeletal muscle. Am. J. Physiol. Endocrinol. Metab. 295, E1191–E1204.
54. Ni S., Li C. K., Xu N. W., Liu X., Wang W., Chen W. Y., et al. (2019). Follistatin-like protein 1 induction of matrix metalloproteinase 1, 3 and 13 gene expression in rheumatoid arthritis synoviocytes requires MAPK, JAK/STAT3 and NF-kappa B pathways. J. Cell. Physiol. 234, 454–463.
55. Nishida Y., Matsubara T., Tobina T., Shindo M., Tokuyama K., Tanaka K., et al. (2010). Effect of low-intensity aerobic exercise on insulin-like growth factor-I and insulin-like growth factor-binding proteins in healthy men. Int. J. Endocrinol. 2010, 452820.
56. Niu R., Nie Z. T., Liu L., Chang Y. W., Shen J. Q., Chen Q., et al. (2021). 13. Albany NY, 8643–8664.
57. Ouchi N., Oshima Y., Ohashi K., Higuchi A., Ikegami C., Izumiya Y., et al. (2008). Follistatin-like 1, a secreted muscle protein, promotes endothelial cell function and revascularization in ischemic tissue through a nitric-oxide synthase-dependent mechanism. J. Biol. Chem. 283, 32802–32811.
58. Pedersen B. K., Febbraio M. A. (2008). Muscle as an endocrine organ: Focus on muscle-derived interleukin-6. Physiol. Rev. 88, 1379–1406.
59. Pedersen L., Pilegaard H., Hansen J., Brandt C., Adser H., Hidalgo J., et al. (2011). Exercise-induced liver chemokine CXCL-1 expression is linked to muscle-derived interleukin-6 expression. J. Physiol. 589, 1409–1420.
60. Pelliccia A., Sharma S., Gati S., Back M., Borjesson M., Caselli S., et al. (2021). 2020 ESC Guidelines on sports cardiology and exercise in patients with cardiovascular disease. Eur. Heart J. 42, 17–96.
61. Peppler W. T., Townsend L. K., Meers G. M., Panasevich M. R., MacPherson R. E. K., Rector R. S., et al. (2019). Acute administration of IL-6 improves indices of hepatic glucose and insulin homeostasis in lean and obese mice. Am. J. Physiol. Gastrointest. Liver Physiol. 316, G166–G178.
62. Ranjbar K., Rahmani-Nia F., Shahabpour E. (2016). Aerobic training and l-arginine supplementation promotes rat heart and hindleg muscles arteriogenesis after myocardial infarction. J. Physiol. Biochem. 72, 393–404.
63. Reintjes A., Fuchs J. E., Kremser L., Lindner H. H., Liedl K. R., Huber L. A., et al. (2016). Asymmetric arginine dimethylation of RelA provides a repressive mark to modulate TNFα/NF-κB response. Proc. Natl. Acad. Sci. U. S. A. 113, 4326–4331.
64. Saboory E., Gholizadeh-Ghaleh Aziz S., Samadi M., Biabanghard A., Chodari L. (2020). Exercise and insulin-like growth factor 1 supplementation improve angiogenesis and angiogenic cytokines in a rat model of diabetes-induced neuropathy. Exp. Physiol. 105, 783–792.
65. Shaw A., Toth B. B., Kiraly R., Arianti R., Csomos I., Poliska S., et al. (2021). Irisin stimulates the release of CXCL1 from differentiating human subcutaneous and deep-neck derived adipocytes via upregulation of NF kappa B pathway. Front. Cell. Dev. Biol. 9, 737872.
66. Shibanuma M., Mashimo J., Mita A., Kuroki T., Nose K. (1993). Cloning from a mouse osteoblastic cell line of a set of transforming-growth-factor-beta 1-regulated genes, one of which seems to encode a follistatin-related polypeptide. Eur. J. Biochem. 217, 13–19.
67. Shin K. O., Bae J. Y., Woo J., Jang K. S., Kim K. S., Park J. S., et al. (2015). The effect of exercise on expression of myokine and angiogenesis mRNA in skeletal muscle of high fat diet induced obese rat. J. Exerc. Nutr. Biochem. 19, 91–98.
68. Shirvani H., Mirnejad R., Soleimani M., Arabzadeh E. (2021). Swimming exercise improves gene expression of PPAR-gamma and downregulates the overexpression of TLR4, MyD88, IL-6, and TNF-alpha after high-fat diet in rat skeletal muscle cells. Gene 775, 145441.
69. Simon F., Duran M., Garabet W., Schelzig H., Jacobs M., Gombert A. (2022). Gene therapy of chronic limb-threatening ischemia: Vascular medical perspectives. J. Clin. Med. 11, 1282.
70. Steensberg A., Keller C., Hillig T., Frosig C., Wojtaszewski J. F. P., Pedersen B. K., et al. (2007). Nitric oxide production is a proximal signaling event controlling exercise-induced mRNA expression in human skeletal muscle. Faseb J. 21, 2683–2694.
71. Strauer B. E., Brehm M., Zeus T., Kostering M., Hernandez A., Sorg R. V., et al. (2002). Repair of infarcted myocardium by autologous intracoronary mononuclear bone marrow cell transplantation in humans. Circulation 106, 1913–1918.
72. Sui Y. J., Potula R., Dhillon N., Pinson D., Li S. P., Nath A., et al. (2004). Neuronal apoptosis is mediated by CXCL10 overexpression in simian human immunodeficiency virus encephalitis. Am. J. Pathol. 164, 1557–1566.
73. Szumilewicz A., Worska A., Piernicka M., Kuchta A., Kortas J., Jastrzebski Z., et al. (2017). The exercise-induced irisin is associated with improved levels of glucose homeostasis markers in pregnant women participating in 8-week prenatal group fitness Program: A pilot study. Biomed. Res. Int. 2017, 9414525.
74. Tang H., Deng S., Cai J. G., Ma X. N., Liu M., Zhou L. (2019). Muscle-derived IL-6 improved insulin resistance of C2C12 cells through activating AMPK and inhibiting p38MAPK signal pathway in vitro. Int. J. Diabetes Dev. Ctries. 39, 486–498.
75. Tania N. P., Maarsingh H., Is T. B., Mattiotti A., Prakash S., Timens W., et al. (2017). Endothelial follistatin-like-1 regulates the postnatal development of the pulmonary vasculature by modulating BMP/Smad signaling. Pulm. Circ. 7, 219–231.
76. Tantiwong P., Shanmugasundaram K., Monroy A., Ghosh S., Li M., DeFronzo R. A., et al. (2010). NF-κB activity in muscle from obese and type 2 diabetic subjects under basal and exercise-stimulated conditions. Am. J. Physiol. Endocrinol. Metab. 299, E794–E801.
77. Tateishi-Yuyama E., Matsubara H., Murohara T., Ikeda U., Shintani S., Masaki H., et al. (2002). Therapeutic angiogenesis for patients with limb ischaemia by autologous transplantation of bone-marrow cells: A pilot study and a randomised controlled trial. Lancet 360, 427–435.
78. Tentolouris A., Eleftheriadou I., Tsilingiris D., Anastasiou I. A., Kosta O. A., Mourouzis I., et al. (2018). Plasma irisin levels in subjects with type 1 diabetes: Comparison with healthy controls. Horm. Metab. Res. 50, 803–810.
79. Treat-Jacobson D., McDermott M. M., Bronas U. G., Campia U., Collins T. C., Criqui M. H., et al. (2019). Optimal exercise programs for patients with peripheral artery disease: A scientific statement from the American heart association. Circulation 139, e10–e33.
80. Tryfonos A., Tzanis G., Pitsolis T., Karatzanos E., Koutsilieris M., Nanas S., et al. (2021). Exercise training enhances angiogenesis-related gene responses in skeletal muscle of patients with chronic heart failure. Cells 10 (8), 1915.
81. Tsou P. S., Wren J. D., Amin M. A., Schiopu E., Fox D. A., Khanna D., et al. (2016). Histone deacetylase 5 is overexpressed in Scleroderma endothelial cells and impairs angiogenesis via repression of proangiogenic factors. Arthritis Rheumatol. 68, 2975–2985.
82. van Hinsbergh V. W., Engelse M. A., Quax P. H. (2006). Pericellular proteases in angiogenesis and vasculogenesis. Arterioscler. Thromb. Vasc. Biol. 26, 716–728.
83. vanLieshout T. L., Bonafiglia J. T., Gurd B. J., Ljubicic V. (2019). Protein arginine methyltransferase biology in humans during acute and chronic skeletal muscle plasticity. J. Appl. Physiol. 127 (1985), 867–880.
84. Wang H., Pei S., Fang S., Jin S., Deng S., Zhao Y., et al. (2021). Irisin restores high glucose-induced cell injury in vascular endothelial cells by activating Notch pathway via Notch receptor 1. Biosci. Biotechnol. Biochem. 85, 2093–2102.
85. Wu F., Song H., Zhang Y., Zhang Y., Mu Q., Jiang M., et al. (2015). Irisin induces angiogenesis in human umbilical vein endothelial cells in vitro and in zebrafish embryos in vivo via activation of the ERK signaling pathway. PLoS One 10, e0134662.
86. Xi Y., Hao M., Liang Q., Li Y., Gong D. W., Tian Z. (2020). Dynamic resistance exercise increases skeletal muscle-derived FSTL1 inducing cardiac angiogenesis via DIP2A-Smad2/3 in rats following myocardial infarction. J. Sport Health Sci. 10, 594–603.
87. Xiao L., Wang Z., Lu N., He Y., Qiao L., Sheng X., et al. (2021). GPER mediates the IL6/JAK2/STAT3 pathway involved in VEGF expression in swine ovary GCs. J. Mol. Endocrinol. 68, 23–33.
88. Xu X., Zhang T., Mokou M., Li L., Li P., Song J., et al. (2020). Follistatin-like 1 as a novel adipomyokine related to insulin resistance and physical activity. J. Clin. Endocrinol. Metab. 105, dgaa629.
89. Yang H. F., Lin X. J., Wang X. H. (2018). Effects of aerobic exercise plus diet control on serum levels of total IGF-1 and IGF-1 binding protein-3 in female obese youths and adolescents. Zhongguo Ying Yong Sheng Li Xue Za Zhi 34, 78–82.
90. Yazdani F., Shahidi F., Karimi P. (2020). The effect of 8 weeks of high-intensity interval training and moderate-intensity continuous training on cardiac angiogenesis factor in diabetic male rats. J. Physiol. Biochem. 76, 291–299.
91. Yousefabadi H. A., Niyazi A., Alaee S., Fathi M., Rahimi G. R. M. (2021). Anti-inflammatory effects of exercise on metabolic syndrome patients: A systematic review and meta-analysis. Biol. Res. Nurs. 23, 280–292.
92. Zhang Q., Cao X. (2019). Epigenetic regulation of the innate immune response to infection. Nat. Rev. Immunol. 19, 417–432.
93. Zhao J., O'Neil M., Vittal A., Weinman S. A., Tikhanovich I. (2019). PRMT1-Dependent macrophage IL-6 production is required for alcohol-induced HCC progression. Gene Expr. 19, 137–150.
94. Zhao S., Zhong J., Sun C., Zhang J. (2021). Effects of aerobic exercise on tc, hdl-C, ldl-C and tg in patients with hyperlipidemia: A protocol of systematic review and meta-analysis. Med. Baltim. 100, e25103.
95. Ziche M., Morbidelli L. (2000). Nitric oxide and angiogenesis. J. Neurooncol. 50, 139–148.
Cita Original
Qi C, Song X, Wang H, Yan Y and Liu B (2022) The role of exercise-induced myokines in promoting angiogenesis. Front. Physiol. 13:981577. doi: 10.3389/fphys.2022.981577
Cita en PubliCE
Chao Qi, Xianjing Song, He Wang, Youyou Yan Bin Liu (2022). El Rol de las Miocinas Inducidas por el Ejercicio en la Promoción de la Angiogénesis. .https://g-se.com/el-rol-de-las-miocinas-inducidas-por-el-ejercicio-en-la-promocion-de-la-angiogenesis-2973-sa-U639bc855e2079
