El Metabolismo Anaeróbico Induce un Mayor Gasto Energético Total Durante el Ejercicio con Restricción del Flujo Sanguíneo
Miguel S. Conceição, Arthur F. Gáspari, Ana PB Ramkrapes, Edson MM Junior, Romulo Bertuzzi, Cláudia R. Cavaglieri, Mara Patrícia T. Chacon-MikahilResumen
Propósito
Se investigaron las contribuciones del sistema energético y el gasto energético total durante el ejercicio de resistencia a baja intensidad asociado con la restricción del flujo sanguíneo (LIE-BFR) y sin restricción del mismo (LIE).
Métodos
Doce hombres participaron en un diseño contrabalanceado y transversal, en el que los sujetos completaron un ejercicio de resistencia a baja intensidad (30 minutos de bicicleta al 40% del ) con o sin BFR, separados por al menos 72 horas de recuperación. La acumulación de lactato en sangre y el consumo de oxígeno durante y después del ejercicio se usaron para estimar el metabolismo anaeróbico láctico, el metabolismo aeróbico y las contribuciones al metabolismo anaeróbico aláctico, respectivamente.
Resultados
Hubo aumentos significativos en el metabolismo anaeróbico láctico (P= 0,008), en el metabolismo aeróbico (P= 0,020) y en el gasto energético total (P= 0,008) en LIE-BFR. No se encontraron diferencias significativas entre las condiciones para el metabolismo anaeróbico aláctico (P= 0,582). La concentración plasmática de lactato fue significativamente mayor en el LIE-BFR a los 15 minutos y en el pico post-ejercicio (todos P≤0,008). La frecuencia cardíaca fue significativamente más alta en el LIE-BFR a los 10, 15, 20, 25 y 30 minutos durante el ejercicio, y 5, 10 y 15 minutos después del ejercicio (todos P≤0,03). La ventilación fue significativamente mayor en el LIE-BFR a los 10, 15 y 20 minutos durante el ejercicio (todos P≤0,003).
Conclusión
El ejercicio de resistencia a baja intensidad realizado con restricción del flujo sanguíneo aumenta los metabolismos anaeróbicos lácticos y aeróbicos, el gasto energético total y las respuestas cardiorrespiratorias.
INTRODUCCIÓN
Es sabido que el entrenamiento de resistencia a intensidad de moderada a alta (es decir, 60-90% del consumo máximo de oxígeno ) es el principal protocolo de ejercicio para inducir un aumento en el [1,2]. Sin embargo, se ha demostrado que con un novedoso protocolo de ejercicio de resistencia, que utiliza restricción del flujo sanguíneo del miembro inferior (BFR) durante el ejercicio de resistencia a baja intensidad (~40% del ) (LIE-BFR), mejora significativamente el (6,4%) [3,4], lo que sugiere que la realización de entrenamiento de resistencia a baja intensidad, cuando se asocia con la restricción del flujo sanguíneo, puede inducir la capacidad cardiorrespiratoria, proporcionando una gran ventaja. Por ejemplo, Abe et al. [3] informaron un aumento del después de 24 sesiones de entrenamiento con ejercicios de ciclos de baja intensidad (15 min al 40% de ) realizados con BFR, en comparación con la misma intensidad de ejercicio sin BFR. Estos hallazgos sugieren que la perturbación periférica inducida por la BFR en el flujo sanguíneo arterial y venoso de la pierna, incluso la hipoxia local [5] y la reducción del retorno venoso [6], producen una elevada demanda metabólica. En consecuencia, la BFR puede estar relacionada con una mejora del metabolismo anaeróbico durante la contracción muscular, lo que resulta en la acumulación de metabolitos, estimulando así el mecanismo cardiorrespiratorio (es decir, a través de metaboreflexión y la reducción del retorno venoso) [7] y los mecanismos musculares [8] para posiblemente aumentar el .
Por consiguiente, algunos estudios han sugerido que durante el ejercicio realizado bajo hipoxia local, el metabolismo aeróbico disminuye, mientras que el metabolismo anaeróbico (es decir, los sistemas energéticos aláctico y láctico) aumenta [9,10]. Se cree que una mayor producción energética anaeróbica puede provocar una mayor actividad metaborrefleja y, en consecuencia, mejorar la respuesta de la frecuencia cardíaca (FC), el gasto cardíaco y la ventilación ( ) para suministrar O2 adecuadamente al músculo ejercitado y eliminar los metabolitos generados por el metabolismo anaeróbico [11-13]. Como resultado, este mecanismo compensatorio producido por la hipoxia local, junto con un retorno venoso reducido, característica del entrenamiento con BFR, puede sobrecargar los componentes centrales del sistema cardiorrespiratorio y conducir a una mejoría en el [14,15]. Además, Egan et al. [8] demostraron que una mayor acumulación de lactato sanguíneo ([La - ]net), que indica una mayor contribución del metabolismo anaeróbico, puede dar como resultado un estrés metabólico significativamente mayor y, en consecuencia, mejorar la síntesis de biogénesis mitocondrial, un factor local que también puede inducir a un mayor . Aunque estas son posibles hipótesis; ambas presentan el metabolismo anaeróbico como un factor desencadenante que aún debe ser identificado durante el LIE-BFR.
Por lo tanto, el propósito del presente estudio fue comparar las contribuciones del sistema energético (es decir, metabolismo aeróbico, anaeróbico aláctico y anaeróbico láctico) y el gasto energético total luego de ejercicio de resistencia a baja intensidad asociado con restricción del flujo sanguíneo (LIE-BFR) y ejercicio de resistencia a baja intensidad sin BFR (LIE). Se hipotetizó que el LIE-BFR aumentaría la producción energética por el metabolismo anaeróbico láctico debido a la reducción en el O2 entregado a los músculos del muslo inducidos por la presión del manguito y así aumentaría el gasto energético total.
MÉTODOS
Sujetos
Doce sujetos masculinos sedentarios sanos participaron voluntariamente en este estudio (las características de los sujetos se describen en la Tabla 1). Los participantes fueron reclutados a través de volantes y carteles en la Universidad. Como criterios de inclusión, los participantes deberían ser hombres jóvenes (de 18 a 30 años), sedentarios a lo sumo, sin contraindicaciones para la práctica del ejercicio en bicicleta y con disponibilidad horaria para cumplir con todas las visitas del proyecto. Como criterios de exclusión, los participantes no podrían tener ninguna enfermedad cardiovascular o metabólica o lesiones musculoesqueléticas en las extremidades inferiores que comprometan su capacidad para realizar el protocolo de ejercicios. Además, ningún participante podría haber participado en entrenamiento de resistencia y/o fuerza al menos seis meses antes del estudio y se les recomendó no consumir alcohol ni drogas ni ningún tipo de sustancia artificial (por ejemplo, suplementos) al menos una semana antes del comienzo del estudio. Al final, los participantes recibieron instrucciones de abstenerse de consumir cafeína y otras sustancias energéticas las 24 horas anteriores a todas las visitas. Los procedimientos experimentales y los posibles riesgos asociados con el estudio se explicaron a todos los sujetos, que proporcionaron un consentimiento por escrito antes de la participación. El estudio fue aprobado por el Comité de Ética de la Universidad de Campinas (número de proceso: 848.145) y llevado a cabo de acuerdo con la declaración normativa con respecto al uso de sujetos humanos conforme a la última revisión de la Declaración de Helsinki.
Los valores se presentan como media + DE. VO2máx: consumo máximo de oxígeno; POmáx: potencia máxima de salida; RCP: punto de compensación respiratoria; VT: umbral ventilatorio.
Tabla 1. Características de los participantes.

Diseño experimental
El estudio empleó un diseño contrabalanceado y transversal en el que todos los sujetos completaron una sesión de ejercicio de resistencia a baja intensidad asociada con restricción del flujo sanguíneo (LIE-BFR) y una sesión de ejercicio de resistencia a baja intensidad (LIE) sin BFR en el cicloergómetro. Antes de la primera sesión de ejercicio, los participantes se sometieron a pruebas de y a una sesión de familiarización con el ejercicio. Los ensayos de ejercicio se separaron por un período entre 72 horas y una semana, durante los cuales se pidió a los sujetos que mantengan su dieta habitual y sus patrones de actividad física.
Pruebas Cardiorespiratorias ( )
Los participantes realizaron una prueba máxima de ejercicio graduado en un cicloergómetro con freno electromagnético (modelo de Quinton: Corival 400, Lode BV, Groningen, Países Bajos). Después de descansar en la bicicleta durante 5 minutos para establecer los parámetros cardiorrespiratorios, los participantes comenzaron el protocolo de prueba incremental. Brevemente, los sujetos comenzaron a pedalear a una carga inicial de 50 W durante 1 minuto y la carga de trabajo se incrementó en 15 W/min hasta alcanzar los 200 W, después de lo cual los incrementos futuros fueron de 10 W/min hasta la fatiga voluntaria [3,16]. Los participantes fueron instruidos para mantener la frecuencia de pedaleo entre 60 y 70 rpm. Los datos del intercambio de gases y de la frecuencia cardíaca se recolectaron continuamente utilizando un sistema metabólico automático de respiración por respiración (CPX, Medical Graphics, St. Paul, Minnesota, EEUU.) y un transmisor de FC (Polar Electro Oy, Kempele, Finlandia) conectado al analizador de gases. La prueba fue considerada máxima cuando se alcanzaron dos o más de los siguientes criterios: una meseta en el consumo de oxígeno, un índice de intercambio respiratorio mayor que 1,1, una frecuencia cardíaca >90% de la frecuencia cardíaca máxima prevista (es decir, 220- edad) y una puntuación >17 en una escala del esfuerzo percibido de 6-20 [17,18]. El máximo consumo de oxígeno se definió como el valor medio de consumo de oxígeno ( ) durante los últimos 30 segundos de la prueba. El umbral ventilatorio (VT) se determinó en el punto de un aumento no lineal en la relación . El punto de compensación respiratoria (RCP) se determinó en el punto de un aumento no lineal en , y la primer disminución en la fracción espiratoria de CO2 [19]. Dos investigadores independientes determinaron estos umbrales; cuando no estaban de acuerdo, se consultó a un tercer investigador independiente. El coeficiente de variación de error típico es el siguiente: VO2max= 3,0%, potencia= 1,9%, índice de intercambio respiratorio (RER)= 5,6%, tiempo hasta el agotamiento= 1,6%. Además, las mediciones del error típico del test y el re-test, y el coeficiente de variación de la concentración del lactacto ([La-]) fueron 0,07 mmol/L y 5,2%.
Sesiones de Prueba Experimentales
Los participantes regresaron al laboratorio por lo menos una semana después de realizar la prueba de y emprender la realización de la primera de las dos sesiones de ejercicios asignadas al azar (descriptos a continuación). Después de descansar sentados durante ~5 minutos, comenzaron el ejercicio. Durante ambas sesiones de ejercicio (descanso, ejercicio y recuperación), los datos del intercambio de gases y de la frecuencia cardíaca se recopilaron de forma contínua utilizando el mismo sistema metabólico automático de respiración por respiración descripto anteriormente. Los datos de la frecuencia cardíaca y de la se promediaron cada 5 min de reposo, ejercicio y recuperación para comparar los patrones cardiorespiratorios de LIE y LIE-BFR. Se recolectaron las muestras de sangre para analizar el [La-] (lóbulo de la oreja) antes de cada sesión de ejercicio, 15 minutos durante el ejercicio, inmediatamente después, y 3, 5 y 7 minutos después del ejercicio y 15 minutos de recuperación. El [La-] máximo post-ejercicio se utilizó para un análisis futuro. Las muestras de sangre (25 μL) se colocaron inmediatamente en microtubos que contenían 25 μL de fluoruro de sodio a 1g% y luego se centrifugaron a 3000 rpm durante 5 min para separar el plasma antes de ser divididas y congeladas/almacenadas a -80°C. Posteriormente, se midió la concentración de lactato en plasma usando un espectrofotómetro (ELx800, Biotek, Winooski, EEUU.) utilizando un kit comercial (Biotecnica, Varginha, Brasil).
Los protocolos de ejercicio consistieron en 30 minutos de bicicleta continua con una frecuencia de pedaleo entre 60 y 70 rpm. Los protocolos LIE-BFR y LIE se llevaron a cabo a una potencia de salida correspondiente al 40% del (70 ± 9,8 W), determinada en pruebas preliminares. El protocolo LIE-BFR se realizó con un manguito sujeto al muslo. Inmediatamente antes de los ensayos, los sujetos descansaron en una camilla mientras se medía la presión de oclusión arterial. Se colocó un manguito de 18 cm de ancho en la porción proximal del muslo (región del pliegue inguinal) y una vez en posición, se infló hasta que se detectó ausencia de pulso arterial auditivo en la arteria tibial mediante auscultación con una sonda vascular Doppler (DV-600 Marted, São Paulo, Brasil) [20]. La presión se liberó lentamente hasta que se detectó el primer pulso arterial, considerado la presión sistólica en la arteria tibial. La presión del manguito se ajustó al 80% de la presión arterial máxima de la tibia [20], se infló el manguito durante toda la sesión de ejercicio y se desinfló inmediatamente después del ejercicio. El promedio de la presión de oclusión máxima fue de 136 ± 22 mmHg y el promedio de la presión de oclusión del 80% fue de 109 ± 18 mmHg.
Control de Dieta/Ejercicio
Antes de cada prueba experimental, se instruyó a los sujetos a que se abstuvieran de entrenar, realizar actividad física vigorosa, consumir alcohol o cafeína durante un mínimo de 48 horas. Además, se les pidió a los sujetos que registraran la ingesta alimentaria 24 horas antes de la primera prueba. En las pruebas posteriores, se les pidió a los sujetos que ingirieran una dieta similar a la primera prueba.
Contribuciones del Sistema Energético y Gasto Energético
La acumulación de lactato en sangre y el consumo de oxígeno durante y después del ejercicio se utilizaron para estimar las contribuciones del metabolismo anaeróbico láctico, el metabolismo aeróbico y el metabolismo anaeróbico aláctico, respectivamente [21]. La contribución del metabolismo aeróbico fue determinada por el área bajo la curva de ejercicio y restando la cantidad de referencia de correspondiente al tiempo de ejercicio total (es decir, 30 min). Para estimar la contribución del metabolismo anaeróbico aláctico, se utilizó un modelo monoexponencial (Ecuación 1) para ajustar los datos de recuperación de consumo de oxígeno (10 min después del ejercicio) [21], y la amplitud multiplicada por la constante de tiempo (Ecuación 2). Para estimar el metabolismo anaeróbico láctico se consideró un valor de 1 mmol∙l -1[La-]net equivalente a 3 ml de O2∙kg -1 de masa corporal [22]. El gasto energético total se calculó como la suma de los tres sistemas energéticos. Estas estimaciones se realizaron utilizando un software específicamente desarrollado para calcular las contribuciones del sistema energético (GEDAE-LaB, São Paulo, Brasil), disponible en http://www.gedaelab.org [21].
![]()
Donde VO 2(t) es el consumo de oxígeno en el tiempo t, es el consumo de oxígeno al inicio, A es la amplitud, td es el retardo de tiempo, t es la constante de tiempo, y 1 indica el componente rápido, respectivamente.
Análisis estadísticos
La normalidad de datos y la igualdad de varianzas se evaluaron mediante las pruebas de Shapiro-Wilk y Levene. La prueba T se utilizó para realizar comparaciones entre las condiciones de las variables dependientes medias del estudio: gasto energético total, metabolismo aeróbico, metabolismo anaeróbico aláctico y metabolismo anaeróbico láctico. Se utilizó un ANOVA bidireccional con medidas repetidas (tiempo versus condición) para comparar el [La -], la FC y las respuestas de . Cuando se encontró un valor F significativo, se realizó el Test Post Hoc de Bonferroni para localizar las diferencias. Los datos se presentan como Media ± Desviación Estándar (DE). El nivel de significancia se estableció en P≤0,05. El análisis estadístico se realizó utilizando la versión 9.3 de SAS para Windows (SAS Institute Inc., Cary, NC, EEUU.). Además, el poder estadístico se calculó utilizando el software G*Power 3.2.1, con un índice de error tipo I (α) del 5%, un tamaño de la muestra de 12 y la correlación específica y el tamaño del efecto de Cohen entre las medidas repetidas de cada variable dependiente principal [ 23 ].
Resultados
Contribuciones del Sistema Energético y Gasto Energético Total
La Figura 1 presenta las contribuciones del sistema energético y el gasto energético total durante el ejercicio. Hubo aumentos significativos en el metabolismo aeróbico (Fig 1A, P= 0,020; poder estadístico = 0,89), metabolismo láctico (Fig. 1C, P= 0,008; poder estadístico = 0,99) y gasto energético total (Fig. 1D, P= 0,008; poder estadístico= 0,96) con el LIE-BFR. No se encontraron diferencias significativas entre las condiciones del metabolismo anaeróbico aláctico (Fig. 1B, P= 0,582; poder estadístico = 0,34).
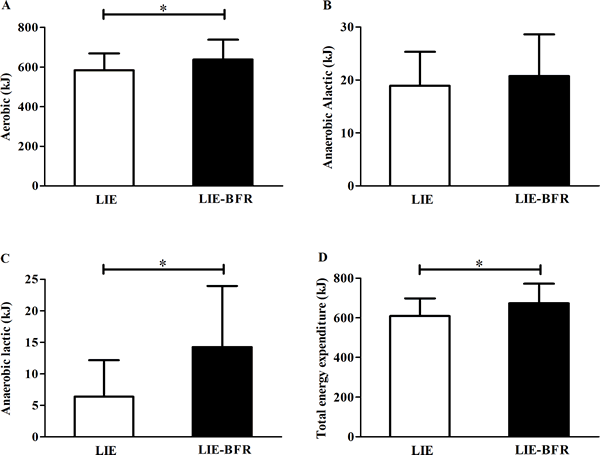
Figura 1. Metabolismo aeróbico (A), metabolismo anaeróbico aláctico (B), metabolismo anaeróbico láctico (C) y gasto energético total (D) durante el ejercicio de resistencia a baja intensidad (LIE) y el ejercicio de resistencia a baja intensidad con restricción del flujo sanguíneo (LIE-BFR). Los valores son media ± DE (n = 12). *Diferencia significativa entre grupos (P≤ 0,05).
Concentración de Lactato [LA-]
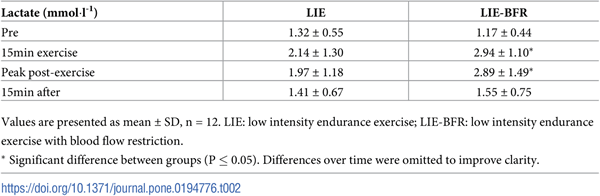
La Tabla 2 muestra la concentración plasmática de lactato antes, durante y después del ejercicio. Se encontró un [La-] significativamente más alto en LIE-BFR comparado con LIE a los 15 minutos (P=0,008) durante el ejercicio y máximo post-ejercicio (P=0,001). La concentración plasmática de lactato aumentó con el tiempo en LIE-BFR (15 min P=0,004, máximo post-ejercicio P=0,04) y LIE (15 min P=0,003, pico post-ejercicio P=0,03), volviendo a los niveles pre-ejercicio después de 15 minutos de recuperación para ambos protocolos.
Tabla 2. Respuestas de la concentración plasmática de lactato en LIE y LIE-BFR.
Respuestas Cardiorrespiratorias
La Figura 2 muestra la respuesta de FC (A) y ventilación (B) a LIE y LIE-BFR. No hubo diferencias significativas entre las condiciones para la FC y la al principio. La frecuencia cardíaca fue significativamente mayor en el LIE-BFR a 10 (P<0,0001), 15 (P= 0,0004), 20 (P= 0,0001), 25 (P<0,0001) y 30 minutos (P<0,0001) durante el ejercicio, y a 5 (P= 0,03), 10 (P<0,0001) y 15 minutos (P<0,0001) de la recuperación. La frecuencia cardíaca aumentó con el tiempo durante el ejercicio y la recuperación en ambos protocolos (todos P<0,0001), sin embargo, solo en LIE volvió al nivel pre-ejercicio a los 10 y 15 minutos de recuperación. La ventilación fue significativamente mayor en el LIE-BFR a los 10 (P<0,0001), 15 (P<0,0001) y 20 minutos (P<0,0001) durante el ejercicio. La ventilación aumentó con el tiempo durante el ejercicio y a los 5 minutos de recuperación (todos P<0,0001) volviendo a los niveles pre-ejercicio después de una recuperación de 10 minutos para ambos protocolos.
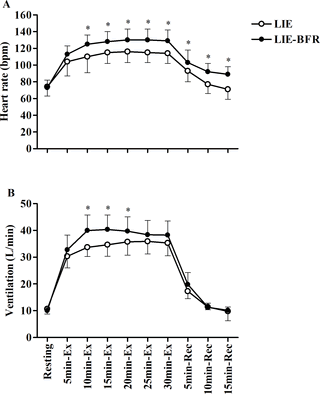
Figura 2. Frecuencia cardíaca y ventilación durante y después del ejercicio de resistencia a baja intensidad (LIE) y en el ejercicio de resistencia a baja intensidad con restricción del flujo sanguíneo (LIE-BFR).
Ej.: ejercicio; Rec: recuperación. Los valores son media ± DE (n= 12). *Diferencia significativa entre grupos (P≤ 0,05). Las diferencias con el tiempo se omitieron para mejorar la claridad.
DISCUSIÓN
Se ha demostrado que el ejercicio de baja intensidad con restricción del flujo sanguíneo promueve aumentos en la capacidad cardiorrespiratoria [3,4]. En consecuencia, planteamos la hipótesis de que la hipoxia local inducida por la BFR produciría una demanda metabólica muscular elevada y podría aumentar el gasto energético en todo el cuerpo y las respuestas cardiorrespiratorias. Informamos que el ejercicio de resistencia a baja intensidad realizado con la restricción del flujo sanguíneo aumentó el metabolismo aeróbico y anaeróbico láctico resultando en el aumento del gasto energético total. Además, encontramos mayores respuestas de [La-], frecuencia cardíaca y en LIE-BFR en comparación con LIE. Tomados colectivamente, nuestros hallazgos sugieren que el ejercicio de bicicleta realizado con restricción del flujo sanguíneo puede provocar perturbaciones adicionales a la homeostasis necesaria para inducir mejoras en el , que normalmente tienen lugar durante el ejercicio de resistencia de intensidad moderada/fuerte sin restricción de flujo sanguíneo.
Un creciente grupo de evidencia sugiere que el ejercicio realizado con restricción del flujo sanguíneo puede mejorar la adaptación del ejercicio [3,4,24,25]. Algunos estudios anteriores han informado que el ejercicio de resistencia de caminar/andar en bicicleta realizado con restricción del flujo sanguíneo puede aumentar la capacidad cardiorrespiratoria, aunque con aumentos más pequeños en comparación con el ejercicio de resistencia de alta intensidad solo [3,4]. Sin embargo, se sabe poco sobre los mecanismos que median estas respuestas cuando se realizan ejercicios de resistencia a baja intensidad con BFR. Como tal, recientemente informamos que, a pesar de la gran respuesta de lactato después de LIE-BFR, no hay respuestas significativas de genes y proteínas relacionadas con la biogénesis mitocondrial y la angiogénesis después de LIE-BFR [16]. A pesar de la falta de resultados significativos para estos marcadores locales, todavía creemos que existe un vínculo entre las perturbaciones metabólicas locales y la adaptación cardiorrespiratoria inducida por LIE-BFR.
Se ha demostrado que la BFR en los músculos de las piernas durante el ejercicio cambió de manera aguda las respuestas cardiovasculares en comparación con las condiciones normales de flujo sanguíneo [26,27]. Aunque es plausible suponer que estos cambios están relacionados con los efectos del manguito presionando la musculatura del muslo sobre los cambios en el patrón de movimiento, se demostró que las disminuciones en la economía de la locomoción con BFR fueron causadas por el aumento de la ventilación, que coincide probablemente con la tasa de producción de CO2 [28]. Además, Ozaki et al., (2010) [27] mostraron que durante el ejercicio de bicicleta a los 20, 40 y 60% del , los pacientes con BFR pueden aumentar significativamente la FC y tienden al aumento del , mientras que no hubo cambios significativos en el mismo ejercicio sin BFR. Por otro lado, Sakamaki-Sunaga et al. (2012) [29] compararon las respuestas cardiorrespiratorias y de lactato con una prueba de marcha gradual con y sin BFR y mostraron un aumento de la FC y del a una carga de trabajo submáxima dada en la condición de BFR. Por lo tanto, se sugiere que la respuesta cardiovascular elevada se debe a la hipoxia local inducida por BFR [5].
De hecho, la presión ejercida por el manguito en la porción superior de cada muslo induce una acumulación de sangre en las piernas con reducción del retorno venoso femoral [30,31]. Asimismo, algunas pruebas respaldan la idea de que existe una capacidad limitada para administrar O2 (Ej., capacidad reducida del flujo sanguíneo arterial femoral) a los músculos que se ejercitan y, en consecuencia, una menor disponibilidad de O2 [9,32,33]. A medida que la disponibilidad de O2 disminuye durante el ejercicio, la cantidad de energía proporcionada por el metabolismo anaeróbico para mantener la contracción muscular aumenta [28,34]. Confirmando este razonamiento, encontramos aquí que el metabolismo aeróbico y en particular el anaeróbico láctico fueron significativamente mayores durante LIE-BFR en comparación con LIE (Fig. 1A y 1C) lo que genera un aumento en el [La-] (Tabla 1). Es posible sugerir que el aumento del [La-] identificado en nuestro estudio sería el resultado de la acumulación de metabolitos en el lecho vascular ocluido de las extremidades inferiores, lo que habría restringido su circulación a través del organismo y, en consecuencia, su uso como sustrato para los músculos y otros tejidos [35]. Sin embargo, creemos que este hecho tuvo menos influencia en las mediciones del [La-], ya que, con 15 minutos de ejercicio, incluso con flujo sanguíneo ocluido, se observó un mayor [La-] en las muestras del lóbulo de la oreja recogidas en las condiciones de LIE-BFR. Esto indica que incluso con BFR, el lactato circulaba por todo el cuerpo y probablemente se usó como sustrato como también en el ejercicio sin BFR. De esta forma, es importante tener en cuenta que, aunque se ha demostrado que el metabolismo aeróbico es el principal sistema energético durante el ejercicio realizado por debajo de la intensidad del [36], es plausible considerar que el metabolismo anaeróbico láctico es una importante fuente de energía para mantener la contracción muscular durante LIE-BFR. Por lo tanto, sugerimos que la perturbación inducida por la BFR en el flujo sanguíneo arterial y venoso de la pierna aumenta la participación del metabolismo anaeróbico láctico debido a la reducción de disponibilidad en O2, posiblemente resultando en el aumento de la FC y la en un intento de proporcionar adecuadamente O2 al músculo que se ejercita.
Al disminuir la disponibilidad de O2 (sangre arterial y venosa de la pierna reducida) a los músculos en ejercicio y retener la necesidad de producción de energía para mantener la contracción muscular, también es plausible suponer que pedalear con BFR podría aumentar la respuesta cardiorrespiratoria por metaboreflejo [37] y/o por disminución del retorno venoso [6,29]. Durante el ejercicio con BFR, el estrés metabólico (p. ej., [La-], Pi, pH) aumentará [38,39] y estimulará las terminaciones nerviosas aferentes del grupo III y IV metabólicamente sensibles dentro del músculo activo, provocando un aumento de reflejo en la actividad del nervio simpático eferente y presión arterial sistémica, conocida como metaboreflejo muscular [12,40], un reflejo que contribuye significativamente a la respuesta cardiorrespiratoria autónoma para el ejercicio, así como, el aumento de la y la frecuencia cardíaca [13,41]. De hecho, hemos encontrado que no solo la aumentó durante el ejercicio, sino que la respuesta de la FC durante y después del ejercicio fue significativamente mayor en LIE-BFR en comparación con LIE (Tabla 2), sugiriendo que el metaboreflejo se activó y también causó un retraso en la reactivación parasimpática [42 - 44]. Otro mecanismo que potencialmente podría contribuir a aumentar la respuesta de la FC en esta situación es la disminución del retorno venoso. Renzi et al., (2010) [6] investigaron los efectos de una caminata en cinta por 2 minutos a 2 millas/hora con un intervalo de 1 minuto con o sin BFR. Encontraron que mientras que el ejercicio con BFR aumenta la FC, el retorno venoso disminuye, teniendo en cuenta que el volumen sistólico es proporcional al llenado ventricular y por lo tanto a la cantidad de sangre que regresa al corazón por el árbol de vasos venosos. Es posible sugerir que la FC aumentó como maniobra compensatoria para aumentar el flujo sanguíneo y la disponibilidad de O2 para los músculos que trabajan. Tomados en conjunto, se estima que el metaboreflejo y el retorno venoso sanguíneo están involucrados en la respuesta de la FC durante y después del ejercicio con BFR. Además, nuestros datos respaldan la idea de que las respuestas de la FC durante y después del ejercicio dependen de la intensidad del ejercicio realizado.
El flujo sanguíneo normal al músculo que trabaja durante el ejercicio al 40% de la carga de trabajo máxima parece no provocar respuestas cardiovasculares, mientras que el ejercicio al 60% de la carga de trabajo máxima puede inducir un importante efecto de presión [37]. Aunque ambos protocolos de ejercicio se realizaron con ejercicios de intensidad leve (40% de la potencia de salida en ), parece que LIE-BFR indujo una gran combinación entre la intensidad y la hipoxia local para aumentar la FC y la , probablemente como resultado de un metaboreflejo y una reducción del retorno venoso sanguíneo. En conjunto, especulamos que disminuyendo la disponibilidad de O2 que culmina en una alta participación del metabolismo anaeróbico y más en el metabolismo aeróbico durante el ejercicio, acompañado por un aumento de la FC y la , podría aumentar el estímulo cardiorrespiratorio y, por lo tanto, mejorar el después de las sesiones de entrenamiento acumuladas de LIE-BFR. Siguiendo este razonamiento, el vínculo entre la perturbación metabólica y la adaptación cardiorrespiratoria inducida por LIE-BFR es la demanda energética. Si bien esta es una hipótesis interesante, sugerimos más estudios crónicos para confirmar si el LIE-BFR puede aumentar la adaptación cardiorrespiratoria y estudios que prueben diferentes presiones del manguito y/o intensidades de ejercicios que verifiquen la contribución del aumento del metabolismo anaeróbico a la consiguiente sobrecarga cardiorrespiratoria.
Una segunda hipótesis surge de este hallazgo, ya que incluso el LIE-BFR se realiza a baja intensidad, los datos actuales muestran que el LIE-BFR puede inducir un gasto energético significativo que en consecuencia puede inducir la pérdida de peso [45]. Respecto a los términos prácticos, es atractivo suponer que el LIE-BFR podría ser una estrategia de ejercicio prometedora para personas que no pueden realizar ejercicio con moderada/alta intensidad y necesitan una buena condición cardiorrespiratoria y perder peso, tanto como personas mayores y obesas. En consecuencia, Karabulut y García (2017) [46] demostraron que los sujetos obesos que realizan ciclismo con BFR aumentan el gasto energético y el estrés cardiovascular. Sin embargo, es importante destacar que el ejercicio de resistencia realizado con BFR muestra menor estrés cardiovascular, medido por la variabilidad de la frecuencia cardíaca y las respuestas hemodinámicas, a una carga baja con BFR (40% ) en comparación a una carga alta sin BFR (70% ) en ancianos [47], sugiriendo la seguridad de este método de ejercicio físico. Es relevante señalar que las características del presente estudio (características de la muestra y diseño experimental) no nos permiten extraer conclusiones definitivas sobre la importancia del LIE-BFR para poblaciones especiales como sujetos ancianos y obesos, o incluso reflejar en beneficios adicionales a un período de entrenamiento. Por lo tanto, podrían llevarse a cabo estudios a largo plazo con diferentes poblaciones para probar estas hipótesis.
En resumen, este es el primer estudio que investiga la contribución de los sistemas energéticos (aeróbico, anaeróbica aláctico y anaeróbico láctico) durante el LIE-BFR. Aquí mostramos que el ejercicio de resistencia a baja intensidad realizado con restricción del flujo sanguíneo aumenta las contribuciones del sistema anaeróbico láctico y aeróbico, el gasto energético total y las respuestas cardiorrespiratorias. Programas de entrenamiento más largos que incorporen ejercicio de resistencia con BFR que correlacionan las mediciones de las contribuciones de los energféticos con las respuestas de adaptación tales como cambios en el y la composición corporal, proporcionarán información importante sobre la eficacia de este método de entrenamiento. Se puede confirmar que el entrenamiento LIE-BFR puede convertirse en una estrategia importante para mejorar la adaptación del entrenamiento y mejorar los resultados de salud en poblaciones que pueden ser incapaces de realizar ejercicios prolongados/intensos, como personas mayores o con sobrepeso/obesas
Agradecimientos
El MPTCM recibió financiación respaldada por Fundo de Apoio ao Ensino, en Pesquisa e Extensão (FAEPEX-Unicamp) - www.prp.unicamp.br. Financiamiento adicional de la Fundación de Investigación de São Paulo (FAPESP, Subsidio No. 2015/19756-3) y CNPq (Subsidio No. 118130/2014-5).
Referencias
1. ACSM. Puesto de posición de la American College of Sports Medicine. (2011). Cantidad y calidad del ejercicio para desarrollar y mantener la capacidad cardiorrespiratoria, musculoesquelética y neuromotora en adultos aparentemente sanos: orientación para la prescripción de ejercicios. Med Sci Sports Exerc. 2011; 43 (7): 1334-59. pmid: 21694556.
2. Swain DP, Franklin BA. (2002). VO (2) reserva y la intensidad mínima para mejorar la aptitud cardiorrespiratoria. Med Sci Sports Exerc. 2002; 34 (1): 152-7. pmid: 11782661.
3. Abe T, Fujita S, Nakajima T, Sakamaki M, Ozaki H, Ogasawara R, y col. (2010). Efectos del entrenamiento de ciclo de baja intensidad con flujo sanguíneo restringido de la pierna sobre el volumen del muslo y el VO2MAX en hombres jóvenes. J Sports Sci Med. 2010; 9 (3): 452-8. pmid: 24149640.
4. Park S, Kim JK, Choi HM, Kim HG, Beekley MD, Nho H. (2010). Aumento en la captación máxima de oxígeno después de un entrenamiento de 2 semanas de caminata con oclusión del flujo sanguíneo en atletas. Eur J Appl Physiol. 2010; 109 (4): 591-600. pmid: 20544348.
5. Mouser JG, Laurentino GC, Dankel SJ, Buckner SL, Jessee MB, Counts BR, et al. (2017). Flujo de sangre en humanos después de un ejercicio de baja carga con y sin restricción de flujo sanguíneo. Appl Physiol Nutr Metab. 2017; 42 (11): 1165-71. pmid: 28704612.
6. Renzi CP, Tanaka H, Sugawara J. (2010). Efectos de la restricción del flujo sanguíneo de la pierna al caminar sobre la función cardiovascular. Med Sci Sports Exerc. 2010; 42 (4): 726-32. pmid: 19952840; PubMed Central PMCID: PMC2888901.
7. Hartwich D, Dear WE, Waterfall JL, Fisher JP. (2011). Efecto de la activación de los metaboreflejos musculares sobre la sensibilidad cardiaca barorrefleja espontánea durante el ejercicio en humanos. J Physiol. 2011; 589 (Pt 24): 6157-71. pmid: 21969452; PubMed Central PMCID: PMC3286693.
8. Egan B, Carson BP, García-Roves PM, Chibalin AV, Sarsfield FM, Barron N, y col. (2010). La regulación dependiente de la intensidad del ejercicio de la abundancia del ARNm del coactivador-1 del receptor activado por el proliferador de peroxisoma está asociada con la activación diferencial de las quinasas de señalización aguas arriba en el músculo esquelético humano. J Physiol. 2010; 588 (Pt 10): 1779-90. pmid: 20308248; PubMed Central PMCID: PMC2887994.
9. Tanimoto M, Madarame H, Ishii N. (2005). Oxigenación muscular y concentración de la hormona de crecimiento plasmática durante y después del ejercicio de resistencia: Comparación entre "KAATSU" y otros tipos de régimen. Entrenamiento Int J KAATSU. 2005; 1: 51-6.
10. Zinner C, Hauser A, Born DP, Wehrlin JP, Holmberg HC, Sperlich B. (2015). Influencia del entrenamiento de intervalos hipóxicos y la recuperación hiperóxica en la activación muscular y la oxigenación en relación con el ejercicio de doble poling. Más uno. 2015; 10 (10): e0140616. pmid: 26468885; PubMed Central PMCID: PMC4607305.
11. O'Leary DS, Augustyniak RA, Ansorge EJ, Collins HL. (1999). El metaboreflejo muscular mejora la administración de O2 al músculo esquelético activo isquémico. Am J Physiol. 1999; 276 (4 Pt 2): H1399-403. pmid: 10199868.
12. Augustyniak RA, Ansorge EJ, O'Leary DS. (2000). El control metaboreflejo muscular del gasto cardíaco y la vasoconstricción periférica exhiben diferentes latencias. Revista americana de fisiología Corazón y fisiología circulatoria. 2000; 278 (2): H530-7. pmid: 10666085.
13. Hansen J, Thomas GD, Jacobsen TN, Victor RG. (2010). El metaboreflejo muscular desencadena la activación simpática paralela en el ejercicio y el descanso del músculo esquelético humano. Am J Physiol. 1994; 266 (6 Pt 2): H2508-14. pmid: 8024012.
14. Boushel R. (2010). Control metaboreflejo muscular de la circulación durante el ejercicio. Acta Physiol (Oxf). 2010; 199 (4): 367-83. pmid: 20353495.
15. Prodel E, Balanos GM, Braz ID, Nobrega AC, Vianna LC, Fisher JP. (2016). Metaboreflejo muscular y regulación del flujo sanguíneo cerebral en humanos: implicaciones para el ejercicio con restricción del flujo sanguíneo. Revista americana de fisiología Corazón y fisiología circulatoria. 2016; 310 (9): H1201-9. pmid: 26873971.
16. Conceição MS, Chacon-Mikahil MP, Telles GD, Libardi CA, Junior EM, Vechin FC, et al. (2016). Isoformas de PGC-1alpha atenuadas después del ejercicio de resistencia con restricción de flujo sanguíneo. Med Sci Sports Exerc. 2016; 48 (9): 1699-707. pmid: 27128665.
17. Borg G, Ljunggren G, Ceci R. (1985). El aumento del esfuerzo percibido, dolores en las piernas, frecuencia cardíaca y lactato sanguíneo durante el ejercicio en una bicicleta ergómetro. Eur J Appl Physiol Occup Physiol. 1985; 54 (4): 343-9. pmid: 4065121.
18. Howley ET, Bassett DR Jr., Welch HG. (1995). Criterios para la captación máxima de oxígeno: revisión y comentarios. Med Sci Sports Exerc. 1995; 27 (9): 1292 - 301. pmid: 8531628.
19. Meyer T, Lucia A, Earnest CP, Kindermann W. (2005). Un marco conceptual para el diagnóstico del rendimiento y la prescripción de entrenamiento a partir de parámetros de intercambio de gases submáximos: teoría y aplicación. Int J Sports Med. 2005; 26 Suppl 1: S38-48. pmid: 15702455.
20. Laurentino GC, Ugrinowitsch C, Roschel H, Aoki MS, Soares AG, Neves M Jr., y col. (2012). El entrenamiento de fuerza con restricción del flujo sanguíneo disminuye la expresión del gen de miostatina. Med Sci Sports Exerc. 2012; 44 (3): 406-12. pmid: 21900845.
21. Bertuzzi R, Melegati J, Bueno S, Ghiarone T, Pasqua LA, Gaspari AF, y col. (2016). GEDAE-LaB: un software gratuito para calcular las contribuciones del sistema de energía durante el ejercicio. Más uno. 2016; 11 (1): e0145733. pmid: 26727499; PubMed Central PMCID: PMC4699761.
22. di Prampero PE, Ferretti G. (1999). La energética del metabolismo muscular anaeróbico: una reevaluación de los conceptos más antiguos y recientes. Respir Physiol. 1999; 118 (2-3): 103-15. Epub 2000/01/27. pmid: 10647856.
23. Faul F, Erdfelder E, Lang AG, Buchner A. G * (2007). Poder 3: un programa flexible de análisis de poder estadístico para las ciencias sociales, del comportamiento y biomédicas. Behav Res Methods. 2007; 39 (2): 175-91. pmid: 17695343.
24. Abe T, Kearns CF, Sato Y. El tamaño y la fuerza muscular se incrementan después del entrenamiento a pie con flujo sanguíneo venoso restringido del músculo de la pierna, entrenamiento de Kaatsu-walk. J Appl Physiol (1985). 2006; 100 (5): 1460-6. pmid: 16339340.
25. Ozaki H, Kakigi R, Kobayashi H, Loenneke JP, Abe T, Naito H. (2014). Efectos de caminar combinados con restricción del flujo sanguíneo de la pierna sobre la señalización mTOR y MAPK en hombres jóvenes. Acta Physiol (Oxf). 2014; 211 (1): 97-106. pmid: 24479982.
26. Iida H, Kurano M, Takano H, Kubota N, Morita T, Meguro K, y col. (2007). Respuestas hemodinámicas y neurohumorales a la restricción del flujo sanguíneo femoral por KAATSU en sujetos sanos. Eur J Appl Physiol. 2007; 100 (3): 275-85. pmid: 17342543.
27. Ozaki H, Brechue WF, Sakamaki M, Yasuda T, Nishikawa M, Aoki N, y col. (2010). Respuestas metabólicas y cardiovasculares al ejercicio de ciclo vertical con reducción del flujo sanguíneo de la pierna. J Sports Sci Med. 2010; 9 (2): 224-30. pmid: 24149689; PubMed Central PMCID: PMC3761724.
28. Mendonca GV, Vaz JR, Teixeira MS, Gracio T, Pezarat-Correia P. (2014). Costo metabólico de la locomoción durante la caminadora con restricción del flujo sanguíneo. Clin Physiol Funct Imaging. 2014; 34 (4): 308-16. pmid: 24237757.
29. Sakamaki-Sunaga M, Loenneke JP, Thiebaud RS, Abe T. (2012). Inicio de la acumulación de lactato sanguíneo y consumo máximo de oxígeno durante la prueba de marcha gradual combinada con y sin restricción del flujo sanguíneo de la pierna. Fisiología comparada del ejercicio. 2012; 8 (2): 177-22.
30. Nakajima T, Iida H, Kurano M, Takano H, Morita T, Meguro K, y col. (2008). Respuestas hemodinámicas a la ingravidez simulada de reposo en cama cabeza abajo de 24 h y restricción del flujo sanguíneo KAATSU. Eur J Appl Physiol. 2008; 104 (4): 727-37. pmid: 18651162.
31. Karabulut M, McCarron J, Abe T, Sato Y, Bemben M. (2011). Los efectos de las diferentes presiones restrictivas iniciales utilizadas para reducir el flujo sanguíneo y la composición del muslo en la oxigenación de los tejidos del cuádriceps. J Sports Sci. 2011; 29 (9): 951-8. pmid: 21547832.
32. Hughson RL, zapatero JK, Tschakovsky ME, Kowalchuk JM. Dependencia del VO2 muscular en la dinámica del flujo sanguíneo al inicio del ejercicio del antebrazo. J Appl Physiol (1985). 1996; 81 (4): 1619-26. pmid: 8904578.
33. Engelen M, Porszasz J, Riley M, Wasserman K, Maehara K, Barstow TJ. Efectos de la hipoxia hipóxica sobre la absorción de O2 y la cinética de la frecuencia cardíaca durante el ejercicio intenso. J Appl Physiol (1985). 1996; 81 (6): 2500-8. pmid: 9018498.
34. Mendonca GV, Vaz JR, Pezarat-Correia P, Fernhall B. (2015). Efectos de caminar con restricción de flujo sanguíneo en el exceso de consumo de oxígeno después del ejercicio. Int J Sports Med. 2015. pmid: 25665001.
35. van Hall G. (2010). Cinética de la lactancia en los tejidos humanos en reposo y durante el ejercicio. Acta Physiol (Oxf). 2010; 199 (4): 499-508. pmid: 20345411.
36. Bertuzzi R, Nascimento EM, Urso RP, Damasceno M, Lima-Silva AE. (2013). Contribuciones del sistema de energía durante la prueba de ejercicio incremental. J Sports Sci Med. 2013; 12 (3): 454-60. pmid: 24149151; PubMed Central PMCID: PMC3772588.
37. Ichinose M, Ichinose-Kuwahara T, Kondo N, Nishiyasu T. (2015). El aumento del flujo sanguíneo al ejercicio muscular atenúa las respuestas cardiovasculares sistémicas durante el ejercicio dinámico en humanos. Am J Physiol Regul Integr Comp Physiol. 2015; 309 (10): R1234-42. pmid: 26377556; PubMed Central PMCID: PMC4666933.
38. Takada S, Okita K, Suga T, Omokawa M, Kadoguchi T, Sato T, y col. (1985). El ejercicio de baja intensidad puede aumentar la masa muscular y la fuerza proporcionalmente al aumento del estrés metabólico en condiciones de isquemia. J Appl Physiol 2012; 113 (2): 199-205. pmid: 22628373.
39. Yasuda T, Abe T, Brechue WF, Iida H, Takano H, Meguro K, y col. (2010). Respuesta de gas sanguíneo venoso y metabolito a contracciones musculares de baja intensidad con compresión externa de la extremidad. Metabolismo. 2010; 59 (10): 1510-9. pmid: 20199783.
40. Seals DR, Victor RG. (1991). Regulación de la actividad nerviosa simpática muscular durante el ejercicio en humanos. Exerc Sport Sci Rev. 1991; 19: 313-49. pmid: 1936089.
41. Augustyniak RA, Collins HL, Ansorge EJ, Rossi NF, O'Leary DS. (2001). El ejercicio severo altera la fuerza y los mecanismos del metaboreflejo muscular. Revista americana de fisiología Corazón y fisiología circulatoria. 2001; 280 (4): H1645-52. pmid: 11247775.
42. Spranger MD, Krishnan AC, Levy PD, O'Leary DS, Smith SA. (2015). Entrenamiento de restricción del flujo sanguíneo y el reflejo presor del ejercicio: una llamada a la preocupación. Revista americana de fisiología Corazón y fisiología circulatoria. 2015; 309 (9): H1440-52. pmid: 26342064.
43. Michael S, Graham KS, Davis GMO. (2017). Respuestas autonómicas cardíacas durante el ejercicio y la recuperación posterior al ejercicio mediante la variabilidad de la frecuencia cardíaca y los intervalos de tiempo sistólicos: una revisión. Fronteras en fisiología. 2017; 8: 301. pmid: 28611675; PubMed Central PMCID: PMC5447093.
44. Fisher JP, Young CN, Fadel PJ. (2015). Ajustes autonómicos para hacer ejercicio en humanos. Fisiología integral. 2015; 5 (2): 475-512. pmid: 25880502.
45. Melzer K, Renaud A, Zurbuchen S, Tschopp C, Lehmann J, Malatesta D, y col. (2016). Alteraciones en el balance de energía de una intervención de ejercicio con ingesta ad libitum de alimentos. Revista de ciencia nutricional. 2016; 5: e7. pmid: 27066256; PubMed Central PMCID: PMC4791516.
46. Karabulut M, Garcia SD. (2017). Respuestas hemodinámicas y gasto de energía durante el ejercicio de restricción del flujo sanguíneo en la población obesa. Clin Physiol Funct Imaging. 2017; 37 (1): 1-7. pmid: 26046808.
47. Ferreira MLV, Sardeli AV, Souza GV, Bonganha V, Santos LDC, Castro A, et al. (2017). Recuperación cardíaca autonómica y hemodinámica después de una sesión única de ejercicio aeróbico con y sin restricción del flujo sanguíneo en adultos mayores. J Sports Sci. 2017; 35 (24): 2412-20. pmid: 28029066.
Cita en PubliCE
Miguel S. Conceição, Arthur F. Gáspari, Ana PB Ramkrapes, Edson MM Junior, Romulo Bertuzzi, Cláudia R. Cavaglieri Mara Patrícia T. Chacon-Mikahil (2018). El Metabolismo Anaeróbico Induce un Mayor Gasto Energético Total Durante el Ejercicio con Restricción del Flujo Sanguíneo. .https://g-se.com/el-metabolismo-anaerobico-induce-un-mayor-gasto-energetico-total-durante-el-ejercicio-con-restriccion-del-flujo-sanguineo-2464-sa-q5ba153c6a035e
