El Ejercicio de Resistencia Mejora el Efecto del Entrenamiento de Fuerza Sobre el Tamaño de la Fibra Muscular y la Expresión de la Proteína de Akt y mTOR
Zuzanna Kazior1, Sarah J. Willis2, Marcus Moberg2, William Apró2, José A. L. Calbet3,4, Hans-Christer Holmberg1, Eva Blomstrand21 Swedish Winter Sports Research Centre, Department of Health Sciences, Mid Sweden University, Östersund, Sweden
2 Swedish School of Sport and Health Sciences, Stockholm, Sweden
3 Department of Physical Education, University of Las Palmas de Gran Canaria, Las Palmas de Gran Canaria, Spain
4 Research Institute of Biomedical and Health Sciences (IUIBS), University of Las Palmas de Gran Canaria, Campus Universitario de Tafira s/n, Las Palmas de Gran Canaria, Canary Island, Spain
Resumen
Los informes acerca del efecto del ejercicio de resistencia sobre la respuesta anabólica al entrenamiento de la fuerza han sido contradictorios. Este estudio re-investigó este tema, enfocándose en los efectos del entrenamiento sobre indicadores de síntesis y degradación de proteínas. Dos grupos de sujetos varones realizaron 7 semanas de ejercicio de fuerza sólo (F; n = 7) o en combinación con el ejercicio de resistencia previo, incluyendo tanto pedaleo continuo como de intervalos (RF; n = 9). Se tomaron biopsias musculares antes y después del período de entrenamiento. Aumentos similares en 1 MR de press de piernas (30%; P <0.05) se observaron en ambos grupos, mientras que el consumo máximo de oxígeno fue elevado (8%; P <0.05) sólo en el grupo de FR. El entrenamiento FR amplió las áreas de las fibras tipo I y fibras tipo II, mientras que el protocolo de F aumentó sólo las fibras tipo II. El área de fibra promedio aumentó por 28% (P <0.05) en el grupo de FR, mientras que ningún aumento significativo se observó en el grupo F. Es más, la expresión de las proteínas de la Akt y de la mTOR fue mejorada en el grupo de FR, mientras que sólo el nivel de mTOR fue elevado después del entrenamiento F. Se correlacionaron alteraciones inducidas por el entrenamiento en los niveles de proteína de la Akt y de la mTOR a los cambios en el área de la fibra de tipo I (r = 0.55-0.61, P <0.05), así como el área de fibra promedio (r = 0.55-0.61, P <0.05), reflejando el rol importante jugado por estas proteínas en relación con la hipertrofia muscular. Ambos regímenes de entrenamiento redujeron el nivel de proteína de MAFbx (P <0.05) y tendió a elevar el de la MuRF-1. Los resultados presentes indican que la hipertrofia más grande observada en el grupo de FR se debe más al estimulación pronunciada de los procesos anabólicos en lugar de la inhibición de los procesos catabólicos.
El entrenamiento concurrente normalmente es realizado pro deportistas de élite y atletas recreativos. El estudio primario de Hickson [1] indicó que el entrenamiento de la resistencia puede empeorar la adaptación al entrenamiento de la fuerza cuando los dos se realizan en la misma sesión. Como consecuencia, los estudios adicionales han mantenido el apoyo a las interacciones negativas entre entrenamiento de la resistencia y de la fuerza, atenuándose el desarrollo de la fuerza y la potencia [2, 3]. Sin embargo, no todos los estudios han encontrado efectos negativos entrenamiento combinado de la resistencia y de la fuerza [2, 3]. Por ejemplo, Lundberg y colegas [4, 5] reportaron recientemente que 5 semanas de entrenamiento concurrente realmente llevaron a un aumento más pronunciado en el volumen muscular, con el mismo aumento en la fuerza muscular. Así, un poco de incertidumbre permanece acerca de la influencia del ejercicio de resistencia sobre la respuesta hipertrófica al ejercicio de fuerza.
La activación de la vía Akt-mTOR (el blanco mecánico de la rapamicina) es considerada de hacer una contribución mayor al desarrollo de la masa muscular y, en realidad, esta vía es activada por diferentes tipos de ejercicio [6]. En el músculo del roedor, la activación de la proteína kinasa AMP-activada (la AMPK) suprime la síntesis de proteínas y atenúa la señalización a través del camino de la mTOR [7], observaciones que han llevado a la propuesta de un mecanismo para la interacción entre el entrenamiento de la fuerza y de la resistencia: la elevación de la actividad de la AMPK inducida por el ejercicio de resistencia inhibe la señalización de la mTOR durante una sesión subsecuente de ejercicio de fuerza. Esta hipótesis se ha evaluado en humanos empleando varias combinaciones de ejercicio agudo de resistencia y de fuerza [8-12]. Aunque los resultados hasta hoy no dan apoyo para la inhibición mediada por la AMPK de la señalización de la mTOR durante el período de recuperación después del ejercicio, el efecto del entrenamiento concurrente a largo plazo sobre la adaptación de la vía de la Akt-mTOR no se ha investigado todavía.
El efecto del entrenamiento concurrente sobre la fuerza muscular se ha documentado relativamente bien, pero se sabe menos sobre los efectos a largo plazo de tal entrenamiento sobre el crecimiento muscular, la composición de las fibras, la densidad capilar, y la capacidad oxidativa. El ejercicio de fuerza se conoce que estimula los procesos anabólicos, llevando al agrandamiento de áreas de las fibras [13, 14]. Al mismo tiempo, ocho semanas de entrenamiento de la fuerza fueron encontradas de estimular la expresión tanto del mARN como los niveles de proteína, de las ubiquitinas ligasas MAFbx y MuRF-1, indicando también la activación de procesos que regulan la degradación de la proteína en el músculo [15]. Sin embargo, no se sabe si el agrandamiento inducido por el entrenamiento de la fuerza en el área de las fibras y las elevaciones de los marcadores para la síntesis y degradación de proteínas son afectadas por el ejercicio de resistencia anterior.
En la presente investigación, dos grupos de sujetos se entrenaron durante siete semanas, un entrenamiento de la fuerza y de la resistencia combinando en las mismas sesiones y el otro realizó entrenamiento de la fuerza sólo. El estudio fue diseñado para examinar aún más si el entrenamiento de la resistencia, con sesión de intervalos de alta intensidad, tiene influencias en respuesta a una sesión subsecuente de ejercicio de fuerza con respecto al desarrollo de fuerza, la composición de la fibra muscular, y el tamaño de las fibras, así como el nivel total de proteínas en la vía de la Akt-mTOR. Además, la expresión de MAFbx y MuRF-1 en los niveles de mARN y de la proteína, fue evaluada.
MATERIALES Y MÉTODOS
Sujetos
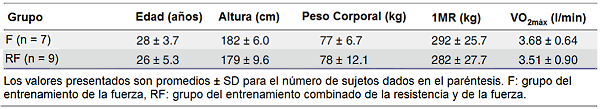
Dieciséis hombres sanos que no realizaban ejercicio de fuerza o de resistencia sobre una base regular, participaron en el estudio. Después de ser totalmente informados sobre el propósito del estudio y los riesgos asociados, ellos dieron su consentimiento informado por escrito para participar. Estos sujetos fueron divididos en dos grupos con características físicas similares (ver Tabla 1). El protocolo del estudio fue aceptado por la Junta de Revisión Ética Regional en Umeå, Suecia, y se realizó de acuerdo con los principios delineados en la Declaración de Helsinki.
Tabla 1. Características físicas de los dos grupos de sujetos.
Determinación del consumo de oxígeno máximo y submáximo
Todas las sesiones de test se llevaron a cabo en un cicloergómetro (Schoberer Rad Messtechnik, Julich, Alemania). Cada sujeto ajustó la altura del asiento y la posición del manubrio para su propia comodidad y estos ajustes fueron registrados y empleados en las sesiones subsecuentes de evaluación. El consumo de oxígeno (VO2) fue determinado en 3-4 ritmos de trabajo submáximos, empezando a 80 W con aumentos posteriores de 30 W. Después de una recuperación de 10 minutos, un test incremental máximo fue realizado, comenzando a 80 W con aumentos de 30 W a cada minuto hasta el agotamiento. El consumo de oxígeno se supervisó continuamente por un sistema on line (AMIS 2001 modelo C; Innovision A/S, Odense, Dinamarca) y los valores promedios durante los 30 segundos finales de cada ritmo de trabajo, fueron calculados. La frecuencia cardíaca (FC) se monitoreada usando un dispositivo S610 Polar continuamente (Polar Electro OY, Kempele, Finlandia). La tasa de trabajo correspondiente a aproximadamente el 65% y el 90% del VO2máx fueron calculados a partir de estas mediciones.
Mediciones de una máxima repetición (1MR)
La 1MR fue determinada en una máquina de press de piernas (Free Motion EPIC PlateLoaded Leg Press, F218, Utah, EE.UU.) como previamente fue descrito por Baechle y Earle [16]. En breve, después del calentamiento (15 repeticiones al 40% de 1MR predecida, seguido por 6 repeticiones al 60-70% de 1MR predecida), la carga fue gradualmente aumentada hasta que el participante fuera incapaz de realizar más de una sola repetición (desde un ángulo de 90° a 180° de la rodilla). Inicialmente 30-40 kg se agregaron a la carga del último precalentamiento, luego la carga era incrementada (5 a 20 kg) en base al rendimiento del sujeto en el nivel previo. Los sujetos hicieron 3-5 intentos para realizar sus 1MRs con 3 minutos de pausa entre cada prueba.
Toda la evaluación (consumo oxígeno máximo y submáximo y la 1MR) se realizó en al menos 5 días antes del inicio del período de entrenamiento y al menos 48 horas después de la finalización del período de entrenamiento. Siempre se realizaron los dos tipos de tests en días diferentes y, si era posible, en el mismo momento del día pre- y post-entrenamiento para cada sujeto.
El programa de entrenamiento
El grupo del entrenamiento de la fuerza sólo (F) realizó el ejercicio de press de piernas, mientras que el grupo de entrenamiento concurrente realizó el ejercicio de resistencia (pedaleo) seguido por 10 minutos de descanso y luego el ejercicio de fuerza (RF). Los sujetos fueron instruidos para continuar sus actividades regulares de la vida diaria (es decir, caminar y pedalear), sin participar en cualquier otro programa de entrenamiento.
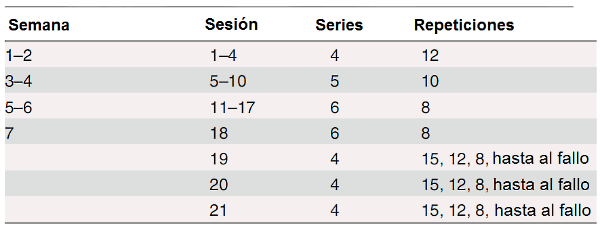
El período de entrenamiento duró siete semanas, con dos sesiones en cada una de las primeras dos semanas y progresivamente aumentado a cuatro sesiones en las semanas seis y siete, dando un total de 21 sesiones (ver Tabla 2 para una descripción más detallada). El ejercicio de press de piernas empezaba a una carga correspondiente al 70% de la 1MR inicial del individuo y esta carga era elevada un 5-7% cada tres o cuatro sesiones de entrenamiento, para igualar la ganancia observada en la fuerza. El número de series se aumentó de cuatro en semana uno a seis en la semana cinco y el número de repeticiones en cada serie disminuyó de doce a ocho con una pausa de 3 minutos entre las series. Los sujetos fueron guiados para realizar cada repetición a un ritmo fijo, es decir, con las fases concéntricas y excéntricas de 2 segundos cada una. Este protocolo del ejercicio de fuerza duraba aproximadamente 30 minutos y se trató de mantener la misma intensidad para ambos grupos.
Tabla 2. Programa del entrenamiento de la fuerza.
Las sesiones de resistencia en un cicloergómetro (Monark 828E, Monark Exercise AB, Vansbro, Suecia) se realizaron aun ritmo de trabajo correspondiente al 63±1.2% del VO2máx con la intensidad de entrenamiento siendo progresivamente aumentada cada dos semanas para mantener una tasa relativa de trabajo constante. Los sujetos fueron alentados a mantener una cadencia estable auto-seleccionada que resultó ser de 60-65 rpm. Las sesiones de pedaleo en intervalos se realizaron a un ritmo de trabajo correspondiente al 95±1.8% del VO2max y fueron incorporadas en las tres semanas finales (las sesiones 12, 14, 16, 18, 20) para mejorar la activación de AMPK [17, 18]. Para más detalles acerca de la progresión del entrenamiento, vea la Tabla 3. Todas las sesiones de entrenamiento fueron monitoreadas para ambos grupos en forma cuidadosa.
Tabla 3. Programa del entrenamiento de la resistencia para el grupo de RF.

Dentro de los 20 minutos después de la realización de una sesión de entrenamiento, los sujetos en el grupo de F recibieron un suplemento de proteínas (Kolozzeum Pure Whey, Estocolmo, Suecia), 20 g disueltos en 500 ml de agua para mejorar la recuperación del músculo. El grupo de RF fue tratado con ese mismo suplemento, pero con la suma de maltodextrina (Fairing Fast Carbs, Järfälla, Suecia) en una cantidad correspondiente al gasto energético individual calculado durante el entrenamiento de la resistencia.
Biopsias musculares
Se tomaron biopsias de la parte lateral del músculo cuádriceps, es decir, del vasto externo, tanto antes como después de 7 semanas de entrenamiento. Se les pidió a los sujetos que se abstengan de entrenar por 2 días antes de las biopsias de pre-entrenamiento y las biopsias de post-entrenamiento se tomaron aproximadamente 2 a 3 días después de la última sesión en 15 sujetos, pero en un sujeto la biopsia del post-entrenamiento se tomó 90 horas después de la última sesión. Durante este período los sujetos se abstuvieron también de entrenar.
Los sujetos llegaron al laboratorio en la mañana luego de un ayuno durante la noche, con el mismo procedimiento pre- y post-entrenamiento. Después de 10 minutos de reposo en supino, la piel sobre la media porción del vasto externo se anestesió con lidocaína 2% (B. Braun Medical, Danderyd, Suecia) y las biopsias fueron tomadas usando la técnica de aguja con succión [19, 20]. Las biopsias de pre-entrenamiento se tomaron de la pierna derecha de 8 sujetos y la pierna izquierda de los otros 8. Para reducir el error metodológico, dos biopsias para los análisis histoquímicos se tomaron de la mayoría de los sujetos [21]. Las biopsias de post-entrenamiento se tomaron 2-3 cm proximal (8 sujetos) o distal (8 sujetos) a las del pre-entrenamiento. El tejido obtenido se limpió rápidamente de la sangre y grasas y fue dividido en dos partes, una parte fue inmediatamente congelada en nitrógeno líquido. La otra parte fue puesta en un medio de encastre (Tissue Tek® O.C.T. Compound) y congelado en isopentano enfriado en su punto de congelación en nitrógeno líquido para los análisis histoquímicos. Las muestras luego se guardaron a -80°C hasta que se analizaran.
Análisis histoquímico
Cortes transversales en serie de 10-µm fueron realizados en un crioestato en -20°C. Después de la preincubación en pH 4.3, 4.6 y 10.3, las secciones estaban marcadas para la ATPasa miofibrilar en pH 9.4 [22]. Las fibras musculares fueron clasificadas como tipo I, IIA, IIB o IIC [23], aunque nosotros usamos la nueva terminología de tipo I, IIA y IIX, puesto que el músculo esquelético humano no contiene fibras de IIB rápidas presentes en los animales pequeños [24]. Para visualizar los capilares, las cortes transversales fueron marcados por el procedimiento de amilasa-PAS [25].
El análisis de imagen por computación (Leica QWin Runner V 3.5.1, Leica Microsystems, Bromma, Suecia) fue realizado para evaluar capilares, composición de las fibras y áreas de las fibras.
Al menos se clasificaron 150-200 fibras y se analizaron en cada punto de tiempo y las áreas fueron determinadas por un mínimo de 15 fibras de cada tipo como fue recomendado previamente [21, 26]. El número promedio de fibras analizado en cada muestra de biopsia era 146 para fibras tipo I (rango 26-419), 75 para las fibras tipo IIA (rango 23-152) y 59 para las fibras tipo IIX (rango 18-176). Sólo en 7 sujetos (3 en el grupo RF y 4 en el grupo R), el número de fibras de IIX se excedió 15 tanto en pre- y post-biopsias.
Ensayos de enzimas
Para las mediciones de las actividades de las enzimas, el tejido muscular que fue inmediatamente congelado en el nitrógeno líquido fue utilizado. Estas muestras fueronliofilizadas y la sangre, grasas, y tejido conectivo, removidos. Aproximadamente 3 mg entonces se homogeneizaron en el medio de la extracción refrescado con hielo (50 mM Tris HCl, 5 mm MgCl2, 1 mm EDTA, pH 8.2) con un suelo de vidrio homogeneizador (100 µl por mg de músculo seco). Las actividades máximas de la citrato sintetasa [27] y de la 3-hidroxiacil CoA deshidrogenasa (HAD) [28] se determinaron bajo condiciones óptimas como se describió previamente. Las mediciones se realizaron en un espectrofotómetrro Beckman Coulter DU 800 (Beckman Coulter Inc., Brea, CA) a 25°C. Los análisis se realizaron en 13 sujetos (8 en el grupo RF y 5 en el grupo F) de quienes el tejido muscular estaba suficientemente disponible.
Cuantificación del mARN
El ARN total se extrajo de 2-3 mg de tejido muscular liofilizado por homogeneización en PureZOL RNA Isolation Reagent (Laboratorios Bio-Rad, Sundbyberg, Suecia) usando un Polytron (Kinematica, Luzern, Suiza). La concentración y pureza del ARN aislado se evaluó espectrofotométricamente como está descrito previamente [29]. Un microgramo de este ARN entonces fue utilizado para generar 20 μl de ADN complementario (cADN) con la Síntesis de cADN del iScript Kit (Laboratorios del Bio-rad). La concentración de cADN, templando la temperatura, y en condiciones para la reacción en cadena de lapolimerasa (la PCR) se optimizó cada par primario y se mantuvieron dentro del rango lineal de amplificación. Para permitir la comparación directa de pre- y post-muestra de cada participante, las muestras fueron llevadas por triplicado en paralelo en la misma de 96 pocillos.
La PCR cuantitativa de tiempo real (RT-qPCR) se realizó en un iCycler de Bio-Rad (Laboratorios Bio-Rad) en una solución de 25 μl que contiene 12.5 μl de SYBR Green Supermix (Laboratorios Bio-Rad), 0.5 μl cada uno de los cebadores delanteros e inversos (10 μmol/l) y 11.5 μl el cADC de la plantilla de l (para detalles extensos, ver [29]). El mARN de GAPDH de mantenimiento se usó como control interno, lo que ha sido validado previamente bajo las mismas condiciones experimentales [29, 30]. La expresión de cada gen designado se evaluó con los el procedimiento 2ΔCt, donde Ct representa la diferencia entre el ΔCt para el gen de interés y el del GAPDH [31]
Immunotransferencia
Aproximadamente 3 mg músculo liofilizado se homogeneizaron en el buffer congelado (80 µl/mg) conteniendo 20 mM HEPES, pH 7.4, 1 mM EDTA, 5 mM EGTA, 10 mM MgCl2, 50 mM ß-glicerofosfato, 1 mM Na3VO4, 2 mM DTT, 1% Tritón X-100, 20 µg/ml de leupeptina, 50 µg/ml de aprotinina, 40 µg/ml de PMSF y 1% combinado de inhibidor de fosfatasa (Sigma P-2850).
Estos homogenatos luego se centrifugaron a 10,000 g durante 10 minutos a 4°C para quitar restos celulares y el sobrenadante reunido y su concentración de proteína determinado por el método de proteína BCA (Pierce Biotechnology, Rockford, IL). Alícuotas del sobrenadante (diluído a una concentración de proteína de 3.0 µg/µl con buffer homogeneizante) era mixto con un volumen igual de buffer de Laemmli y calentado durante 5 minutos a 95°C para desnaturalizar las proteínas. Luego, 30 µg de proteína fueron cargados en un gel SDS-PAGE y llevados en hielo a 200 V durante 120 minutos para separar las proteínas. Ambas muestras del mismo sujeto fueron llevados a cabo sobre el mismo gel.
La gel luego se incubó en el buffer de transferencia (25 mm de Tris-HCl, 192 mm de glicina, 20% de metanol) a 4°C durante 30 minutos antes de que la transferencia electrofirética de las proteínas a una membrana de fluoruro de polivinilidina (Bio-Rad, Laboratorios, Richmond, CA) por 3 hs en hielo en un refrigerador a 4°C. La membrana se bloqueó como consecuencia a la temperatura ambiente durante 1 hs en TBS (Salina Tris amortiguada; 10 mm Tris pH 7.6, 100 mm NaCl) conteniendo 5% de leche seca sin grasa y luego incubada toda la noche a 4°C con anticuerpos primarios disponibles comercialmente, diluidos en TBS que contienen 0.1% Tween 20 (TBST) con 2.5% de leche seca sin grasa: GAPDH (1:5,000), Akt (1:1,000), mTOR (1:1,000), S6K1 (1:1,000) comprado de Cell Signaling Technology (Beverly, MA); α-tubulina (1:5,000) de Sigma-Aldrich (St. Louis, MO); MAFbx (1:1,000) de Abcam (Cambridge, Reino Unido) y MuRF1 (1:1,000) de Santa Cruz Biotechnology (Santa Cruz, CA). Los dos anticuerpos últimos que se han sido recientemente validados usando MAFbx y MuRF-1 transfectaron células HEK293 y un negativo no-transfectado de control [32].
Las membranas luego se lavaron en TBST e incubaron con un anticuerpo secundario (anti-conejo, anti-ratón (1:1,000) comprado en Cell Signaling Technology (Beverly, MA) o anti-cabra (1:1,000) de Abcam (Cambridge, Reino Unido)) durante 1 hs a temperatura ambiente antes del lavado en serie y visualización de las proteínas por quimioluminescencia mejorada usando el sistema Molecular Imager ChemiDoc XRS (Laboratorios de Bio-Rad). Todas las bandas fueron analizadas usando la herramienta Quantity One version 4.6.3 software (Laboratorios de Bio-Rad) y los niveles de proteína expresados como unidades arbitrarias respecto a la GAPDH, puesto que esta proteína estuvo inalterada por los protocolos de entrenamiento. En contraste, el nivel de α-tubulina que se usa a menudo como la proteína de referencia fue mayor después de ambos protocolos de entrenamiento.
Análisis estadístico
Todos los datos se expresan como medias ± SD y fueron verificados para la distribución normal antes de realizar los análisis estadísticos paramétricos. Un ANOVA de medidas repetidas bidireccional (tiempo, grupo) fue aplicado para evaluar y comparar el efecto del entrenamiento en los grupos RF y F. Cuando el ANOVA mostró un efecto principal significativo o interacción entre tiempo y grupo, el test post hoc LSD de Fisher fue aplicado para identificar dónde las diferencias ocurrieron. Un valor P <0.05 fue considerado estadísticamente significativo.
RESULTADOS
Fuerza muscular y consumo de oxígeno
Los diferentes regímenes de entrenamiento produjeron la misma mejora en la fuerza muscular (efecto principal del tiempo; P <0.01). La 1MR aumentó por 30%, de 292±25.7 a 378±37.4 kg en el grupo F y de 282±27.7 a 367±31.2 kg en el grupo RF. El aumento progresivo en la carga de trabajo relativa durante el período de entrenamiento de siete semanas también era similar en los dos grupos (datos no mostrados). El peso corporal aumentó en ambos grupos ligeramente pero significativamente (efecto principal del tiempo; P <0.05), de 76.6±6.68 a 78.6±8.16 kg en el grupo F y de 77.5±12.1 a 78.7±12.0 kg en el grupo RF.
El VO2 máximo aumentó de 3.51±0.90 a 3.80±0.78 l/min (P <0.05) en el grupo RF, pero permaneció inalterado en el grupo F (3.68±0.64 pre- vs 3.69±0.56 post-entrenamiento l/min). También cuando fue expresado por kg de peso corporal, el consumo máximo de oxígeno aumentó de 45.1±8.5 a 48.2±6.9 ml/min/kg (P <0.05) en el grupo RF, pero permaneció inalterado en el grupo F (48.3±8.3 pre- vs 47.3±7.9 post-entrenamiento ml/min/kg). Además, el tiempo hasta al agotamiento durante el test máximo se mejoró de 8.52±2.24 a 9.43±2.19 minutos (P <0.05) en el grupo RF, pero se mantuvo sin cambios en el grupo F (9.07±1.51 pre- vs 8.97±1.55 minutos post-entrenamiento). Para todas las tres variables, el ANOVA reveló una interacción significativa (tiempo y grupo), además un efecto principal significativo del tiempo se descubrió para el VO2máx (l/min) y para el tiempo hasta al agotamiento.
Actividades de las enzimas
En el grupo RF, la actividad máxima de la citrato sintetasa (CS) fue un 21% superior (58.2±12.1 a 70.2±12.2 µmol/min/g, P <0.05) después del período de entrenamiento, mientras que la actividad máxima de la HAD fue inalterada (39.8±11.0 y 40.9±6.7 µmol/min/g antes y después de entrenarse, respectivamente). Los valores correspondientes para la CS en el grupo F eran: 56.3±6.6 y 58.6±4.8 µmol/min/g y para HAD: 45.1±5.6 y 41.6±4.2 µmol/min/g antes y después de entrenarse, respectivamente. Para la actividad de la CS, el ANOVA reveló un efecto principal del tiempo así como una interacción significativa (tiempo y grupo).
Histoquímica
Siete semanas de entrenamiento RF redujeron la proporción relativa de fibras tipo I de 56 a 46% (P <0.05; efecto principal del tiempo e interacción tiempo y grupo), sin influenciar significativamente la proporción de fibras tipo IIA y tipo IIX (Tabla 4). El entrenamiento de fuerza sólo no alteró la composición de las fibras significativamente, aunque en ambos grupos la proporción de fibras tipo IIC (intermedias) tendieron a aumentar con el entrenamiento (P = 0.072; efecto principal del tiempo) (Tabla 4).
Tabla 4. Composición de fibras, área de fibra, y la densidad capilar en las biopsias del vasto externo tomado antes (Pre) y después (Post) de 7 semanas de entrenamiento
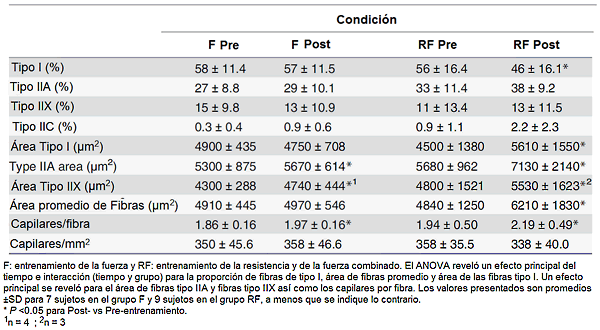
El área de fibras promedio significativamente sólo aumentó en el grupo RF, 28% vs virtualmente ningún aumento en el grupo F (Tabla 4). El protocolo del RF aumentó las áreas de fibras tipo I, IIA y IIX por 25, 26 y 15%, respectivamente, mientras que sólo las áreas de fibras tipo IIA y IIX fueron significativamente mejoradas, 7% y 10%, respectivamente en el grupo F (Tabla 4). El ANOVA reveló un efecto principal del tiempo (P <0.01) así como la interacción tiempo y grupo (P <0.01) para el área de fibras promedio y área de fibras tipo I así como un efecto principal del tiempo P <0.05) para las áreas de tipo IIA y IIX.
El número de capilares por fibra fue elevado por 5% y 13% después de 7 semanas de entrenamiento en los grupos F y RF, respectivamente (efecto principal del tiempo; P <0.05). El número de capilares por mm cuadrado no fue alterado en cualquiera de los grupos (Tabla 4).
Niveles de mARN y proteína total
El nivel de proteína de la Akt fue superior un 32% después del entrenamiento RF, pero inalterado en el grupo F (Fig. 1A; efecto principal del tiempo (P <0.01) e interacción tiempo y grupo (P <0.01)). El contenido de proteína de la mTOR fue mayor un 24% y un 15% en los grupos RF y F, respectivamente, mientras el contenido de S6K1 cayó por aproximadamente un 10% en ambos grupos (Fig. 1B y 1C), con el ANOVA revelando un efecto principal del tiempo (P <0.05) en el caso de ambas proteínas. Ningún régimen influenció significativamente los niveles del mARN que codifica para las proteínas consideradas que regulan la actividad de la mTOR (Rheb, REDD1 y 2, datos no mostrados).
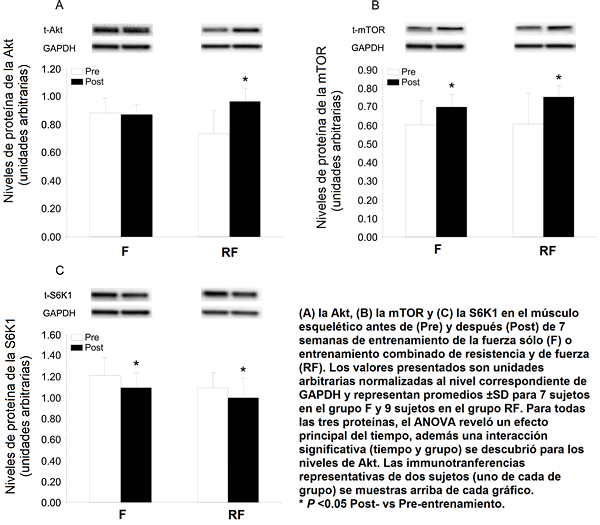
Figura 1. Niveles de proteínas en la vía de señalamiento de la Akt, antes y después de 7 semanas de entrenamiento.
La expresión de las ubiquitinas ligasas fue influenciada hasta algún punto diferentemente por los dos regímenes de entrenamiento. El nivel de mARN del MuRF-1 fue elevado en el grupo RF, pero no en el grupo F (una interacción tiempo y grupo se reveló en el ANOVA). En contraste, el nivel de proteína del MuRF-1 tendió a ser superior (P = 0.082; efecto principal del tiempo) después del entrenamiento RF y F. El nivel del mARN del MAFbx no fue alterado en ningún caso, aunque el nivel de la proteína correspondiente fue reducido por ambas formas de entrenamiento (Fig. 2; efecto principal significativo del tiempo).
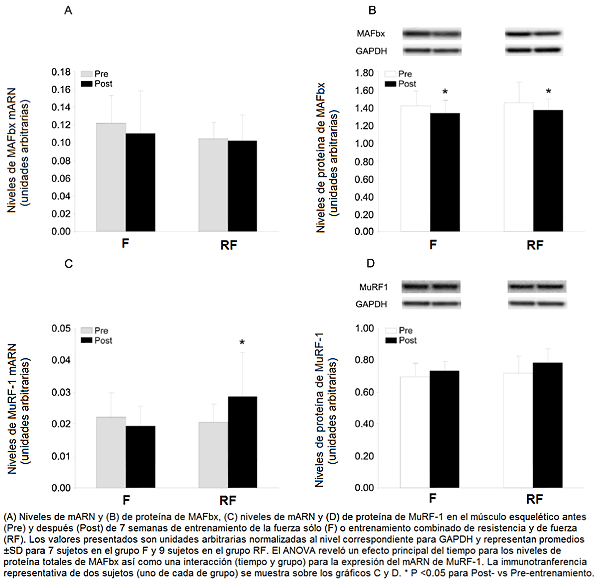
Figura 2. Expresión de MAFbx y de MuRF-1 antes y después de 7 semanas de entrenamiento.
Correlaciones
Hubo una correlación significativa entre los cambios en el nivel de proteína de la Akt y los cambios tanto en el área de la fibra de tipo I (r = 0.61, P <0.05) como en el área de fibras promedio (r = 0.61, P <0.05; Fig. 3A y 3B), pero no con los cambios en las fibras tipo IIA o tipo IIX. También los cambios en proteína de la mTOR se correlacionó significativamente con los cambios en el área de la fibra de tipo I (r = 0.55, P <0.05) y área de fibras promedio (r = 0.55, P <0.05, Fig. 4A y 4B), pero no con los cambios en las fibras tipo IIA o tipo IIX.
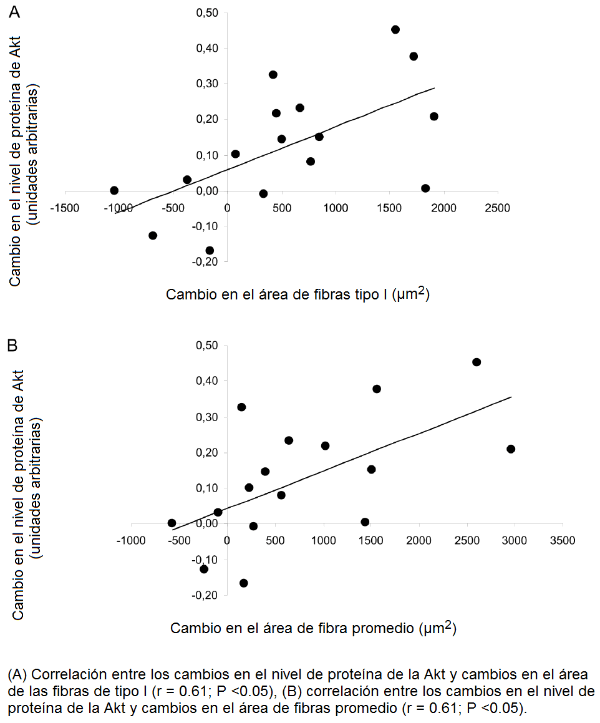
Figura 3. Relación entre los cambios en la proteína de la Akt y cambios en el área de fibras.
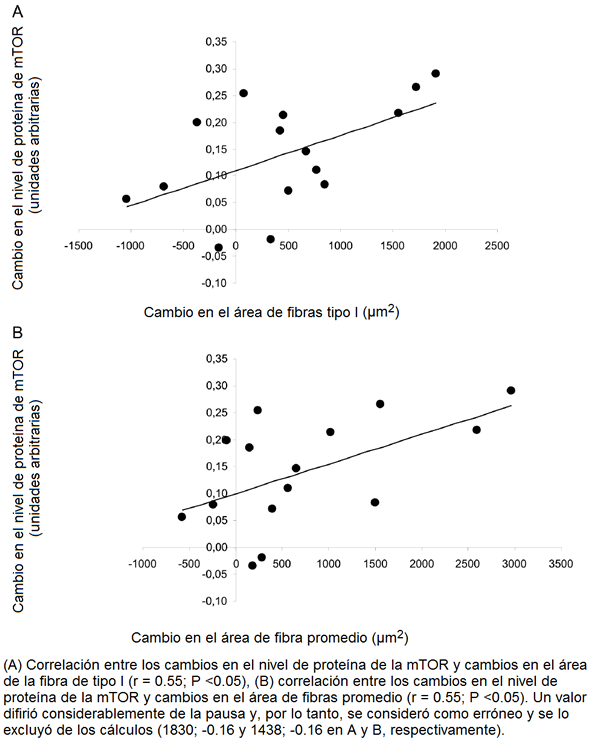
Figura 4. Relación entre los cambios en la proteína de la mTOR y los cambios en el área de las fibras.
DISCUSIÓN
El principal hallazgo en el presente estudio fue que el entrenamiento de la resistencia no daña la mejora en la fuerza máxima o hipertrofia de las fibras inducida por una sesión subsecuente de entrenamiento de la fuerza. Realmente, el entrenamiento combinado llevó a un aumento más pronunciado en el área de las fibras musculares, acompañado por las elevaciones en los niveles de las proteínas de la Akt y de la mTOR en el músculo del vasto externo. Además, el entrenamiento combinado mejoró el área de las fibras tipo I y fibras tipo II, mientras que el entrenamiento de la fuerza sólo aumentó las fibras tipo II.
Sin embargo, el aumento más grande en el área de la fibra muscular y así, el agrandamiento similar en el volumen muscular después del entrenamiento combinado de la fuerza y de la resistencia, no se reflejó en una mayor mejora de la fuerza muscular. La 1 MR se elevó a la misma magnitud para ambos protocolos del entrenamiento, conforme con un reciente reporte de Lundberg y colegas [5], donde los sujetos realizaron entrenamiento unilateral de 5 semanas. Esto indica que la mejora en la fuerza máxima (1MR) observada después de nuestro período relativamente corto de 7 semanas de entrenamiento, es ampliamente debido a la adaptación neuromuscular.
Siete semanas de entrenamiento combinado mejoraron el VO2máx y la actividad máxima de la enzima citrato sintetasa del ciclo del TCA, conforme con resultados previos sobre el entrenamiento de la resistencia [33]. Inesperadamente, la actividad máxima de la HAD, que se ha reportado que cambia de una manera similar a las encimas del ciclo del TCA [28, 34], estuvo sin cambios. De esta forma, es posible que el entrenamiento de la fuerza pudo haber neutralizado el aumento esperable en la actividad de la HAD después del entrenamiento de la resistencia. Además, el número de capilares por fibra aumentó, aunque el número de capilares por mm cuadrado estuvo inalterado como resultado de la pronunciada hipertrofia de la fibra muscular.
De acuerdo con reportes previos, nuestro protocolo del entrenamiento de la fuerza no indujo cambios en VO2máx, en la actividad de la citrato sintetasa o HAD [35, 36]. Sin embargo, Tang y colaboradores [14] observaron una elevada capacidad oxidativa (actividades de la CS y HAD) después de 12 semanas de entrenamiento de la fuerza. La razón para los resultados divergentes en estos estudios no está clara pero el uso de protocolos de entrenamiento diferentes y sujetos diferentemente entrenados pueden explicar parcialmente los distintos resultados..
El protocolo del entrenamiento concurrente redujo la proporción de fibras de tipo I y tendió a aumentar la proporción de fibras de tipo IIA, mientras que el entrenamiento de la fuerza no tuvo tales efectos. Una reducción en la proporción de las fibras de tipo I después del entrenamiento combinado no ha sido reportado previamente, pero un aumento en las fibras de tipo IIA, normalmente se encuentra acompañado por una reducción correspondiente en la proporción de fibras de tipo IIX [13]. La reducción en la proporción de fibras de tipo I, así como una elevación en la proporción de fibras de tipo IIA, de hecho, han sido observadas después de 4-6 semanas de entrenamiento de sprint o 9 semanas de entrenamiento de la fuerza combinado con saltos pliométricos [37, 38]. En estos estudios, así como en nuestro grupo combinado, una transición de las fibras de tipo I al tipo IIA parece reflejar una adaptación funcional, aunque los mecanismos subyacentes permanecen inciertos.
Aunque ambos regímenes del entrenamiento produjeron hipertrofia, ellos influenciaron las dos fibras principales en forma diferente. El entrenamiento concurrente amplió las áreas de las fibras de tipo I y de tipo II, mientras que el entrenamiento de la fuerza sólo aumentó las áreas de las fibras de tipo II. Esto hace pensar en un efecto adicional del entrenamiento de la fuerza y de la resistencia sobre la hipertrofia muscular así como una respuesta cualitativamente diferente. Reportes previos que indican que el entrenamiento de la resistencia aumenta ambos tipos de fibras I y II en sujetos previamente desentrenados [39], apoyan nuestra suposición de un efecto adicional de los dos tipos de entrenamientos, aunque no puede descartarse que el efecto es debido a la cantidad mayor de trabajo llevada a cabo por el grupo RF. Es más, el efecto relativamente grande en este grupo puede atribuirse probablemente a la naturaleza 'desentrenada' de los sujetos, puesto que la activación aguda de la señalización intracelular tanto al ejercicio de la resistencia como al ejercicio de fuerza, es más pronunciada en el músculo desentrenado que en el músculo entrenado [40, 41]. Con respecto al entrenamiento de la fuerza sólo, nuestras observaciones están de acuerdo con algunos otros estudios, aunque los aumentos en ambos tipos de fibras principales han sido encontrados por otros [13, 14]. Los diferentes regímenes de entrenamiento, incluyendo la intensidad, el volumen, y la duración del período de entrenamiento, probablemente explican, al menos en parte, los distintos resultados.
Los dos regímenes del entrenamiento indujeron cambios diferentes en las proteínas involucradas en la regulación de los procesos anabólicos en el músculo con el entrenamiento combinado llevando a mejores niveles de ambas proteínas de la Akt y de la mTOR, mientras que el entrenamiento sólo de la fuerza aumentó el contenido de proteína de la mTOR (Fig 1). El ejercicio de resistencia agudo se sabe que estimula la señalización de la Akt, mientras que el ejercicio de fuerza estimula la actividad de la mTOR, a menudo, pero no siempre sin el envolvimiento de la Akt [30, 42, 43]. Es más, se reportaron que ocho semanas de entrenamiento de la fuerza aumentan la expresión del mARN de la mTOR y de la raptor, una proteína que liga a la mTOR y es esencial para la actividad del complejo 1 de la mTOR [44]. Esta observación indica que además de la activación aguda de la mTOR, el entrenamiento de la fuerza modula también la expresión del gen de la mTOR. Suponiendo que el efecto del entrenamiento es debido a los efectos acumulativos de sesiones repetidas de entrenamiento, los resultados presentes se podrían haber anticipado; sin embargo, no se han demostrado aumentos en los niveles de proteína de la Akt y de la mTOR en el músculo humano previamente.
A nuestro conocimiento, solamente un estudio previo en humanos ha estudiado el efecto del entrenamiento de la fuerza sobre los niveles de proteínas anabólicas, y algo diferentes los resultados fueron presentados [45]. Doce semanas de ejercicio de fuerza concéntrico o excéntrico con una pierna, no tuvo efecto sobre el nivel de la proteína de la Akt y de la mTOR a pesar de un 6-8% de aumento en el área transversal del cuádriceps [45]. No hay ninguna explicación obvia para resultados en parte divergentes, aunque los diferentes tipos de ejercicio empleados podrían contribuir a la respuesta diversa.
La influencia divergente de nuestros dos protocolos del entrenamiento, es decir, mejores niveles de las proteínas de la Akt y de la mTOR en el grupo combinado pero solamente mayor contenido de la mTOR en el grupo F, podría ser el mecanismo subyacente del aumento más pronunciado en el área de fibras promedio causado por el entrenamiento combinado. Alternativamente, podría argumentarse que la activación de la señalización de la Akt durante el ejercicio de resistencia, se relaciona a su rol en el metabolismo de la glucosa [46, 47] en lugar de la señalización anabólica. Hablar en contra de este punto de vista es la observación de que el nivel de proteína de la Akt fue similar en individuos entrenados en y en sedentarios [48]. Es más, las correlaciones observadas entre las alteraciones en la expresión de estas proteínas y el área de fibras promedio y el área de las fibras de tipo I (Fig. 3 y 4) dan más apoyo de su envolvimiento en la hipertrofia muscular, como previamente fue demostrado para el músculo del roedor [49]. En base a los resultados presentes es tentativo indicar que la activación de la proteína de la Akt y de la mTOR, potencia el estímulo de síntesis de proteínas.
En contraste a los niveles mejorados de la proteína de la Akt y de la mTOR, ambos regímenes de entrenamiento llevaron a una reducción en el nivel de la S6K1, una proteína en la misma dirección de la mTOR que se usa a menudo como indicador de la activación del complejo mTORC1. Aunque, la razón para la regulación divergente de estas proteínas es poco clara, es posible que la regulación de la S6K1 pueda amplificar su retroalimentación inhibitoria en la proteína del sustrato 1 del receptor de insulina (IRS) que perjudica la activación de la fosfoinositol-3-kinasa (PI3K) y la Akt [50, 51]. Además, la S6K1 podría ser expresada en niveles altos en el músculo del vasto externo humano, de forma tal que una cierta magnitud de la baja regulación, por lo tanto, no atenúe su capacidad para estimular la síntesis de proteínas. Sin embargo, en la actualidad, es difícil de especular en la significancia de la reducción en el nivel de S6K1. Se requieren estudios más extensos para explorar los efectos del entrenamiento sobre la capacidad de la vía de señalamiento de la mTOR.
Los sujetos en el presente estudio recibieron un suplemento de proteína después de la realización de cada sesión de entrenamiento a fin de estimular la síntesis de proteínas y estandarizar su ingesta dietética durante el período de recuperación temprana. Recientemente, Camera y colegas [52] reportaron que los procesos anabólicos se estimularon más potentemente por el ejercicio concurrente (extensión de piernas seguido por 30 min de pedaleo) cuando una bebida con proteínas fue consumida inmediatamente después. Un efecto similar también se ha observado después del ejercicio de fuerza [53]. Por lo tanto, es poco probable que los suplementos que nosotros empleamos produzcan diferentes respuestas en los dos grupos. Los sujetos que realizaron el ejercicio concurrente también recibieron carbohidratos determinados para compensar su consumo de energía durante el pedaleo, pero esto es poco probable que haya influido en la respuesta anabólica puesto que se ha demostrado que los carbohidratos tienen pequeño o ningún efecto estimulatorio en la síntesis de proteínas del músculo [54].
Un aumento inducido por entrenamiento sobre el volumen muscular requiere que la tasa de síntesis de proteínas exceda a la de degradación de las proteínas, lo que llevará a la acreción de masa muscular en el tiempo. En el músculo esquelético, el sistema proteasoma que involucra a las ubiquitinas ligasas MAFbx y MuRF-1, se considera que juegan un rol principal en los procesos de degradación [55, 56]. Es más, la activación de la proteína de la Akt no sólo ha sido vinculada a los procesos anabólicos pero también a las reacciones catabólicas inhibiendo sobreregulación transcripcional de las ubiquitinas ligasas [57-59]. Por lo tanto, podría esperarse que estos procesos se atenuaran en el grupo RF. Sin embargo, ambos regímenes de entrenamiento indujeron cambios similares en los niveles de la proteína de las dos ubiquitina ligasas, es decir, tendieron a elevar el nivel de proteína de MuRF-1 mientras bajaron el nivel de la proteína de MAFbx. Estas observaciones indican que las alteraciones en los niveles del mARN después del ejercicio agudo observado previamente en varios estudios [29, 30, 60-63], de hecho, están reflejadas en los cambios en los niveles de la proteína. Esto, a su vez, da mayor apoyo para la propuesta de que estas dos ubiquitinas ligasas juegan roles diferentes en relación con la degradación de las proteínas, remodelamiento del músculo y adaptación al entrenamiento [29, 30]. Sin embargo, el efecto inhibitorio predecido de la activación de la Akt sobre las ubiquitinas ligasas en el grupo RF no ocurrió, en base a los cambios similares en ambos regímenes de entrenamiento. Por consiguiente, nuestros resultados presentes indican que la hipertrofia fibrilar más pronunciada en el grupo RF es debido más a la estimulación anabólica que a la inhibición de los procesos catabólicos.
En resumen, la investigación actual provee evidencia adicional de que el ejercicio de resistencia no compromete el estímulo anabólico surgido por el entrenamiento de la fuerza subsecuente. Nuestro entrenamiento combinado mejoró la expresión de ambas proteínas de la Akt y de la mTOR, así como las áreas de las fibras de tipo I y fibras de tipo II, mientras que el entrenamiento sólo de la fuerza llevó a un mayor contenido de proteína de la mTOR y un mayor tamaño de las fibras de tipo II. Además, las correlaciones entre los cambios en los niveles de proteína de la Akt y de la mTOR y los cambios en las áreas de las fibras de tipo I y el área de fibras promedio indican que estas proteínas juegan un rol importante en la hipertrofia. Nosotros también encontramos, sin embargo, una disociación entre la sobreregulación de la mTOR y su 'blanco' designado S6K1, lo que pueden tener implicaciones para la sensibilidad en esta vía, aunque esto debe ser determinado. El entrenamiento combinado redujo la proporción de fibras de tipo I, pero ningún cambio en la composición de la fibra se observó después del entrenamiento de la fuerza exclusivo.
Reconocimientos
Los autores desean agradecer a los participantes por su entusiasmo y cooperación.
Contribuciones de los autores
Idea y diseño de los experimentos: ZK SJW HCH EB. Realización de los experimentos: ZK SJW JALC HCH EB. Análisis de los datos: ZK SJW MM WA EB. Herramientas de materiales/análisis contribuidas: MM WA HCH EB. Redacción del artículo: ZK EB.
Referencias
1. Hickson RC (1980). Interference of strength development by simultaneously training for strength and endurance. Eur J Appl Physiol Occup Physiol. 45(2–3).:255–63. Epub 1980/01/01. pmid:7193134. doi: 10.1007/bf00421333
2. Leveritt M, Abernethy PJ, Barry BK, Logan PA (1999). Concurrent strength and endurance training. A review. Sports Med. 28(6).:413–27. Epub 2000/01/07. pmid:10623984. doi: 10.2165/00007256-199928060-00004
3. Fyfe JJ, Bishop DJ, Stepto NK (2014). Interference between concurrent resistance and endurance exercise: molecular bases and the role of individual training variables. Sports Med. 44(6).:743–62. Epub 2014/04/15. doi: 10.1007/s40279-014-0162-1 pmid:24728927.
4. Lundberg TR, Fernandez-Gonzalo R, Gustafsson T, Tesch PA (2013). Aerobic exercise does not compromise muscle hypertrophy response to short-term resistance training. J Appl Physiol. 114(1).:81–9. Epub 2012/10/30. doi: japplphysiol.01013.2012 [pii]
5. Lundberg TR, Fernandez-Gonzalo R, Tesch PA (2014). Exercise-induced AMPK activation does not interfere with muscle hypertrophy in response to resistance training in men. J Appl Physiol (1985). 116(6). :611–20. Epub 2014/01/11. doi: japplphysiol.01082.2013 [pii]
6. Coffey VG, Hawley JA. (2007). The molecular bases of training adaptation. Sports Med. 37(9).:737–63. Epub 2007/08/29. doi: 3791 [pii]. pmid:17722947.
7. Bolster DR, Crozier SJ, Kimball SR, Jefferson LS. (2002). AMP-activated protein kinase suppresses protein synthesis in rat skeletal muscle through down-regulated mammalian target of rapamycin (mTOR). signaling. J Biol Chem. 277(27).:23977–80. Epub 2002/05/09. doi: 10.1074/jbc.C200171200 [pii]. pmid:11997383.
8. Carrithers JA, Carroll CC, Coker RH, Sullivan DH, Trappe TA. (2007). Concurrent exercise and muscle protein synthesis: implications for exercise countermeasures in space. Aviat Space Environ Med. 78(5).:457–62. Epub 2007/06/02. pmid:17539438.
9. Coffey VG, Jemiolo B, Edge J, Garnham AP, Trappe SW, Hawley JA. (2009). Effect of consecutive repeated sprint and resistance exercise bouts on acute adaptive responses in human skeletal muscle. American Journal of Physiology-Regulatory Integrative and Comparative Physiology. 297(5).:R1441–R51. doi: 10.1152/ajpregu.00351.2009 pmid:ISI:000271371900025.
10. Coffey VG, Pilegaard H, Garnham AP, O'Brien BJ, Hawley JA. (2009). Consecutive bouts of diverse contractile activity alter acute responses in human skeletal muscle. Journal of Applied Physiology.106 (4).:1187–97. doi: 10.1152/japplphysiol.91221.2008 pmid:ISI:000264753000022.
11. Wang L, Mascher H, Psilander N, Blomstrand E, Sahlin K. (2011). Resistance exercise enhances the molecular signaling of mitochondrial biogenesis induced by endurance exercise in human skeletal muscle. J Appl Physiol. 111(5).:1335–44. Epub 2011/08/13. doi: japplphysiol.00086.2011 [pii]
12. Apro W, Wang L, Ponten M, Blomstrand E, Sahlin K. (2013). Resistance exercise induced mTORC1 signalling is not impaired by subsequent endurance exercise in human skeletal muscle. Am J Physiol Endocrinol Metab. Epub 2013/05/02. doi: ajpendo.00091.2013 [pii]
13. Fry AC. (2004). The role of resistance exercise intensity on muscle fibre adaptations. Sports Med. 34(10).:663–79. Epub 2004/09/01. doi: 34104 [pii]. pmid:15335243.
14. Tang JE, Hartman JW, Phillips SM. (2006). Increased muscle oxidative potential following resistance training induced fibre hypertrophy in young men. Appl Physiol Nutr Metab. 31(5).:495–501. Epub 2006/11/18. doi: h06-026 [pii]
15. MacNeil LG, Glover E, Bergstra TG, Safdar A, Tarnopolsky MA. (2014). The Order of Exercise during Concurrent Training for Rehabilitation Does Not Alter Acute Genetic Expression, Mitochondrial Enzyme Activity or Improvements in Muscle Function. PLoS One. 9(10). doi: ARTN e109189
16. Baechle TR, Earle RW. (2008). Essentials of Strength Training and Conditioning 3rd ed. Champaign, IL: Human Kinetics.
17. Chen ZP, Stephens TJ, Murthy S, Canny BJ, Hargreaves M, Witters LA, et al. (2003). Effect of exercise intensity on skeletal muscle AMPK signaling in humans. Diabetes. 52(9).:2205–12. doi: 10.2337/diabetes.52.9.2205 pmid:ISI:000185027600003.
18. Wojtaszewski JF, Nielsen P, Hansen BF, Richter EA, Kiens B. (2000). Isoform-specific and exercise intensity-dependent activation of 5'-AMP-activated protein kinase in human skeletal muscle. J Physiol. 528 Pt 1:221–6. Epub 2000/10/06. doi: PHY_1384 [pii]. pmid:11018120; PubMed Central PMCID: PMC2270117.
19. Bergström J. (1962). Muscle electrolytes in man. Scand J Clin Lab Invest. Suppl 68.
20. Hennessey JV, Chromiak JA, Della Ventura S, Guertin J, MacLean DB. (1997). Increase in percutaneous muscle biopsy yield with a suction-enhancement technique. J Appl Physiol (1985). 82(6). :1739–42. Epub 1997/06/01. pmid:9173935.
21. Blomstrand E, Ekblom B. (1982). The needle biopsy technique for fibre type determination in human skeletal muscle—a methodological study. Acta Physiol Scand. 116(4).:437–42. Epub 1982/12/01. doi: 10.1111/j.1748-1716.1982.tb07163.x pmid:6221506.
22. Brooke MH, Kaiser KK. (1969). Some comments on the histochemical characterization of muscle adenosine triphosphatase. J Histochem Cytochem. 17(6).:431–2. Epub 1969/06/01. pmid:4241223. doi: 10.1177/17.6.431
23. Brooke MH, Kaiser KK. (1970). Three "myosin adenosine triphosphatase" systems: the nature of their pH lability and sulfhydryl dependence. J Histochem Cytochem. 18(9).:670–2. Epub 1970/09/01. pmid:4249441. doi: 10.1177/18.9.670
24. Schiaffino S, Reggiani C. (1996). Molecular diversity of myofibrillar proteins: gene regulation and functional significance. Physiol Rev. 76(2).:371–423. Epub 1996/04/01. pmid:8618961.
25. Andersen P. (1975). Capillary density in skeletal muscle of man. Acta Physiol Scand. 95(2).:203–5. Epub 1975/10/01. doi: 10.1111/j.1748-1716.1975.tb10043.x pmid:127508.
26. Blomstrand E, Celsing F, Friden J, Ekblom B. (1984). How to calculate human muscle fibre areas in biopsy samples—methodological considerations. Acta Physiol Scand. 122(4).:545–51. Epub 1984/12/01. doi: 10.1111/j.1748-1716.1984.tb07543.x pmid:6084399.
27. Alp PR, Newsholme EA, Zammit VA. (1976). Activities of citrate synthase and NAD+-linked and NADP+-linked isocitrate dehydrogenase in muscle from vertebrates and invertebrates. Biochem J. 154(3).:689–700. Epub 1976/03/15. pmid:8036; PubMed Central PMCID: PMC1172771. doi: 10.1042/bj1540689
28. Essen B, Jansson E, Henriksson J, Taylor AW, Saltin B. (1975). Metabolic characteristics of fibre types in human skeletal muscle. Acta Physiol Scand. 95(2).:153–65. Epub 1975/10/01. doi: 10.1111/j.1748-1716.1975.tb10038.x pmid:242187.
29. Borgenvik M, Apro W, Blomstrand E. (2012). Intake of branched-chain amino acids influences the levels of MAFbx mRNA and MuRF-1 total protein in resting and exercising human muscle. Am J Physiol Endocrinol Metab. 302(5).:E510–21. Epub 2011/12/01. doi: ajpendo.00353.2011 [pii]
30. Mascher H, Tannerstedt J, Brink-Elfegoun T, Ekblom B, Gustafsson T, Blomstrand E. (2008). Repeated resistance exercise training induces different changes in mRNA expression of MAFbx and MuRF-1 in human skeletal muscle. Am J Physiol Endocrinol Metab. 294(1).:E43–51. Epub 2007/11/01. doi: 00504.2007 [pii]
31. Wong ML, Medrano JF. (2005). Real-time PCR for mRNA quantitation. Biotechniques. 39(1).:75–85. Epub 2005/08/03. doi: 05391RV01 [pii]. pmid:16060372.
32. Apro W, Moberg M, Hamilton DL, Ekblom B, van Hall G, Holmberg HC, et al. (2015). Resistance exercise-induced S6K1 kinase activity is not inhibited in human skeletal muscle despite prior activation of AMPK by high-intensity interval cycling. Am J Physiol Endocrinol Metab. 308(6).:E470–81. Epub 2015/01/22. doi: ajpendo.00486.2014 [pii]
33. Saltin B, Gollnick P. (1983). Skeletal muscle adaptability: significance for metabolism and performance. Handbook of physiology: Skeletal Muslce. Bethesda, MD, USA: American Physiological Society; p. 555–631.
34. Schantz P, Henriksson J, Jansson E. (1983). Adaptation of human skeletal muscle to endurance training of long duration. Clin Physiol. 3(2).:141–51. Epub 1983/04/01. pmid:6682735. doi: 10.1111/j.1475-097x.1983.tb00685.x
35. Costill DL, Coyle EF, Fink WF, Lesmes GR, Witzmann FA. (1979). Adaptations in skeletal muscle following strength training. J Appl Physiol Respir Environ Exerc Physiol. 46(1).:96–9. Epub 1979/01/01. pmid:37209.
36. Green H, Goreham C, Ouyang J, Ball-Burnett M, Ranney D. (1999). Regulation of fiber size, oxidative potential, and capillarization in human muscle by resistance exercise. Am J Physiol. 276(2 Pt 2).:R591–6. Epub 1999/02/10. pmid:9950941.
37. Jansson E, Esbjornsson M, Holm I, Jacobs I. (1990). Increase in the proportion of fast-twitch muscle fibres by sprint training in males. Acta Physiol Scand. 140(3).:359–63. Epub 1990/11/01. doi: 10.1111/j.1748-1716.1990.tb09010.x pmid:2150579.
38. Perez-Gomez J, Olmedillas H, Delgado-Guerra S, Royo IA, Vicente-Rodriguez G, Ortiz RA, et al. (2008). Effects of weight lifting training combined with plyometric exercises on physical fitness, body composition, and knee extension velocity during kicking in football. Applied Physiology Nutrition and Metabolism-Physiologie Appliquee Nutrition Et Metabolisme.33(3).:501–10. doi: 10.1139/H08-026 pmid:ISI:000255690400010.
39. Andersen P, Henriksson J. (1977). Capillary supply of the quadriceps femoris muscle of man: adaptive response to exercise. J Physiol. 270(3).:677–90. Epub 1977/09/01. pmid:198532; PubMed Central PMCID: PMC1353538. doi: 10.1113/jphysiol.1977.sp011975
40. Phillips SM, Parise G, Roy BD, Tipton KD, Wolfe RR, Tarnopolsky MA. (2002). Resistance training-induced adaptations in skeletal muscle protein turnover in the fed state. Can J Physiol Pharmacol. 80(11).:1045–53. Epub 2002/11/01. doi: 10.1139/Y02-134 pmid:12489923.
41. Benziane B, Burton TJ, Scanlan B, Galuska D, Canny BJ, Chibalin AV, Zierath JR, Stepto NK. (2008). Divergent cell signaling after short-term intensified endurance training in human skeletal muscle. Am J Physiol Endocrinol Metab. 295(6).:E1427–38. Epub 2008/09/30. doi: 10.1152/ajpendo.90428.2008 pmid:18827172.
42. Deldicque L, Atherton P, Patel R, Theisen D, Nielens H, Rennie MJ, et al. (2008). Decrease in Akt/PKB signalling in human skeletal muscle by resistance exercise. European Journal of Applied Physiology. 104(1).:57–65. doi: 10.1007/s00421-008-0786-7 pmid:ISI:000257123000007.
43. Camera DM, Edge J, Short MJ, Hawley JA, Coffey VG. (2010). Early time course of Akt phosphorylation after endurance and resistance exercise. Med Sci Sports Exerc. 42(10).:1843–52. Epub 2010/03/03. doi: 10.1249/MSS.0b013e3181d964e4 pmid:20195183.
44. Lamas L, Aoki MS, Ugrinowitsch C, Campos GE, Regazzini M, Moriscot AS, et al. (2010). Expression of genes related to muscle plasticity after strength and power training regimens. Scand J Med Sci Sports. 20(2).:216–25. Epub 2009/05/09. doi: SMS905 [pii]
45. Rahbek SK, Farup J, Moller AB, Vendelbo MH, Holm L, Jessen N, et al. (2014). Effects of divergent resistance exercise contraction mode and dietary supplementation type on anabolic signalling, muscle protein synthesis and muscle hypertrophy. Amino Acids. 46(10).:2377–92. Epub 2014/07/10. doi: 10.1007/s00726-014-1792-1 pmid:25005782.
46. Krook A, Roth RA, Jiang XJ, Zierath JR, Wallberg-Henriksson H. (1998). Insulin-stimulated Akt kinase activity is reduced in skeletal muscle from NIDDM subjects. Diabetes. 47(8).:1281–6. Epub 1998/08/14. pmid:9703329. doi: 10.2337/diab.47.8.1281
47. Thorell A, Hirshman MF, Nygren J, Jorfeldt L, Wojtaszewski JF, Dufresne SD, et al. (1999). Exercise and insulin cause GLUT-4 translocation in human skeletal muscle. Am J Physiol. 277(4 Pt 1).:E733–41. Epub 1999/10/12. pmid:10516134.
48. Yu M, Blomstrand E, Chibalin AV, Wallberg-Henriksson H, Zierath JR, Krook A. (2001). Exercise-associated differences in an array of proteins involved in signal transduction and glucose transport. J Appl Physiol (1985). 90(1). :29–34. Epub 2001/01/03. pmid:11133890.
49. Rommel C, Bodine SC, Clarke BA, Rossman R, Nunez L, Stitt TN, et al. (2001). Mediation of IGF-1-induced skeletal myotube hypertrophy by PI(3). K/Akt/mTOR and PI(3).K/Akt/GSK3 pathways. Nat Cell Biol. 3(11).:1009–13. Epub 2001/11/21. doi: 10.1038/ncb1101-1009 [pii]. pmid:11715022.
50. Harrington LS, Findlay GM, Gray A, Tolkacheva T, Wigfield S, Rebholz H, et al. (2004). The TSC1-2 tumor suppressor controls insulin-PI3K signaling via regulation of IRS proteins. J Cell Biol. 166(2).:213–23. Epub 2004/07/14. doi: 10.1083/jcb.200403069 [pii]. pmid:15249583; PubMed Central PMCID: PMC2172316.
51. Um SH, Frigerio F, Watanabe M, Picard F, Joaquin M, Sticker M, et al. (2004). Absence of S6K1 protects against age- and diet-induced obesity while enhancing insulin sensitivity. Nature. 431(7005).:200–5. Epub 2004/08/13. doi: 10.1038/nature02866 [pii]. pmid:15306821.
52. Camera DM, West DWD, Phillips SM, Rerecich T, Stellingwerff T, Hawley JA, et al. (2015). Protein Ingestion Increases Myofibrillar Protein Synthesis after Concurrent Exercise. Medicine and Science in Sports and Exercise. 47(1).:82–91. doi: 10.1249/Mss.0000000000000390 pmid:ISI:000346354800012.
53. Phillips SM. (2014). A brief review of critical processes in exercise-induced muscular hypertrophy. Sports Med. 44 Suppl 1:S71–7. Epub 2014/05/06. doi: 10.1007/s40279-014-0152-3 pmid:24791918; PubMed Central PMCID: PMC4008813.
54. Borsheim E, Cree MG, Tipton KD, Elliott TA, Aarsland A, Wolfe RR. (2004). Effect of carbohydrate intake on net muscle protein synthesis during recovery from resistance exercise. J Appl Physiol (1985). 96(2). :674–8. Epub 2003/11/05. doi: 10.1152/japplphysiol.00333.2003 [pii]. pmid:14594866.
55. Bodine SC, Latres E, Baumhueter S, Lai VK, Nunez L, Clarke BA, et al. (2001). Identification of ubiquitin ligases required for skeletal muscle atrophy. Science. 294(5547).:1704–8. Epub 2001/10/27. doi: 10.1126/science.1065874 [pii]. pmid:11679633.
56. Bodine SC, Baehr LM. (2014). Skeletal muscle atrophy and the E3 ubiquitin ligases MuRF1 and MAFbx/atrogin-1. American Journal of Physiology-Endocrinology and Metabolism. 307(6).:E469–E84. doi: 10.1152/ajpendo.00204.2014 pmid:ISI:000342368900001.
57. Sandri M, Sandri C, Gilbert A, Skurk C, Calabria E, Picard A, et al. (2004). Foxo transcription factors induce the atrophy-related ubiquitin ligase atrogin-1 and cause skeletal muscle atrophy. Cell.117(3).:399–412. Epub 2004/04/28. doi: S0092867404004003 [pii]. pmid:15109499.
58. Lecker SH, Goldberg AL, Mitch WE. (2006). Protein degradation by the ubiquitin-proteasome pathway in normal and disease states. J Am Soc Nephrol. 17(7).:1807–19. pmid:16738015. doi: 10.1681/asn.2006010083
59. Egerman MA, Glass DJ. (2014). Signaling pathways controlling skeletal muscle mass. Critical Reviews in Biochemistry and Molecular Biology. 49(1).:59–68. doi: 10.3109/10409238.2013.857291 pmid:ISI:000333035600004.
60. Coffey VG, Shield A, Canny BJ, Carey KA, Cameron-Smith D, Hawley JA. (2006). Interaction of contractile activity and training history on mRNA abundance in skeletal muscle from trained athletes. Am J Physiol Endocrinol Metab. 290(5).:E849–55. Epub 2005/12/13. doi: 00299.2005 [pii]
61. Churchley EG, Coffey VG, Pedersen DJ, Shield A, Carey KA, Cameron-Smith D, et al. (2007). Influence of preexercise muscle glycogen content on transcriptional activity of metabolic and myogenic genes in well-trained humans. J Appl Physiol. 102(4).:1604–11. Epub 2007/01/16. doi: 01260.2006 [pii]
62. Louis E, Raue U, Yang Y, Jemiolo B, Trappe S. (2007). Time course of proteolytic, cytokine, and myostatin gene expression after acute exercise in human skeletal muscle. J Appl Physiol. 103(5).:1744–51. Epub 2007/09/08. doi: 00679.2007 [pii]
63. Drummond MJ, Miyazaki M, Dreyer HC, Pennings B, Dhanani S, Volpi E, et al. (2009). Expression of growth-related genes in young and older human skeletal muscle following an acute stimulation of protein synthesis. J Appl Physiol. 106(4).:1403–11. Epub 2008/09/13. doi: 90842.2008 [pii]
Cita Original
Endurance Exercise Enhances the Effect of Strength Training on Muscle Fiber Size and Protein Expression of Akt and mTOR Zuzanna Kazior, Sarah J. Willis, Marcus Moberg, William Apró, José A. L. Calbet, Hans-Christer Holmberg, Eva Blomstrand
Cita en PubliCE
Zuzanna Kazior, Sarah J. Willis, Marcus Moberg, William Apró, José A. L. Calbet, Hans-Christer Holmberg Eva Blomstrand (2016). El Ejercicio de Resistencia Mejora el Efecto del Entrenamiento de Fuerza Sobre el Tamaño de la Fibra Muscular y la Expresión de la Proteína de Akt y mTOR. .https://g-se.com/el-ejercicio-de-resistencia-mejora-el-efecto-del-entrenamiento-de-fuerza-sobre-el-tamano-de-la-fibra-muscular-y-la-expresion-de-la-proteina-de-akt-y-mtor-2096-sa-c57cfb2727af8b
