Efectos del Entrenamiento de Esprint sobre la Expresión de Glutatión en el Hígado y en el Musculo Esquelético
Shawn Stover1, Mallory McCartney1, Cory Keesee1, Leah Fletcher11 Department of Biology and Environmental Science, Davis & Elkins College, Elkins, West Virginia, Estados Unidos.
Resumen
El ejercicio anaeróbico agudo produce estrés oxidativo. Sin embargo, estudios previos indican que el entrenamiento de esprínt de alta intensidad puede atenuar los efectos del estrés oxidativo. Se planteó la hipótesis que la regulación por incremento del glutatión reducido (GSH) es la responsable de la protección contra el estrés oxidativo asociado con el entrenamiento de esprint. Treinta y tres ratones fueron distribuidos al azar en tres grupos: control, agudo y entrenados. Los ratones del grupo entrenados participaron en un programa de ejercicio de alta intensidad que consistió en correr en cinta rodante dos días por semana durante 12 semanas. Al final del período de entrenamiento, los ratones del grupo entrenados y los del grupo agudo realizaron una sola sesión de esprint de alta intensidad. Los ratones del grupo control no realizaron ejercicio. Las concentraciones de GSH y glutatión oxidado (GSSG) fueron determinadas espectrofotométricamente en los músculos soleo y extensor largo de los dedos (EDL) y en el hígado. Luego del ejercicio agudo, las concentraciones de GSH (mol/g de tejido) en el soleo y en el EDL disminuyeron significativamente, en relación a sus respectivos controles. Al mismo tiempo, aumentaron significativamente las concentraciones de GSSG (mol/g de tejido) en ambos músculos. Después de 12 semanas de entrenamiento de esprint, las concentraciones de GSH en el soleo y en el EDL no fueron significativamente diferentes de las de sus controles respectivos, incluso mientras que las concentraciones de GSSG en los músculos aumentaron significativamente. Los resultados del estudio no demostraron ningún cambio en el glutatión del hígado luego de la realización de esprints agudos o del entrenamiento de esprint. Los datos indican que los niveles controles de GSH pueden ser recuperados por el músculo esquelético como resultado del entrenamiento de esprint de alta intensidad. Sin embargo, el GSH regulado por incremento no sería importado por el hígado.
Palabras Clave: Ejercicio anaeróbico, estrés oxidativo
El ejercicio anaeróbico agudo produce estrés oxidativo. Sin embargo, estudios previos indican que el entrenamiento de esprínt de alta intensidad puede atenuar los efectos del estrés oxidativo. Se planteó la hipótesis que la regulación por incremento del glutatión reducido (GSH) es la responsable de la protección contra el estrés oxidativo asociado con el entrenamiento de esprint. Treinta y tres ratones fueron distribuidos al azar en tres grupos: control, agudo y entrenados. Los ratones del grupo entrenados participaron en un programa de ejercicio de alta intensidad que consistió en correr en cinta rodante dos días por semana durante 12 semanas. Al final del período de entrenamiento, los ratones del grupo entrenados y los del grupo agudo realizaron una sola sesión de esprint de alta intensidad. Los ratones del grupo control no realizaron ejercicio. Las concentraciones de GSH y glutatión oxidado (GSSG) fueron determinadas espectrofotométricamente en los músculos soleo y extensor largo de los dedos (EDL) y en el hígado. Luego del ejercicio agudo, las concentraciones de GSH (mol/g de tejido) en el soleo y en el EDL disminuyeron significativamente, en relación a sus respectivos controles. Al mismo tiempo, aumentaron significativamente las concentraciones de GSSG (mol/g de tejido) en ambos músculos. Después de 12 semanas de entrenamiento de esprint, las concentraciones de GSH en el soleo y en el EDL no fueron significativamente diferentes de las de sus controles respectivos, incluso mientras que las concentraciones de GSSG en los músculos aumentaron significativamente. Los resultados del estudio no demostraron ningún cambio en el glutatión del hígado luego de la realización de esprints agudos o del entrenamiento de esprint. Los datos indican que los niveles controles de GSH pueden ser recuperados por el músculo esquelético como resultado del entrenamiento de esprint de alta intensidad. Sin embargo, el GSH regulado por incremento no sería importado por el hígado.
Palabras claves: Ejercicio anaeróbico, estrés oxidativo.
INTRODUCCION
La generación de especies reactivas del oxígeno (ROS) como el oxígeno singlete, el radical superóxido y el radical hidroxilo, se produce como consecuencia del metabolismo celular normal (27). El daño molecular relacionado a las ROS incluye rupturas de la cadena de ADN y modificaciones de una base (11), oxidación de las cadenas laterales de los aminoácido y fragmentación de polipéptidos (20) y la degradación de ácidos grasos poliinsaturados y fosfolípidos por peroxidación de lípidos (4). El procesamiento de las ROS se lleva a cabo mediante el sistema de defensa de antioxidante endógeno del cuerpo que incluye actividad enzimática de la superóxido dismutasa (SOD), glutatión peroxidasa (GPx) y glutatión reductasa (GR), junto con antioxidantes exógenos consumidos a través de la dieta (27). El estrés oxidativo puede ser definido como una condición en que la producción celular de ROS excede la capacidad fisiológica del cuerpo para inactivarlas (4).
El aumento en el consumo de oxígeno durante el ejercicio aeróbico está acompañado por un aumento en las ROS. El ejercicio aeróbico agudo genera ROS creando una perturbación en el transporte de electrones que produce una excesiva aparición de radicales superóxido (4). Sin embargo, el entrenamiento de resistencia a largo plazo reduce eficazmente el daño asociado con el mayor consumo de oxígeno, reforzando la defensa antioxidante del cuerpo. Se ha demostrado que las actividades de GPx (30), GR (30) y SOD (7,19) aumentan en respuesta al entrenamiento de resistencia.
El ejercicio anaeróbico agudo también puede promover el estrés oxidativo. En las ratas, un solo esprint de 1 min a 45 m∙ min-1 aumenta los hidroperóxidos lipídicos y las sustancias reactivas del acido tiobarbitúrico en el musculo esquelético, lo que indicaría una peroxidación de lípidos significativa (1). En los ratones, seis esprints de 30 seg a una velocidad de 30 m∙ min-1 aumentaron significativamente la concentración de malondialdehido (MDA), un marcador de peroxidación de lípidos, en el músculo de esquelético (6). En seres humanos, seis esprints de 150 m aumentaron significativamente los niveles plasmáticos de MDA (22). Además, hay estudios previos que indican que el entrenamiento de esprint puede atenuar los efectos del estrés oxidativo. En ratas, luego del entrenamiento de esprint, aumenta significativamente la actividad de las enzimas GPx y GR en el músculo cardíaco y esquelético (3). En ratones, el entrenamiento de esprint reduce la peroxidación de lípidos en el músculo esquelético, tal como lo indica la disminución en la concentración de MDA (6). En los seres humanos, el entrenamiento de esprint produce una disminución en las concentraciones plasmáticas de MDA y de carbonilos proteicos, ambos marcadores bioquímicos de estrés oxidativo, en comparación con los sujetos desentrenados (5).
El glutatión reducido (GSH) tiene un papel prominente en la defensa celular contra el estrés oxidativo inactivando las ROS, ya sea directamente o en forma de sustrato para la GPx (9). Investigaciones previas han demostrado que el ejercicio físico extenuante puede afectar la homeostasis del GSH disminuyendo su concentración en los tejidos, perturbando su estado redox celular e interfiriendo con su síntesis y transporte (14,15). Además, otros estudios (13,21,26) sugieren que el GSH celular endógeno no es suficiente para controlar la mayor oxidación asociada con el ejercicio vigoroso. Por lo tanto sería beneficioso aumentar los niveles de GSH celular para proporcionar protección contra el estrés oxidativo inducido por el ejercicio.
El estudio presente investigó la hipótesis que una regulación por incremento de GSH es la responsable de la protección contra el estrés oxidativo asociada con el entrenamiento de esprint. Si la hipótesis es cierta, entonces los niveles de GSH deben disminuir, mientras que los niveles de glutatión oxidado (disulfuro de glutatión, o GSSG) aumentan en el músculo esquelético luego de una sola serie de esprint de alta intensidad generadora de estrés oxidativo. Por otra partes, luego de un entrenamiento de esprint de larga duración y alta intensidad, es necesario recuperar suficiente GSH en el músculo esquelético, para brindar la protección contra el estrés oxidativo observada en los estudios previos (3,5,6). Dado que el hígado es el principal lugar donde se realiza la síntesis de novo de glutatión (8), se plantea la hipótesis que el hígado exportará cantidades significativas de GSH al plasma y finalmente, al musculo esquelético durante el ejercicio agudo. Finalmente, los niveles postentrenamiento de GSH en el hígado deben recuperarse como resultado del aumento en la síntesis de novo.
MÉTODOS
Animales
El Comité Institucional de Cuidado y Uso Animal de la Universidad de Davis & Elkins aprobó este estudio. Treinta y tres ratones ICR masculinos albinos (CD-1®) (Harlan, Indianapolis, EN), de 5 a 7 semanas de edad al momento de comenzar el estudio, fueron alojados individualmente en jaulas ventiladas (Maxi-Miser Positive Individual Ventilation System, Thoren Caging Systems, Inc., Hazelton, PA). El sistema de jaulas se colocó en un cuarto mantenido a 16 a 22°C con ciclos de 12:12 luz-oscuridad. Todos los ratones podían acceder libremente al agua y a la comida (Dieta fortificada para Ratas y Ratones, Kaytee Products, Inc., Chilton, WI). Los 33 ratones fueron divididos al azar en tres grupos: control (n = 9), agudo (n = 11) y entrenados (n = 13).
Entrenamiento de Esprint
Los ratones entrenados realizaron un programa de ejercicios de alta intensidad que consistió en correr en cinta rodante 2 días/semana durante 12 semanas. Cada sesión incluyó tres a seis esprints de 30 seg a una velocidad de 24 a 30 m∙ min-1 (con pendiente de 5 a 15°; ver Tabla 1), con un intervalo de recuperación de 1 min entre cada esprint. Los ratones de los grupos control y agudo no realizaron el proceso de entrenamiento. Una reja electrificada (0,1 MA) colocada en la parte de atrás de la cinta rodante se utilizó esporádicamente como motivación para correr. Todos los procedimientos de ejercicio fueron realizados entre las 8:00 a.m y las 9:00 a.m.
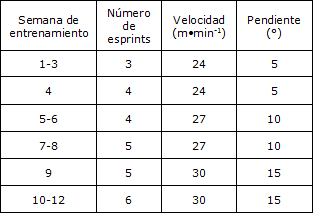
Tabla 1. Programa de entrenamiento de los ratones.
Esprint Agudo
Al final del período de entrenamiento, los ratones del grupo entrenados y agudo realizaron seis esprints consecutivos de 30 seg en una cinta rodante para roedores, a una velocidad de 24 a 30 m∙ min-1 (pendiente de 15°), con un intervalo de recuperación de 1 min entre cada esprint. Los ratones del grupo control no realizaron ejercicio. Una reja electrificada (0,1 MA) colocada en la parte de atrás de la cinta rodante fue utilizada esporádicamente como motivación para correr. Todos los procedimientos de ejercicio fueron realizados entre las 8:00 a.m y las 9:00 a.m.
Determinación de GSH/GSSG
Los ratones fueron sacrificados por dislocación cervical. El sacrificio de los animales que realizaron ejercicio se llevó a cabo inmediatamente después del intervalo de recuperación final de 1 min. En 22 ratones (5 controles, 8 agudos y 9 entrenados), se realizó la extracción de los músculos sóleo y del extensor largo de los dedos (EDL), a continuación fueron enjuagados con agua destilada fría (el H2O), homogeneizados en buffer Tris-HCl 20mM (pH 7,4) y puestos en acido 5,5-ditio-bis-2-nitrobenzoico (DTNB) a temperatura ambiente. En los otros 11 ratones (4 controles, 3 agudos y 4 entrenados), el hígado fue extraído y procesado de la misma manera. El DTNB se combina con el glutatión para generar un producto con absorbancia máxima a 412 nm (Cuvette Assay para GSH/GSSG, Oxford Biomedical Research, Oxford, MI). La prueba utiliza un derivado de la piridina como agente neutralizante de tioles para las muestras de GSSG. El agente neutralizante reacciona rápidamente para mantener el glutatión en su estado oxidado. Las muestras de los grupos entrenado y control fueron analizadas espectrofotométricamente a 412 nm. El glutatión total (GSHt) y las concentraciones de GSSG fueron calculadas a partir de los valores de absorbancia por medio de la siguiente fórmula: [GSHt/GSSG] = [(∆A-∆B) - b] ÷ a x df donde [GSHt/GSSG] es la concentración µM de GSHt o GSSG presente en la muestra, ∆A es el cambio en la absorbancia de la muestra a 412 nm a lo largo de 10 min, ∆B el cambio en la absorbancia en el blanco (dH2O) a 412 nm a lo largo de 10 min, a es la pendiente de la curva estándar de GSH o GSSG (los estándares fueron incluidos en el kit de determinación), b es la ordenada al origen de la curva estándar y df el factor de dilución de la muestra. Las concentraciones de glutatión reducido (GSH) se estimaron substrayendo los valores de GSSG a los valores de GSHt.
Análisis estadísticos
Los datos fueron analizados mediante un análisis de la varianza de una vía (ANOVA). Para comparar grupos específicos en el ANOVA se aplicó el test de la mínima diferencia significativa de Fischer. Un nivel del alfa de P≤0,05 se consideró estadísticamente significativo. Los datos se presentan en forma de media ± desviación estándar.
RESULTADOS
Esprint agudo
En el hígado los esprints agudos no alteraron significativamente las concentraciones de GSH y GSSG (µmol/g de tejido) (Figura 1). Las muestras de hígado del grupo agudo presentaron concentraciones medias de GSH y GSSG de 3,17 ± 0,044 y 0,332 ± 0,009, respectivamente. Las muestras del grupo control tenían concentraciones medias de 3,35 ± 0,091 y 0,32 ± 0,003, respectivamente. Luego del ejercicio agudo, las concentraciones de GSH (µmol/g de tejido) en el sóleo (0,478 ± 0,059) y en el EDL (0,442 ± 0,125) disminuyeron significativamente, en relación a sus controles respectivos (0,619 ± 0,021 y 0,566 ± 0,02; Figura 2). Al mismo tiempo, las concentraciones de GSSG (µmol/g de tejido) en el sóleo (0,077 ± 0,011) y en el EDL (0,084 ± 0,011) aumentaron significativamente, en relación a los controles respectivos (0,055 ± 0,005 y 0,062 ± 0,003; Figura 3).
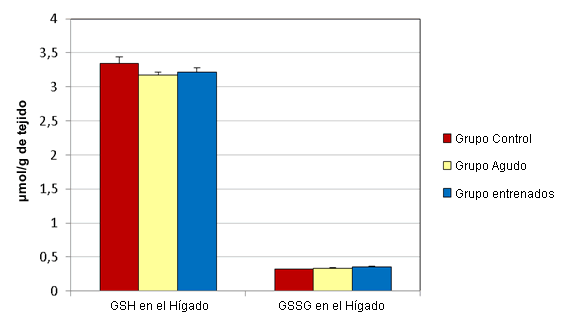
Figura 1. Efectos del ejercicio sobre las concentraciones de GSH y GSSG en el hígado. Los valores se presentan en forma de media ± desviación estándar.
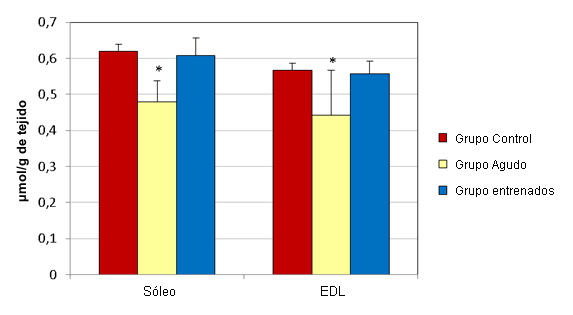
Figura 2. Efectos del ejercicio en la concentración de GSH en el sóleo y en el EDL. Los valores se presentan en forma de media ± desviación estándar; * Presenta diferencias significativas con el grupo control (P≤0,05).
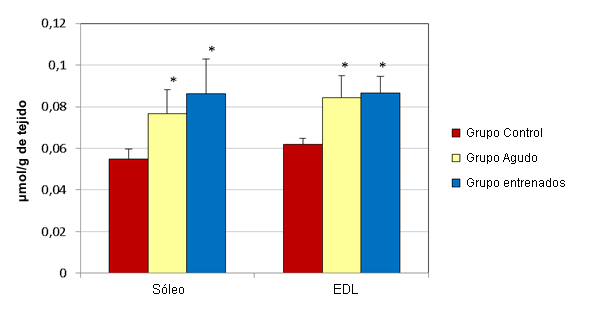
Figura 3. Efecto del ejercicio en las concentraciones de GSSG en el sóleo y en el EDL. Los valores se presentan en forma de media ± desviación estándar; * Presenta diferencias significativas con el grupo control (P≤0,05).
El entrenamiento de esprint no altero significativamente las concentraciones de GSH y GSSG (µmol/g de tejido) en el hígado (Figura 1). Las muestras de hígado del grupo que realizó entrenamiento presentaron concentraciones medias de GSH y de GSSG de 3,213 ± 0,064 y 0,36 ± 0,009, respectivamente. Las muestras del grupo control tenían concentraciones medias de 3,35 ± 0,091 y 0,32 ± 0,003, respectivamente. Luego de 12 semanas de entrenamiento de esprint, las concentraciones de GSH (µmol/g de tejido) en el sóleo (0,608 ± 0,048) y en el EDL (0,557 ± 0,035) no fueron significativamente diferentes de las de lo controles respectivos (0,619 ± 0,021 y 0,566 ± 0,02; Figura 2). Al mismo tiempo, las concentraciones de GSSG (µmol/g de tejido) en el sóleo (0,086 ± 0,017) y en el EDL (0,087 ± 0,008) aumentaron significativamente, en relación con sus controles respectivos (0,055 ± 0,005 y 0,062 ± 0,003; Figura 3).
DISCUSIÓN
En el estudio presente, los ratones entrenados y no entrenados realizaron una sesión aguda de ejercicio anaeróbico, que consistió en 6 esprints consecutivos de 30 seg en una cinta rodante para ratones, a una velocidad de 24 a 30 m∙ min-1 (pendiente de 15°), con un intervalo de recuperación de 1 min entre cada esprint. Se ha demostrado previamente que este protocolo induce eficazmente la peroxidación de lípidos en el músculo esquelético de contracción rápida, tal como lo indica un aumento significativo en la concentración de MDA en el EDL (6). Sin embargo, el mecanismo por el cual el ejercicio anaeróbico agudo produce estrés oxidativo no ha sido establecido claramente. Se ha sugerido que la potencia glucolítica alcanza un máximo muy temprano durante el ejercicio de alta intensidad y que esto es seguido por una significativa síntesis de ATP mitocondrial (24,29). Además de la contribución del metabolismo aeróbico y de la perturbación subsecuente en el transporte de electrones, el aumento en las ROS generado por el ejercicio de esprint también puede ser afectado por isquemia/reperfusión. La incorporación súbita de oxígeno luego de un esprint puede reaccionar con los intermediarios metabólicos acumulados y generar altos niveles de ROS (4,12).
Los efectos beneficiosos del entrenamiento de esprint de alta intensidad también han sido establecidos en investigaciones previas. La peroxidación de lípidos, tal como lo indica la concentración de MDA, disminuye significativamente en el EDL después de 12 semanas de entrenamiento de esprint (6). El mecanismo que existe detrás de la disminución de la peroxidación no está claro. Es posible que el efecto beneficioso se deba a una mayor capacidad para realizar fosforilación oxidativa. Los estudios previos han confirmado un aumento en la masa mitocondrial en respuesta a las condiciones de estrés oxidativo (16,17). Además, un aumento en GSH puede contribuir con la adaptación de entrenamiento. Se ha demostrado que el entrenamiento de resistencia aumenta el contenido de GSH en los músculos de los miembros posteriores de los perros (15) y ratas (19). El entrenamiento de esprint de alta intensidad podría producir un efecto similar.
El GSH desempeña un papel fundamental en la defensa celular contra el estrés oxidativo desactivando las ROS, ya sea directamente o como sustrato para la GPx (9). La conversión de GSH a GSSG está catalizada por GPx durante la detoxificación reductiva del peróxido de hidrógeno (23). El GSH se regenera a partir del GSSG mediante la actividad de GR (25). Aunque algunas células epiteliales tienen la capacidad de incorporar el GSH (10), la mayoría de las células recurren a la síntesis de novo para mantener sus reservas celulares. El GSH se sintetiza por un proceso de dos pasos en el cual participan las enzimas γ-glutamato-cisteína ligasa (GCL) y glutatión sintetasa (GS). La GCL cataliza la reacción intracelular que produce la unión de un residuo de cisteína que contiene un grupo sulfidrilo a un residuo de glutamato. La actividad de GS agrega un residuo de glicina para completar el tripéptido (9).
Los resultados del estudio actual demuestran una disminución significativa en la concentración de GSH, acompañada por un aumento en GSSG, en el sóleo y EDL de ratones no entrenados después de una sesión aguda de esprint. Sin embargo, luego de 12 semanas de entrenamiento, la concentración de GSH se recupera hasta los niveles del grupo control en ambos músculos, a pesar de que las concentraciones de GSSG permanecen significativamente elevadas en comparación con los controles correspondientes (Figura 2 y 3). Estos resultados sugieren que hay un aumento en la síntesis de GSH en respuesta al entrenamiento de esprint. Para confirmar esta hipótesis es necesario realizar un análisis de la actividad de GCL, el factor limitante en la síntesis de GSH.
No se observaron diferencias significativas entre los músculos soleo y EDL en ninguno de los grupos, a pesar del hecho que el soleo tradicionalmente se considera un músculo oxidativo de contracción lenta, mientras que el EDL se considera como de contracción rápida, con más de un metabolismo glucolítico. En las ratas, hay una distinción clara entre los músculos de contracción lenta y rápida, en lo que se refiere a la composición del tipo de fibra. En la línea consanguínea de Lewis por ejemplo, sobre la base de la histoquímica de la ATPasa, los músculos sóleos tienen 96% de fibras oxidativas de tipo I, mientras que los músculos EDL tienen aproximadamente 76% de fibras glucolíticas de tipo IIb (28). Sin embargo en los ratones, hay mucho más variación entre las líneas/cepas, con una mezcla mayor de tipos de fibra. En la cepa ICR, por ejemplo, la histoquímica de la ATPasa ha demostrado que el músculo sóleo tiene sólo 66% de fibras de tipo I, mientras que los músculos EDL tienen aproximadamente 67% de fibras tipo IIb (2).
El hígado es la principal ubicación de la síntesis de novo de GSH (8). Se ha demostrado que la concentración de GSH en el hígado disminuye después de una serie aguda de ejercicio de resistencia (18,21). Esta disminución podría deberse al hecho que el GSH es utilizado por la GPx como sustrato y es oxidado a GSSG por hidroperóxidos que han aumentado durante el ejercicio (13). Los resultados del estudio actual no demostraron ningún cambio en el glutatión del hígado después de esprints agudos o de 12 semanas de entrenamiento de esprint (Figura 1). Dado que tanto la forma oxidada como la reducida del glutatión se mantienen sin cambios en el hígado, es posible que los protocolos de esprint no generaran la cantidad suficiente de hidroperóxidos para convertir el GSH a GSSG. El músculo esquelético podría estar sintetizando cantidades suficientes del propio GSH para compensar el estrés oxidativo inducido por el ejercicio. También es posible que el hígado esté exportando el GSH recientemente sintetizado a los músculos en concentraciones demasiado pequeñas, en relación a la concentración total, para ser detectadas mediante el ensayo actual.
CONCLUSIONES
Los resultados del estudio presente demuestran una disminución significativa en la concentración de GSH en músculo esquelético luego de la realización de esprints agudos. Además, los datos indican que los niveles controles de GSH pueden recuperarse como resultado del entrenamiento de esprint de alta intensidad. Sin embargo, el GSH regulado por incremento no sería importado a partir del hígado.
AGRADECIMIENTOS
El equipamiento de la investigación fue obtenido mediante subsidios West Virginia Experimental Program to Stimulate Competitive Research (WVEPSCoR) and the West Virginia IDeA Network of Biomedical Research Excellence (WV-INBRE). Los animales, kits de análisis e insumos prescindibles fueron obtenidos a través de la Beca de Investigación Davis & Elkins College Faculty Research Fellowship
Dirección de contacto:
Shawn K. Stover, PhD, Department of Biology & Environmental Science, Davis & Elkins College, 100 Campus Drive, Elkins, WV 26241. Phone: (304) 637-1275; Email: stovers@dewv.edu.
Referencias
1. Alessio HM, Goldfarb AH, Cutler RG (1988). MDA content increases in fast- and slow-twitch skeletal muscle with intensity of exercise in a rat. Am J Physiol; 255:C874-C877
2. Askew GN, Marsh RL (1997). The effects of length trajectory on the mechanical power output of mouse skeletal muscles. J Exp Biol; 200:3119-3131
3. Atalay M, Seene T, Hanninen O, Sen CK (1996). Skeletal muscle and heart antioxidant defenses in response to sprint training. Acta Physiol Scanda; 158:129-134
4. Bloomer RJ, Goldfarb AH (2004). Anaerobic exercise and oxidative stress – a review. Can J Appl Physiol; 29(3):245-263
5. Bloomer RJ, Falvo MJ, Fry AC, Schilling BK, Smith WA, Moore CA (2006). Oxidative stress response in trained men following repeated squats or sprints. Med Sci Sports Exerc; 38(8):1436-1442
6. Cunningham P, Geary M, Harper R, Pendleton A, Stover S (2005). High intensity sprint training reduces lipid peroxidation in fast-twitch skeletal muscle. JEPonline; 8(6):18-25
7. Da Silva LA, Pinho CA, Rocha LG, Tuon T, Silveira PC, Pinho RA (2009). Effect of different models of physical exercise on oxidative stress markers in mouse liver. Appl Physiol Nutr Metab; 34(1):60-65
8. Fernandez-Checa JC, Yi JR, Garcia Ruiz C, Ookhtens M, Kaplowitz N (1996). Plasma membrane and mitochondrial transport of hepatic reduced glutathione. Semin Liv Dis;16:147-158
9. Griffith OW (1999). Biologic and pharmacologic regulation of mammalian glutathione synthesis. Free Radic Biol Med; 27:922-935
10. Hagen TM, Aw TY, Jones DP (1988). Glutathione uptake and protection against oxidative injury in isolated kidney cells. Kidney Int; 34:74-81
11. Halliwell B, Guttheridge JMC (1989). Free Radicals in Biology and Medicine. 2nd Edition. New York: Clarendon Press, Oxford University Press
12. Jackson MJ (2000). Exercise and oxygen radical production by muscle. In: Sen CK, Packer L, Hanninen O, Editors. Handbook of Oxidants and Antioxidants in Exercise. Amsterdam: Elsevier Science: 57-68
13. Ji LL, Fu RG (1992). Responses of glutathione system and antioxidant enzymes to exhaustive exercise and hydroperoxide. J Appl Physiol; 72:549-554
14. Ji LL, Leeuwenburgh C (1995). Glutathione and exercise. In: Somani S. (Editor). Pharmacology in Exercise and Sports. Boca Raton, FL: CRC Press,: 97-123
15. Kretzschmar M, Muller D (1993). Aging, training, and exercise: a review of effects of plasma glutathione and lipid peroxidation. Sports Med;15:196-209
16. Lee H, Yin P, Lu C, Chi C, Wei Y (2000). Increase of mitochondria and mitochondrial DNA in response to oxidative stress in human cells. Biochem J; 348:425-432
17. Lee H, Yin P, Chi , Wei Y (2002). Increase in mitochondrial mass in human fibroblasts under oxidative stress and during replicative cell senescence. J Biomed Sci; 9(6):517-526
18. Leeuwenburgh C, Ji LL (1995). Glutathione depletion in rested and exercised mice: Biochemical consequence and adaptation. Arch Biochem Biophys; 316:941-949
19. Leeuwenburgh C, Hollander J, Leichtweis S, Fiebig R, Gore M, Ji LL (1997). of glutathione antioxidant system to endurance training are tissue and muscle fiber specific. Am J Physiol; 272:R363-R369
20. Levine RL, Stadtman ER (2001). Oxidative modification of proteins during aging. Exp Gerentol; 36:1495-1502
21. Lew H, Pyke S, Quintanilha A (1985). Change in the glutathione status of plasma, liver and muscle following exhaustive exercise in rats. FEBS Lett; 185:262-266
22. Marzatico F, Pansarasa O, Bertorelli L, Somenzini L, Della Valle G (1997). Blood free radical antioxidant enzymes and lipid peroxides following long-distance and lactacidemic performances in highly trained aerobic and sprint athletes. J Sports Med Phys Fitness; 37:235-239
23. Meister A (1983). Selective modification of glutathione metabolism. Science; 220:472-477
24. Nioka S, Moser D, Lech G, Evengelisti M, Verde T, Chance B, Kuno S (1998). Muscle deoxygenation in aerobic and anaerobic exercise. Adv Exp Med Biol; 454:63-70
25. Schultz GE, Schirmer RH, Sachsenheimer W, Pai EF (1978). The structure of the flavoenzyme glutathione reductase. Nature; 273:120-124
26. Sen CK, Marin E, Kretzschmar M, Hanninen O (1992). Skeletal muscle and liver glutathione homeostasis in response to training, exercise and immobilization. J Appl Physiol; 73:1265-1272
27. Sen CK, Packer L, Hanninen O, Editors (1994). Exercise and Oxygen Toxicity. Amsterdam: Elsevier Science
28. Soukup T, Zacharova G, Smerdu V (2002). Fibre type composition of soleus and extensor digitorum longus muscles in normal female inbred Lewis rats. Acta Histochem;104(4):399-405
29. Sundaram K, Panneerselvam KS (2006). Oxidative stress and DNA single strand breaks in skeletal muscle of aged rats: role of carnitine and lipoic acid. Biogerontology; 7(2):111-118
30. Venditti P, Di Meo S (1997). Effect of training on antioxidant capacity, tissue damage, and endurance of adult male rats. Int J Sports Med; 18:497-502
Cita Original
McCartney M, Keesee C, Fletcher L, Stover S. Effects of Sprint Training on Glutathione Expression in Liver and Skeletal Muscle. JEPonline 2011; 14(5):66-74.
Cita en PubliCE
Shawn Stover, Mallory McCartney, Cory Keesee Leah Fletcher (2011). Efectos del Entrenamiento de Esprint sobre la Expresión de Glutatión en el Hígado y en el Musculo Esquelético. .https://g-se.com/efectos-del-entrenamiento-de-esprint-sobre-la-expresion-de-glutation-en-el-higado-y-en-el-musculo-esqueletico-1435-sa-u57cfb2720f586
