Efectos de Diferentes Protocolos de Ejercicio de Sobrecarga sobre el Óxido Nítrico, la Peroxidación de Lípidos y la Actividad de la Creatina Quinasa en Hombres Sedentarios
Nevin Atalay Güzel1, Serkan Hazar2, Deniz Erbas31 Gazi University, School of Physical Education and Sports, Department of Exercise Physiology, Ankara, Turkey.
2 Nigde University, School of Physical Education and Sports, Nigde, Turkey.
3 Gazi University, Faculty of Medicine, Department of Physiology, Ankara, Turkey.
Resumen
El propósito de este estudio fue determinar los cambios en la respuesta oxidativa y en el daño muscular inducido por el ejercicio luego de la realización de dos protocolos diferentes de ejercicio de sobrecarga. Particularmente se investigó si el entrenamiento de baja intensidad o de alta intensidad provoca alteraciones en la actividad de la peroxidación de los lípidos, del óxido nítrico (NO2) y de la creatina quinasa (CK) en el plasma humano. Veinte hombres desentrenados participaron en el presente estudio. Diez de los sujetos realizaron ejercicios con sobrecarga de alta intensidad (HR) en forma de circuito y el resto realizó ejercicios de sobrecarga de baja intensidad (LR) en forma de circuito, con 4 ejercicios diferentes conformando una serie. Se extrajeron muestras de sangre venosa antes de comenzar el ejercicio, inmediatamente post ejercicio y a la 6ta, 24ta, 48va y 72da horas post ejercicio. Las muestras fueron analizadas para determinar marcadores de daño muscular (CK), peroxidación de lípidos (MDA) y producción de NO2. La producción de NO2 se incrementó en el grupo HR (p<0.05). Los dos diferentes protocolos de ejercicio provocaron un incremento significativo en la respuesta de la MDA entre los valores pre y post ejercicio (p<0.05). Además, se observaron diferencias significativas en los valores post ejercicio de MDA entre los grupos (p<0.05) observándose los mayores valores en el grupo HR. La actividad de la CK mostró un incremento significativo en todos los valores post ejercicio (p<0.05) en ambos grupos, pero no se observaron diferencias entre los grupos LR y HR. Estos hallazgos respaldan la idea de que el ejercicio de sobrecarga de alta intensidad induce una mayor producción de radicales libres en comparación con el ejercicio de sobrecarga de baja intensidad.
Palabras Clave: anaeróbico, intensidad, peroxidación de lípidos, daño, sangre
INTRODUCCION
Se ha demostrado que luego de la realización de ejercicios aeróbicos y anaeróbicos de suficiente intensidad se produce un incremento en la oxidación de macromoléculas (Bloomer et al., 2006). La generación de especies reactivas del oxígeno y del nitrógeno (RONS), tal como oxígeno singlete (-O), el radical superóxido (O2-), el radical hidroxilo (OH-) y el peroxinitrito (ONO2-) ocurre como consecuencia del metabolismo celular normal y parece incrementarse bajo condiciones de estrés psicológico y físico incrementado (Sen et al., 1994). Sin embargo, durante la realización de ejercicios de carácter anaeróbico (e.g., sobrecarga, isométrico, excéntrico y esprints) existen otras vías de generación de RONS (Boomer et al., 2004) que incluyen la isquemia-reperfusión, la producción de xantina y NADPH oxidasa, el metabolismo prostanoide, la actividad respiratoria fagocítica, la disrupción de proteínas que contienen hierro y la alteración de la homeostasis del calcio (Bloomer et al., 2006). La producción de RONS a través de estas vías puede resultar parcialmente de acciones musculares excéntricas, las cuales causan lesiones musculares (McHugh et al., 1999).
Se han reportado diversos beneficios del entrenamiento de sobrecarga tales como el control del peso corporal, la prevención de la osteoporosis, la mejora de los factores de riesgo de enfermedad cardiovascular y la prevención de lesiones (Dinubile, 1991; Verrill and Ribisl, 1996). Sin embargo, la realización de ejercicios de sobrecarga en forma excesiva puede incrementar el estrés oxidativo y el daño celular (Liu et al., 2005). Hay dos teorías que respaldan el concepto de que el entrenamiento con sobrecarga puede derivar en un incremento en la producción de radicales libres de oxígeno en los músculos activos. Una hipótesis ampliamente respaldada involucra la lesión por isquemia-reperfusión (McBride et al., 1998). Las contracciones musculares intensas pueden resultar en una reducción temporaria en el flujo sanguíneo y en la disponibilidad de oxígeno con la subsiguiente isquemia. Luego de la contracción (relajación muscular), la repercusión produce una abundante re-introducción de O2 y resulta en la formación de radicales O2-. El estrés mecánico es otra hipótesis utilizada para explicar el incremento en los radicales libres (Viitala et al., 2004). En particular, el ejercicio excéntrico, que produce altos niveles de tensión muscular, ha mostrado resultar en daño del tejido muscular. Esto inicia el proceso inflamatorio y eventualmente produce radicales libres de oxígeno y la peroxidación de lípidos.
Los niveles plasmáticos de malondialdehído (MDA) han mostrado correlacionar con los niveles de creatina quinasa (CK), un marcador del daño muscular (Kanter et al., 1988). Se han llevado a cabo intentos por establecer una relación entre los radicales libres y el daño muscular (McBride et al., 1998). Diversos estudios han mostrado que, en pacientes con distrofia muscular, se produce un incremento en la peroxidación de los lípidos (Foxley et al., 1991).
El óxido nítrico (NOx) es un radical libre producido en los sistemas biológicos. Si bien este radical, en bajas concentraciones, participa en diversos procesos fisiológicos tales como el control de la presión sanguínea, la neurotransmisión y el aprendizaje y la memoria; en altas concentraciones, es una citotoxina. Aunque no se ha establecido por completo el preciso mecanismo por el cual se produce la alteración en la síntesis o actividad del NOx durante el ejercicio, diversos estudios han sugerido que el estrés de flujo y de corte en el endotelio activa la síntesis y liberación de NOx en las células endoteliales (Cooke et al., 1991; Lawson et al., 1997). Tanto el estrés de flujo como el estrés de corte incrementan la concentración intracelular de calcio en las células endoteliales, lo cual a su vez, deriva en la activación de la NOx sintetasa (Node et al., 1997; Ohno et al., 1993). También se cree que la liberación de NOx mediada por flujo es importante para la vasodilatación inducida por el ejercicio, tal como lo sugiere el trabajo de Gilligan y colaboradores (1994). Este estudio sugiere que el estrés de corte durante el ejercicio puede incrementar la producción de NOx en sujetos normales.
El propósito del presente estudio fue examinar los efectos de dos diferentes protocolos de ejercicio con sobrecarga, en términos de volumen e intensidad, sobre los marcadores del estrés oxidativo y del daño muscular en el plasma de hombres saludables y sedentarios.
METODOS
Sujetos
Veinte hombres saludables y desentrenados (con una edad promedio de 27.8 ± 2.8 años, talla de 1.79 ± 0.07 m y peso corporal de 75.9 ± 9.7 kg) participaron en este estudio. Estos fueron aleatoriamente asignados a un grupo que realizó ejercicios con sobrecarga a alta intensidad (HR, n = 10) o a un grupo que realizó ejercicios con sobrecarga a baja intensidad (LR, n = 10). Todos los procedimientos experimentales fueron aprobados por el comité de ética de la Universidad Gazi. Todos los sujetos dieron su consentimiento verbal y escrito antes de participar en el estudio.
Protocolo de Ejercicio
Los sujetos fueron familiarizados con los 4 ejercicios que conformaron el circuito de entrenamiento con sobrecarga (sentadillas y extensiones de rodilla para las extremidades inferiores, y dorsales en polea y press de banca para las extremidades superiores), y posteriormente se determinó su fuerza en una repetición máxima (1RM) en cada uno de los ejercicios. La intensidad y las repeticiones por intensidad para los dos grupos experimentales se muestran en la Tabla 1.
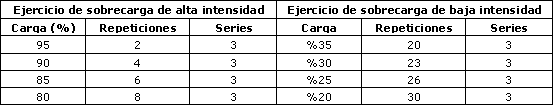
Tabla 1. Protocolos de ejercicio con sobrecarga de alta y baja
intensidad.
Los sujetos realizaron el circuito de entrenamiento con sobrecarga a las 8.30 a.m., luego de ayunar por la noche y de no haber realizado ejercicios en los dos días previos. Luego de una entrada en calor en cicloergómetro (15 min, 75W), los grupos HR y LR realizaron sus respectivos circuitos de entrenamiento. Los tiempos de recuperación entre los diferentes ejercicios fueron de un minuto.
Recolección de Muestras Sanguíneas
Las muestras de sangre venosa fueron extraídas de la vena antecubital mediante la técnica de venicpuntura antes del ejercicio, inmediatamente después (dentro de 1 min) y a la 6ta, 24ta, 48va y 72da horas post ejercicio. Las muestras de sangre fueron inmediatamente centrifugadas a 1500 RFC durante 10 min a 4ºC y el plasma fue separado y conservado en tubos Eppendorf a - 70ºC para su subsiguiente uso. Las muestras de plasma fueron utilizadas para la medición de la MDA, nivel de NOx y actividad de la CK.
Análisis Bioquímicos
Medición del NOx: Los niveles de NOx fueron medidos en plasmas como nitritos utilizando la reacción modificada de Giess, luego de convertir los nitratos en nitritos con cloruro de vanadio. Se prepararon curvas estándar para el nitrito de sodio. Los valores fueron calculados con curvas de calibración estándar para NaNO2 y NaNO3 tal como se describiera previamente (Green et al., 1982; Miranda et al., 2001).
Peroxidación de Lípidos: La peroxidación de lípidos fue cuantificada midiendo la formación de sustancias reactivas al ácido tiobarbitúrico tal como lo describieran Kurtel et al., 1992. Las alícuotas (0.5 mL) fueron centrifugadas y el sobrenadante fue agregado a 1 mL de solución que contenía 15% (wt/vol) de ácido tricarboxílico, 0.375% (wt/vol) de ácido tiobarbitúrico, y 0.25 N de HCl. Se removió el precipitado de proteínas mediante centrifugación y el sobrenadante fue transferido a tubos de ensayo de vidrio que contenían 0.02% (wt/vol) de hidroxitolueno butilado para evitar la peroxidación adicional de los lípidos durante las subsiguientes etapas. Las muestras fueron calentadas durante 15 min a 100ºC en un baño de agua hirviendo, enfriadas y centrifugadas para remover el precipitado. La absorbancia de cada muestra fue determinada a 532 nm. Los niveles de peroxidación de lípidos fueron expresados en términos de equivalentes de MDA utilizando un coeficiente de extinción de 1.56 × 105 mol-1.
Creatina Quinasa (CK): La actividad plasmática de creatina quinasa fue evaluada en las muestras sanguíneas utilizando un dispositivo bioquímico Hitachi 912 con instrumental Roche Diagnostic.
Análisis Estadísticos
Los valores obtenidos se expresaron como medias ± EE y fueron comparados utilizando el análisis de varianza ANOVA para medidas repetidas. Se utilizó el test de Bonferroni para determinar que el origen de las diferencias. Se utilizó la prueba t para medidas independientes para comparar los valores correspondientes entre los grupos. Se utilizó la correlación de Pearson para determinar la correlación entre las variables. La significancia estadística fue establecida a p<0.05.
RESULTADOS
Los niveles de NOx se incrementaron significativamente 6 horas después del ejercicio en el grupo HR (p<0.05). Dicho incremento persistió a las 24 y 48 horas (p<0.05 para ambos), luego de lo cual los niveles de NOx retornaron a los valores pre ejercicio a las 72 horas. Sin embargo, los niveles de NOx no cambiaron luego del ejercicio en el grupo LR (Figura 1).
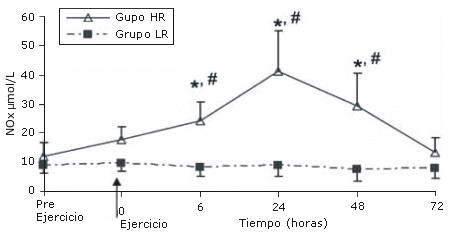
Figura 1. Valores de NOx (μmol/L) antes y después de los
protocolos de ejercicio de sobrecarga de baja (LR) y alta (HR) intensidad.
*Diferencia del valor medido pre ejercicio en el grupo HR (P<0.05). #Diferencia
del correspondiente valor en el grupo LR (P<0.05)
Los niveles de MDA también se incrementaron inmediatamente post ejercicio tanto en el grupo HR como en el grupo LR (p<0.05 para ambos) pero luego, se redujeron rápidamente a los niveles pre ejercicio a las 6 horas. Los niveles de MDA no fueron significativamente diferentes de los niveles pre ejercicio a las 6, 24, 48 y 72 horas post ejercicio en ambos grupos (Figura 2). Dicho incremento súbito en los niveles de MDA fue significativamente mayor en el grupo HR en comparación con el grupo LR (p<0.05) (Figura 2).
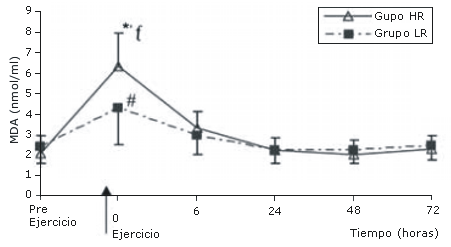
Figura 2. Valores de MDA (mmol/L) antes y después de los protocolos de
ejercicio de sobrecarga de baja (LR) y alta (HR) intensidad. *Diferencia del
valor medido pre ejercicio en el grupo HR (P<0.05). ƒDiferencia del
correspondiente valor en el grupo LR (P<0.05). #Diferencia del valore medido pre
ejercicio en el grupo LR (p<0.05)
Los niveles de CK en el grupo HR se incrementaron significativamente post ejercicio y este incremento se mantuvo durante 48 horas (p<0.05 para todos). Posteriormente, los niveles de CK retornaron a los valores pre ejercicio a las 72 horas. Un patrón similar se observó para la CK en el grupo LR. No se observaron diferencias significativas en los valores de CK entre los grupos (Figura 3).
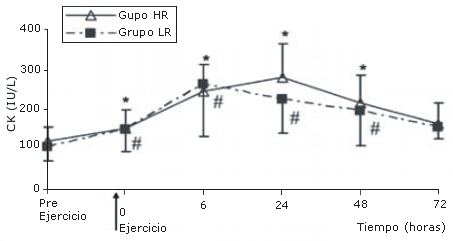
Figura 3. Valores de CK (IU/L) antes y después de los protocolos de
ejercicio de sobrecarga de baja (LR) y alta (HR) intensidad. *Diferencia del
valor medido pre ejercicio en el grupo HR (P<0.05). #Diferencia del valore
medido pre ejercicio en el grupo LR (p<0.05)
Se observó una fuerte correlación entre la actividad e la CK y los niveles de NOx en el grupo HR (r = 0.557, p<0.05). No se observaron correlaciones entre las otras variables.
DISCUSION
Este estudio examinó los efectos de diferentes protocolos de ejercicio de sobrecarga sobre los marcadores del daño muscular, la peroxidación de los lípidos y la respuesta del óxido nítrico en el plasma de hombres sedentarios. Uno de los principales hallazgos de esta investigación fue el incremento en la producción de NOx con el ejercicio de sobrecarga de alta intensidad (grupo HR) (p<0.05). La respuesta de la MDA a los dos diferentes protocolos de ejercicio con sobrecarga mostró un incremento significativo entre los valores obtenidos pre ejercicio y aquellos obtenidos inmediatamente post ejercicio en ambos grupos (p<0.05). También se observaron diferencias significativas en los niveles de MDA medidos inmediatamente después del ejercicio entre los dos grupos (p<0.05). La actividad de la CK se incrementó significativamente (p<0.05) y se mantuvo elevada en todos los momentos de medición post ejercicio en ambos grupos pero no hubo diferencia entre los grupos.
La formación vascular de NOx está directamente facilitada por el incremento en el estrés de corte (Cooke et al., 1991; Miller and Burnett, 1992). Durante una sesión de ejercicio físico, el gasto cardíaco se incrementa y la sangre se redistribuye a los músculos activos. El incremento en el flujo sanguíneo inducido por el ejercicio provoca un incremento en el estrés de corte (Van Citters and Franklin, 1969), proveyendo de esta manera un posible acoplamiento entre el ejercicio y la formación endógena de NOx. Si bien no se ha resuelto completamente cual es el rol del NOx derivado del endotelio durante una serie aguda de ejercicio, el entrenamiento que implica la realización de series repetidas de ejercicio a lo largo de semanas o meses regula la bioactividad endotelial del NOx (Maiorana et al., 2003). Nosotros observamos que la producción de NOx se incrementó en el grupo HR (p<0.05). También se observó que este incremento se mantuvo luego de 6 horas post ejercicio, de acuerdo con los resultados del NOx en el grupo HR, y que continuó elevado luego de 24 y 48 horas post ejercicio (Figura 1). En acuerdo con estos hallazgos, se ha reportado que el NOx se incrementa en el plasma venoso luego de la realización de ejercicios prolongados tales como carrera y ciclismo (Jungersten et al., 1997) y luego de la realización de ciclismo progresivo hasta el VO2máx (Node et al., 1997). En contraste, algunos estudios no han observado cambios en el metabolismo del NOx luego de la realización de ejercicio progresivo en cinta ergométrica hasta el agotamiento, en humanos saludables (Komiyama et al., 1997; Poveda et al., 1997; St Croix et al., 1999). En nuestro estudio, no se observaron diferencias significativas en los niveles de NOx entre los distintos momentos de medición en el grupo LH (Figura 1). Nuestros resultados sugieren que el ejercicio de sobrecarga incrementa la producción de NOx , solo cuando este se realiza a altas intensidades. De acuerdo con los resultados de las correlaciones, cuando se compararon los mismos momentos de medición, hubo una correlación positiva entre la actividad de la CK y los niveles de NOx en el grupo HR (r = 0.557 p<0.05).
En diversos estudios se han utilizado diferentes modos de ejercicio para estudiar el efecto de una serie aguda de ejercicio sobre los diferentes índices del estrés oxidativo y los marcadores del daño muscular, y se han reportado diferentes resultados con los diferentes modos de ejercicio (Alessio et al., 2000; Atalay et al., 1996; Khanna et al., 1999; Lovlin et al., 1987; McBride et al., 1998; Viitala et al., 2004; Simpson et al., 2005). El ejercicio de sobrecarga consiste de acciones musculares estáticas y repetitivas. Estas incluyen acciones musculares concéntricas y excéntricas, que han sido consideradas respectivamente como protocolos de ejercicio de sobrecarga de baja y alta intensidad (Liu et al., 2005). En base a investigaciones previas, se ha determinado que la intensidad del protocolo de ejercicio utilizado es uno de los factores principales para crear el ambiente fisiológico para el incremento de la producción de radicales libres (Sahlin et al., 1992; Saxton et al., 1994). Pocos estudios han valorado el estrés oxidativo resultante del ejercicio con sobrecarga (McBride et al., 1998; Surmen-Gur et al., 1999). Se ha observado un incremento en el MDA sanguíneo en los dos días posteriores a la realización de un protocolo de entrenamiento de sobrecarga para todo el cuerpo (McBride et al., 1998) pero no se reportaron cambios en el MDA sanguíneo luego de 6 min de realizar 20 acciones excéntricas/concéntricas de extensiones de rodilla (Surmen-Gur et al., 1999). No se han observado cambios en los TBARS luego de la realización de ejercicios con sobrecarga de alta intensidad para todo el cuerpo realizado hasta el agotamiento. Las diferencias en los protocolos pueden haber contribuido a la discrepancia entre los resultados. En este estudio tanto la alta intensidad como la baja intensidad de ejercicio resultaron en un incremento significativo en la peroxidación de los lípidos inmediatamente post ejercicio (p<0.05). Pero se observaron mayores valores en el grupo HR (Figura 2). Maughan et al (1989) sugiere que los mayores cambios en el MDA se producen a las 6 horas post ejercicio, mientras que algunos estudios solo han examinado los valores de MDA inmediatamente post ejercicio. Algunas investigaciones, que utilizado ejercicios de sobrecarga para examinar la formación de radicales libres no han observado incrementos en la formación de estos (Ortenblad et al., 1997; Sahlin et al., 1992; Saxton et al., 1994). Esto puede ser resultado de la utilización de cargas livianas y de la menor activación muscular.
Las intensas contracciones asociadas con el ejercicio de sobrecarga pueden resultar en isquemia-reperfusión en el sitio de los músculos activos. Los radicales libres actúan como mediadores de la lesión por isquemia-reperfusión en los músculos esqueléticos y resulta en la lesión del tejido muscular que es acompañada por el incremento en los niveles de CK. Kanter et al (1993, 1988) trambién ha mostrado que las mediciones de MDA plasmático se correlacionan con la actividad de la CK durante el ejercicio. En el presente estudio, el MDA plasmático alcanzó los valores pico inmediatamente después del ejercicio en ambos grupos, pero la actividad plasmática de la CK alcanzó los valores pico a las 24 horas post ejercicio en el grupo HR y a las 6 horas post ejercicio en el grupo LR, y además se observaron mayores valores en el grupo HR. No obstante no se observaron diferencias entre ambos grupos (Figura 3). La actividad de la creatina quinasa observada en esta investigación indica que se produjo daño muscular luego del ejercicio con ambos protocolos de ejercicio. Los dos tipos de ejercicio utilizados para estudiar el daño muscular, carreras cuesta abajo y contracciones musculares de alta intensidad, muestran diferentes respuestas de la CK. Por ejemplo, luego de realizar carreras cuesta abajo, la actividad de la CK lleva a su pico a las 12-24 horas post ejercicio, con incrementos en el rango de los 100 a los 600 IU (Byrnes et al., 1985; Clarkson and Hubal, 2002; Schwane et al., 1983), mientras que luego de la realización de contracciones excéntricas de alta intensidad este incremento no se produce sino hasta pasadas 48 horas de la finalización del ejercicio, y el pico de actividad (generalmente 2000-10000 IU) se produce a los 4-6 días post ejercicio (Clarkson et al., 1992). Los hallazgos del presente estudio confirman que el ejercicio de sobrecarga de alta intensidad puede resultar en la formación de radicales libres. Estos radicales libres pueden desempeñar un rol en la adaptación del tejido muscular al estrés fisiológico causado por el ejercicio de sobrecarga (). La isquemia-reperfusión durante el ejercicio de sobrecarga en el sitio de los músculos activos, y la producción post ejercicio de radicales libres a través de la vía oxidativa en los neutrófilos, son factores clave a tener en cuenta cuando se trata de reducir las lesiones musculares durante este tipo de ejercicio (Pyne, 1994).
CONCLUSIONES
En conclusión, el ejercicio HR causó incrementos en los niveles de NOx, MDA y CK. Asimismo el ejercicio LR incrementó los niveles de MDA y CK pero no afectó los niveles de NOx. El daño muscular provocado por el ejercicio de sobrecarga puede relacionarse con el nivel de sobrecarga aplicado. Se requieren de más investigaciones para asistir a nuestro entendimiento del rol potencial del ejercicio con sobrecarga para generar un incremento en el estrés oxidativo, especialmente debido a que esta forma de ejercicio anaeróbico es una de las formas de ejercicio más ampliamente prescrita en los programas para la mejora de la aptitud física.
Puntos Clave
- El ejercicio de sobrecarga de alta intensidad provocó el incremento en los niveles de NOx, MDA y CK.
- El ejercicio de sobrecarga de baja intensidad provocó el incremento de los niveles de MDA y CK pero no afectó los niveles de NOx.
- El daño muscular provocado por el ejercicio de sobrecarga puede relacionarse con el nivel de sobrecarga aplicado.
Referencias
1. Alessio, H.M., Hagerman, A.E., Fulkerson, B.K., Ambrose, J., Rice, R.E. and Wiley R.L (2000). Generation of reactive oxygen species after exhaustive aerobic and isometric exercise. Medicine and Science in Sports and Exercise 32, 1576-1581
2. Atalay, M., Seene, T., Hanninen, O. and Sen C.K (1996). Skeletal muscle and heart antioxidant defenses in response to sprint training. Acta Physiologica. Scandinavica 158, 129-134
3. Bloomer, R.J. and Goldfarb, A.H (2004). Anaerobic exercise and oxidative stress: a review. Canadian. Journal of Applied Physiology 29, 245-263
4. Bloomer, R.J., Falvo, M.J., Fry, A.C., Schilling, B.K., Smith, W.A. and Moore, C.A (2006). Oxidative stress response in trained men following repeated squats or sprints. Medicine and Science in Sports and Exercise 38, 1436-1442
5. Byrnes, W.C., Clarkson, P.M., White, J.S., Hsieh, S.S., Frykman, P.N. and Maughan, R.J (1985). Delayed onset muscle soreness following repeated bouts of downhill running. Journal of Applied Physiology 59, 710-715
6. Clarkson, P.M., Nosaka, K. and Braun, B (1992). Muscle function after exercise-induced muscle damage and rapid adaptation. Medicine and Science in Sports and Exercise 24, 512-520
7. Clarkson, P.M. and Hubal, M.J (2002). Exercise-induced muscle damage in humans. American Journal of Physical Medicine & Rehabilitation 81, 52-69
8. Cooke, J.P., Rossitch, E,. Jr, Andon, N.A., Loscalzo, J. and Dzau, V.J (1991). Flow activates an endothelial potassium channel to release an endogenous nitrovasodilator. The Journal of Clinical Investigation 88, 1663-1671
9. Dinubile, N.A (1991). Strength training. Clinics in Sports Medicine 10, 33-62
10. Foxley, A., Edwards, R.H. and Jackson, M.J (1991). Enhanced lipid peroxidation in Duchenne dystrophy muscle may be secondary to muscle damage. Biochemical Society Transactions 19, 180S
11. Gilligan, D.M., Panza, J.A., Kilcoyne, C.M., Waclawiw, M.A., Casino, P.R. and Quyyumi, A.A (1994). Contribution of endothelium-derived nitric oxide to exercise-induced vasodilation. Circulation 90, 2853-2858
12. Green, L.C., Wagner, D.A., Glogowski, J., Skipper, P.L., Wishnok, J.S. and Tannenbaum, S.R (1982). Analysis of nitrate, nitrite and 15N nitrate in biological fluids. Analytical Biochemistry 126, 131-138
13. Jungersten, L., Ambring, A., Wall, B., and Wennmalm, A (1997). Both physical fitness and acute exercise regulate nitric oxide formation in healthy humans. Journal of Applied Physiology 82:760-764
14. Kanter, M.M., Lesmes, G.R., Kaminsky, L.A., La Ham-Saeger, J. and Nequin, N.D (1988). Serum creatine kinase and lactate dehydrogenase changes following an eighty kilometer race. Relationship to lipid peroxidation. European Journal of Applied Physiology and Occupational Physiology 57, 60-63
15. Kanter, M.M., Nolte, L.A. and Holloszy, J.O (1993). Effects of an antioxidant mixture on lipid peroxidation at rest and post exercise. Journal of Applied Physiology 74, 965-969
16. Khanna, S., Atalay, M., Laaksonen, D.E., Gul, M., Roy, S. and Sen, C.K (1999). Alpha-lipoic acid supplementation: tissue glutathione homeostasis at rest and after exercise. Journal of Applied Physiology 86, 1191-1196
17. Komiyama, Y., Kimura, Y., Nishimura, N., Hara, K., Mori, T., Okuda, K., Munakata, M., Masuda, M., Murakami, T. and Takahashi, H (1997). Vasodepressor effects of exercise are accompanied by reduced circulating ouabainlike immunoreactivity and normalization of nitric oxide synthesis. Clinical and Experimental Hypertension 19, 363-372
18. Kurtel, H., Granger, D.N., Tso, P. and Grisham, M.B (1992). Vulnerability of intestinal interstitial fluid to oxidant stress. The American Journal of Physiology 263, 573-578
19. Lawson, D.L., Chen, L. and Mehta, J.L (1997). Effects of exercise-induced oxidative stress on nitric oxide release and antioxidant activity. The American Journal of Cardiology 80, 1640-1642
20. Liu, J.F., Chang, W.Y., Chan, K.H., Tsai, W.Y., Lin, C.L. and Hsu, M.C (1997). Blood lipid peroxides and muscle damage increased following intensive resistance training of female Weightlifters. Annals of the New York Academy of Science 1042, 255-261
21. Lovlin, R., Cottle, W., Pyke, I., Kavanagh, M. and Belcastro, A.N (2005). Are indices of free radical damage related to exercise intensity?. European Journal of Applied Physiology 56, 313-316
22. Maiorana, A., O'Driscoll, G., Taylor, R. and Green, D (2003). Exercise and the nitric oxide vasodilator system. Sports Medicine 33, 1013-1035
23. Maughan, R., Donnellly, A.E., Gleeson, M., Whiting, P.H., Walker, K.A. and Clough, P.J (1989). Delayed onset muscle damage and lipid peroxidation in man after a downhill run. Muscle & Nerve 12, 332-336
24. McBride, J.M., Kraemer, W.J., Triplett-McBride, T. and Sebastianelli, W (1998). Effect of resistance exercise on free radical production. Medicine and Science in Sports and Exercise 30, 67-72
25. McHugh, M.P., Connolly, D.A., Eston, R.G. and Gleim, G.W (1999). Exercise-induced muscle damage and potential mechanisms for the repeated bout effect. Sports Medicine 27, 157-170
26. Miller, V.M. and Burnett, J.C. Jr (1992). Modulation of NO and endothelin by chronic increases in blood flow in canine femoral arteries. The American Journal of Physiology 263, 103-108
27. Miranda, K.M., Espey, M.G. and Wink, D.A (2001). A rapid simple spectrophotometric method for simultaneous detection of nitrate and nitrite. Nitric Oxide 5, 67-71
28. Node, K., Kitakaze, M., Sato, H., Koretsune, Y., Katsube, Y., Karita, M., Kosaka, H. and Hori, M (1997). Effect of acute dynamic exercise on circulating plasma nitric oxide level and correlation to norepinephrine release in normal subjects. The American Journal of Cardiology 79, 526-528
29. Ohno, M., Gibbons, G.H., Dzau, V.J. and Cooke, J.P (1993). Shear stress elevates endothelial cGMP. Role of a potassium channel and G protein coupling. Circulation 88, 193-197
30. Ortenblad, N., Madsen, K., and Djurhuus, M.S (1997). Antioxidant status and lipid peroxidation after short-term maximal exercise in trained and untrained humans. The American Journal of Physiology 272,1258-1263
31. Poveda, J.J., Riestra, A., Salas, E., Cagigas, M.L., Lopez-Somoza, C., Amado, J.A. and Berrazueta, J.R (1997). Contribution of nitric oxide to exercise-induced changes in healthy volunteers: effects of acute exercise and long-term physical training. European Journal of Clinical Investigation 27, 967-971
32. Pyne, D.B (1994). Regulation of neutrophil function during exercise. Sports Medicine 17, 245-258
33. Ramel, A., Wagner, K.H. and Elmadfa, I (2004). Plasma antioxidants and lipid oxidation after submaximal resistance exercise in men. European Journal of Nutrition 43, 2-6
34. Sahlin, K., Cizinsky, S., Warholm, M. and Hoberg, J (1992). Repetitive static muscle contractions in humans-a trigger of metabolic and oxidative stress?. European Journal of Applied Physiology and Occupational Physiology 64, 228-236
35. Saxton, J.M., Donnelly, A.E. and Roper, H.P (1994). Indices of free-radical-mediated damage following maximum voluntary eccentric and concentric muscular work. European Journal of Applied Physiology and Occupational Physiology 68,189-193
36. Sen, C.K., Packer, L. and Hanninen, O (1994). Exercise and oxygen toxicity. Amsterdam: Elsevier Science
37. Schwane, J.A, Johnson, S.R., Vandenakker, C.B. and Armstrong, R.B (1983). Delayed-onset muscular soreness and plasma CPK and LDH activities after downhill running. Medicine and Science in Sports Exercise 15, 51-56
38. Simpson, R.J., Wilson, M.R., Black, J.R., Ross, J.A., Whyte, G.P., Guy, K. and Florida-James, G.D (2005). Immune alterations, lipid peroxidation, and muscle damage following a hill race. Canadian Journal of Applied Physiology 30, 196-211
39. St Croix, C.M., Wetter, T.J., Pegelow, D.F., Meyer, K.C. and Dempsey, J.A (1999). Assessment of nitric oxide formation during exercise. American Journal of Respiratory and Critical Care Medicine 159, 1125-1133
40. Surmen-Gur, E., Ozturk, E., Gur, H., Punduk, Z. and Tuncel, P (1999). Effect of vitamin E supplementation on post-exercise plasma lipid peroxidation and blood antioxidant status in smokers: with special reference to haemoconcentration effect. European Journal of Applied Physiology and Occupational Physiology 79, 472-478
41. Van Citters, R.L. and Franklin, D.L (1969). Cardiovascular performance of Alaska sled dogs during exercise. Circulation Research 24, 33-42
42. Verrill, D.E. and Ribisl, P.M (1996). Resistive exercise training in cardiac rehabilitation. An update. Sports Medicine 21, 347-383
43. Viitala, P.E., Newhouse, I.J., LaVoie, N. and Gottardo, C (2004). The effects of antioxidant vitamin supplementation on resistance exercise induced lipid peroxidation in trained and untrained participants. Lipids in Health and Disease 22, 3-14
Cita en PubliCE
Nevin Atalay Güzel, Serkan Hazar Deniz Erbas (2011). Efectos de Diferentes Protocolos de Ejercicio de Sobrecarga sobre el Óxido Nítrico, la Peroxidación de Lípidos y la Actividad de la Creatina Quinasa en Hombres Sedentarios. .https://g-se.com/efectos-de-diferentes-protocolos-de-ejercicio-de-sobrecarga-sobre-el-oxido-nitrico-la-peroxidacion-de-lipidos-y-la-actividad-de-la-creatina-quinasa-en-hombres-sedentarios-918-sa-M57cfb2719d5e6
