Efectos Combinados de la Glucosa y Fructosa en la Absorción de Fluidos a partir de Bebidas Hipertónicas con Carbohidratos-Electrolitos
G. Patrick Lambert1, Stephen Lanspa2, Rebecca Welch3, Xiaocai Shi41 Department of Exercise Science, Creighton University, Omaha, NE, Estados Unidos.
2 Department of Medicine, Creighton University, Omaha, NE, Estados Unidos.
3 Department of Surgery, Creighton University, Omaha, NE, Estados Unidos.
4 Gatorade Sport Science Institute, Barrington, IL, Estados Unidos.
Resumen
Este estudio analizó el efecto de la glucosa y la fructosa en conjunto, en comparación con el efecto de la glucosa sola sobre la absorción de agua de las soluciones hipertónicas de carbohidratos-electrólitos (CES) en el intestino delgado. Seis soluciones fueron perfundidas en el duodeno-yeyuno y luego se determinó el flujo de agua mediante la técnica de perfusión regional. Las soluciones utilizadas fueron: 1) 6% de glucosa, 2) 3% de glucosa + 3% de fructosa, 3) 8% de glucosa, 4) 4% de glucosa + 4% de fructosa, 5) 10% de glucosa, o 6) 5% de glucosa + 5% de fructosa. Todas las soluciones también contenían 20 mEq de sodio, 3 mEq de potasio y saborizantes y colorantes para simular las CES que se ingieren normalmente. El flujo de agua se relacionó con la osmolalidad (r=0,79) y las soluciones que contenían 6% de glucosa, 3% de glucosa + 3% de fructosa, y 4% de glucosa + 4% de fructosa promovieron una mayor (p<0,05) tasa de absorción de agua que las soluciones que contenían 8% de glucosa, 10% de glucosa y 5% glucosa + 5% de fructosa. Estos resultados indican que el aumento en la osmolalidad afecta negativamente la absorción de fluidos, y esto se atenúa con una CES al 8% moderadamente hipertónica que contenga fructosa y glucosa en comparación con una bebida que solo contenga glucosa.
Palabras Clave: intestino, agua, rehidratación
INTRODUCCION
La tasa de absorción intestinal de fluidos es un factor limitante para una rápida rehidratación oral. Se ha establecido que los principales factores que afectan la tasa de absorción de fluidos son la osmolalidad y el contenido de sustratos de la solución de rehidratación (1, 2). Muchas bebidas deportivas que se ingieren normalmente son hipertónicas, y van desde 300 a 600 mOsm (3) e incluso alcanzan valores superiores como en el caso de las gaseosas (es decir, 600-700 mOsm) (4). Dicha hiperosmolalidad refleja principalmente las concentraciones de carbohidratos (CHO) que se utilizaron (es decir, generalmente una concentración del 6-10%). Estas cantidades de CHO mejoran la palatabilidad y, en el caso de las bebidas deportivas, son una fuente de energía exógena mayor para los músculos activos que las soluciones con menor concentración de CHO. Sin embargo, la tasa de absorción de fluidos a partir de soluciones de CHO-electrólitos hipertónicas (CES) normalmente no es tan grande como la de las soluciones isotónicas o hipotónicas (1), y pueden producir síntomas gastrointestinales (5) que pueden exacerbarse con la deshidratación (6).
La inclusión de dos o más sustratos transportables (ej. glucosa y fructosa) en lugar de uno (por ej., glucosa) en las soluciones isotónicas o ligeramente hipertónicas parecería aumentar la tasa de absorción de fluidos (1). Esto cumple con lo que ya se conoce respecto al acoplamiento de la absorción de agua con la absorción de solutos en el intestino (7, 8). En lo que respecta a las bebidas deportivas, la combinación de glucosa y fructosa también parecería aumentar la oxidación de carbohidratos (9). Sin embargo no se sabe si el aumento en la absorción de fluidos también es cierto para las soluciones de osmolalidad aun mayor, como se discutió previamente. Utilizando metodologías de medición indirecta de absorción de agua, Jentjens et al. (9) demostraron que esto podía ser posible durante la realización de ejercicio en condiciones de calor. Basados en esto, y en el hecho de que tantos individuos consumen bebidas hipertónicas para rehidratarse, el propósito del presente estudio consistió en determinar directamente si la presencia de dos monosacáridos, glucosa y fructosa, promoverían una mayor tasa de absorción de agua que la glucosa sola, en condiciones crecientes de concentración de CHO y osmolalidad.
Planteamos la hipótesis de que la adición de fructosa, en una cantidad equimolar a la glucosa, produciría una tasa mayor de absorción de agua a partir de soluciones moderadamente hipertónicas en comparación con las soluciones que sólo contienen glucosa.
METODOS
Sujetos
Antes de participar en el estudio cada sujeto proporcionó por escrito su consentimiento informado, y fueron seleccionados tanto varones como mujeres.
Debido a que la técnica de perfusión regional requiere intubación oral con un catéter multilumen, todos los sujetos fueron evaluados para determinar si presentaban la capacidad de tolerar cómodamente la intubación. Además, un médico realizó una evaluación del historial de salud y un examen físico para descartar alguna contraindicación para participar en el estudio. Todos los procedimientos y protocolos fueron aprobados por el Comité de Revisión Institucional de la Universidad de Creighton.
Luego del proceso de selección participaron ocho individuos saludables (6 varones: edad 26±2 años; masa corporal 78,3±2,7 kg y 2 mujeres: edad 22±0 años; masa corporal 66,0±5,9 kg). Dos sujetos se retiraron a la mitad del estudio después de experimentar síntomas gastrointestinales (i.e, náuseas, diarrea) luego de la evaluación de las soluciones de CHO al 10% (ver la composición de la bebida más adelante). Estas soluciones fueron subsiguientemente descartadas de los estudios posteriores. Un sujeto también abandonó en el medio del estudio debido a que presentó incomodidad en la garganta. En total, se evaluaron 4-6 sujetos en cada solución. Un análisis de potencia de un estudio previo (10) reveló que cuatro sujetos aportarían 80% de probabilidad de establecer efectos significativos en el flujo de agua, que era nuestra variable de interés principal, por lo que no se reclutaron más sujetos. Es necesario resaltar que los estudios que utilizan la técnica de perfusión regional muchas veces deben confiar en números de sujetos relativamente bajos (es decir, 4-6 sujetos) (11-15), debido a la dificultad de encontrar sujetos que toleren confortablemente la intubación.
Procedimientos
Los sujetos acudieron al Centro Médico de la Universidad de Creighton a las 7:30 de la mañana en dos días experimentales luego de un ayuno de toda la noche. Al llegar, a las participantes de sexo femenino se les realizó un test de orina para descartar embarazo con el fin de eliminar el posible riesgo de exposición del feto a la radiación de la fluoroscopía. En un día experimental fijado, se administró a la garganta el anestésico local Cetacaine® (Cetylite, Industries, Inc.) y un catéter multilumen (Arndorfer, Greendale, WI) fue colocado a través de la cavidad oral mediante guía fluoroscópica en el duodeno-yeyuno, situando el puerto de infusión a ~10 cm de distancia del esfínter pilórico. El catéter fue construido con tres lúmenes y cada uno finalizaba en forma de puerto que serviría, ya sea para la infusión o para el muestreo de la solución de prueba. El sitio de muestreo proximal se localizó a 10 cm del sitio de infusión y a esta distancia se la definió como segmento de mezcla (16). El sitio de muestreo distal se localizó a 40 cm del sitio de muestreo proximal y a esta distancia se la definió como segmento de prueba en el estudio (10), y abarcó esencialmente ~20 cm de duodeno y ~20 cm de yeyuno. En el extremo distal del catéter se colocó tungsteno para aumentar el peso. Después de la colocación del catéter, la primera de dos o tres soluciones de prueba fue infundida a 15 mL.min-1 durante 70 min en el duodenoyeyuno a través del puerto de infusión del catéter multilumen. Los primeros 30 min se consideraron como período de equilibrio para alcanzar condiciones de estado estable (17). El orden en que se administraron las soluciones entre los sujetos fue aleatorio. Las seis soluciones evaluadas fueron las siguientes: 1) 6% de glucosa (333 mM), 2) 3% de glucosa (167 mM) + 3% de fructosa (167 mM), 3) 8% de glucosa (444 mM), 4) 4% de glucosa (222 mM) + 4% de fructosa (222 mM), 5) 10% de glucosa (555 mM), y 6) 5% de glucosa (278 mM) + 5% de fructosa (278 mM).
Todas las soluciones contenían además 20 mEq de sodio (Na+), 3 mEq de potasio (K+), saborizantes y colorantes, y 1 mg.mL-1 de polietilenglicol (PEG; 3350 Da; Miralax®, Braintree, Laboratories Inc.); para la determinación del flujo de agua intestinal.
Todas las soluciones tenían un pH de 3,0.
Luego del período de equilibrio de 30 min y al final de los 70 min totales de perfusión para cada bebida, se tomó una muestra de sangre (10 mL) de la vena antecubital, se centrifugó, y el plasma fue congelado a -20 C y posteriormente analizado para determinar la osmolalidad, y el contenido de Na+ y K+ plasmáticos.
Durante el período de perfusión, se aspiraron muestras intestinales en intervalos de 10 min a partir de los puertos proximal (mL.min-1) y distal (mediante sifonaje continuo) del segmento de prueba. Estas muestras también fueron congeladas a -20 ºC y luego fueron analizadas para determinar el contenido de PEG, glucosa, fructosa, Na+ y K+ y osmolalidad. Los cálculos de flujo de agua fueron realizados en base a las fórmulas de Cooper et al. (16):
QE = I.[PEG]I/[PEG]P - SP
QL = QE. [PEG]P/[PEG]D
QN = QL - QE
Donde I es la tasa de infusión (15 mL.min-1); QE es la tasa de flujo que ingresa; QL es la tasa de flujo que sale; QN es el movimiento de agua neto hacia adentro o hacia afuera del lumen intestinal; SP es la tasa de muestreo en el sitio proximal; y [PEG]I, [PEG]P, y [PEG]D son las concentraciones de PEG en la bebida de infusión, en el sitio de muestreo proximal, y en el sitio de muestreo distal, respectivamente. El flujo de solutos fue determinado a partir de las concentraciones de PEG junto con las concentraciones de cada soluto de interés (es decir, glucosa, fructosa, Na+, K+) mediante la siguiente fórmula:
SN = [soluto]D. QL - [soluto]P. QE
Donde SN es el movimiento neto de solutos hacia adentro o hacia afuera del lumen intestinal, [soluto]D es la concentración de soluto en el sitio de muestreo distal y [soluto]P es la concentración de soluto en el sitio de muestreo proximal. Para determinar flujo total de electrólitos, los flujos de Na+ y K+ fueron duplicados para considerar el transporte simultáneo de aniones.
Las concentraciones de PEG fueron determinadas por el método de turbidometría (18), las concentraciones de CHO fueron determinadas mediante Cromatogrfía Líquida de Alta Eficacia (HPLC) (Dionex S.A., Model DX-500; Sunnyvale CA), la osmolalidad fue calculada por la disminución del punto de congelación (Precision Systems, Model 2430; Natick, MA), y Na+/K+ fueron determinados mediante fotometría de llama (Instrumentation Labs, Model IL 943;Lexington, MA).
Análisis Estadísticos
Se analizaron las siguientes variables dependientes: flujo de agua, flujo de CHO, flujo de Na+, flujo de K+, flujo total de solutos, osmolalidad de la solución, osmolalidad en el segmento de prueba, osmolalidad del plasma, y concentraciones de Na+ y K+ en el plasma. Los datos fueron analizados mediante un ANOVA simple y las diferencias significativas fueron identificadas con el test de la Mínima Diferencia Significativa (LSD) de Fisher Protegido.
Para algunas correlaciones se aplicó el coeficiente de correlación r de Pearson. El nivel de significancia en todas las comparaciones fue fijado a un nivel p<0,05.
RESULTADOS
El flujo de agua presentó diferencias significativas (p<0,05) entre las soluciones (Tabla 1) y mostró una elevada correlación (r=0,79) con la osmolalidad en el segmento de prueba (Figura 1). Cuando se compararon las soluciones de 8% de CHO, la absorción de agua aumentó significativamente cuando la solución contenía fructosa. Las soluciones con concentraciones menores a ~370 mOsm en el segmento de prueba (6% glucosa, 3% de glucosa + de 3% fructosa, y 4% de glucosa + 4% de fructosa) aumentaron la absorción neta de agua y fueron significativamente (p<0,05) diferentes de aquellas con osmolalidades de ~390 mOsm o mayores en el segmento de prueba (8% de glucosa, 10% de glucosa y 5% de glucosa + 5% de fructosa), las cuales aumentaron la secreción neta de agua. Esto se observa en la Figura 2.
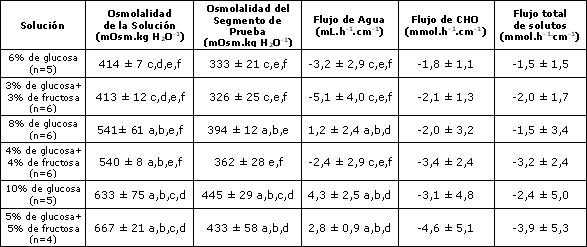
Tabla 1. Valores de osmolalidad de las soluciones y en el segmento de prueba y valores de flujos de agua, CHO y de solutos totales Los valores se presentan como Media±DS. Los valores negativos indican absorción. Las letras indican diferencias significativas (p<0,05): a=presenta diferencias significativas respecto a la bebida que contiene glucosa al 6%; b=presenta diferencias significativas respecto a la bebida que contiene 3% de glucosa + 3% de fructosa; c=presenta diferencias significativas respecto a la bebida que contiene 8% de glucosa; d=presenta diferencias significativas respecto a la bebida que contiene 4% de glucosa + 4% de fructosa; e=presenta diferencias significativas respecto a la bebida que contiene 10% de glucosa; f= presenta diferencias significativas respecto a la bebida que contiene 5% de glucosa + 5% de fructosa.
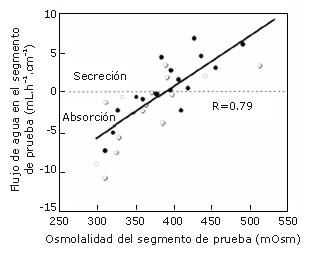
Figura 1. Efecto de la osmolalidad del segmento de prueba sobre el flujo neto de agua. Los valores de flujo de agua negativos indican absorción mientras que los valores positivos indican secreción. Los círculos vacíos corresponden a las soluciones con dos sustratos transportables (glucosa y fructosa) y los círculos llenos corresponden a las soluciones con un solo sustrato transportable (glucosa).
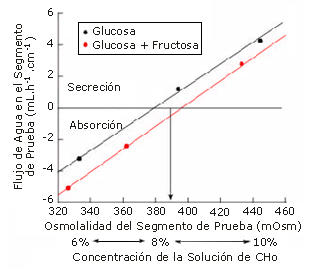
Figura 2. Relación entre los valores medios de flujo neto de agua, concentración de CHO en la solución, y osmolalidad del segmento de prueba. Los valores negativos indican absorción mientras que los valores positivos indican secreción. Los valores de las desviaciones estándar (DS) se presentaron previamente en la Tabla 1, por lo que se excluyeron de la figura para mayor claridad. También se presentaron en la Tabla 1 las anotaciones correspondientes a las diferencias significativas observadas entre las soluciones. La flecha indica que la absorción neta cambia a secreción neta en el momento en que la osmolalidad en el segmento de prueba es ~390 mOsm.
Como se indicó previamente en la sección Métodos, las soluciones con concentraciones de 6%, 8%, y 10%, que diferían en la concentración total de CHO, también presentaron diferentes osmolalidades iniciales. Sin embargo no se observaron diferencias en la osmolalidad, en las soluciones con la misma concentración de CHO. Los datos de la osmolalidad media del segmento de prueba (Tabla 1) indicaron que las soluciones con 6% de CHO diferían significativamente, tanto de la solución con 10% de CHO como de la solución de glucosa al 8%, pero no presentaban diferencias con la solución que contenía 4% de glucosa + 4% de fructosa. Esta última solución también presentó diferencias con ambas soluciones de CHO al 10% en el segmento de prueba.
No se observaron diferencias significativas entre las soluciones en el flujo de CHO o en el flujo total de solutos (Tabla 1). En las soluciones el flujo de Na+ tomó valores que iban de 0,3±0,2 a 1,0±0,2 mEq.L-1 (secreción neta), mientras que el flujo de K+ presentó valores comprendidos entre 0,21±0,01 a 0,27±0,07 mEq.L-1 (absorción neta) y no se observaron diferencias significativas. La Figura 3 presenta los resultados del flujo total de solutos en función de la concentración de CHO de la solución original, y además contemplando si la solución contenía glucosa o glucosa + fructosa.
La osmolalidad del plasma permaneció esencialmente inalterada durante los experimentos, tomando valores comprendidos entre 288 y 291 mOsm (Tabla 2). Los valores de sodio y de potasio plasmáticos tampoco cambiaron dentro o entre los experimentos (valores de Na+=138 a 141 mEq; valores de K+=3,9 a 4,5 mEq; Tabla 2).
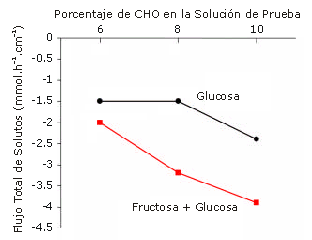
Figura 3. Efectos de la presencia de uno (glucosa) vs. dos (glucosa + fructosa) sustratos transportables sobre la relación entre el porcentaje de CHO en las soluciones de prueba y el flujo total medio de solutos. Los valores negativos indican absorción. Las desviaciones estándar se presentaron previamente en la Tabla 1 y fueron excluidas de la figura para mayor claridad. No se observaron diferencias significativas entre las soluciones.
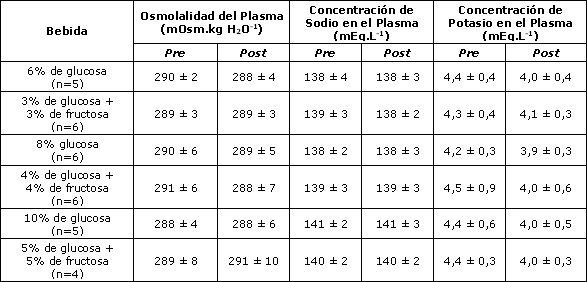
Tabla 2. Osmolalidad, y concentraciones de sodio y potasio en el plasma. Los valores se presentan en forma de media±DS.
DISCUSION
Los principales resultados fueron: 1) el reemplazo de 4% de glucosa con 4% de fructosa en una solución hipertónica con 8% de glucosa aumentó su absorción, 2) las soluciones con osmolalidades en el segmento de prueba inferiores a ~370 mOsm fueron absorbidas más rápidamente que aquellas con osmolalidades superiores a ~390 mOsm (las cuales provocaron secreción neta de agua), y 3) la absorción de agua entre las soluciones estudiadas estuvo altamente relacionada con la osmolalidad del segmento de prueba. Estos resultados coinciden con lo que se conoce sobre el acoplamiento de absorción de agua con la absorción de glucosa, fructosa, y electrólitos en el epitelio del intestino delgado. A medida que se absorben los solutos, el agua ingresa debido a que se produce un gradiente osmótico. Si se puede lograr una mayor absorción de solutos agregando más sustratos transportables a una solución, la absorción de agua debería también incrementarse, para que la osmolalidad del lumen no se vea severamente comprometida. Sin embargo, el flujo neto de agua también es altamente dependiente de la osmolalidad del lumen. Concretamente, si la osmolalidad del lumen en el segmento de prueba excede ~400 mOsm, tal como se observó en el presente estudio (Tabla 1), se producirá una secreción neta con el objetivo de alcanzar un gradiente osmótico favorable para la subsecuente absorción de agua. Si la osmolalidad del lumen es casi isotónica (o hipotónica), se produce una absorción neta de agua, debido a la absorción de solutos y a un gradiente osmótico favorable. Además, la glucosa sola refuerza la absorción de agua activando el transportador SGLT1 que puede actuar como una bomba de agua, donde se estima que 260 moléculas de agua serán transportadas por cada molécula de glucosa absorbida (es decir, 26 gramos de agua transportada por cada gramo de glucosa transportada) (19). También se ha observado que la activación del transportador SGLT1 promueve el transporte de agua y solutos a través de la vía paracelular (intercelular) abriendo las uniones fuertes (20, 21). De esta manera la glucosa sola puede estimular la absorción significativa de agua. Debido a que todas las soluciones en el presente estudio tenían concentraciones de glucosa (167-555 mM) mucho mayores que el Km del SGLT1 ( Km=28 mM) (20), la adición de fructosa, que es transportada por un mecanismo diferente (GLUT-5), podría aumentar el transporte de agua creando un gradiente osmótico aun mayor. La siguiente discusión abordará los efectos de la osmolalidad y la absorción de solutos sobre el flujo neto de agua en el presente estudio.
Efecto de la Osmolalidad en la Absorción de Agua
En nuestro estudio la Figura 1 muestra que la osmolalidad del segmento de prueba presentó una fuerte correlación con la tasa de absorción de agua.
La Tabla 1 y la Figura 2 indican que las soluciones con osmolalidades en el segmento de prueba inferiores a ~370 mOsm (es decir, 6% de glucosa, 3% de glucosa + 3% de fructosa, y 4% de glucosa + 4% de fructosa) tenía una tasa de absorción de agua significativamente mayor que aquéllas con osmolalidades superiores a ~390 mOsm (es decir, 8% de glucosa, 10% de glucosa, y 5% de glucosa + 5% de fructosa) qué causaron una secreción neta de agua.
Además, no se observaron diferencias entre las soluciones cuya osmolalidad era inferior ~370 mOsm y tampoco se observaron diferencias entre las soluciones cuya osmolalidad era superior a ~390 mOsm.
Nuestros resultados coinciden con la mayoría de los resultados de otros trabajos que han estudiado la absorción en el duodenoyeyuno. En los estudios de soluciones de CHO al 6% con osmolalidades en el segmento de prueba que van de 250 a 350 mOsm, no se observaron diferencias en la absorción de agua (12, 22, 23). Por otra parte, no se observó ningún efecto de la osmolalidad sobre la absorción de agua en el yeyuno cuando se evaluaron sólo soluciones hipotónicas (<290 mOsm) (24). Sin embargo, como también se observó en el presente estudio, cuando la osmolalidad del segmento de prueba es notablemente hipertónica, se produce una secreción neta de agua (25, 26).
En contraste con nuestros resultados, Ryan y col. (27) observaron que una bebida con 8% CHO que contenía glucosa, fructosa, y maltodextrina, y una osmolalidad media en el segmento de prueba de 328 mOsm no fue absorbida tan rápidamente como una solución de CHO al 6% que contenía glucosa y sacarosa y una osmolalidad media en el segmento de prueba de 284 mOsm. Probablemente la causa de las diferencias entre los estudios se debe al flujo de Na+.
En el estudio realizado por Ryan y col. (27), la solución con 6% de CHO contenía 20 mEq de Na+ y promovió la absorción de sodio, mientras que la solución con 8% de CHO contenía sólo 5 mEq de Na+ y causó la secreción de sodio. Esta secreción de sodio probablemente provocó secreción de agua y originó una menor absorción neta de agua en comparación con la solución con 6% de CHO. Esta diferencia en los resultados señala que deben ser considerados numerosos factores cuando se realizan comparaciones de las tasas de absorción de agua entre los diferentes estudios.
Notablemente, algunos (1, 12, 22, 23, 28-30), pero no todos (24), los estudios realizados en seres humanos también han demostrado que las soluciones isotónicas son absorbidas a la misma velocidad (1, 22, 23, 27, 29) o más rápidamente (10, 26, 30) que las soluciones hipotónicas o el agua. Las diferencias entre los estudios que evaluaron el efecto de la osmolalidad en la absorción de agua intestinal en humanos podrían reflejar la clase de CHO utilizados, concentraciones de los electrólitos (como se mencionó anteriormente), o el segmento intestinal que se estudió. Por ejemplo, soluciones que contienen oligo o polisacáridos (por ej, maltodextrina) tendrán menor osmolalidad antes de la ingestión o infusión; sin embargo, una vez que el CHO es hidrolizado en el intestino, la osmolalidad de la solución aumenta notablemente y puede inhibir la absorción de agua (23). Otro factor importante a la hora de comparar los resultados del presente estudio con otros trabajos, es el segmento de prueba intestinal estudiado. En muchos estudios, incluido éste, el segmento de prueba incluyó tanto el duodeno como la porción proximal del yeyuno (1, 10, 12, 22, 23, 27-29, 31-35), mientras que en otros estudios sólo se estudió el yeyuno (24, 30). El duodeno es más permeable que el yeyuno, por lo tanto incluirlo en el segmento de prueba generalmente aumenta la absorción de agua en comparación a cuando se realiza la evaluación solo en el yeyuno (29). Además, su inclusión es más práctica en términos de simular lo que ocurriría si la solución fuera ingerida. De modo similar, previamente se observó que la absorción de agua en el duodeno era similar si un individuo bebía la solución o si la misma era infundida a una tasa constante (33).
El mecanismo que permite la mayor absorción de agua a partir de con baja osmolalidad está relacionado al gradiente osmótico creado entre el fluido del lumen intestinal y las vellosidades del intestino delgado. Hallback et al. (36, 37) determinaron que cuando la mucosa intestinal se expone a soluciones con diferentes osmolalidades, la osmolalidad de las vellosidades intestinales aumenta para crear un gradiente osmótico favorable (hasta cierto punto) para la absorción de agua. Por ejemplo, cuando son expuestas a un una solución de glucosa-electrólitos (320 mOsm), la osmolalidad media en el extremo de las vellosidades es ~700 mOsm en los humanos (36). Esta osmolalidad relativamente elevada de las vellosidades se crea mediante un transportador intestinal contracorriente, y permite que ocurra la absorción pasiva de agua. Incluso puede crearse un gradiente osmótico en condiciones donde el lumen es hipertónico, como en el presente estudio.
Esto permite absorber soluciones moderadamente hipertónicas. En las condiciones del presente estudio, parecería que la absorción se produce en una osmolalidad luminal de ~390 mOsm punto a partir del cual predomina la secreción neta.
Efecto de Absorción de Solutos sobre la Absorción de Agua
Se planteó la hipótesis que indicaba que la presencia de glucosa y fructosa, en lugar de glucosa solamente, aumentaría la absorción de agua de una CES moderadamente hipertónica (por ejemplo, CES al 8%). Esta hipótesis se basó en evidencias previas directas (método de perfusión segmentaria) (1) e indirectas (método del óxido de deuterio) (9) que indicaban que el aumento en la absorción de solutos, debido a la presencia de varios sustratos transportables, mejora la absorción de agua. Nuestra hipótesis fue corroborada; sin embargo, no se observaron diferencias en el flujo de CHO o solutos totales, por lo tanto no está claro el mecanismo que produce este efecto. La probable razón por la cual no se observaron diferencias significativas en el flujo de CHO puede deberse a una insuficiente potencia estadística y a las varianzas relativamente grandes entre las soluciones. Sin embargo, nosotros no pensamos que la variabilidad entre los sujetos provenga de diferencias de edad o género debido a que ningún estudio ha demostrado diferencias en la absorción varones y mujeres, y no se observaron diferencias significativas en las edades entre varones y mujeres. En este estudio, el análisis de la potencia estadística que se realizó para establecer cual sería el tamaño de muestra adecuado se realizó en base al flujo de agua y no al flujo de CHO. Así, si bien con 4-6 sujetos por solución se observaron diferencias en el flujo de agua, corroborando nuestra hipótesis, el número y la gran variación entre sujetos impidieron observar diferencias en el flujo de CHO. En base a los presentes datos acerca del flujo de CHO, sería necesario evaluar 30 sujetos para poder observar diferencias significativas. No obstante, parecería que una CES moderadamente hipertónica (es decir, CHO al 8%) podría beneficiarse por la presencia de un segundo sustrato transportable para aumentar la absorción de agua.
Con todas las soluciones del estudio se produjo secreción neta de sodio, mientras que, simultáneamente se produjo absorción neta de potasio. La secreción de sodio observada ha sido previamente informada con otras soluciones hipertónicas (1, 27), y probablemente refleja ya sea: 1) un esfuerzo por transformar la solución hipertónica en isotónica a través de la secreción de iones cloruro y bicarbonato lo que provoca un arrastre eléctrico de sodio, y, así, la entrada de agua en el lumen (38), o 2) un elevado gradiente de concentración de sodio en el plasma en relación con el lumen. Por ejemplo, con respecto al último caso, cuando es perfundida una concentración elevada de sodio (60 mEq), junto con una concentración de glucosa relativamente alta (140 mm), se observa una absorción neta de sodio (en lugar de secreción) (39).
Efecto de las Diferencias en el Flujo de Agua sobre las Variables Plasmáticas
Si bien las dos soluciones que contenían CHO al 6% y la solución que contenía 4% de glucosa + 4% de fructosa fueron absorbidas con mayor rapidez que las otras soluciones en el intestino proximal, esto no fue detectado a través de cambios en las determinaciones del plasma (por ejemplo, osmolalidad). Estos resultados no son sorprendentes, debido a que las variables plasmáticas son reguladas estrictamente por los riñones y cualquier desviación de lo normal se corrige rápidamente mediante las correspondientes respuestas renales (por ej., un aumento en el clearance de agua libre).
Conclusiones
En síntesis, este estudio indica que en adultos saludables, la absorción de agua en el duodeno- yeyuno a partir de CES moderadamente hipertónicas (es decir, CHO al 8%) puede ser incrementada por la presencia de glucosa y fructosa en comparación a una bebida con glucosa sola. Además, las CES que producen osmolalidades inferiores a ~390 mOsm en el intestino proximal son absorbidas más rápidamente que las soluciones por encima de ~390 mOsm, las cuales promueven la secreción neta. Desde un punto de vista práctico, los individuos que desean rehidratarse rápidamente probablemente obtendrían mayores beneficios a partir de una CES con <8% de CHO que contenga glucosa y fructosa en vez de glucosa solamente.
Agradecimientos
Este estudio fue subsidiado por el Instituto de Ciencias del Deporte Gatorade.
Referencias
1. Shi X., Summers R. W., Schedl H. P., Flanagan S. W., Chang R. T., Gisolfi C. V (1995). Effects of carbohydrate type and concentration and solution osmolality on water absorption. Med Sci Sports Exerc 27(12):1607-1615
2. Wapnir R. A., Lifshitz F (1985). Osmolality and solute concentration their relationship with oral hydration solution effectiveness: an experimental assessment. Pediatr Res 19(9):894-898
3. Millard-Stafford M (1992). Fluid replacement during exercise in the heat: review and recommendations. Sports Med 13 (4):223-233
4. Lambert G. P., Bleiler T. L., Chang R. T., Johnson A. K., Gisolfi C. V (1993). Effects of carbonated and noncarbonated beverages at specific intervals during treadmill running in the heat. Int J Sport Nutr 3: 177-193
5. Brouns F., Beckers E (1993). Is the gut an athletic organ? Digestion, Absorption and Exercise. Sports Med 15 (4):242-257
6. Van Niewenhoven M. A., Vriens B. E. P. J., Brummer R. J. M., Brouns F (2000). Effect of dehydration on gastrointestinal function at rest and during exercise in humans. Eur J Appl Physiol 83: 578-584
7. Curran P. F., Macintosh J. R (1962). A model system for biological water transport. Nature 193: 347-348
8. Diamond J. M., Bossert W. H (1967). Standing gradient osmotic flow: a mechanism for coupling of water and solute transport in epithelia. J Gen Physiol 50: 2061-2083
9. Jentjens R. L. P. G., Underwood K., Achten J., Currell K., Mann C. H., Jeukendrup A. E (2006). Exogenous carbohydrate oxidation rates are elevated after combined ingestion of glucose and fructose during exercise in the heat. J Appl Physiol 100: 807-816
10. Gisolfi C. V., Summers R. W., Schedl H. P., Bleiler T. L., Oppliger R. A (1990). Human intestinal water absorption: Direct vs indirect measurements. Am J Physiol 258: G216-G222
11. Rogers J., Summers R. W., Lambert G. P (2005). Gastric emptying and intestinal absorption of a low-carbohydrate sport drink during exercise. Int J Sport Nutr Exerc Metab 15: 220-235
12. Gisolfi C. V., Lambert G. P., Summers R. W (2001). Intestinal fluid absorption during exercise: role of sport drink osmolality and [Na+]. Med Sci Sports Exerc 33 (6):907-915
13. Fordtran J. S., Saltin B (1967). Gastric emptying and intestinal absorption during prolonged severe exercise. J Appl Physiol 23 (3): 331-335
14. Leiper J. B., Maughan R. J (1986). The effect of luminal tonicity on water absorption from a segment of the intact human jejunum. J Physiol 378: 95P
15. Leiper J. B., Maughan R. J (1987). Water and solute absorption from the intact human jejunum in hydrated and mildly dehydrated humans. Clin Sci 73 (Suppl. 17):32P
16. Cooper H., Levitan R., Fordtran J. S., Ingelfinger R. J (1966). A method for studying absorption of water and solute from the human small intestine. Gastroenterology 50: 1-7
17. Whalen G. E., Harris J. A., Geenen J. E., Soergel K. H (1966). Sodium and water absorption from the human small intestine: accuracy of the perfusion method. Gastroenterology 51 (6): 975-984
Cita Original
Lambert, G.P., Lanspa, S.J., Welch R., Shi, X. Combined Effects of Glucose and Fructose on Fluid Absorption from Hypertonic Carbohydrate-Electrolyte Solutions. JEPonline; 11 (2): 46-55, 2008.
Cita en PubliCE
G. Patrick Lambert, Stephen Lanspa, Rebecca Welch Xiaocai Shi (1930). Efectos Combinados de la Glucosa y Fructosa en la Absorción de Fluidos a partir de Bebidas Hipertónicas con Carbohidratos-Electrolitos. .https://g-se.com/efectos-combinados-de-la-glucosa-y-fructosa-en-la-absorcion-de-fluidos-a-partir-de-bebidas-hipertonicas-con-carbohidratos-electrolitos-1106-sa-k57cfb271bea47
