Efecto de la Ingesta de Phlebodium Decumanum sobre la Respuesta Inmunológica Inducida por el Entrenamiento en Estudiantes Universitarios Sedentarios
José A. González-Jurado1, Francisco Pradas2, Edgardo S. Molina3, Carlos de Teresa41 Faculty of Sport, University of Pablo de Olavide, Sevilla, Spain.
2 Faculty of Human Sciences and Education, University of Zaragoza, Spain.
3 Faculty of Arts and Physical Education, Metropolitan University of Sciences Education, Department of Physical Education, Santiago, Chile.
4 Andaluzian Sport Medicine Centre, San Juan de Dios Universitary Hospital, Granada, Spain.
Resumen
Se considera que el entrenamiento un buen método para provocar diferentes grados de disfunción inmunológica que afectan el rendimiento físico y algunas respuestas fisiológicas en relación con el estrés oxidativo y la inflamación de grado bajo. El Phlebodium decumanum es un polipodiáceo que puede inducir a efectos inmuno-moduladores demostrados, específicamente dirigidos a la liberación de citoquinas pro-inflamatorias por medio de macrófagos en respuesta a diferentes estímulos, según lo que reportaron varios estudios in vitro. El objetivo de este estudio ha sido evaluar el efecto modulador del phlebodium decumanum sobre la respuesta inmunológica inducida por el ejercicio físico. A treinta y un sujetos (solo hombres) se los dividió de manera aleatoria en dos grupos: Grupo PD (n = 18); edad: 22.1 ± 1.81, peso 74.21 ± 8.74 kg), que fue tratado con phlebodium decumanum; y Grupo P (n = 13); edad: 22.5 ± 1.63, peso 78 ± 12.5 kg), que fue tratado con un placebo. Antes y después de un mes de programa de entrenamiento llevado a cabo por ambos grupos (tres veces por semana), se midieron los siguientes parámetros de rendimiento y variables de respuesta inmunológica: Fuerza dinámica máxima; entrenamiento por intervalos; prueba de tenis; niveles de citoquinas pro-inflamatorias (TNFα, IL6) y anti-inflamatorias (TNF-IIrs, IL1-ra). Los datos se analizaron estadísticamente con test U de Mann-Whitney y un test Wilcoxon para datos apareados (p < 0.05). Se registraron diferencias estadísticamente significativas dentro de los grupos antes y después del programa de entrenamiento. El grupo PD mostró una mejora significativa en los parámetros de rendimiento (prueba de fuerza muscular: dorsal: p < 0.002; deltoides: p < 0.03; y pectorales: p < 0.07; entrenamiento por intervalos: p < 0.06; prueba de tenis: p < 0.02). Los niveles de citoquina dieron como resultado un perfil más positivo en el grupo PD que en el grupo P, en el que se registraron niveles de IL-6 más elevados (p < 0.02) y una reducción del TNF-IIrs (p < 0.003) y el IL1-ra (p < 0.03). En este estudio, la utilización del phlebodium decumanum demostró efectos beneficiosos en la modulación de la respuesta inmunológica durante el rendimiento físico.
Palabras Clave: ejercicio físico, inmunomodulación, TNFα, IL6, TNF-IIrs, IL1-ra
INTRODUCCIÓN
El sistema inmunológico es una red compleja en la que las diferentes clases de células y moléculas trabajan juntas para proteger al cuerpo. Su función está dirigida específicamente a reconocer moléculas o antígenos para desarrollar una respuesta efectiva contra los ataques de la inflamación o la infección. La actividad del sistema inmunológico representa una defensa esencial contra las infecciones y el cáncer. La respuesta exitosa depende de la activación de células específicas (linfocitos y células accesorias) y la producción de anticuerpos. Sin embargo, una reacción inadecuada puede inducir a efectos negativos en la célula huésped, determinando inflamación y daño del tejido (Ciliberti et al., 2009).
La función de las células del sistema inmunológico está regulada por la acción de moléculas específicas llamadas citoquinas, principalmente las linfocinas y las monocinas. Las citoquinas son secretadas por los linfocitos y los monocitos para controlar la proliferación y la diferenciación de las células del sistema inmunológico (Sigal y Ron, 1994), y desde un punto de vista estructural, son proteínas solubles de bajo peso molecular, péptidos y/o glicoproteínas que participan e intervienen en el control y la comunicación entre las células involucradas en la respuesta inmunológica. Existen casi cincuenta tipos de citoquinas diferentes que se han clasificado según su actividad fisiológica: actividad pro-inflamatoria, antiviral, inmuno-estimulante, hematopoyética, anti-inflamatoria o inmuno-reguladora (Nieman, 1997).
La inflamación es uno de los efectos más evidentes que se producen a la hora de realizar ejercicio físico. Su grado depende de las variables que describen al ejercicio, como la duración, la intensidad, la frecuencia, etc. (Ploeger et al., 2009). Muchos estudios reportaron que la práctica del ejercicio físico moderado podría ser beneficiosa para estimular la eficacia del sistema inmunológico (Klentrou et al., 2002). Por el contrario, el estrés generado por el entrenamiento intenso o de larga duración puede deteriorar su función (Córdova et al., 2010), provocando un efecto de disfunción inmunológica.
Comprender las alteraciones del sistema inmunológico, que son resultado del ejercicio físico prolongado, es el primer paso para diseñar las estrategias preventivas o terapéuticas contra los problemas funcionales asociados a las actividades deportivas. La modulación del sistema inmunológico da como resultado efectos beneficiosos en la práctica deportiva (Cordova y Alvarez-Mon, 1999a; 1999b).
En la actualidad, existen algunas drogas y complementos nutricionales, como el ácido acetil-salicílico (Aspirin®) o el glicofosfopeptical (Inmunoferon®), que muestran una actividad inmuno-moduladora. La última ha demostrado un fuerte efecto anti-inflamatorio, dando como resultado una inhibición de las citoquinas pro-inflamatorias (i.e. TNFα). Además, puede disminuir los niveles de las proteínas de suero asociadas al daño muscular (Villarrubia et al., 1997). De manera similar, se ha utilizado al Ibuprofen® como terapia inmuno-moduladora para prevenir el daño muscular durante el ejercicio físico intenso (Hasson et al., 1993).
El Phlebodium decumanum es un polipodiáceo que crece en algunas áreas específicas de América Central. La variedad utilizada en este estudio se cultivó en el monocultivo puro y procesado de manera orgánica ubicado en las cercanías del Lago Yojoa (Norte de Honduras). Las diferentes composiciones que comprenden una fracción purificada y estandarizada soluble en agua obtenida de las hojas del phlebodium decumanum (EXPLY) han demostrado su efecto inmuno-modulador, específicamente dirigido hacia la liberación de TNF mediante macrófagos en respuesta a varios estímulos. Al parecer, tienen una acción de amortiguación sobre los niveles de TNF, cumpliendo una función en la regulación de la homeostasis de las citoquinas pro-inflamatorias (Punzon et al 2003). A varias composiciones que contienen EXPLY se les ha otorgado prestigio tanto en suplementaciones nutricionales (alimentos funcionales) como en bebidas energizantes. Además, se han registrado diferentes solicitudes de patentes para la utilización del phlebodium decumanum para la corrección del síndrome de sobreentrenamiento (P-9900133®).
La actividad inmuno-moduladora del Phlebodium Decumanum se ha evaluado en diferentes investigaciones in vitro (Gridling et al., 2009; Punzón et al., 2003), como también in vivo (Tuominen et al., 1991, Vasänge et al., 1994; 1997).
El objetivo de este estudio ha sido evaluar el efecto modulador del phlebodium decumanum sobre las respuestas inmunológicas que surgen del ejercicio físico intenso y sus hipotéticos beneficios sobre el rendimiento físico en los adultos sedentarios.
Los propósitos específicos de este estudio fueron la evaluación de:
- Los cambios adaptativos en los parámetros inmunológicos basales en respuesta al entrenamiento aeróbico.
- Los efectos del phlebodium decumanum sobre dichos cambios y sobre aquellos inducidos por el ejercicio anaeróbico de alta intensidad.
En el presente estudio se han evaluado cuatro tipos de citoquinas. A dos de ellas, en general, se las considera como citoquinas pro-inflamatorias: El factor de necrosis tumoral (TNFα) y la interleucina-6 (IL-6). Por otro lado, el antagonista del receptor IL-1 (IL-1ra) y el receptor soluble del factor de necrosis tumoral 2 (sTNFR2) como moléculas anti-inflamatorias.
MÉTODOS
Para este estudio se seleccionaron a cincuenta estudiantes pertenecientes a Cardenal Spinola (Universidad de Sevilla, España). Todos los participantes dieron su consentimiento informado por escrito para formar parte del estudio, que se llevó a cabo de acuerdo con las directrices propuestas en la Declaración de Helsinki. A los estudiantes se los dividió de manera aleatoria en dos grupos: Experimental (25 GPD) y Placebo (25 GP) para realizar una prueba multigrupo a doble ciego.
A los participantes se los distribuyó de manera equitativa en dos grupos, según su consumo máximo de oxigeno (VO2máx), medido con un protocolo basado en la prueba de un ejercicio máximo graduado en cinta ergométrica (Runrace D-140, Technogym, Italia) y un analizador de gases (Oxicon Delta, Jaeger, Alemania): El último está basado en un sistema infrarrojo y uno paramagnético, que se utilizaron para medir los niveles de CO2 y O2, respectivamente. Según los resultados alcanzados en esta prueba, se distribuyó a los participantes en dos grupos (n = 25), aunque el estudio finalmente se llevó a cabo con 31 sujetos distribuidos de la siguiente manera: 18 sujetos en el grupo GPD (edad promedio: 22.1 años (1.81); peso promedio: 74.21 (8.74)); y 13 sujetos en grupo GP (edad promedio: 22.5 años (1.63); peso promedio: 78.0 (12.5)).
Todos los participantes incluidos en el estudio solían jugar al tenis de manera esporádica y no participaban de ninguna otra investigación. Ninguno de ellos pertenecía a una federación oficial de tenis ni participaba de ninguna competencia oficial.
A los sujetos que pertenecían al grupo Experimental se les proporcionaron cápsulas de 400 mg, que contenían 250 mg de extracto hidrosoluble de la hoja y 150 mg de rizoma pulverizada de phlebodium decumanum (patente no. P-9900133) (2 cápsulas-3 veces/día). A los sujetos que pertenecían al grupo Placebo se los trató con cápsulas de 400 mg que contenían levadura de cerveza (2 cápsulas-3 veces/día). Las suplementaciones nutricionales las distribuyó Helsint S.A.L. (Madrid, España) y el tratamiento se llevó a cabo durante 4 semanas.
Ni los sujetos ni el operador sabían qué tipo de medicamento se suministró durante la prueba. A todos los sujetos también se los incluyó en un protocolo de entrenamiento durante 4 semanas (3 veces/semana). Cada sesión se dividió en tres partes:
- golpes de tenis en una cancha de tenis. Trabajando de a pares, cada sujeto ejecutó 500 golpes de la siguiente manera: 125 golpes de drive paralelos; 125 golpes de drive cruzados; 125 golpes de revés paralelos y 125 golpes de revés cruzados.
- Entrenamiento de fuerza dinámica: Consistió del entrenamiento de tres grupos musculares: Músculos pectorales: Press de banca; Músculos dorsales: tirones en polea; Músculo deltoides: press de hombro con mancuernas. Cada serie se realizó con una intensidad del 55%-60% (entre 15 y 20 repeticiones máximas) (Brzycki, 1993). Se llevaron a cabo tres series de cada ejercicio durante las primeras dos semanas, incrementando hasta cuatro series durante las últimas dos semanas de entrenamiento con un tiempo de recuperación de 2 minutos.
- Entrenamiento con sobrecarga. Se realizó a través de un protocolo de entrenamiento por intervalos, realizando una carrera en redondo con una distancia de ocho metros a intensidad máxima, corriendo así un total de 160 metros.
La recuperación se decidió de acuerdo a la frecuencia cardiaca medida con un monitor de frecuencia cardiaca (Polar® Vantage NV, Polar Electro OY, Finlandia) cuando ésta alcanzaba un valor de 125-130 latidos por minuto. Este programa de entrenamiento tuvo una duración de 20 minutos durante las primeras dos semanas, 25 minutos durante la tercera y cuarta semanas, y 30 minutos durante la primera y la última sesión.
Los niveles sanguíneos del factor de necrosis tumoral alfa (TNFoc), la interleucina-6 (IL-6), el antagonista del receptor de Interleucina-1-(IL-lra) y el receptor soluble de TNF II (TNF-IIrs) se han medido antes y después de completar el programa de entrenamiento, junto con el rendimiento físico, utilizando pruebas específicas. Las muestras de sangre se recolectaron en tubos de vidrio que contenían 35 μmol de EDTA de dipotasio y se centrifugaron durante 30 minutos (3758 rpm) a 4º C. El suero sanguíneo obtenido se separó en dos tubos Eppendorf etiquetados con un código personal y se almacenó a -80ºC.
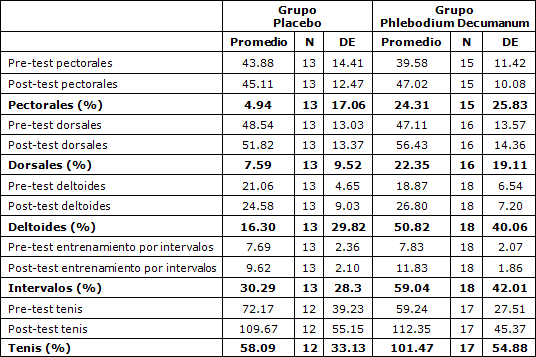
Tabla 1. Estadística descriptiva de los parámetros de rendimiento registrados en los grupos evaluados.
El análisis se llevó a cabo utilizando un ensayo inmunoabsorbente ligado a enzimas (ELISA; R&D systems, Minneapolis, MN, EUA). Los rendimientos físicos y técnicos del tenis también se evaluaron en una cancha de tenis con una máquina lanza pelotas de tenis (KALENDA®, ESPAÑA), de acuerdo con los procedimientos descritos anteriormente por Van Dam y Pruimboom (Dam y Pruimboom, 1992). La fuerza máxima dinámica también se ha evaluado a través de una prueba sub-máxima y de acuerdo con una formula matemática previamente descrita por Brzycki (1993), que expresa este valor comenzando por el valor de peso sub-máximo (i.e. 10 RM o 12 RM). También se ha tenido en cuenta la cantidad de repeticiones realizadas por los participantes durante los primeros y los últimos días de entrenamiento. El mismo operador controló a todos los sujetos incluidos en el estudio, como también las sesiones que se realizaron a diario bajo las mismas condiciones, sin diferencias entre los grupos.
Análisis Estadísticos
Se controlaron los valores registrados para cada variable antes y después de completar el estudio para la distribución normal (Shapiro-Wilk), comparándolos dentro del grupo y entre los grupos. Los datos distribuidos normalmente se analizaron con una prueba t (p< 0.05). Los datos no distribuidos normalmente se analizaron con un test U de Mann-Whitney y con un test de Wilcoxon (p<0.05). Los análisis estadísticos se trataron utilizando SPSS 11.0 para Windows (SPSS Inc, Chicago, EUA).
RESULTADOS
En las Tablas 1 y 2 se resumieron los valores medios (DE) de las variables evaluadas en el estudio.
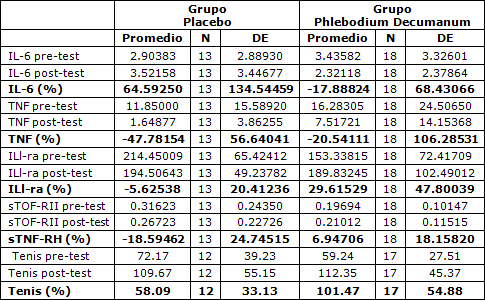
Tabla 2. Estadística descriptiva de los niveles de citoquinas registrados en los grupos evaluados (pg/ml).Interleucina-6 (IL-6), Factor de necrosis tumoral (TNF), Antagonista del receptor de Interleucina-1 (IL1-ra), Receptor soluble de TNF II (sTNF-RII).
Niveles de Citoquinas Pro-Inflamatorias
En la Figura 1 se han resumido los valores de IL-6 media pre-test y post-test registrados en los grupos evaluados. Se observó una disminución significativa en los niveles plasmáticos de IL-6 en el grupo PD (p < 0.039). Por el contrario, se ha registrado una leve mejora en los niveles plasmáticos de IL-6 en el grupo de placebo, aunque no fue significativo (p = 0.53).
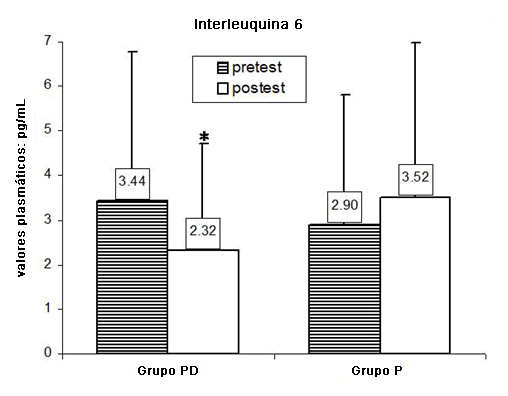
Figura 1. Valores de IL-6 media pre-test y post-test registrados en los grupos evaluados.*p < 0.05.
En la Figura 2 se han resumido los valores de TNF-α media pre-test y post-test registrados en los grupos evaluados. Se observó una disminución en los niveles plasmáticos en el grupo PD (p < 0.05) y el grupo P (p < 0.06) después de realizar el ejercicio físico.
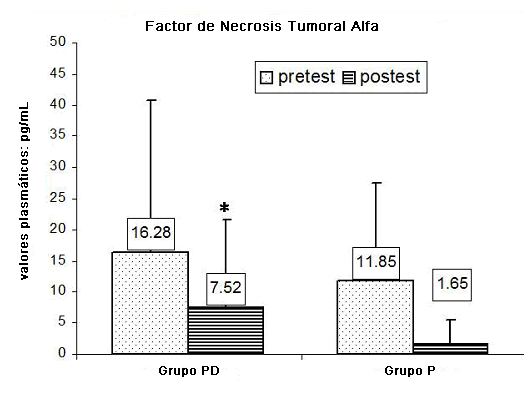
Figura 2. Valores de TNF-α media pre-test y post-test registrados en los grupos evaluados. * p < 0.05.
Niveles de Citoquinas Anti-Inflamatorias
En la Figura 3 se ha reportado una comparación entre los niveles plasmáticos de IL-1 dentro de los grupos experimentales. Los niveles de IL-1 mejoraron de manera significativa en el grupo PD (p < 0.026), mientras que en el grupo P se produjo una disminución, aunque no fue estadísticamente significativa (p = 0.146).
En la Figura 4 se ha resumido una comparación entre los niveles plasmáticos de TNF-IIrs dentro de los grupos experimentales. Los niveles plasmáticos de TNF-II mejoraron de manera significativa en el grupo PD (p < 0.04), mientras que el grupo P alcanzó una disminución estadísticamente significativa (p = 0.036).
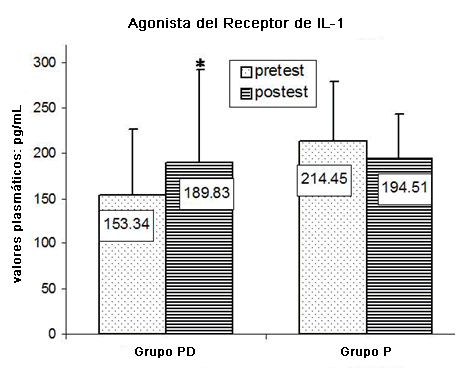
Figura 3. Comparación entre los niveles plasmáticos de IL-1 registrados dentro de los grupos experimentales.*p < 0.05.
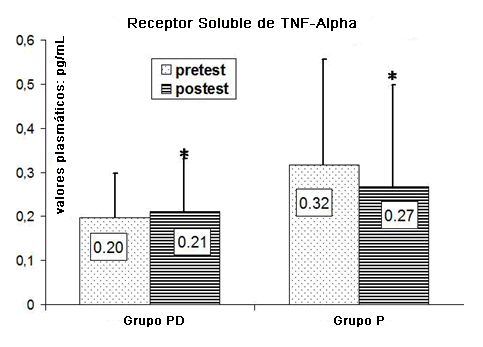
Figura 4. Comparación entre los niveles plasmáticos de TNF-IIrs registrados dentro de los grupos experimentales. *p<0.05.
Además, se llevó a cabo una evaluación de los valores iniciales de las variables evaluadas en el estudio, para analizar la homogeneidad entre los dos grupos experimentales. No se han registrado diferencias significativas para la IL-6, el TNF-alpha, y el TNR-IIrs (test U de Mann-Whitney: p = 0.38, p = 0.6 y p = 0.3, respectivamente). Se han detectado niveles de IL-1ra más elevados en el grupo P pre-test (p < 0.025). Se han comparado los niveles de cambio expresados en porcentajes a fin de evaluar la existencia de diferencias entre los grupos experimentales registradas después del entrenamiento. En la Figura 5 se han resumido los cambios en los niveles de citoquinas entre los grupos experimentales pre-test y post-test (expresados como porcentajes). Se han registrado diferencias significativas entre los grupos para todas las citoquinas evaluadas en el estudio, excepto para el TNFα. Esta evaluación se ha llevado a cabo utilizando un test U de Mann-Whitney para la IL-6 (p < 0.02), el IL1-ra (p < 0.03) y el TNFrsII (p < 0.003), mientras que para el TNFα (p = 0.36) se aplicó una prueba t.
DISCUSIÓN
Los cambios en los niveles de citoquinas durante la respuesta inflamatoria inducida por el ejercicio físico intenso difieren de los observados durante la infección (Ostrowski et al., 1999; Pedersen y Toft, 2000; Petersen y Pedersen, 2005; Suzuki et al., 2002).
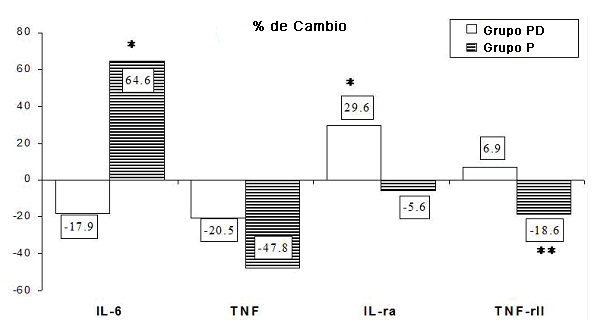
Figura 5. Porcentajes de cambios en los niveles de citoquinas registrados entre los grupos experimentales pre-test y post-test. *p<0.05; **p<0.01.
En el último, los niveles plasmáticos de citoquinas suelen ser los siguientes: TNFα, IL-1, IL-6, IL1ra, sTNF-IIR (Agha Alinejad y Molanouri Shamsi, 2010; Moldoveanu et al., 2001; Pedersen y Toft, 2000). Durante el entrenamiento físico los niveles plasmáticos de IL-6 mejoraron de manera considerable con una posterior disminución en el período posterior al entrenamiento (Pedersen et al., 2003; 2004). Se han registrado niveles de TNFα y IL-6 más elevados inmediatamente después de completar el programa de entrenamiento, mientras que los porcentajes de IL1ra y sTNF-IIR más elevados se alcanzaron después de una hora de recuperación (Ostrowski et al., 1999; 2001; Petersen y Pedersen, 2005; 2006, Ruth et al., 1996; Tilg et al., 1997).
A la IL-6 se la considera como el principal mediador de la respuesta aguda y se activa en caso de situaciones estresantes, como el entrenamiento físico. La IL-6 regula los niveles de TNFα a través de un mecanismo que disminuye su producción. Por lo que los niveles plasmáticos de TNFα pueden no mejorar durante el entrenamiento e incluso disminuir, como se reportó en investigaciones previas (Agha Alinejad y Molanouri Shamsi, 2010; Croft et al., 2009; Gray et al., 2008; Moldoveanu et al., 2001; Nielsen y Pedersen, 2007; Pedersen et al., 2004; Petersen y Pedersen, 2006; Steensberg, 2003; Suzuki et al., 2002).
Los resultados de este estudio mostraron que los niveles plasmáticos de IL-6 mejoraron 48 horas después del entrenamiento en el grupo de Placebo, aunque no fueron significativos. Muchos estudios reportaron que la mejora de esta citoquina depende de la magnitud del esfuerzo físico. Aunque la mejora de la IL-6 es evidente, estos niveles son temporarios y tienden a disminuir después de finalizado el entrenamiento físico. (Bruunsgaard et al., 1997; Croft et al., 2009; Drenth et al., 1995; Gray et al., 2008; Moldoveanu et al., 2000; Ostrowski et al., 1998; Pedersen et al., 2004; Petersen y Pedersen, 2006). Sin embargo, en este estudio las mediciones se realizaron 48 horas después de finalizar la última sesión de entrenamiento. Por el contrario, los niveles plasmáticos de IL-6 disminuyeron de manera significativa en los grupos PD (p < 0.05). Existieron diferencias significativas en el porcentaje de niveles de IL-6 entre los dos grupos antes y después del programa de entrenamiento (p < 0.02).
Investigaciones previas reportaron que los niveles plasmáticos de TNFα mejoran después del entrenamiento de resistencia extremo (Drenth et al., 1995; Moldoveanu et al., 2000; Ostrowski et al., 1999). Comparando los datos pre- y post-entrenamiento, este estudio resaltó una significativa disminución de estos niveles en ambos grupos (p < 0.05), sin diferencias significativas entre ellos (p = 0.35). Las discrepancias pueden deberse al hecho de que en el presente estudio los análisis se realizaron 48 horas después de completar la última sesión de entrenamiento, mientras que en otros estudios la mejora se registra inmediatamente después de completar la sesión de entrenamiento o después de algunas horas.
Los resultados concuerdan con las investigaciones previas que reportaron una disminución significativa o incluso ningún cambio en los niveles de TNFα después del entrenamiento físico (Gokhale et al., 2007; Suzuki et al., 2002). Según Moldoveanu et al. (2000; 2001), la regulación del TNFα inducido por el ejercicio físico depende de la intensidad y la duración del estímulo físico.
Una vez completa la última fase, los niveles plasmáticos elevados de TNFα se mantuvieron solo por un breve período de tiempo, dificultando así su medición precisa después del entrenamiento físico. Las citoquinas anti-inflamatorias IL-1ra y TNF-IIrs tuvieron un comportamiento similar. El IL-1ra inhibe la actividad del IL-1, disminuyendo sus potenciales efectos adversos (Cordova y Alvarez-Mon, 1999b; Cordova y Alvarez-Mon, 1999a; Ruth et al., 1996).
Varios estudios reportaron una mejora en las citoquinas anti-inflamatorias, como el IL-1ra, debido al entrenamiento físico (Nieman, 1997; Nieman et al., 2006; Suzuki et al., 2000). Aunque el entrenamiento físico determina una mejora en los niveles de las citoquinas pro-inflamatorias, esta respuesta es equilibrada gracias a la producción de citoquinas con efecto inhibitorio por encima de las inflamatorias (IL-1ra y TNF-IIrs) (Ostrowski et al., 1999). Puede especularse que las citoquinas anti-inflamatorias disminuyen la cantidad y duración de la respuesta inflamatoria debido al ejercicio físico.
En este estudio, ambos niveles plasmáticos de IL-1ra y TNF-IIrs disminuyeron en el grupo GP después del entrenamiento. Esta disminución fue estadísticamente significativa solo para el TNF-IIrs (p < 0.05), mientras que no se registraron diferencias significativas entre los niveles pre- y post-entrenamiento de IL-1ra (p = 0.14). En el grupo PD los niveles plasmáticos para IL-1ra y TNF-IIrs mejoraron de manera significativa después del entrenamiento (p < 0.05). Los análisis estadísticos revelaron diferencias significativas entre los dos grupos evaluados para ambos parámetros evaluados (IL-1ra: p < 0.03 y TNF-IIrs: p < 0.003, respectivamente). Estos resultados concuerdan con las investigaciones previas que resaltan la influencia ejercida por la IL-6 sobre la producción de IL-1ra, IL-10 (Emmanuel y Lie, 1996; Ronsen et al., 2002; Ruth et al., 1996; Steensberg, 2003) y TNF-IIrs (Cordova Martinez et al., 2006; Drenth et al., 1998; Tilg et al., 1997).
CONCLUSIÓN
Los resultados de este estudio muestran que los niveles de los indicadores de la respuesta inmunológica pueden ser afectados por la práctica deportiva o la actividad física de intensidad media-elevada. El Phlebodium decumanum demostró un efecto beneficioso en este estudio, induciendo a una disminución en los niveles de citoquinas pro-inflamatorias y a una mayor concentración de citoquinas anti-inflamatorias. Se ha resaltado su efecto protector y modulador sobre la respuesta inmunológica.
AGRADECIMIENTOS
Se agradece a Helsint S.A.L. por su apoyo económico para este estudio.
Puntos Clave
- La práctica deportiva o la actividad física de intensidad media-elevada tres veces por semana durante 4 semanas inducen a cambios en los niveles de los indicadores de la respuesta inmunológica.
- La ingesta de Phlebodium decumanum indujo a una disminución en los niveles de citoquinas pro-inflamatorias y a una mayor concentración de citoquinas anti-inflamatorias.
- Las citoquinas anti-inflamatorias tienen un efecto protector y modulador sobre la respuesta inmunológica.
Referencias
1. Agha Alinejad, H. and Molanouri Shamsi, M (2010). Exercise induced release of cytokines from skeletal muscle: Emphasis on IL-6. Iranian Journal of Endocrinology and Metabolism, 12, 181-190
2. Bruunsgaard, H., Galbo, H., Halkjaer-Kristensen, J., Johansen, T.L., Maclean, D.A. and Pedersen, B.K (1997). Exercise-induced in-crease in serum inferleukin-6 in humans is related to muscle damage. Journal of Physiology 499, 833-841
3. Brzycki, M (1993). Strength testing. Predicting a one-rep max from reps-to-fatigue. Journal of Physical Education, Recreation & Dance 64, 88-90
4. Ciliberti, E., Carambia, L., Cavallin, S., Cerda, O.L., Poderoso, J.J. and Rabinovich, G.A (2009). Tolerance and autoimmunity. Novel therapeutic approaches. Conceptos emergentes de tolerancia y autoinmunidad: Nuevos enfoques terapeuticos 69, 460-465. (In Spanish)
5. Cordova, A. and Alvarez-Mon, M (1999). Immune system (I): General concepts, adaptation to physical exercise and clinical implica-tions (El sistema inmune (I): Conceptos generales, adaptacion al ejercicio fisico e implicaciones clínicas). Archivos de Medicina del Deporte 69, 47-54. (In Spanish)
6. Cordova, A. and Alvarez-Mon, M (1999). Immune system (II): Effect of immunomodulators in recovery of sportsmen (El sistema inmune (II): Importancia de los inmunomoduladores en la recuperacion del deportista). Archivos de Medicina del Deporte 70, 155-165. (In Spanish)
7. Córdova, A., Sureda, A., Tur, J.A. and Pons, A (2010). Immune re-sponse to exercise in elite sportsmen during the competitive sea-son. Journal of Physiology and Biochemistry 66, 1-6
8. Cordova Martinez, A., Monserrat, J., Villa, G., Reyes, E. and Soto, M.A.M (2006). Effects of AM3 (Inmunoferon®) on increased serum concentrations of interleukin-6 and tumour necrosis factor receptors I and II in cyclists. Journal of Sports Sciences 24, 565-573
9. Croft, L., Bartlett, J.D., Maclaren, D.P.M., Reilly, T., Evans, L., Mattey, D.L., Nixon, N.B., Drust, B. and Morton, J.P (2009). High-intensity interval training attenuates the exercise-induced in-crease in plasma IL-6 in response to acute exercise. Applied Physiology, Nutrition and Metabolism 34, 1098-1107
10. Dam, B.V. and Pruimboom, L (1992). Un nuevo test en tenis. Revista de Entrenamiento Deportivo 6, 29-33. (In Spanish)
11. Drenth, J.P.H., Krebbers, R.J.M., Bijzet, J. and Van Der Meer, J.W.M (1998). Increased circulating cytokine receptors and ex vivo in-terleukin-1 receptor antagonist and interleukin-beta production but decreased tumour necrosis factor-alpha production after a 5-km run. European Journal of Clinical Investigation 28, 866-872
12. Drenth, J.P.H., Van Uum, S.H.M., Van Deuren, M., Pesman, G.J., Van Der Ven- Jongekrijg, J. and Van Der Meer, J.W.M (1995). En-durance run increases circulating IL-6 and IL-1ra but downregu-lates ex vivo TNF-alpha and IL-1beta production. Journal of Applied Physiology 79, 1497-1503
13. Emmanuel, G. and Lie, T (1996). Increased plasma levels of Interleukin-1 receptor antagonist (IL-1ra) following short maximal exercise. Chest 110, 63S
14. Gokhale, R., Chandrashekara, S. and Vasanthakumar, K.C (2007). Cytokine response to strenuous exercise in athletes and non-athletes-an adaptive response. Cytokine 40, 123-127
15. Gray, S.R., Robinson, M. and Nimmo, M.A (2008). Response of plasma IL-6 and its soluble receptors during submaximal exercise to fatigue in sedentary middle-aged men. Cell Stress and Chaper-ones 13, 247-251
16. Hasson, S.M., Daniels, J.C., Divine, J.G., Niebuhr, B.R., Richmond, S., Stein, P.G. and Williams, J.H (1993). Effect of ibuprofen use on muscle soreness, damage, and performance: A preliminary in-vestigation. Medicine and Science in Sports and Exercise 25, 9-17
17. Klentrou, P., Cieslak, T., Macneil, M., Vintinner, A. and Plyley, M (2002). Effect of moderate exercise on salivary immunoglobulin A and infection risk in humans. European Journal of Applied Physiology 87, 153-158
18. Moldoveanu, A.I., Shephard, R.J. and Shek, P.N (2000). Exercise ele-vates plasma levels but not gene expression of IL-1beta, IL-6, and TNF-alpha in blood mononuclear cells. Journal of Applied Physiology 89, 1499-1504
19. Moldoveanu, A.I., Shephard, R.J. and Shek, P.N (2001). The cytokine response to physical activity and training. Sports Medicine 31, 115-144
20. Nielsen, A.R. and Pedersen, B.K (2007). The biological roles of exer-cise-induced cytokines: IL-6, IL-8, and IL-15. Applied Physiology, Nutrition and Metabolism 32, 833-839
21. Nieman, D.C (1997). Immune response to heavy exertion. Journal of Applied Physiology, 82, 1385-1394
22. Nieman, D.C., Henson, D.A., Davis, J.M., Dumke, C.L., Utter, A.C., Murphy, E.A., Pearce, S., Gojanovich, G., Mcanulty, S.R. and Mcanulty, L.S (2006). Blood leukocyte mRNA expression for IL-10, IL-1Ra, and IL-8, but not IL-6, increases after exercise. Journal of Interferon and Cytokine Research 26, 668-674
23. Ostrowski, K., Rohde, T., Asp, S., Schjerling, P. and Pedersen, B.K (1999). Pro- and anti-inflammatory cytokine balance in strenu-ous exercise in humans. Journal of Physiology 515, 287-291
24. Ostrowski, K., Rohde, T., Asp, S., Schjerling, P. and Pedersen, B.K (2001). Chemokines are elevated in plasma after strenuous exer-cise in humans. European Journal of Applied Physiology 84, 244-245
25. Ostrowski, K., Rohde, T., Zacho, M., Asp, S. and Pedersen, B.K (1998). Evidence that interleukin-6 is produced in human skeletal mus-cle during prolonged running. Journal of Physiology 508, 949-953
26. Pedersen, B.K., Steensberg, A., Fischer, C., Keller, C., Keller, P., Plomgaard, P., Febbraio, M. and Saltin, B (2003). Searching for the exercise factor: Is IL-6 a candidate? . Journal of Muscle Research and Cell Motility 24, 113-119
27. Pedersen, B.K., Steensberg, A., Fischer, C., Keller, C., Keller, P., Plomgaard, P., Wolsk-Petersen, E. and Febbraio, M (2004). The metabolic role of IL-6 produced during exercise: Is IL-6 an ex-ercise factor? . Proceedings of the Nutrition Society 63, 263-267
28. Pedersen, B.K. and Toft, A.D (2000). Effects of exercise on lympho-cytes and cytokines. British Journal of Sports Medicine 34, 246-51
29. Petersen, A.M.W. and Pedersen, B.K (2005). The anti-inflammatory effect of exercise. Journal of Applied Physiology 98, 1154-1162
30. Petersen, A.M.W. and Pedersen, B.K (2006). The role of IL-6 in mediat-ing the anti-inflammatory effects of exercise. Journal of Physi-ology and Pharmacology 57, 43-51
31. Ploeger, H.E., Takken, T., De Greef, M.H. and Timmons, B.W (2009). The effects of acute and chronic exercise on inflammatory markers in children and adults with a chronic inflammatory dis-ease: a systematic review. Exercise Immunology Review 15, 6-41
32. Punzón, C., Alcaide, A. and Fresno, M (2003). In vitro anti-inflammatory activity of Phlebodium decumanum. Modulation of tumor necrosis factor and soluble TNF receptors. International Immunopharmacology 3, 1293-1299
33. Ronsen, O., Lea, T., Bahr, R. and Pedersen, B.K (2002). Enhanced plasma IL-6 and IL-1ra responses to repeated vs. single bouts of prolonged cycling in elite athletes. Journal of Applied Physiol-ogy 92, 2547-2553
34. Ruth, J.H., Bienkowski, M., Warmington, K.S., Lincoln, P.M., Kunkel, S.L. and Chensue, S.W (1996). IL-1 receptor antagonist (IL-1ra) expression, function, and cytokine-mediated regulation during mycobacterial and schistosomal antigen-elicited granuloma formation. Journal of Immunology 156, 2503-2509
35. Sigal, L. and Ron, Y (1994). Immunology and inflammation. Basic mechanisms and clinical consequences. New York, McGraw Hill
36. Steensberg, A (2003). The role of IL-6 in exercise-induced immune changes and metabolism. Exercise Immunology Review 9, 40-47
37. Suzuki, K., Nakaji, S., Yamada, M., Totsuka, M., Sato, K. and Suga-wara, K (2002). Systemic inflammatory response to exhaustive exercise. Cytokine kinetics. Exercise Immunology Review 8, 6-48
38. Suzuki, K., Yamada, M., Kurakake, S., Okamura, N., Yamaya, K., Liu, Q., Kudoh, S., Kowatari, K., Nakaji, S. and Sugawara, K (2000). Circulating sytokines and hormones with immunosup-pressive but neutrophil-priming potentials rise after endurance exercise in humans. European Journal of Applied Physiology 81, 281-287
39. Tilg, H., Dinarello, C.A. and Mier, J.W (1997). IL-6 and APPs: Anti-inflammatory and immunosuppressive mediators. Immunology Today 18, 428-432
40. Tuominen, M., Bohlin, L. and Rolfsen, W (1991). Anti-inflammatory and immunomodulatory activity of the fern Polypodium de-cumanum. Planta Medica 58, 306-310
41. Vasänge, M., Rolfsen, W. and Bohlin, L (1997). A sulphonoglycolipid from the fern Polypodium decumanum and its effect on the platelet activating-factor receptor in human neutrophils. Journal of Pharmacy and Pharmacology 49, 562-566
42. Vasänge, M., Tuominen, M., Perera-Ivarsson, P., Shen, J., Bohlin, L. and Rolfsen, W (1994). The fern Polypodium decumanum, used in the treatment of psoriasis, and its fatty acid constituents as inhibitors of leukotriene B4 formation. Prostaglandins Leukotrienes and Essential Fatty Acids 50, 279-284
43. Villarrubia, V.G., Moreno Koch, M.C., Calvo, C., González, S. and Alvarez-Mon, M (1997). The immunosenescent phenotype in mice and humans can be defined by alterations in the natural immunity reversal by immunomodulation with oral AM3. Immunopharmacology and Immunotoxicology 19, 53-74
44. Agha Alinejad, H. and Molanouri Shamsi, M (2010). Exercise induced release of cytokines from skeletal muscle: Emphasis on IL-6. Iranian Journal of Endocrinology and Metabolism, 12, 181-190
45. Bruunsgaard, H., Galbo, H., Halkjaer-Kristensen, J., Johansen, T.L., Maclean, D.A. and Pedersen, B.K (1997). Exercise-induced in-crease in serum inferleukin-6 in humans is related to muscle damage. Journal of Physiology 499, 833-841
46. Brzycki, M (1993). Strength testing. Predicting a one-rep max from reps-to-fatigue. Journal of Physical Education, Recreation & Dance 64, 88-90
47. Ciliberti, E., Carambia, L., Cavallin, S., Cerda, O.L., Poderoso, J.J. and Rabinovich, G.A (2009). Tolerance and autoimmunity. Novel therapeutic approaches. Conceptos emergentes de tolerancia y autoinmunidad: Nuevos enfoques terapeuticos 69, 460-465. (In Spanish)
48. Cordova, A. and Alvarez-Mon, M (1999). Immune system (I): General concepts, adaptation to physical exercise and clinical implica-tions (El sistema inmune (I): Conceptos generales, adaptacion al ejercicio fisico e implicaciones clínicas). Archivos de Medicina del Deporte 69, 47-54. (In Spanish)
49. Cordova, A. and Alvarez-Mon, M (1999). Immune system (II): Effect of immunomodulators in recovery of sportsmen (El sistema inmune (II): Importancia de los inmunomoduladores en la recuperacion del deportista). Archivos de Medicina del Deporte 70, 155-165. (In Spanish)
50. Córdova, A., Sureda, A., Tur, J.A. and Pons, A (2010). Immune re-sponse to exercise in elite sportsmen during the competitive sea-son. Journal of Physiology and Biochemistry 66, 1-6
51. Cordova Martinez, A., Monserrat, J., Villa, G., Reyes, E. and Soto, M.A.M (2006). Effects of AM3 (Inmunoferon®) on increased serum concentrations of interleukin-6 and tumour necrosis factor receptors I and II in cyclists. Journal of Sports Sciences 24, 565-573
52. Croft, L., Bartlett, J.D., Maclaren, D.P.M., Reilly, T., Evans, L., Mattey, D.L., Nixon, N.B., Drust, B. and Morton, J.P (2009). High-intensity interval training attenuates the exercise-induced in-crease in plasma IL-6 in response to acute exercise. Applied Physiology, Nutrition and Metabolism 34, 1098-1107
53. Dam, B.V. and Pruimboom, L (1992). Un nuevo test en tenis. Revista de Entrenamiento Deportivo 6, 29-33. (In Spanish)
54. Drenth, J.P.H., Krebbers, R.J.M., Bijzet, J. and Van Der Meer, J.W.M (1998). Increased circulating cytokine receptors and ex vivo in-terleukin-1 receptor antagonist and interleukin-beta production but decreased tumour necrosis factor-alpha production after a 5-km run. European Journal of Clinical Investigation 28, 866-872
55. Drenth, J.P.H., Van Uum, S.H.M., Van Deuren, M., Pesman, G.J., Van Der Ven- Jongekrijg, J. and Van Der Meer, J.W.M (1995). En-durance run increases circulating IL-6 and IL-1ra but downregu-lates ex vivo TNF-alpha and IL-1beta production. Journal of Applied Physiology 79, 1497-1503
56. Emmanuel, G. and Lie, T (1996). Increased plasma levels of Interleukin-1 receptor antagonist (IL-1ra) following short maximal exercise. Chest 110, 63S
57. Gokhale, R., Chandrashekara, S. and Vasanthakumar, K.C (2007). Cytokine response to strenuous exercise in athletes and non-athletes-an adaptive response. Cytokine 40, 123-127
58. Gray, S.R., Robinson, M. and Nimmo, M.A (2008). Response of plasma IL-6 and its soluble receptors during submaximal exercise to fatigue in sedentary middle-aged men. Cell Stress and Chaper-ones 13, 247-251
59. Hasson, S.M., Daniels, J.C., Divine, J.G., Niebuhr, B.R., Richmond, S., Stein, P.G. and Williams, J.H (1993). Effect of ibuprofen use on muscle soreness, damage, and performance: A preliminary in-vestigation. Medicine and Science in Sports and Exercise 25, 9-17
60. Klentrou, P., Cieslak, T., Macneil, M., Vintinner, A. and Plyley, M (2002). Effect of moderate exercise on salivary immunoglobulin A and infection risk in humans. European Journal of Applied Physiology 87, 153-158
61. Moldoveanu, A.I., Shephard, R.J. and Shek, P.N (2000). Exercise ele-vates plasma levels but not gene expression of IL-1beta, IL-6, and TNF-alpha in blood mononuclear cells. Journal of Applied Physiology 89, 1499-1504
62. Moldoveanu, A.I., Shephard, R.J. and Shek, P.N (2001). The cytokine response to physical activity and training. Sports Medicine 31, 115-144
63. Nielsen, A.R. and Pedersen, B.K (2007). The biological roles of exer-cise-induced cytokines: IL-6, IL-8, and IL-15. Applied Physiology, Nutrition and Metabolism 32, 833-839
64. Nieman, D.C (1997). Immune response to heavy exertion. Journal of Applied Physiology, 82, 1385-1394
65. Nieman, D.C., Henson, D.A., Davis, J.M., Dumke, C.L., Utter, A.C., Murphy, E.A., Pearce, S., Gojanovich, G., Mcanulty, S.R. and Mcanulty, L.S (2006). Blood leukocyte mRNA expression for IL-10, IL-1Ra, and IL-8, but not IL-6, increases after exercise. Journal of Interferon and Cytokine Research 26, 668-674
66. Ostrowski, K., Rohde, T., Asp, S., Schjerling, P. and Pedersen, B.K (1999). Pro- and anti-inflammatory cytokine balance in strenu-ous exercise in humans. Journal of Physiology 515, 287-291
67. Ostrowski, K., Rohde, T., Asp, S., Schjerling, P. and Pedersen, B.K (2001). Chemokines are elevated in plasma after strenuous exer-cise in humans. European Journal of Applied Physiology 84, 244-245
68. Ostrowski, K., Rohde, T., Zacho, M., Asp, S. and Pedersen, B.K (1998). Evidence that interleukin-6 is produced in human skeletal mus-cle during prolonged running. Journal of Physiology 508, 949-953
69. Pedersen, B.K., Steensberg, A., Fischer, C., Keller, C., Keller, P., Plomgaard, P., Febbraio, M. and Saltin, B (2003). Searching for the exercise factor: Is IL-6 a candidate? . Journal of Muscle Research and Cell Motility 24, 113-119
70. Pedersen, B.K., Steensberg, A., Fischer, C., Keller, C., Keller, P., Plomgaard, P., Wolsk-Petersen, E. and Febbraio, M (2004). The metabolic role of IL-6 produced during exercise: Is IL-6 an ex-ercise factor? . Proceedings of the Nutrition Society 63, 263-267
71. Pedersen, B.K. and Toft, A.D (2000). Effects of exercise on lympho-cytes and cytokines. British Journal of Sports Medicine 34, 246-51
72. Petersen, A.M.W. and Pedersen, B.K (2005). The anti-inflammatory effect of exercise. Journal of Applied Physiology 98, 1154-1162
73. Petersen, A.M.W. and Pedersen, B.K (2006). The role of IL-6 in mediat-ing the anti-inflammatory effects of exercise. Journal of Physi-ology and Pharmacology 57, 43-51
74. Ploeger, H.E., Takken, T., De Greef, M.H. and Timmons, B.W (2009). The effects of acute and chronic exercise on inflammatory markers in children and adults with a chronic inflammatory dis-ease: a systematic review. Exercise Immunology Review 15, 6-41
75. Punzón, C., Alcaide, A. and Fresno, M (2003). In vitro anti-inflammatory activity of Phlebodium decumanum. Modulation of tumor necrosis factor and soluble TNF receptors. International Immunopharmacology 3, 1293-1299
76. Ronsen, O., Lea, T., Bahr, R. and Pedersen, B.K (2002). Enhanced plasma IL-6 and IL-1ra responses to repeated vs. single bouts of prolonged cycling in elite athletes. Journal of Applied Physiol-ogy 92, 2547-2553
77. Ruth, J.H., Bienkowski, M., Warmington, K.S., Lincoln, P.M., Kunkel, S.L. and Chensue, S.W (1996). IL-1 receptor antagonist (IL-1ra) expression, function, and cytokine-mediated regulation during mycobacterial and schistosomal antigen-elicited granuloma formation. Journal of Immunology 156, 2503-2509
78. Sigal, L. and Ron, Y (1994). Immunology and inflammation. Basic mechanisms and clinical consequences. New York, McGraw Hill
79. Steensberg, A (2003). The role of IL-6 in exercise-induced immune changes and metabolism. Exercise Immunology Review 9, 40-47
80. Suzuki, K., Nakaji, S., Yamada, M., Totsuka, M., Sato, K. and Suga-wara, K (2002). Systemic inflammatory response to exhaustive exercise. Cytokine kinetics. Exercise Immunology Review 8, 6-48
81. Suzuki, K., Yamada, M., Kurakake, S., Okamura, N., Yamaya, K., Liu, Q., Kudoh, S., Kowatari, K., Nakaji, S. and Sugawara, K (2000). Circulating sytokines and hormones with immunosup-pressive but neutrophil-priming potentials rise after endurance exercise in humans. European Journal of Applied Physiology 81, 281-287
82. Tilg, H., Dinarello, C.A. and Mier, J.W (1997). IL-6 and APPs: Anti-inflammatory and immunosuppressive mediators. Immunology Today 18, 428-432
83. Tuominen, M., Bohlin, L. and Rolfsen, W (1991). Anti-inflammatory and immunomodulatory activity of the fern Polypodium de-cumanum. Planta Medica 58, 306-310
84. Vasänge, M., Rolfsen, W. and Bohlin, L (1997). A sulphonoglycolipid from the fern Polypodium decumanum and its effect on the platelet activating-factor receptor in human neutrophils. Journal of Pharmacy and Pharmacology 49, 562-566
85. Vasänge, M., Tuominen, M., Perera-Ivarsson, P., Shen, J., Bohlin, L. and Rolfsen, W (1994). The fern Polypodium decumanum, used in the treatment of psoriasis, and its fatty acid constituents as inhibitors of leukotriene B4 formation. Prostaglandins Leukotrienes and Essential Fatty Acids 50, 279-284
86. Villarrubia, V.G., Moreno Koch, M.C., Calvo, C., González, S. and Alvarez-Mon, M (1997). The immunosenescent phenotype in mice and humans can be defined by alterations in the natural immunity reversal by immunomodulation with oral AM3. Immunopharmacology and Immunotoxicology 19, 53-74
Cita Original
Jose A. Gonzalez-Jurado, Francisco Pradas, Edgardo S. Molina and Carlos de Teresa. Effect of Phlebodium Decumanum on the Immune Response Induced By Training in Sedentary University Students. Journal of Sports Science and Medicine (2011) 10, 315 - 321
Cita en PubliCE
José A. González-Jurado, Francisco Pradas, Edgardo S. Molina Carlos de Teresa (2011). Efecto de la Ingesta de Phlebodium Decumanum sobre la Respuesta Inmunológica Inducida por el Entrenamiento en Estudiantes Universitarios Sedentarios. .https://g-se.com/efecto-de-la-ingesta-de-phlebodium-decumanum-sobre-la-respuesta-inmunologica-inducida-por-el-entrenamiento-en-estudiantes-universitarios-sedentarios-1417-sa-e57cfb2720b1bb
