Efecto de la Administración de Eritropoyetina Recombinante Humana (EPOrHu) en los Niveles Séricos del Receptor Soluble de Transferrina (RST) y en el Rendimiento en Ciclismo
Káre I. Birkeland, Jim Stray-Gundersen, Peter Hemmersbach, Jostein Hallen, Egil Haug, Roald Bahr0 Hormone Laboratory, Aker University Hospital and Norwegian University of Sport and Physical Education, Oslo, Noruega
Resumen
Objetivo: Evaluamos la posibilidad de usar el receptor soluble de la transferrina (RST) como indicador de dopaje con eritropoyetina recombinante humana (EPOrHu). Métodos: Realizamos un estudio con atletas varones en doble-ciego, controlado con placebo, en el cual administramos 5000 U de EPOrHu (N = 10) o un placebo (N = 10) tres veces por semana (181-232 U kg-1 sem-1) durante 4 semanas. Durante el estudio medimos el hematocrito, la concentración de hemoglobina, el receptor soluble de transferrina (RST), los niveles de ferritina, eritropoyetina (EPO) y cuantificamos los efectos sobre el rendimiento a través de la medición del tiempo hasta el agotamiento y el consumo de oxígeno máximo (VO2max) en una bicicleta ergométrica. Resultados: El hematocrito aumentó de 42,7±1,6% a 50,8±2,0% en el grupo que consumió EPO y alcanzó un valor máximo un día después de que el tratamiento finalizara. En el grupo EPO, se observó un aumento en el RST (de 3,1±0,9 a 6,3±2,3 mg L-1, P<0,001) y en la relación entre el RST y ferritina (RST/ferritina) (varió de 3,2±1,6 a 11,8±5,1, P<0,001). El aumento del RST fue significativo después de una semana de tratamiento y se mantuvo por una semana después del tratamiento (Post). Los valores individuales del RST a lo largo del período de estudio demostraron que 8 de cada 10 sujetos que consumieron EPOrHU, pero ninguno de los sujetos del grupo placebo, presentaron niveles de RST que superaron el intervalo de confianza de 95% fijado para todos los sujetos al inicio del estudio (= 4,6 mg L-1). En el grupo EPO el VO2max aumentó de un valor de 63,6±4,5 mL kg-1 min-1 determinado antes de la administración a un valor de 68,1±5,4 mL kg-1 min-1 2 días después de la administración de EPOrHU (7 % de aumento, P=0,001). No se observaron cambios en el hematocrito, RST, RST/ferritina ni enVO2max en el grupo placebo. Conclusión: Los niveles séricos de RST pueden ser utilizados como un marcador indirecto de una eritropoyesis fuera de lo normal hasta una semana después de la administración de EPOrHU, pero los efectos en el rendimiento de resistencia tienen una duración mayor a la del aumento en el RST.
Palabras Clave: EPOrHu, consumo de oxigeno máximo, ferritina, hematocrito
INTRODUCCION
Los nuevos desarrollos en la farmacología y en los tratamientos clínicos frecuentemente conducen a un uso incorrecto de estos agentes para mejorar el rendimiento deportivo. Poco tiempo después de que la eritropoyetina humana recombinante (EPOrHu) estuviera disponible para el tratamiento de la anemia, comenzaron a circular rumores que estaba siendo utilizada indebidamente en los deportes de resistencia (8). Por lo tanto la hormona peptídica fue prohibida a partir de 1990 por el Comité Internacional de los Juegos Olímpicos (16), pero no se contaba con ningún método analítico para detectar el uso indebido de la misma. Desde entonces, se han explorado muchos métodos para detectar la administración de EPOrHu (4). Entre estos se incluyen la prueba directa de administración de EPOrHu a través de la identificación de EPOrHu en sangre u orina (20, 21) y el análisis de parámetros indirectos de estimulación de eritropoyesis como el recuento de reticulocitos, el número de macrocitos hipocrómicos (6) y los niveles séricos del receptor soluble de transferrina (RST) (1, 2, 7, 13, 14). Gareau y colaboradores (13) demostraron previamente que un tratamiento con una alta dosis de EPOrHu a corto plazo producía un aumento significativo en la concentración sérica del RST y en la relación entre RST y ferritina, y recientemente los autores confirmaron esto usando dosis mas bajas durante un plazo mayor (1). Los autores sugirieron que un nivel elevado de RST o RST/ferritina en el suero puede ser utilizado como indicador de dopaje con EPOrHu.
Un problema adicional al desarrollo de un test de detección de administración de EPOrHu en atletas es la posibilidad que la duración del efecto sobre el rendimiento sea mayor que la duración de cualquier cambio hematológico asociado con el uso indebido de la EPOrHu. El mecanismo probable por el cual la EPOrHu mejoraría el rendimiento es la estimulación de la eritropoyesis que aumenta la cantidad de glóbulos rojos circulantes, la concentración de hemoglobina y el contenido de oxígeno en las arterias (11, 12). Este aumento en el contenido de oxígeno de las arterias conduce a un aumento en el consumo de oxígeno máximo en los atletas altamente entrenados (9, 10, 19). En aquellos eventos deportivos que dependen del consumo de oxígeno máximo, el rendimiento mejora (5, 22). Una vez que la administración de EPOrHu se interrumpe, la cantidad de glóbulos rojos regresa gradualmente a los niveles originales pero esto puede demorar semanas (10). Como resultado, se puede producir “una ventana abierta” donde no se observa ninguna evidencia de uso indebido de EPOrHu pero el rendimiento se incrementa. Además, la mayor cantidad de glóbulos rojos puede permitirle al atleta mantener un estímulo de entrenamiento mayor, algo que permitiría una mejora subsiguiente en el rendimiento bastante alejada en el tiempo del momento en que existía evidencia del uso indebido de EPOrHu.
El objetivo del estudio presente consistió en documentar los cambios en el RST durante 4 semanas de administración de dosis moderadas de EPOrHu en atletas saludables, altamente entrenados de sexo masculino siguiendo una metodología de administración en doble ciego y controlada con placebo. Además quisimos cuantificar los efectos de la administración de EPOrHu en el consumo de oxígeno máximo. Finalmente, buscamos establecer la evolución en el tiempo de los cambios en el consumo de oxígeno máximo y RST después de la administración de EPOrHu para determinar en qué momento del proceso de dopaje es posible utilizar el RST para reflejar el uso indebido de EPOr Hu.
MÉTODOS
En el estudio participaron voluntariamente veinte atletas varones saludables, altamente entrenados provenientes de disciplinas como ciclismo, orientación, running, triatlón, natación y esquí a campo traviesa. El criterio de inclusión fue: Tener parámetros hematológicos normales, entre los que se incluía un hematocrito entre 38 y 45% y un valor de ferritina sérica dentro del rango de referencia normal de nuestro laboratorio (25-200 µg L-1); no poseer antecedentes de enfermedad tromboembólica o hipertensión; y ningún otro factor de riesgo conocido de enfermedad cardiovascular. Durante el período de cribado realizado antes del estudio, todos los participantes realizaron un examen médico que contempló la obtención de una muestra de sangre y de orina, una prueba de familiarización y un test de ejercicio máximo. Las pruebas se realizaron en una bicicleta ergométrica con freno mecánico (Monark Ergomedic 83 9E, Varberg, Suecia), y en las mismas se determinó el consumo de oxígeno y el tiempo hasta el agotamiento. Los sujetos fueron asignados al azar al grupo EPO (N=10; edad: 23±2 años; talla: 181±6 centímetros; peso: 73±6 kg; consumo de oxígeno máximo: 63,3±3,9 mL kg-1-min-1) o a un grupo placebo (N=10; edad: 25±4 años; talla: 182±8 centímetros; peso: 75±4 kg; consumo de oxígeno máximo: 60,7±4,4 mL kg-1-min-1) con apareamiento en función del tipo de deporte y nivel de entrenamiento.
La asignación a los grupos se realizó en doble ciego con cegamiento para los participantes y técnicos e investigadores que participaron en los muestreos de sangre, los análisis de las muestras y los tests de ejercicio. Los participantes recibieron 5000 U de EPOrHu (181-232 U kg-1 sem-1) (Recormon, Boehringer Mannheim GmbH, Mannheim, Alemania) o un placebo (1 mL NaCl 9 g L-1) de manera subcutánea tres veces por semana durante 30 días, o hasta que el hematocrito fuera ≥50%, momento en cual se interrumpían las inyecciones. A partir de allí se realizó un seguimiento durante 4 semanas con pruebas de sangre repetidas y tests de ejercicios. Todos los sujetos, incluyendo a los individuos que recibieron el placebo, recibieron suplementación con hierro en forma oral con 270 mg-d-1 de Fe2+ en forma líquida (Neo-Fer, Nycomed Pharma AS, Oslo, Noruega). Los sujetos, incluso los que recibieron el placebo, recibieron información por escrito y de manera oral y firmaron un consentimiento informado antes de participar en el estudio. El estudio fue aprobado por el Comité de Ética Regional del Concilio de Investigación Noruego para las Ciencias y Humanidades, y por la Autoridad de Control de Medicamentos de Noruega. El estudio también fue aprobado por el Comité Olímpico de Noruega y por la Confederación de Deportes y los sujetos no participaron en competencias nacionales durante el tiempo en que se realizó el estudio (es decir, durante el período de administración de EPOrHu y durante hasta por lo menos 4 semanas después de recibir la última inyección). Ninguno de los sujetos participó en competencias internacionales durante 3 meses después del estudio. Ningún sujeto se enfermó y necesitó medicación durante el estudio.
Análisis de sangre.
Las muestras de sangre se obtuvieron inmediatamente antes del comiendo del tratamiento y luego de esto, tres veces semanalmente durante el período de tratamiento, en los primeros 5 días después de interrumpir el tratamiento y dos veces semanalmente durante el resto de las 4 semanas del período de seguimiento. Los participantes arribaron al laboratorio antes del entrenamiento entre las 7 y las 9 de la mañana y permanecieron sentados quietos durante 20 min hasta que les realizaran la extracción de sangre de una vena antecubital. Dos mL de sangre se colocaron en tubos con EDTA para determinar la concentración de hemoglobina y el hematocrito con un Contador de Células Sysmex K-100 (Toa Médical Electronic Comp. S.A., Kobe, Japón) con coeficientes de variación entre ensayos (CV) <3%. Además se extrajeron muestras de sangre de 5-mL para la extracción de suero; para lo cual se las dejó coagular y a continuación se retiró el suero que fue colocado a -20°C hasta el análisis. Se midió la concentración de EPO en el suero mediante un método de inmunoquimioluminiscencia (Nichols Inst. Diagnostics, San Juan Capistrano, CA) con coeficientes de variación intra e inter ensayo de 4-12%. La concentración sérica de RST se determinó con un método inmunoenzymático (Orion Diagnostica, Espoo, Finlandia) y también mediante un método de inmunoensayo enzimático (Ramco Laboratories Inc., Houston, TX), ambos métodos con un coeficiente de variación inter ensayo <10%. Todos los resultados de RST presentados en este trabajo de investigación fueron obtenidos usando el método Orion. La concentración sérica de ferritina se midió con un método estándar mediante un analizador Cobas Bio (Basilea, Suiza) que presentaba un coeficiente de variación inter ensayo <5%. Todas las muestras de un individuo fueron analizadas en una sola corrida analítica.
Tests de ejercicio.
Después de una entrada en calor de 5 a 10-minutos, los sujetos pedalearon hasta el agotamiento en una bicicleta ergométrica con freno electrónico. La carga de trabajo inicial se fijó en 100 W y aumentó 50 W cada 2 min hasta el agotamiento volitivo. Los participantes debían mantener una cadencia de 85-95 rpm, y si la cadencia disminuía por debajo de 75 rpm, la prueba se detenía y se registraba el tiempo hasta el agotamiento. Los gases expirados se recolectaron en tres a cinco bolsas de Douglas de manera continua durante los últimos 3-4 minutos de la prueba. El volumen se determinó mediante un espirómetro (KL Engineering, Northridge, CA). Las concentraciones del aire de la habitación y de los gases expirados se midieron por espectrometría de masa (Perkin-Elmer MGA 1100, St. Louis, MO). La temperatura y la presión de la bolsa fueron registradas. La bolsa de por lo menos 45 segundos que presentaba el mayor valor de consumo de oxígeno se designó como consumo de oxígeno máximo. Los análisis post test del cociente respiratorio (>1,1) y de frecuencia cardíaca (dentro del 5% del máximo estimado para la edad) fueron utilizados como criterio adicional para confirmar que se había alcanzado el consumo de oxígeno máximo. Adicionalmente, se analizó la relación consumo de oxígeno-producción de potencia para determinar si se había alcanzado un plateau en el consumo de oxígeno.
Análisis estadístico
Los valores se presentan en forma de Media±SD. Para cada variable de interés se realizó un análisis de la varianza. Se realizaron test t post hoc en aquellos casos en que se observaran interacciones significativas. Para analizar la correlación se calculó el coeficiente de Pearson. Generalmente se presentan los valores de P exactos y valores P<0,05 fueron considerados significativos.
RESULTADOS
En el grupo EPO dos sujetos debieron interrumpir el tratamiento antes del día 30 (después de los días 17 y 23) porque alcanzaron el hematocrito ≥50% que se fijó como nivel de corte. Las inyecciones de sus pares correspondientes (grupo control) también se detuvieron. En el grupo EPO el valor del hematocrito se incrementó desde 42,7±1,6% al comienzo del estudio hasta 50,8±2,0% (P <0,001) un día post tratamiento (Figura 1). Todos los sujetos que recibieron el tratamiento con EPO alcanzaron un hematocrito≥50% durante el tratamiento o durante los días 1-5 en el período post tratamiento. No se observaron cambios en el hematocrito en el grupo placebo.
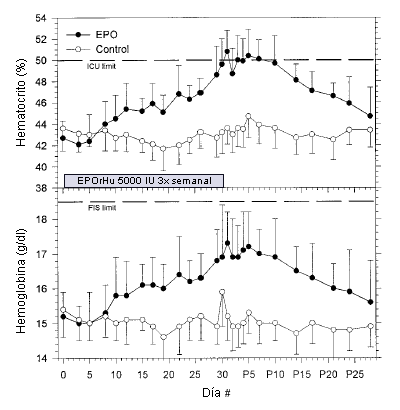
Figura 1. Valores de hematocrito (panel superior) y hemoglobina (panel inferior) de los sujetos del grupo que recibió tratamiento con EPOrHu (círculos negros, N = 10) y del grupo control (círculos blancos, N = 10) durante el tratamiento (días 1-30) y durante el período post tratamiento (días P1-P28). Los valores se expresan en forma de Media ±SD. Las líneas punteadas señalan los límites pre-competencias fijados por la Unión Internacional de Ciclismo (UCI) para el hematocrito (hematocrito = 50%) y por la Federación de Esquí Internacional (FIS) para la hemoglobina (hemoglobina = 18,5 g L-1).
En el grupo EPO, los niveles séricos de RST aumentaron durante el tratamiento pasando de 3,1±0,9 a 6,3±2,3 mg-L-1 (P <0,001) mientras que en el grupo placebo no cambiaron (Figura 2). El aumento en el RST fue significativo después de una semana de tratamiento y se mantuvo durante dos semanas después de que se interrumpió el tratamiento. Los niveles de ferritina se redujeron durante el tratamiento con EPO pasando de 109±62 a 41±17 µg L-1 (P=0,007) a pesar de la suplementación con hierro. Los niveles de ferritina no cambiaron en el grupo placebo (Figura 2). La relación entre RST y la ferritina (X100) aumentó de 3,2±1,6 a 11,8±5,1 (P <0,001) en el grupo EPO y no cambió en el grupo placebo (Figura 2).
Los valores individuales del RST durante el período de estudio demostraron que 8 de 10 sujetos adquirieron niveles de RST que superaron el intervalo de confianza (IC) de 95% para todos los sujetos al inicio (= 4,6 mg L-1) cuando el tratamiento se detuvo, y 7 de 10 superaron el IC de 99% (=5,4 mg L-1). Ninguno de los sujetos pertenecientes al grupo placebo presentó valores por encima de estos niveles.
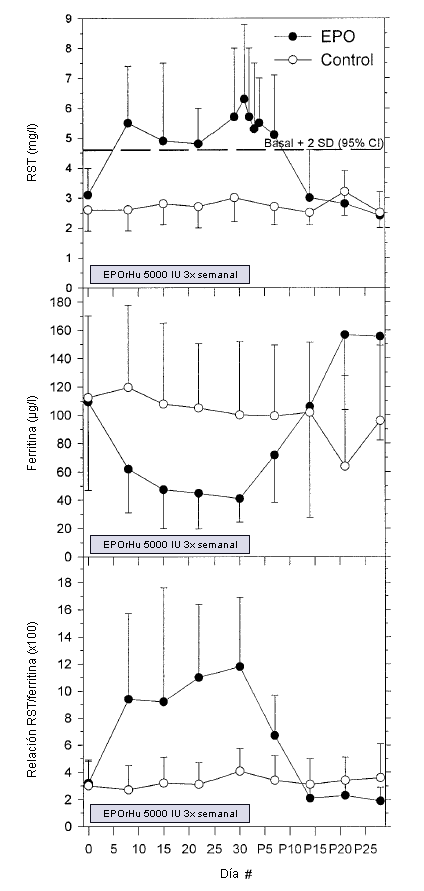
Figura 2. Valores de concentración de receptor soluble de transferrina (RST; panel superior), concentración de ferritina (panel central), y RST-ferritina (X100; panel inferior) para los sujetos tratados con EPOrHu (círculos negros, N = 10) y sujetos del grupo control (círculos blancos, N = 10) durante el tratamiento (días 1-30) y durante el período post tratamiento (días P1-P28). Los datos se presentan en forma de Media (±SD). La línea punteada en el panel superior muestra la media +2 SD (95% CI) obtenida con todos los sujetos al inicio del estudio (= 4,6 mg L-1).
Durante el tratamiento el consumo de oxígeno máximo aumentó significativamente en el grupo EPO, tanto en comparación con el grupo control como en comparación con los valores iniciales (Figura 3). El consumo de oxígeno máximo inicial del grupo EPO fue 63,3±3,9 mL kg-1 min-1 y aumentó a 68,1±5,4 mL kg-1 min-1 un día después del tratamiento (P=0,001 versus el valor inicial).
El cambio desde el valor inicial (comienzo del estudio) hasta el valor obtenido un día después del tratamiento fue + 4,9±3,2 mL kg-1 min-1 en el grupo EPO y +0,6±1,9 mL kg-1 min-1 en el grupo placebo (P<0,003 versus grupo EPO). No se observaron cambios en el peso corporal en ningún grupo. El consumo de oxígeno máximo presentó una leve tendencia hacia un aumento aunque no significativo en el grupo placebo durante el período del estudio (Figura 3). En el grupo EPO el tiempo hasta el agotamiento aumentó de un valor de 12,8±1,0 min observado al comienzo del estudio a un valor de 14,0±1,4 min determinado un día después del tratamiento (P <0,0001) mientras que en el grupo control la variación fue de 13,1±1,5 min a 13,3±1,5 min (P= 0,04).

Figura 3. Valores del consumo de oxígeno máximo (barras) y tiempo hasta el agotamiento (círculos) de los sujetos que recibieron EPOrHu (barras ralladas/círculos negros, N = 10) y los sujetos del grupo control (símbolos blancos, N = 10) antes del tratamiento (día 0) y en el período post tratamiento (días P1-P28). Los datos se presentan en forma de Media (±SD)
Los niveles séricos de EPO obtenidos al inicio del estudio fueron 13,7±7,7 U L-1 en el grupo EPO y 9,7±6,2 U-L-1 en el grupo control (NS). Veinticuatro horas después de la última inyección la concentración sérica de EPO era 41,8±9,8 U L-1 (P <0,001 versus el valor obtenido al inicio), y se redujo a los niveles previos al tratamiento 48-72 h después de la última inyección (Figura 4).
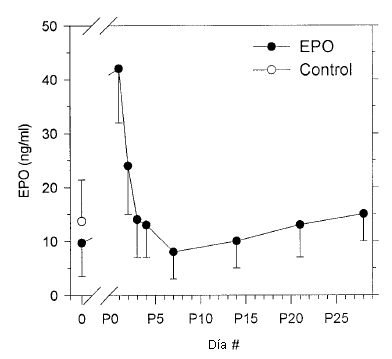
Figura 4. Niveles séricos de EPO en los participantes tratados con EPOr Hu (círculos negros, N = 10) antes del tratamiento (día 0) y durante el período post tratamiento (días P1-P28) y valores observados al inicio del estudio en el grupo control (círculos blancos, N = 10). Los valores se presentan en forma de Media (±SD)
Dado que resultados publicados previamente de las mediciones RST después de la administración de EPOrHu fueron obtenidos utilizando diferentes inmunoensayos (1, 13) y se ha demostrado que los diferentes inmunoensayos no arrojan resultados uniformes (18), nosotros también medimos el RST en nuestras 198 muestras de suero con el inmunoensayo Ramco. Aunque los resultados obtenidos con los dos métodos se correlacionaron significativamente (r=0,70, P <0,001, RSTORION = 0,7 x RSTRAMCO + 0,96), se encontraron diferencias considerables, y el límite para lo que se considera valores normales de RST debe ser definido por separado en cada ensayo. Sin embargo, no se observaron diferencias entre los dos inmunoensayos en los cambios en los niveles séricos de RST durante el tratamiento y en la sensibilidad para detectar la administración de EPOrHu.
DISCUSIÓN
El objetivo principal del estudio presente fue evaluar la eficacia y la evolución en el tiempo del receptor soluble de transferrina (RST) como marcador para el uso de EPOrHu en atletas y relacionarlo con una posible ventaja sobre el rendimiento. El valor sérico de RST se elevó después de 1 semana de tratamiento con EPOrHu y la elevación se mantuvo durante todo el tratamiento en 8 de los 10 participantes. Además, en 5 de 10 sujetos el RST siguió elevado durante 1 semana post tratamiento.
El consumo de oxígeno máximo y el tiempo hasta el agotamiento estuvieron significativamente elevados hasta por 3 semanas luego de la administración lo que proporcionaría una ventaja sobre el rendimiento en los deportes de resistencia. Estos datos indican una ventaja en el rendimiento durante por lo menos de 2 semanas posteriores a cualquier indicación de uso de EPOrHu. Existe una gran ventana abierta durante la cual la EPOrHu no es detectable por el método del RST y durante la cual el rendimiento de resistencia mejora enormemente. Por consiguiente, un valor normal de RST no nos permite descartar el uso de EPOrHu. Sin embargo, si se observa un valor elevado de RST, es una evidencia indirecta muy sólida del uso de EPOrHu. Esto demuestra que el RST puede ser utilizado como un indicador indirecto de dopaje con EPOrHu, aunque la especificidad de este método debe ser exhaustivamente investigada en un grupo grande de atletas bajo diferentes condiciones fisiológicas, por ejemplo, durante el entrenamiento en altitud.
Debido a la disminución en los niveles de ferritina, los cambios en la relación RST/ferritina fueron aun mas pronunciados que los niveles de RST. Sin embargo, el aumento en la relación RST/ferritina no fue tan pronunciado como el que se observó en un estudio previo (13). En este estudio, Gareau et al. administraron dosis de EPO más altas y no aportaron suplementación férrica lo que podría haber producido una reducción más pronunciada en la ferritina sérica y, por consiguiente, una diferencia más marcada entre el grupo control y el grupo que recibió el tratamiento. Es probable que atletas que usan EPOrHu para obtener una ventaja en el rendimiento también utilicen suplementos de hierro, y nosotros sugerimos que los niveles de RST por si solos pueden ser un parámetro más robusto que la relación RST/ferritina como indicador del uso de EPOrHu. En nuestro grupo placebo conformado por atletas saludables con niveles de ferritina normales, la suplementación con hierro no alteró los niveles medios de RST ni de ferritina durante el estudio. Sin embargo, nosotros no podemos descartar que dosis más grandes de hierro, sobre todo si son administradas intravenosamente, puedan provocar resultados diferentes. Por otra parte, no se observó ninguna correlación significativa entre los niveles de ferritina iniciales y los cambios observados en el RST durante el tratamiento con EPOrHu.
Las inyecciones repetidas de EPOrHu provocan un aumento en el hematocrito y en la concentración de hemoglobina que depende de la dosis y del tiempo (12). Ésta es la razón por la cual se utiliza la EPOrHu en la medicina clínica como tratamiento eficaz para la anemia causada por fallo renal, enfermedades inflamatorias y malignas, y para reforzar la eficacia de la donación de sangre autóloga antes de una operación (3). Éste también es el motivo para su potencial uso indebido como agente de dopaje para mejorar el rendimiento en los deportes de resistencia. El estudio presente es el primer estudio aleatorizado, controlado con placebo que demuestra que la administración de dosis moderadas de EPOrHu durante 4 sem incrementa significativamente el consumo de oxígeno máximo y el tiempo hasta el agotamiento en atletas de resistencia saludables, altamente entrenados. Estos datos son similares y confirman los resultados obtenidos en un estudio realizado sin cegamiento y no controlado con placebo (10). En una encuesta realizada 2 días después de haber finalizado el período de tratamiento, cuando el efecto sobre el hematocrito y el consumo de oxígeno máximo era máximo, sólo 5 de los 10 sujetos del grupo EPO respondieron que ellos suponían que habían recibido EPOrHu, tres informaron que creyeron que habían integrado el grupo placebo y dos no pudieron responder. Además se observó una mejora en el tiempo hasta el agotamiento en el grupo control, aunque no del mismo orden de magnitud que la mejora observada en el grupo EPO. Esto demuestra la importancia de un diseño con cegamiento y controlado con placebo.
Para evitar los potenciales riesgos para la salud y para combatir el dopaje, algunas federaciones deportivas internacionales impiden la participación en competencias de atletas con hematocritos o con niveles de hemoglobina que se encuentren por encima de ciertos límites. La Federación de Esquí Internacional (FIS) excluye a los atletas masculinos que poseen niveles de hemoglobina de 18,5 g 100 mL-1(que corresponde a un hematocrito de aproximadamente 56%), mientras que la Federación Internacional de Ciclismo (UCI), para la participación en las competencias ha fijado un límite para el hematocrito de 50%. Aunque los límites mantienen una cierta medida de seguridad para los atletas y limitan la magnitud de la ventaja sobre el rendimiento, la Figura 3 demuestra que los sujetos estaban en el límite de los valores que fija la UCI y ampliamente por debajo del límite fijado por FIS después de 4 semanas de haber recibido EPOrHu. Así, es posible obtener una mejora significativa en el rendimiento del consumo de oxígeno máximo a pesar de que el hematocrito y los niveles de hemoglobina se encuentren dentro de los límites fijados.
Nosotros no realizamos pruebas contrarreloj en este estudio para determinar si la mejora en el consumo oxígeno máximo se traduciría en una mejora real en el rendimiento en el campo y en diferentes disciplinas deportivas. Sin embargo, observamos un aumento de 10% en el tiempo hasta el agotamiento en la bicicleta ergométrica. En un estudio previo realizado por uno de los autores (15), un aumento en el hematocrito inducido por la altura de menos de la mitad de la magnitud observada en este estudio (4 semanas a 2500 m) permitió obtener un aumento de 1,5% en el rendimiento de prueba contrarreloj de 5000-m que persistió por lo menos 3 semanas después de haber dejado las condiciones de altitud. Aun cuando el grado de mejora en el rendimiento haya sido similar al efecto obtenido por la exposición a la altitud, claramente representaría la diferencia entre ganar una medalla o no en las competencias de nivel internacional.
Las inyecciones repetidas de EPOrHu producen varios cambios bien definidos en el cuerpo que pueden ser monitoreados por medio del análisis de una muestra de sangre. En los minutos y horas después de una inyección de EPOrHu, pueden medirse niveles altos de EPO en el suero (17), y también es posible detectar EPOrHu en la orina (21). Sin embargo, como la vida media en sangre después de las inyecciones intravenosas es relativamente corta y las variaciones entre los individuos son considerables, la simple medición de la concentración de EPO no es un método específico ni sensible para detectar el dopaje con EPOrHu (17). Algunos días después de la inyección de EPOrHu, se produce un aumento en el recuento de reticulocitos seguido por un aumento en el nivel de hemoglobina, en el hematocrito, y en la cantidad de glóbulos rojos (1). Además se produciría un aumento en los eritrocitos con un bajo contenido de hemoglobina (6), y un aumento en el nivel de RST (2, 7, 14). Previamente se ha demostrado mediante el método ELISA, que la administración de dosis altas de EPOrHu a seres humanos produce un aumento significativo en la concentración sérica de RST (13). En la actualidad este es uno de los parámetros indirectos más prometedores para indicar el uso de EPOrHu en atletas. Sin embargo, nuestros resultados demuestran que la sensibilidad del RST como indicador de la administración de EPOrHu es limitada. En dos individuos los niveles séricos de RST nunca aumentaron por encima de los valores medios +2 SD obtenidos al inicio, debido a un bajo nivel pre tratamiento y a que durante el tratamiento se produjo un aumento (de 1,3 a 3,6 mg L-1 y de 2,1 a 3,1 mg L-1, respectivamente). Aunque el valor medio de RST del grupo se mantuvo elevado 7 días después de la interrupción del tratamiento, cuando implementamos el nivel de corte de 4,6 mg L-1, sólo 5 de los 10 sujetos superaban este nivel en ese momento. Se necesitan estudios adicionales para poner a punto el método antes de que pueda ser utilizado para controlar el dopaje. Es necesario definir la variación fisiológica normal en poblaciones grandes y las variaciones debidas a la influencia de la elevada altitud, a las cámaras con baja presión de oxígeno, a la suplementación con hierro, al estado de entrenamiento, a las diferencias raciales y a otros estados fisiológicos y patológicos.
Además de las limitaciones en la sensibilidad y especificidad demostradas en el estudio presente, el método del RST es sólo un test indirecto de dopaje con EPOrHu. Wide y Bengtsson (20) presentaron en 1990 un método directo prometedor para distinguir entre EPO endógena y recombinante y posteriormente aportaron datos que podrían ser efectivos para determinar el uso indebido de EPOrHu (21). Sin embargo, es necesario realizar estudios adicionales para explorar los méritos del método de Wide y Bengtsson como método directo. Aun cuando este método sea exacto y práctico, las muestras deben ser obtenidas dentro de 48-72 h de la última inyección, pero los efectos sobre el rendimiento se mantienen durante un tiempo mucho mayor.
En resumen, nuestra investigación demuestra que la administración de EPOrHu necesaria para aumentar el hematocrito de 42,7% a 50,8% en atletas de resistencia pudo ser detectada por un aumento en RST en 80% de los atletas durante la administración de EPOrHu y en 50% de los atletas una semana después de la interrupción de la administración de EPOrHu. Además el consumo de oxígeno máximo, aumentó significativamente durante 3 semanas luego de la administración, lo que produjo una gran “ ventana abierta" en la cual la detección por este método es improbable y el rendimiento de resistencia mejora enormemente. Nosotros concluimos que la detección del uso de EPOrHu en atletas, con este o con otros marcadores, sólo será posible con tests realizados de manera aleatoria fuera de las competencias.
Agradecemos Raynald Gareau por las discusiones e ideas estimulantes durante la fase de planificación del estudio. El estudio fue subsidiado por el Comité Olímpico y Confederación de Deportes de Noruega, Boehringer Mannheim, y Nycomed Pharma AS. Agradecemos además la ayuda técnica de Kristine Fiskum, Bjarte Justnaes, Ørjan Kvalheim, Inger Myrland, Jeroen Oustein, Hidde van der Ploeg, Tone Rasmussen, Hanne Staff y Marit Stokkebø.
Referencias
1. Audran, M., R. Gareau, S. Matecki, et al. (1999). Effects of erythropoietin administration in training athletes and possible indirect detection in doping control. Med. Sci. Sports Exerc. 5:639-645.
2. Beguin, Y., H. A. Huebers, B. Josephson and C. A. Finch. (1988). Transferrin receptors in rat plasma. Proc. Nati. Acad. Sci. 85:637-640.
3. Bergstróm, J. (1993). New aspects of erythropoietin treatment. J. Intern. Med. 233:445-462,.
4. Birkeland, K, and P. Hemmersbach. (1999). Issues related to blood sampling in athletes for doping control. Sports Med. 28:25-30.
5. Buick, F. J., N. Gledhill, A. B. Froese, L. Spriet, and E. C. Meyers. (1980). Effect of induced erythrocythemia on aerobic work capacity. J. Appl. Physiol. 48:636-642.
6. Casoni, I., G. Ricci, E. Ballarin, et al. (1993). Hematological indices of erythropoietin administration in athletes. Int. J. Sports Med. 14: 307-311.
7. Cazzola, M., L. Ponchio, Y. Beguin, et al. (1992). Subcutaneous erythropoietin for treatment of refractory anemia in hematological disorders: results of a phase I/II clinical trial. Blood 79:29-37.
8. Erslev, A. (1987). Erythropoietin coming of age. N. Engl. J. Med. 316: 101-103,.
9. Ekblom, B., A. N. Goldbarg, and B. Gullbring. (1972). Response to exercise after blood loss and reinfusion. J. Appl. Physiol. 33:175-180.
10. Ekblom, B., and B. Berglund. (1991). Effect of erythropoietin administration on maximal aerobic power. Scand. J. Med. Sci. Sports 1:88-93.
11. Ekblom, B. (1996). Blood doping and erythropoietin: the effects of variation in hemoglobin concentration and other related factors on physical performance. Am. J. Sports Med. 24:S40-S42.
12. Erslev, A. J. (1991). Erythropoietin. N. Engl. J. Med. 324:1339-1344.
13. Gareau, R., M. Audran, R. D. Baynes, A. Duvallet, L. Senegal, and G. R. Brisson. (1996). Erythropoietin abuse in athletes. Nature 380: 113.
14. Huebers, H. A., Y. Beguin, P. Pootrakul, D. Einspahr, and C. A. Finch. (1990). Intact transferrin receptors in human plasma and their relation on erythropoiesis. Blood 75:102-107.
15. Levine, B. D., and J. Stray-Gundersen. (1997). "Living high-training low": effect of moderate-altitude acclimatization with low-altitude training on performance. J. Appl. Physiol. 83:102-112.
16. Olympic Movement Anti-Doping Code. (1999). International Olympic Committee, Lausanne, Switzerland, appendix A, ISBN 92-9149-054-7, pp. 32-43
17. Souillard, A., M. Audran, F. Bressolle, R. Gareau, A. Duvallet, and J.-L. Chanal. (1996). Pharmacokinetics and pharmacody-namics of recombinant human erythropoietin in athletes: blood sampling and doping control. Br. J. Clin. Pharmacol. 42:355-364.
18. Suominen, P., K. Punnonen, A. Rajamáki, and K. Irjala. (1997). Evaluation of new immunoenzymometric assay for measuring soluble transferrin receptor to detect iron deficiency in anemic patients. Clin. Chem. 43:1641-1646.
19. Warren, G. L., and K. J. Cureton. (1989). Modeling the effects of alterations in hemoglobin concentration on V02max. Med. Sci. Sports Exerc. 21:526-531.
20. Wide, L., and C. Bengtsson. (1990). Molecular charge heterogeneity of human serum erythropoietin. Br. J. Haematol. 76:121-127.
21. Wide, L., C. Bengtsson, B. Berglund, and B. Ekblom. (1995). Detection in blood and urine of recombinant erythropoietin administered to healthy men. Med. Sci. Sports Exerc. 27:1569-1576.
22. Williams, M. H., S. Wesseldine, T. Somma, and R. Schuster. (1981). The effect of induced erythrocytemia upon 5-mile treadmill run time. Med. Sci. Sports Exerc. 13:169-175.
Cita Original
Birkeland, K. I., J. Stray-Gundersen, P. Hemmersbach, J. Hallen, E. Haug, y R. Bahr. Effect of EPOr HU administration on serum levels of RST and cycling performance. Med. Sci. Sports Exerc. (2000).Vol. 32, No. 7, pp. 1238-1243.
Cita en PubliCE
Káre I. Birkeland, Jim Stray-Gundersen, Peter Hemmersbach, Jostein Hallen, Egil Haug Roald Bahr (2015). Efecto de la Administración de Eritropoyetina Recombinante Humana (EPOrHu) en los Niveles Séricos del Receptor Soluble de Transferrina (RST) y en el Rendimiento en Ciclismo. .https://g-se.com/efecto-de-la-administracion-de-eritropoyetina-recombinante-humana-eporhu-en-los-niveles-sericos-del-receptor-soluble-de-transferrina-rst-y-en-el-rendimiento-en-ciclismo-1772-sa-E57cfb272497fd
