Dinámica de la Frecuencia Cardíaca luego del Ejercicio en Pacientes Cardíacos que Padecen o No Diabetes Tipo 2
Jouko Karjalainen3, Victor R Neves1,2, Antti M Kiviniemi1, Arto J Hautala1, Olli-Pekka Piira3, Aparecida M Catai2, Timo H Mäkikallio3, HeikkiVeli Huikuri3, Mikko P Tulppo1,31 Department of Exercise and Medical Physiology. Verve, Oulu, Finland.
2 Department of Physiotherapy, Federal University of São Carlos. São Carlos, São Carlos, Brazil.
3 Department of Internal Medicine, Institute of Clinical Medicine. University of Oulu, Oulu, Finland.
Resumen
Objetivo: La incidencia de eventos cardiovasculares es mayor en pacientes con enfermedad coronaria que padecen además diabetes tipo 2 (CAD+T2D) que en pacientes con CAD sin T2D. Existe cada vez más evidencia de que la fase de recuperación post ejercicio es una fase vulnerable para varios eventos cardiovasculares. Se hipotetizó que la regulación autonómica difiere entre pacientes con CAD que padecen o no T2D durante la condición post-ejercicio. Métodos: 68 pacientes con CAD+T2D (edad: 61 ± 5 años; 78% hombres; fracción de eyección (EF): 67 ± 8, 100% con β-bloqueantes) y 64 pacientes con CAD (edad: 62 ± 5 años, 80% hombres; EF: 64 ± 8, 100% con β-bloqueantes), realizaron un test de ejercicio máximo limitado por síntomas en un cicloergómetro. La recuperación de la frecuencia cardíaca (HR) luego del ejercicio se calculó como la pendiente de la HR durante los primeros 60 s posteriores a la finalización del ejercicio (HRRSLOPE). Se midieron los intervalos R-R antes (5 min) y después del ejercicio desde el minuto 3 al minuto 8, en ambos casos en posición supina. Los intervalos R-R fueron analizados utilizando los métodos de tiempo y frecuencia y mediante el método de fluctuaciones sin tendencia (α1). Resultados: el BMI fue de 30 ± 4 vs 27±3 kg·m-2 (p<0.001); la capacidad máxima de ejercicio, 6.5 ± 1.7 vs 7.7 ± 1.9 METs (p<0.001); la HR máxima, 128 ± 19 vs 132 ± 18 latidos/min (p = ns); y la HRRSLOPE, −0.53 ± 0.17 vs −0.62 ± 0.15 latidos/s (p=0.004), para los pacientes con CAD con y sin T2D, respectivamente. No se hallaron diferencias entre los grupos respecto de la HRRSLOPE ajustada por los METs, el BMI y la medicación (ANCOVA, p = 0.228 para T2D y, e.g., p = 0.030 para los METs). Los pacientes con CAD+T2D exhibieron una mayor HR en reposo que los pacientes no diabéticos (57 ± 10 vs. 54 ± 6 latidos/min, p=0.030), pero no se observaron otras diferencias en la dinámica de la HR tanto en reposo como post-ejercicio. Conclusión: la recuperación de la HR presenta un retraso en pacientes con CAD+T2D, sugiriendo una desmejora de la actividad vagal y/o una incrementada actividad simpática luego del ejercicio. La desmejora de la recuperación de la HR luego del ejercicio en pacientes diabéticos, comparados con pacientes no diabéticos, se relaciona más estrechamente con la baja capacidad de ejercicio y la obesidad que con la T2D en sí misma.
Palabras Clave: recuperación de la frecuencia cardíaca, diabetes tipo 2, regulación autonómica
INTRODUCCIÓN
La incidencia de eventos cardiovasculares es mayor en pacientes con enfermedad coronaria (CAD) que presentan diabetes tipo 2 (T2D) que en pacientes con CAD pero sin T2D (Haffner et al., 1998; Junttila et al., 2010), pero los mecanismos fisiológicos o patofisiológicos que provocan estas diferencias no se conocen con totalidad. La alteración de la regulación autonómica es uno de los potenciales mecanismos que resultan en el incrementado número de eventos cardiovasculares en pacientes con CAD+T2D (Okada et al., 2010; Pop-Busui et al., 2010; Lanza et al., 2011). La regulación autonómica, puede estudiarse utilizando diversos métodos de laboratorio, o durante tests en condiciones ambulatorias tales como el test de inclinación de cabeza (head-up tilt test) y los test de prensión (Montano et al., 1994; Tulppo et al., 2001, 2005; Fu et al., 2002), o mediante mediciones ambulatorias de la variabilidad de la frecuencia cardíaca (HR) y mediciones de la presión sanguínea (Pagani et al., 1985; Kleiger et al., 1987; Piira et al., 2011). El análisis de la regulación autonómica durante y luego del ejercicio también ha sido utilizada en diferentes ámbitos fisiológicos (Yamamoto et al., 1991; Gregoire et al., 1996; Tulppo et al., 1996, 1998b) y clínicos (Cole et al., 1999, 2000; Jouven and Ducimetiere, 2000; Jouven et al., 2005; Kiviniemi et al., 2011). Existe evidencia creciente de que la fase de recuperación posterior al ejercicio es una fase vulnerable para diversos eventos cardiovasculares. Estudios transversales de casos han mostrado que el ejercicio como disparador del infarto agudo de miocardio no se limita al tiempo de ejercicio, sino que se extiendo por un cierto período posterior a la finalización de la actividad física (Siscovick et al., 1982, 1984; Albert et al., 2000; von Klot et al., 2008). Similarmente, el riesgo de muerte súbita se incrementa transitoriamente en los 30 min posteriores a la realización de ejercicios vigorosos, y que los episodios de fibrilación auricular se producen más comúnmente luego del ejercicio (Siscovick et al., 1982, 1984; Coumel, 1994; Albert et al., 2000; Huikuri, 2008). La medición de la función autonómica en la fase muy temprana de la recuperación post-ejercicio también ha provisto de información pronostica. Por ejemplo, la recuperación retrasada de la HR a los 1-2 min post ejercicio ha mostrado predecir los eventos cardiovasculares en la población general, en diversos grupos de pacientes y estudios con animales (Cole et al., 1999; Lauer and Froelicher, 2002; Nissinen et al., 2003; Jouven et al., 2005; Smith et al., 2005). Recientemente, hemos mostrado que la co-activación de las dos ramas autonómicas puede producirse durante la fase de recuperación posterior al ejercicio (Tulppo et al., 2011), lo cual podría explicar parcialmente el agrupamiento de diversos eventos cardiovascular en la fase de recuperación post ejercicio.
La presente investigación fue diseñada para estudiar el comportamiento de la dinámica de la HR durante el ejercicio y en la fase de recuperación post ejercicio en pacientes CAD con y sin T2D, agrupados por edad, fracción de eyección (EF) y sexo. Nuestra hipótesis fue que la regulación autonómica, medida mediante la recuperación de la HR y mediante métodos de variabilidad de la HR, es diferente en pacientes con CAD que padecen o no T2D, particularmente durante la condición post-ejercicio.
MÉTODOS
Sujetos y Protocolo del Estudio
El presente estudio fue llevado a cabo en el Departamento de Ejercicio y Fisiología Médica de Verve (Oulu, Finland) y en el Hospital-Universidad de Oulu, y los pacientes fueron seleccionados de la base de datos de pacientes de ARTEMIS (Innovation to Reduce Cardiovascular Complications of Diabetes at the Intersection) entre aquellos que presentaban CAD estable y que además presentaban (n = 64) o no (n = 68) T2D. Los criterios de exclusión fueron la inhabilidad para realizar un test de estrés por ejercicio, angina inestable al momento del reclutamiento, edad avanzada (> 75 años), un infarto de miocardio reciente (< 6 meses), nefropatía severa, fallo cardíaco, terapia de revascularización cardíaca programada, T2D diagnosticada antes de los 6 meses del comienzo del estudio, neuropatía autonómica diabética, demencia, alcoholismo, abuso de drogas o cualquier condición que pudiera impedir que el sujeto diera su consentimiento informado. La CAD fue documentada mediante angiografía coronaria y la T2D fue verificada mediante un test oral de tolerancia a la glucosa de acuerdo con las recomendaciones actuales (WHO, 1999). El estudio fue llevado a cabo de acuerdo con la Declaración de Helsinki y los comités locales de ética para la investigación del Hospital Ostrobothnia del Distrito Norte (Oulu, Finland) aprobaron el protocolo. Todos los sujetos dieron su consentimiento informado.
Las mediciones de laboratorio se llevaron a cabo en el Departamento de Ejercicio y Fisiología Médica en Verve (Oulu, Finland). No se les permitió a los pacientes consumir alimentos o cafeína en las 3 h previas a los tests. El ejercicio físico y el uso de alcohol se prohibieron para las 24 h previas a los tests de ejercicio. Se recolectaron registros electrocardiográficos (ECG) y los intervalos R-R durante 10 min en reposo, durante el ejercicio y durante los 10 min post ejercicio con los sujetos en posición supina. La respiración fue espontánea en todas las fases. Se recolectaron muestras de sangre capilar para el análisis de la concentración de HbA1c antes de la evaluación (Afinion™AS100, Axis-Shield PoCAS, Oslo, Norway).
Test de Estrés por Ejercicio
Todos los pacientes realizaron un test incremental máximo en un cicloergómetro (Monark Ergomedic 839 E; Monark Exercise AB, Vansbro, Sweden), comenzando con una carga de 30 W y con incrementos en la carga de 10 y 15W, para hombres y mujeres respectivamente, a cada minuto y hasta el agotamiento. Treinta segundos después de finalizar con el ejercicio, los sujetos se colocaron en posición supina y no se les permitió moverse o hablar durante la fase de recuperación.
La ventilación (VE) y el intercambio de gases (M909 Ergospirometer, Medikro, Kuopio, Finland) fueron medidos y reportados como valores medios para períodos de un minuto. El mayor valor medio de consumo de oxígeno para un período de un minuto fue considerado como el consumo de oxígeno pico (VO2peak). La carga máxima (W) y los METs máximos fueron calculados como la carga de trabajo promedio y como los METs registrados durante el último minuto del test. La actividad electro-cardiomiográfica fue monitoreado y registrado utilizando un ECG estándar de 12 derivaciones (M909 Ergospirometer, Medikro, Kuopio, Finland), y al mismo tiempo se registraron los intervalos R-R con un dispositivo Polar que posee una frecuencia de muestreo de 1000 Hz (Polar Electro, Kempele, Finland). La presión sanguínea fue medida con un esfigmomanómetro electrónico (Tango, Sun-Tech, Raleigh, NC, USA) tanto en reposo como durante el test de ejercicio. Los pacientes fueron estimulados a alcanzar la carga máxima, siempre limitada por aparición de síntomas, y el ejercicio era detenido si se observaba una depresión >0.2 mV en el segmento ST.
La HR máxima fue calculada como el valor medio de 5 intervalos R-R antes de la finalización del ejercicio a partir de los datos R-R del dispositivo Polar y fue convertida en HR máxima en latidos·min-1 con la siguiente ecuación: HR máxima (latidos·min-1 ) = 60 (intervalo R-R medio en ms/1000) – 1. La respuesta cronotrópica al ejercicio fue calculada mediante el índice de respuesta cronotrópica (CRI) con la siguiente ecuación: CRI = 100·(HR máxima – HR reposo) · (220 – Edad – HR reposo) – 1 (Kiviniemi et al., 2011), y la HR de reserva como la HR máxima menos la HR de reposo. Los valores de la recuperación de la HR fueron calculados como los valores medios de 5 intervalos R-R a los 15 (HRR15), 30 (HRR30), 60 (HRR60) y 120 (HRR120) segundos posteriores a la finalización del test de ejercicio, utilizando los datos del dispositivo Polar. Posteriormente, la recuperación de la HR (latidos·min-1 ) se calculó como el cambio entre la HR máxima y la recuperación de la HR a los 15, 30, 60 y 120 s post ejercicio. La pendiente de la HR durante los 60 s de la recuperación post-ejercicio (HRRSLOPE) fue calculada mediante un modelo linear utilizando los valores de HR previamente descritos en los puntos de HR máxima y a los 15, 30, 60 y 120 s de la recuperación (Figura 1).
Variabilidad de la Frecuencia Cardíaca
Los intervalos R-R fueron analizados utilizando los datos de los últimos 5 min del período de reposo, en cada carga durante el ejercicio (períodos de 1 min) y entre los 3 y 8 min (5 min) de la recuperación post ejercicio.
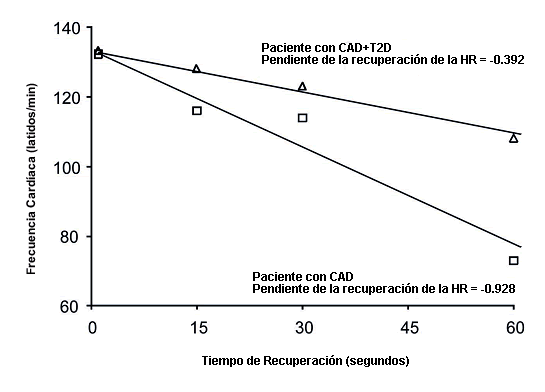
Figura 1. Ejemplo de la recuperación de la frecuencia cardíaca expresada como la pendiente de la frecuencia cardíaca en los primeros 60 s posteriores a la finalización del ejercicio para dos pacientes (con y sin diabetes tipo 2) de edad y frecuencia cardíaca máxima similar. La pendiente fue calculada mediante un modelo linear utilizando los valores medios de 5 intervalos R-R [convertidos a valores de HR en latidos/min con la ecuación 60·(media de los intervalos R-R en ms(100)-1] al máximo del ejercicio y a los 15, 30, 60 y 120 s de la recuperación post-ejercicio.
Previamente al análisis de la variabilidad de la HR (utilizando los datos R-R del Polar), todos los intervalos R-R fueron editados manualmente para excluir todos los latidos prematuros y ruidos, los cuales dieron cuenta de < 8% en cada sujeto. Los datos del ECG fueron utilizados durante la edición para confirmar el origen sinusoidal. Se utilizó un modelo autoregresivo para estimar la potencia de las densidades espectrales de la variabilidad de la HR luego de nivelación para eliminar tendencias (Huikuri et al., 1996; Tulppo et al., 1996). El espectro de potencia fue cuantificado midiendo el área bajo dos bandas de frecuencia: potencia LF (0.04 – 0.15 Hz) y potencia (HF) (0.15 – 0.4 Hz). Los detalles del espectro-análisis han sido descritos previamente (Task Force of the European Soci-ety of Cardiology and the North American Society of Pacing and Electrophysiology, 1996). El método de análisis de la fluctuación para eliminar tendencias (Detrended Fluctuation Analysis, DFA) fue utilizado para calcular las propiedades de correlación fractal de los datos de los intervalos R-R (Peng et al., 1995; Iyengar et al., 1996). En este estudio, el exponente (α-1) de ajuste a corto plazo (4-11 latidos) fue calculado en base a experimentos previos (Mäkikallio et al., 1996).
Análisis Estadístico
Los datos se presentan como medias ± DE. La distribución Gaussiana de los datos fue verificada a través del test de bondad de ajuste de Kolmogorov-Smirnov (valor z > 1.0). Para valorar los efectos principales en las mediciones repetidas de la recuperación de la HR post ejercicio (HRR15, HRR30, HRR60 y HRR120) se utilizó el análisis de varianza ANOVA de dos factores (tiempo × grupo), seguido de comparaciones post hoc (pruebas t no apareadas). Las diferencias significativas post hoc en la recuperación de la HR entre los grupos fueron ajustadas por los METs máximos, por el BMI y por las medicaciones (agonistas del calcio y nitratos) utilizando el análisis ANCOVA. Para otras variables, se utilizó el test de Student para pruebas no apareadas y así valorar las diferencias entre los grupos CAD y CAD+T2D en datos normalmente distribuidos. Se utilizó el test de Mann-Whitney para valorar las diferencias de los índices de la variabilidad de la HR entre los grupos. Para analizar las variables categóricas se utilizó la prueba de Chi cuadrado. Los datos fueron analizados utilizando el software SPSS (SPSS 19.0, SPSS Inc., Chicago, USA). Los valores p<0.05 fueron considerados estadísticamente significativos.
RESULTADOS
Población Estudiada
Las características de la población de estudio, incluyendo las comparaciones entre pacientes diabéticos y no diabéticos, se muestran en la Tabla 1. La composición corporal de los pacientes diabéticos, e.g., peso (p<0.001), circunferencia de la cintura (p<0.001), BMI (p<0.001), y HbA1c (p<0.001) difirió de los pacientes no diabéticos. Sin embargo, la presión sanguínea, la EF, la historia de infartos, y la revascularización y el tabaquismo no difirieron entre los pacientes diabéticos y no diabéticos (Tabla 1). La medicación no difirió entre los grupos, excepto para los antagonistas del calcio, los nitratos y los antidiabéticos que fueron más comunes entre los diabéticos que entre los pacientes no diabéticos (Tabla 1).
Respuesta de la HR al Ejercicio Máximo
Los resultados del test de ejercicio máximo, incluyendo las comparaciones entre pacientes diabéticos y no diabéticos, se muestran en la Tabla 2. La capacidad máxima de ejercicio (p<0.001) fue menor entre los pacientes diabéticos, pero la HR máxima (p = 0.178) fue similar entre los pacientes diabéticos y no diabéticos (Tabla 2).
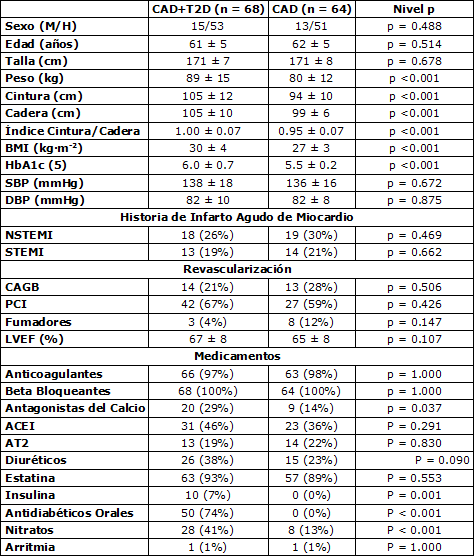
Tabla 1. Características de los pacientes. Los valores son medias ± DE. BMI, índice de masa corporal; HbA1c, hemoglobina glucosada; SBP, presión sistólica; DBP, presión diastólica; HR, frecuencia cardíaca; NSTEMI, infarto de miocardio sin elevación del segmento ST; STEMI, infarto de miocardio con elevación del segmento ST; revascularización: los pacientes que al menos habían sido sometidos a un procedimiento (CABG, by-pass coronario o PCI, intervención coronaria percutánea); LVEF, fracción de eyección del ventrículo izquierdo; ACEI, inhibidor de la enzima convertidora de angiostesina; AT2, bloqueante del receptor de angiostesina II; CAD grupo con enfermedad coronaria; CAD+T2D, grupo con enfermedad coronaria y diabetes tipo 2.
La HR de reserva fue menor (p = 0.027) y el CRI tendió a ser menor (p = 0.057) en los pacientes diabéticos que en los no diabéticos. Sin embargo, no se observaron diferencias significativas entre los grupos respecto de la HR de reserva o del CRI luego de ajustar los valores con los METs máximos, el BMI y la medicación, e.g., para la HR de reserva ANCOVA p = 0.686, p < 0.001, p = 0.126 y p = 0.169 para diabet3es, METs, BMI y antagonistas del calcio, respectivamente. No se observaron diferencias entre los grupos respecto de la prevalencia de la depresión del segmento ST > 0.1 mV durante el test de ejercicio.
Recuperación de la HR
La diabetes tipo 2 modificó la recuperación de la HR post ejercicio (efecto principal para la interacción tiempo × grupo, p = 0.037).
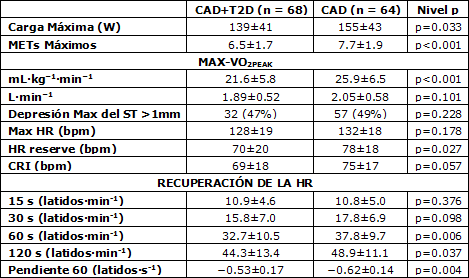
Tabla 2. Capacidad máxima de ejercicio y recuperación de la frecuencia cardíaca. Los valores son medias ± DE. METs, equivalentes metabólicos; VO2peak, consumo pico de oxígeno; HR, frecuencia cardíaca; CRI, índice de respuesta máxima cronotrópica.
Los pacientes diabéticos exhibieron una recuperación retrasada de la HR en los puntos HRR60 (p = 0.006), HRR120 (p = 0.037) y en la HRRSLOPE (p = 0.004) en comparación con los pacientes no diabéticos (Tabla 2). Sin embargo, no se observaron diferencias significativas entre los grupos respecto del a HRR60, la HRR120 o la HRRSLOPE luego del ajuste por los METs máximos, el BMI y la medicación; e.g., para HRR60 ANCOVA p = 0.223, p = 0.061 p = 0.387 y p = 0.094 para la diabetes, METs, BMI y antagonistas del calcio, respectivamente. Los valores correspondientes para la HRR120 fueron p = 0.980, p = 0.001, p = 0.451 y p = 0.006; y para HRRSLOPE, p = 0.228, p = 0.030, p = 0.404 y p = 0.079, para la diabetes, los METs, el BMI y los antagonistas del calcio, respectivamente. Los nitratos no modificaron el comportamiento de la HR entre los grupos en ninguna de las condiciones. Ejemplos de la HRRSLOPE para sujetos diabéticos y no diabéticos se muestran en la Figura 1.
HR y Variabilidad de la HR en reposo, Durante del Ejercicio Submáximo y Luego del Ejercicio
La frecuencia cardíaca y la variabilidad de la HR antes y después del ejercicio, incluyendo las comparaciones entre los pacientes diabéticos y no diabéticos se muestran en la Tabla 3. Cinco pacientes diabéticos fueron excluidos de los análisis debido a un número significativo de extra-sístoles y artefactos técnicos en los datos de los intervalos R-R. Un paciente no diabético fue excluido debido a extra-sístoles en las condiciones pre y post ejercicio y otro en la condición post ejercicio debido a la misma razón.
Los pacientes diabéticos tuvieron una mayor HR en la condición de reposo que los pacientes no diabéticos (p = 0.030), pero no se observaron otras diferencias tanto en la condición de reposo como en la condición post ejercicio (Tabla 3). La HR o la variabilidad de la HR no difirieron entre los grupos durante el ejercicio submáximo al 40, 60 u 80% de consumo de oxígeno pico; e.g., la HR fue de 92 ± 12 vs 95 ± 14 latidos·min-1 (p=0.099) y α1 1.02 ± 0.37 vs. 1.02 ± 0.32 (p = 0.93) al 61 ± 5%, y al 61 ± 5% del consumo de oxígeno pico para los pacientes diabéticos y no diabéticos, respectivamente.
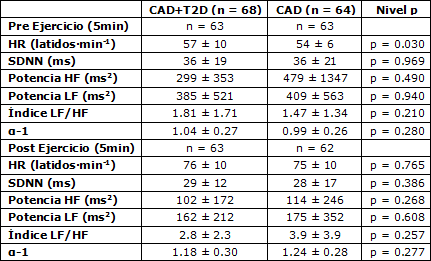
Tabla 3. Valores lineales y no lineales promedio de la variabilidad de la frecuencia cardíaca antes del ejercicio (5 min) y en la condición post ejercicio (entre el minuto 3 y el minuto 8), en posición supina. Los valores son medias ± DE. HR, frecuencia cardíaca; SDNN, entre intervalos R-R normales; HF, potencia de alta frecuencia de los intervalos R-R; LF, potencia de baja frecuencia de los intervalos R-R; α-1, exponente del ajuste fractal de los intervalos R-R.
DISCUSIÓN
El presente estudio mostró que la recuperación de la HR post ejercicio fue menor en los pacientes con CAD+T2D que en los pacientes con CAD, lo que sugiere una desmejora de la modulación vagal y/o una aumentada actividad simpática luego del ejercicio para pacientes diabéticos. La desmejora en la recuperación de la HR en pacientes diabéticos fue más obvia 1 minuto después del ejercicio, documentado por los índices HRR60 y HRRSLOPE. Sin embargo, la peor recuperación de la HR al inicio de la recuperación post ejercicio en pacientes diabéticos, en comparación con los no diabéticos, probablemente estuvo más relacionada con la baja capacidad de ejercicio y la obesidad que con la T2D en sí misma. En conjunto, estos datos sugieren que el retraso en la recuperación de la HR luego del ejercicio en pacientes con T2D puede revertirse mediante la prevención y el tratamiento, e.g., ejercicio regular y manejo del peso corporal.
Dinámica de la HR Post Ejercicio
El interjuego entre la regulación simpática y vagal de la HR durante el ejercicio se organiza en un modo recíproco, i.e., el incremento de la actividad simpática es acompañado por una reducción de la actividad vagal en el corazón durante el ejercicio dinámico (Robinson et al., 1966; Maciel et al., 1986; Orizio et al., 1988; Yamamoto and Hughson, 1991; Tulppo et al., 1996, 1998b). Sin embargo, este comportamiento recíproco se ve alterado en la fase de recuperación post ejercicio debido a las diferencias temporales en el patrón de recuperación en las ramas autónomas (Tulppo et al., 2011). Luego de la finalización del ejercicio se produce una rápida restauración de la actividad vagal (Imai et al., 1994; Goldberger et al., 2006; Martinmaki and Rusko, 2008; Tulppo et al., 2011). Por el contrario, el sistema nervioso simpático parece tener una mayor latencia para retornar al estado basal luego de la finalización del ejercicio, resultando en una hiperactividad del sistema simpático de mayor duración (Ray, 1993; Tulppo et al., 2011). En conjunto, estos cambios n la regulación autonómica podrían resultar en una activación dual de las ramas simpática y vagal en la condición post ejercicio (Tulppo et al., 2011). Estos cambios en la actividad autonómica en la condición post ejercicio podrían en parte explicar los hallazgos clínicos ya que, particularmente, la fase de recuperación post ejercicio ha mostrado ser una fase vulnerable para diversos eventos cardiovasculares (Siscovick et al., 1982, 1984;Albert et al., 2000;von Klot et al., 2008).
Se sabe que los pacientes con CAD+T2D presentan un mayor riesgo de eventos cardíacos que los pacientes con CAD que no padecen de diabetes. La alteración de la regulación autonómica en la condición post-ejercicio es uno de los potenciales mecanismos, debido a que una recuperación más lenta de la HR luego del ejercicio también se ha asociado con eventos cardiovasculares en diferentes poblaciones clínicas y subclínicas (Cole et al., 1999; Lauer and Froelicher, 2002; Nissinen et al., 2003; Jouven et al., 2005). En el presente estudio, la recuperación de la HR entre los minutos 1 y 2 posteriores al ejercicio fue el único marcador de la actividad autonómica que diferenció a los pacientes diabéticos de los no diabéticos agrupados por edad, sexo y EF, todos bajo tratamiento con medicamento, incluyendo los β-bloqueantes. Debido a la compleja interacción de la regulación autonómica que se produce en la fase inicial post ejercicio, es difícil detectar diferencias en la recuperación de la HR entre pacientes diabéticos y no diabéticos debido a la desmejora de la activación vagal o al aumento de la activación simpática o ambos. Además, las catecolaminas circulantes pueden haber contribuido a la hiperreactividad simpática post ejercicio (Krock andHartung, 1992), pero desafortunadamente en el presente estudio no se midieron las concentraciones de epinefrina o norepinefrina. Un hallazgo novel del presente estudio fue que no hubo diferencia entre los grupos de pacientes respecto de la recuperación de la HR post ejercicio luego del ajuste por los METs y el BMI. Estos hallazgos enfatizan que el ejercicio regular y el manejo del peso corporal son potenciales tratamientos para mejorar la recuperación de la HR en pacientes con CAD+T2D. Un punto importante es que los antagonistas del calcio modifican la HR, particularmente a los 2 min post ejercicio. Los pacientes que utilizan antagonistas del calcio comúnmente exhiben una hipertensión más severa asociada con un retraso en la recuperación de la HR (Carnethon et al., 2011).
Respuesta de la HR al Ejercicio Máximo
La medición de la respuesta cronotrópica al ejercicio ha sido utilizada para valorar, particularmente, la influencia simpática sobre el corazón y ha mostrado ser un poderoso predictor de la mortalidad por causas cardíacas en poblaciones asintomáticas (Azarbal et al., 2004; Gulati et al., 2005; Jouven et al., 2005; Savonen et al., 2006; Kiviniemi et al., 2011) y en pacientes con diversas enfermedades cardíacas (Myers et al., 2007; Savonen et al., 2008; Kiviniemi et al., 2011). En el presente estudio, la HR de reserva fue menor y la respuesta cronotrópica ajustada por la edad (CRI) tendió a ser menor en los pacientes con CAD+T2D que en los pacientes con CAD sin diabetes. Sin embargo, no se observaron diferencias entre los grupos de pacientes cuando estos índices fueron ajustados por el BMIM.
Variabilidad de la HR
La diabetes tipo 2 ha mostrado reducir la variabilidad de la HR y la sensibilidad barorefleja en pacientes T2D sin CAD (Masaoka et al., 1985; Frattola et al., 1997). Existen estudios previos en donde la T2D ha mostrado estar asociada con una reducción adicional en la sensibilidad barorefleja entre pacientes con CAD (Wykretowicz et al., 2005), o en la variabilidad de la HR entre pacientes con T2D y con fallo cardíaco o CAD (Burger and Aronson, 2001; Kiviniemi et al., 2010). Además, en el presente estudio, los índices de la variabilidad de la HR a corto plazo medidos en reposo en la condición post ejercicio no fueron diferentes entre los pacientes con CAD y con y sin T2D. Existen diversas explicaciones potenciales para estos hallazgos. Primero, las muestras fueron cuidadosamente emparejadas de acuerdo con la edad, el sexo, la EF, y la utilización de β-bloqueantes, los cuales se sabe que afectan la variabilidad de la HR y pueden en parte explicar los hallazgos del presente estudio. Segundo, las medidas de la variabilidad de la HR a corto plazo en condiciones de laboratorio no poseen tanta reproducibilidad como los registros sobre 24 hs (Huikuri et al., 1990; Tulppo et al., 1998b), y pueden verse influenciadas por la presencia de los médicos, lo que suele denominarse como “efecto de la bata blanca” sobre los sujetos (Grassi et al., 1999). Tercero, los altos niveles de norepinefrina circulantes, particularmente post ejercicio, puede resultar en cambios abruptos en la dinámica latido a latido de los intervalos R-R lo cual no puede detectarse mediante los métodos de medición de la variabilidad de la HR (Tulppo et al., 1998a). Contrariamente a la variabilidad de la HR medida en reposo o a los pocos minutos post ejercicio, los cambios en ambas ramas autonómicas se producen en décimas de segundo, desde la dominancia simpática a la restauración de la actividad vagal, resultando en una reducción de la HR post ejercicio (Tulppo et al., 2011). El comportamiento característico de la regulación autonómica post ejercicio máximo es el principal candidato a explicar las diferencias en la recuperación de la HR entre los grupos de pacientes diabéticos y no diabéticos.
Limitaciones del Estudio
Las mediciones del presente estudio fueron llevadas a cabo fueron realizadas con los sujetos bajo prescripción continua de medicamentos debido a razones éticas y a los bien conocidos efectos del abandono del uso de beta-bloqueantes. Sin embargo, los resultados del presente estudio tendrían más implicaciones prácticas cuando se realicen análisis en el momento en que los pacientes se encuentren con su medicación normal.
Aplicaciones Clínicas
En base a los resultados del presente estudio, es importante enfatizar el rol del ejercicio físico para el mantenimiento de una buena función cardiovascular, para la mejora del rendimiento físico y para la pérdida de peso. Si bien todos los pacientes se encontraban bajo un régimen optimizado de medicamentos, es importante subrayar que la modificación del comportamiento, el ejercicio y la dieta deberían tener una prioridad similar a los medicamentos preventivos (Chow et al., 2010).
CONCLUSIONES
La recuperación de la frecuencia cardíaca 1 minuto después del ejercicio es el índice que mejor separó a los pacientes con CAD que padecen o no T2D, incluso mejor que las mediciones de la variabilidad de la HR en reposo, durante el ejercicio o en la condición post-ejercicio. La recuperación retrasada de la HR en los pacientes con CAD+T2D, comparados con los pacientes con CAD y sin T2D, sugiere una desmejora de la actividad vagal y/o una aumentada actividad simpática luego del ejercicio. Sin embargo, esta desmejora de la recuperación de la HR inmediatamente después del ejercicio en los pacientes diabéticos, y comparado con los pacientes no diabéticos, probablemente esté más relacionada con la capacidad de ejercicio y la obesidad que con la T2D en sí misma.
Agradecimientos
Este estudio fue subvencionado por una beca del Centro Finlandés de Desarrollo Tecnológico (TEKES. Helsinki. Finland), la Fundación Paavo Nurmi, Turku, Finlandia, por Polar Electro Oy, Kempele, Finlandia y por Hur Oy, Kokkola, Finlandia y por el Consejo Nacional de Desarrollo Científico y Tecnológico, Brasilia, Brasil. (proc. 200630/2010-5).
Referencias
1. Albert, C. M., Mittleman, M. A., Chae, C. U., Lee, I. M., Hennekens, C. H., and Manson, J. E (2000). Triggering of sudden death from cardiac causes by vigorous exertion. . N.Engl. J.Med. 343, 1355–1361
2. Azarbal, B., Hayes, S. W., Lewin, H. C., Hachamovitch, R., Cohen, I., and Berman, D. S (2004). The incremental prognostic value of percent-age of heart rate reserve achieved over myocardial perfusion single-photon emission computed tomography in the prediction of cardiac death and all-cause mortality: superiority over 85% of maximal age-predicted heart rate. J. Am. Coll. Cardiol.44, 423–430
3. Burger, A. J., and Aronson, D (2001). Effect of diabetes mellitus on heart rate variability in patients with congestive heart failure. Pacing Clin. Electrophysiol. 24, 53–59
4. Carnethon, M. R., Sternfeld, B., Liu, K., Jacobs, D. R. Jr., Schreiner, P. J., Williams, O. D., Lewis, C. E., and Sidney, S (2011). Corre-lates of heart rate recovery over 20 years in a healthy population sample. Med. Sci. Sports Exerc. doi:10.1249/MSS.0b013e31822cb190
5. Chow, C. K., Jolly, S., Rao-Melacini, P., Fox, K. A., Anand, S. S., and Yusuf, S (2010). Association of diet, exercise, and smoking modification with risk of early cardiovascular events after acute coronary syndromes. Circula-tion121, 750–758
6. Cole, C. R., Blackstone, E. H., Pashkow, F. J., Snader, C. E., and Lauer, M. S (1999). Heart-rate recovery immediately after exercise as a predictor of mortality.N.Engl. J.Med.341, 1351–1357
7. Cole, C. R., Foody, J. M., Blackstone, E. H., and Lauer, M. S (2000). Heart rate recovery after submaximal exercise testing as a predictor of mortality in a cardiovascularly healthy cohort. Ann. Intern. Med. 132, 552–555
8. Coumel, P (1994). Paroxysmal atrial fibrillation: a disorder of autonomic tone?. Eur. Heart J. 15(Suppl. A), 9–16
9. Frattola, A., Parati, G., Gamba, P., Paleari, F., Mauri, G., Di Rienzo, M., Castiglioni, P., and Mancia, G (1997). Time and frequency domain estimates of spontaneous baroreflex sensitivity provide early detection of autonomic dysfunction in diabetes mellitus. Diabetologia 40, 1470–1475
10. Fu, Q., Levine, B. D., Pawelczyk, J. A., Ertl, A. C., Diedrich, A., Cox, J. F., Zuckerman, J. H., Ray, C. A., Smith, M. L., Iwase, S., Saito, M., Sugiyama, Y., Mano, T., Zhang, R., Iwasaki, K., Lane, (2002). Cardiovascular and sympathetic neural responses to handgrip and cold pressor stimuli in humans before, during and after spaceflight. J. Physiol. (Lond.)544, 653–664
11. Goldberger, J. J., Le, F. K., Lahiri, M., Kannankeril, P. J., Ng, J., and Kadish, A. H (2006). Assessment of parasympathetic reactivation after exercise. Am. J. Physiol. Heart Circ. Physiol.290, H2446–H2452
12. Grassi, G., Turri, C., Vailati, S., Dell’oro, R., and Mancia, G (1999). Muscle and skin sympathetic nerve traffic during the “white-coat” effect. Circulation100, 222–225
13. Gregoire, J., Tuck, S., Yamamoto, Y., and Hughson, R. L (1996). Heart rate variability at rest and exercise: influence of age, gender, and physical training. Can. J. Appl. Physiol.21, 455–470
14. Gulati, M., Black, H. R., Shaw, L. J., Arnsdorf, M. F., Merz, C. N., Lauer, M. S., Marwick, T. H., Pandey, D. K., Wicklund, R. H., and Thisted, R. A (2005). The prognostic value of a nomogram for exercise capacity in women. N. Engl.J.Med.353, 468–475
15. Haffner, S. M., Lehto, S., Rönnemaa, T., Pyorälä, K., and Laakso, M (1998). Mortality from coronary heart disease in subjects with type 2 diabetes and in nondiabetic subjects with and without prior myocardial infarction. N.Engl.J.Med.339, 229–234
16. Huikuri, H. V., Kessler, K. M., Terracall, E., Castellanos, A., Linnaluoto, M. K., and Myerburg, R. J (1990). Reproducibility and circadian rhythm of heart rate variability in healthy subjects. Am. J. Cardiol.65, 391–393
17. Huikuri, H. V., Seppanen, T., Koistinen, M. J., Airaksinen, J., Ikaheimo, M. J., Castellanos, A., and Myerburg, R. J (1996). Abnormalities in beat-to-beat dynamics of heart rate before the spontaneous onset of life-threatening ventricular tachyarrhythmias in patients with prior myocardial infarction. Circulation 93, 1836–1844
18. Imai,K., Sato,H.,Hori,M.,Kusuoka,H., Ozaki,H.,Yokoyama,H., Takeda,H., Inoue, M., and Kamada, T (1994). Vagally mediated heart rate recovery after exercise is accelerated in athletes but blunted in patients with chronic heart failure. J. Am. Coll. Cardiol.24, 1529–1535
19. Iyengar, N., Peng, C. K., Morin, R., Goldberger, A. L., and Lipsitz, L. A (1996). Age-related alterations in the fractal scaling of cardiac interbeat interval dynamics. Am. J. Physiol. 271, R1078–R1084
20. Jouven, X., and Ducimetiere, P (2000). Recovery of heart rate after exercise. N.Engl.J.Med.342, 662–663
21. Jouven, X., Empana, J. P., Schwartz, P. J., Desnos, M., Courbon, D., and Ducimetiere, P (2005). Heart-rate profile during exercise as a predictor of sudden death. N. Engl. J. Med. 352, 1951–1958
22. Junttila, M. J., Barthel, P., Myerburg, R. J., Makikallio, T. H., Bauer, A., Ulm, K., Kiviniemi, A., Tulppo, M., Perkiomaki, J. S., Schmidt, G., and Huikuri, H. V (2010). Sudden cardiac death after myocardial infarction in patients with type 2 diabetes. Heart Rhythm 7, 1396–1403
23. Kiviniemi, A. M., Tiinanen, S., Hautala, A. J., Seppanen, T., Norton, K. N., Frances, M. F., Nolan, R. P., Huikuri, H. V., Tulppo,M. P., and Shoemaker, J. K (2010). Low-frequency oscillations in R-R interval and blood pressure across the continuumof cardiovascular risk. Auton. Neurosci.158, 92–99
24. Kiviniemi,A.M.,Tulppo,M. P.,Hautala, A. J., Makikallio, T. H., Perkiomaki, J. S., Seppanen, T., and Huikuri, H. V (2011). Long-term outcome of patients with chronotropic incompetence after an acute myocardial infarction. Ann. Med. 43, 33–39
25. Kleiger, R. E., Miller, J. P., Bigger, J. T. Jr., and Moss,A. J (1987). Decreased heart rate variability and its association with increased mortality after acute myocardial infarction. Am. J. Cardiol.59, 256–262
26. Krock, L. P., andHartung, G. H (1992). Influence of post-exercise activity on plasma catecholamines, blood pressure and heart rate in normal subjects. Clin. Auton. Res.2, 89–97
27. Lanza, G. A., Barone, L., Scalone, G., Pitocco, D., Sgueglia, G. A., Mollo, R., Nerla, R., Zaccardi, F., Ghirlanda, G., and Crea, F (2011). Inflammation-related effects of adjuvant influenza A vaccination on platelet activation and cardiac autonomic function. J. Intern. Med.269, 118–125
28. Lauer, M. S., and Froelicher, V (2002). Abnormal heart-rate recovery after exercise. Lancet360, 1176–1177
Cita Original
Neves VR, Kiviniemi AM, Hautala AJ, Karjalainen J, Piira O-P, Catai AM, Mäkikallio TH, Huikuri HV and Tulppo MP (2011) Heart rate dynamics after exercise in cardiac patients with and without type 2 diabetes. Front. Physio. 2:57. doi: 10.3389/fphys.2011.00057
Cita en PubliCE
Jouko Karjalainen, Victor R Neves, Antti M Kiviniemi, Arto J Hautala, Olli-Pekka Piira, Aparecida M Catai, Timo H Mäkikallio, HeikkiVeli Huikuri Mikko P Tulppo (2012). Dinámica de la Frecuencia Cardíaca luego del Ejercicio en Pacientes Cardíacos que Padecen o No Diabetes Tipo 2. .https://g-se.com/dinamica-de-la-frecuencia-cardiaca-luego-del-ejercicio-en-pacientes-cardiacos-que-padecen-o-no-diabetes-tipo-2-1463-sa-F57cfb272146fc
