Correlaciones Musculares y Sistémicas de la Hipertrofia Muscular Inducida por el Entrenamiento de la Fuerza
Cameron J. Mitchell, Tyler A. Churchward-Venne, Leeann Bellamy, Gianni Parise, Steven K. Baker, Stuart M. PhillipsResumen
Propuesta: Para determinar las relaciones entre los cambios de post-ejercicio en factores sistémicos [testosterona, hormona de crecimiento (GH), factor de crecimiento 1 como la insulina (IGF-1) e interleucina 6 (IL-6)], o intramusculares [contenido proteico del receptor de andrógeno del músculo esquelético (AR) y estado de fosforilación de la p70S6K] en una cohorte de tamaño moderado de hombres jóvenes exhibiendo hipertrofia muscular divergente inducida por entrenamiento de la fuerza.
Métodos: Veinte tres varones adultos completaron 4 sesiones por semanas de entrenamiento de la fuerza durante 16 semanas. Se obtuvieron biopsias musculares antes y después del período de entrenamiento y la respuesta aguda de 1 y 5 hs después de la primera sesión de entrenamiento. Las hormonas y citocinas en suero fueron inmediatamente medidas, 15, 30 y 60 minutos después de la primera y última sesiones de entrenamiento del estudio.
Resultados: El área de fibra promedio aumentó por 20% (rango: -7 a 80%; P <0.001). El contenido de proteína del AR se mantuvo sin cambios con el entrenamiento (veces que cambió = 1.17 ± 0.61; P=0.19); hubo una correlación significativa, sin embargo, entre los cambios en el contenido del AR y el área de fibra (r=0.60, P=0.023). La fosforilación de la p70S6K se elevó 5 horas después del ejercicio, lo que se correlacionó con las ganancias en el área de fibra promedio (r=0.54, P=0.007). No hubo ninguna relación entre la magnitud de los cambios de pre- o post-entrenamiento inducidos por el ejercicio en las concentraciones de testosterona libre, de GH, o de IGF-1 e hipertrofia de la fibra muscular; sin embargo, la magnitud del ejercicio de la respuesta post-ejercicio de la IL-6 se correlacionó con la hipertrofia muscular (r=0.48, P=0.019).
Conclusión: Los aumentos post-ejercicio en las hormonas circulantes no se relacionó a la hipertrofia luego del entrenamiento. Los cambios inducidos por ejercicio en IL-6 se correlacionaron con la hipertrofia, pero el mecanismo para el rol de la IL-6 en la hipertrofia es desconocido. Los aumentos agudos en la fosforilación de la p70S6K y los cambios en el contenido de proteína del AR muscular, se correlacionaron con la hipertrofia muscular que implica procesos intramusculares en vez de sistémicos en la mediación de la hipertrofia.
Palabras Clave: Hipertrofia muscular, fuerza, entrenamiento
Abstract
Purpose: To determine relationships between post-exercise changes in systemic [testosterone, growth hormone (GH), insulin like grow factor 1 (IGF-1) and interleukin 6 (IL-6)], or intramuscular [skeletal muscle androgen receptor (AR) protein content and p70S6K phosphorylation status] factors in a moderately-sized cohort of young men exhibiting divergent resistance training-mediated muscle hypertrophy.
Methods: Twenty three adult males completed 4 sessions•wk-1 of resistance training for 16 wk. Muscle biopsies were obtained before and after the training period and acutely 1 and 5 h after the first training session. Serum hormones and cytokines were measured immediately, 15, 30 and 60 minutes following the first and last training sessions of the study.
Results: Mean fiber area increased by 20% (range: -7 to 80%; P<0.001). Protein content of the AR was unchanged with training (fold change = 1.17 ± 0.61; P=0.19); however, there was a significant correlation between the changes in AR content and fiber area (r=0.60, P=0.023). Phosphorylation of p70S6K was elevated 5 hours following exercise, which was correlated with gains in mean fiber area (r=0.54, P=0.007). There was no relationship between the magnitude of the pre- or post-training exercise-induced changes in free testosterone, GH, or IGF-1 concentration and muscle fiber hypertrophy; however, the magnitude of the post exercise IL-6 response was correlated with muscle hypertrophy (r=0.48, P=0.019).
Conclusion: Post-exercise increases in circulating hormones are not related to hypertrophy following training. Exercise-induced changes in IL-6 correlated with hypertrophy, but the mechanism for the role of IL-6 in hypertrophy is not known. Acute increases, in p70S6K phosphorylation and changes in muscle AR protein content correlated with muscle hypertrophy implicating intramuscular rather than systemic processes in mediating hypertrophy.
Keywords: Muscle hypertrophy, strength, training
INTRODUCCIÓN
Está bien establecido que el entrenamiento de la fuerza puede llevar a la hipertrofia muscular [1] que parece ser el resultado de períodos acumulados de aumentos post-ejercicio en la síntesis de proteínas del músculo, que excede la degradación de proteínas del músculo produciendo la acreción de proteína neta por más tiempo [2]. Nosotros hemos examinado cómo las diferencias en los paradigmas contráctiles afectan la síntesis de proteínas del músculo esquelético (MPS, muscle protein synthesis) [3-5]. Como consecuencia, hemos estudiado la influencia de algunas de estas mismas variables en afectar a la hipertrofia del músculo esquelético luego de un entrenamiento prolongado [6,7] con el acuerdo general entre mediciones de corta plazo de la MPS y la hipertrofia. Mientras algunos estudios han mostrado efectos pequeños de las variables del entrenamiento como los períodos de descanso entre las series y carga relativa de entrenamiento sobre la hipertrofia muscular [7,8], otros estudios no los tienen [6,9]. Una observación consistente es un alto grado de heterogeneidad en la respuesta hipertrófica al entrenamiento de la fuerza [10,11]; las causas subyacentes de esta variabilidad en la respuesta hipertrófica son poco conocidas.
Como explicaciones potenciales para estos cambios en la heterogeneidad hipertrófica en la expresión de gen miogénico [12], abundancia del microARN[13], y capacidad para la adición mionuclear vía células satélite [14], han sido examinados. Otra investigación ha examinado los cambios agudos post-ejercicio sobre los factores circulantes propuestos de ser anabólicos para el músculo como la testosterona, la hormona de crecimiento, y el IGF-1 [15,16]. Sin embargo, nosotros hemos propuesto, y con evidencia, que los cambios en estos factores circulantes después de una única sesión de ejercicio de fuerza no están relacionados a la magnitud de la respuesta de la MSP o a la hipertrofia muscular con el entrenamiento de la fuerza [17-19]. En contraste, muchos afirman que la respuesta hormonal aguda al ejercicio de fuerza es un motor importante de la hipertrofia y se ha usado una respuesta hormonal transitoria para establecer la eficacia de las intervenciones, incluyendo el ejercicio y los cambios basados en la nutrición, para atribuir la significancia en un nivel fenotípico y funcional; para revisiones, ver en [20,21]. Hay que remarcar que, la acción anabólica de la testosterona en el músculo es mediada vía los receptores del andrógeno (AR), el mARN para lo cual, se ha demostrado de ser sobrerregulado por el ejercicio de fuerza [22], y que los cambios en su expresión de la proteína se han reportado de correlacionarse con la magnitud de la hipertrofia muscular [23]; así, nosotros buscamos determinar si los cambios en la proteína del AR juegan un rol en la mediación de la hipertrofia.
La citocina interleucina-6 (IL-6) ha sido implicada como reguladora de la función de las células satélite [24] y su liberación después del ejercicio de fuerza se correlaciona bien con la IL-6 medida en el músculo y en la sangre [24]. Las concentraciones de IL-6 circulante también se han tomado como indicador del estado inflamatorio de reposo [25]. Es interesante observar que en las mujeres post-menopáusicas, una fuerte relación entre la adiposidad abdominal y la IL-6 era negativamente asociada con los cambios en la IL-6 y en la ganancia de la masa magra con el entrenamiento de la fuerza [26]. Es incierto en los hombres sanos jóvenes si la respuesta de la IL-6 al ejercicio de fuerza se relaciona a la hipertrofia muscular después del entrenamiento.
En un análisis retrospectivo nosotros reportamos que la respuesta aguda de varias hormonas (la testosterona, la GH, y el IGF-1), muchas veces establecidas como reguladoras claves anabólicas de la hipertrofia [20,21] con el entrenamiento de la fuerza, fueron poco relacionadas a la respuesta hipertrófica con el entrenamiento de la fuerza [19]. Este análisis [19], sin embargo, no involucra una manipulación nutricional que podría disimular la verdadera naturaleza de la influencia hormonal sobre la hipertrofia. Así, el propósito de este estudio fue evaluar la relación probable entre la magnitud de la elevación aguda en las hormonas circulantes - testosterona, GH, e IGF-1 - después del ejercicio de fuerza previo y tardío durante un período (16 semanas) de entrenamiento, y examinar la relación con la hipertrofia muscular. Nosotros examinamos los cambios en el contenido de proteína del AR muscular y los cambios agudos en la fosforilación de la p70S6K puesto que ellos son proteínas que se han demostrado de estar relacionados a la respuesta hipertrófica en los humanos [23,27]. Nosotros también examinamos la relación entre la respuesta aguda de la IL-6 al ejercicio de fuerza y a la magnitud de la hipertrofia luego del entrenamiento [24].
MÉTODOS
Sujetos
Veinte tres varones adulto jóvenes sanos (177±8 cm, 84.1±16.9 kg, 26.4±4.4 kg/m2, 24±3 años) participaron en el estudio. Los sujetos eran recreativamente activos pero no habían participado en ningún entrenamiento de la fuerza durante al menos un año. Todos declararon estar sanos en base a las respuestas a una encuesta de chequeo médico estándar. La evaluación de la fuerza fue dirigida para determinar la fuerza isotónica voluntaria definida por 1 máxima repetición (1MR) para el ejercicio de press de piernas y el de press de pecho al comienzo y final del período de entrenamiento. Los sujetos se abstuvieron de actividad física vigorosa por 72 hs antes de las sesiones de evaluación.
Declaración de Ética
El estudio fue aceptado por la Hamilton Health Sciences Research Ethics Board y conformó a las normas para el uso de participantes humanos en la investigación como está delineado en la 5ta Declaración de Helsinki y con las guías actuales de la agencia de investigación del Tri-Concilio de Canadá para el uso de participantes humanos en investigación (http://www.pre.ethics.gc.ca/eng/policy-politique/initiatives/tcps2-eptc2/Default/). El consentimiento informado por escrito fue obtenido antes de que todos los participantes ingresen en el estudio.
El protocolo del entrenamiento de la fuerza
Los sujetos fueron sometidos a 16 semanas de entrenamiento de la fuerza de cuerpo entero, progresivo, consistente en cuatro sesiones de entrenamiento por semana. Cada semana implicaban en dos sesiones de entrenamiento del tren superior y dos sesiones de entrenamiento del tren inferior. Los ejercicios del tren superior eran el press de pecho, press de hombros Hammer Strength, Lake Forest, IL), tirón de polea alta, remos para romboides (Atlantis, Laval, Quebec), curl de bíceps, y extensión de tríceps (Hur, Kokkola, Finlandia). Los ejercicios del tren inferior eran el press de piernas (Maxam, Hamilton, Ontario), extensión de piernas (Atlantis, Laval, Quebec), curl de piernas y press de pantorrilla (Hur, Finlandia). El programa consistió en 4 bloques de 4 semanas cada uno. El primer bloque consistió en 3 series (2 series durante la primera semana) de 12 repeticiones para cada ejercicio y 60 segundos de pausa entre las series. El segundo bloque consistió en 3 series (4 durante la semana última) de 10 repeticiones con 90 segundos de pausa entre las series. El tercer bloque consistió en 4 series (2 series durante semana 1) de 8 repeticiones con 100 segundos de pausa entre las series. El último bloque consistió en 4 series (3 series durante semana 1) de 6 repeticiones con 120 segundos entre las series. La serie última para cada ejercicio realizado se hizo al fallo muscular momentáneo. Para maximizar las ganancias posibles de la fuerza y de la masa magra como resultado del entrenamiento [28], los sujetos consumían inmediatamente después de cada sesión de entrenamiento y con el desayuno en los días de no entrenamiento, una bebida con proteínas que contenía 30 g de proteína de la leche, 25.9 g de carbohidratos y 3.4 g de grasa (Musahi P30, Notting Hill, Australia).
La evaluación de las hormonas/citocinas
Después de la evaluación de la fuerza, los sujetos descansaron durante al menos 96 horas. Los sujetos se reportaron al laboratorio para una muestra de sangre y biopsia muscular en reposo de sus músculos del vasto externo. Los sujetos luego fueron sometidos a un turno agudo de ejercicio de fuerza que consistió en el press de piernas, el curl de piernas, la extensión de piernas y el press de pantorrillas realizados con 4 series de 8 repeticiones con 2 minutos de descanso entre las series. Al final de la sesión del ejercicio de fuerza, una muestra de sangre fue tomada y se ingirió la bebida con proteínas antes descrita. Luego, se tomaron muestras de sangre a los 15, 30 y 60 minutos post-ejercicio. Las biopsias musculares (~100mg) también se tomaron 1 hora y 5 horas después del ejercicio de fuerza. La sesión aguda del ejercicio de fuerza fue repetida después del período de entrenamiento, la carga de 8MR fue fijada en base a los recientes tests de 1MR de los sujetos.
Tratamiento de las muestras
Se homogeneizaron las muestras musculares previamente en hielo en un buffer como está descrito [29]. Las concentraciones de proteínas fueron determinadas vía ensayo de proteína BCA (Thermo Scientific, Rockford, IL, EE.UU.). Luego, se prepararon muestras activas de igual concentración en el buffer de Laemmli [30] y cantidades iguales de proteína (20 µg) fueron cargadas en geles 10% prevaciadas (BIO-RAD Mini-PROTEAN TGX Gels, Bio-Rad Laboratories, EE.UU.) para la separación por electroforesis. Más tarde, las proteínas fueron transferidas a una membrana de fluoruro de polivinilideno, bloqueado en 5% de leche desnatada (para el AR) o 5% de albúmina de suero bovino (para la p70S6K) durante 1 hs, e incubadas toda la noche a 4°C en anticuerpo primario contra el receptor de AR (1:2000, abcam, #ab3510) o p70S6KThr389 fosforilizada. (1:1000 Santa Cruz Biotechnology # sc-11759). Luego se lavaron las membranas en TBST e incubadas en anticuerpo secundario por 1h a temperatura ambiente antes de la detección de las proteínas con quimioluminescencia (SuperSignalWest Dura Extended Duration Substrate, ThermoScientific, #34075) en un sistema de imagen FluorChem PV (Alpha Innotech, Santa Clara, CA, EE.UU.). El AR Total y la proteína de la p70S6K fosforilada fueron expresadas respecto a la abundancia de α-tubulina (1:2000, Sigma-Alderich, St. Louis, MO, EE.UU. #T6074) y se presentaron como veces que cambiaron de pre- a post-entrenamiento. Las imágenes fueron cuantificadas por densitometría usando el software ImageJ (National Institute of Health, EE.UU.)
Análisis sanguíneo
Las muestras de suero sanguíneo fueron reunidas en tubos de 4 ml evacuados desde un catéter de poliuretano 22 insertado en la vena antecubital mientras un goteo salino de 0.9% fue usado para mantener el catéter. El suero luego era extraído para coagular a temperatura ambiente durante una hora antes de que se centrifugaras a 4000 rpm durante 10 minutos. El plasma sanguíneo entonces era reunido y helado a -20°C hasta el análisis posterior. Se analizaron las muestras plasmáticas para la hormona de crecimiento en suero, testosterona libre, IGF-1, IL-6, TNF-α, CRP y cortisol usando ensayos inmunométricos quimioluminiscentes de dos sitios de base sólida (Immulite; Intermedico, Holliston, MA). Los coeficientes de variación de estas hormonas estaban por debajo del 5% y todos los ensayos incluyeron normas externas y comprobaciones de calidad diarias. Las concentraciones de las hormonas son poco corregidas por los cambios en el volumen plasmático puesto que éstas son concentraciones a las que los tejidos designados como potenciales podrían ser expuestos.
CSA de la fibra muscular
Se obtuvieron biopsias musculares antes y después de los 16 semanas del período de entrenamiento del músculo vasto externo usado una aguja Bergström modificada de 5mm para la succión manual bajo anestesia local (2% xilocaína). Las muestras de biopsias musculares fueron llevadas a temperatura de corte óptima (OCT, optimal cutting temperature) y congeladas en líquido isopentano en preparación para el seccionamiento y análisis vía immunofluroescencia. Las secciones musculares de 7µm en el espesor fueron cortadas sobre un portaobjetos de vidrio y se dejaron enfriar a temperatura ambiente por 30 minuto antes de ser fijadas por 10 minutos en 4% de paraformaldehido. Luego se lavaron las secciones de 3x5min en salina tamponada con fosfato (PBS, phosphate buffered saline) con Tween, y bloqueadas por 1hr RT (en PBS que contenía 2% de albúmina de suero bovino, 5% de suero bovino fetal, 0.2% Tritón x-100, 0.1% ácida sódica, y 2% de suero de cabra). La incubación primaria del anticuerpo en Laminina (1:750, Abcam ab11575), en MHCI (puro, DSHB), y en MHCII (1:1000, Abcam ab91506) se completó en 2hr a RT o toda la noche a 4°C. La detección secundaria del anticuerpo incluyó Laminina (Alexa Fluor 488 goat anti-rabbit, 1:500, Invitrogen A11008), MHCI (Alexa Fluor 488 goat anti-mouse, 1:500, Invitrogen A11029), y MHCII (Alexa Fluor goat anti-rabbit, 1:500, Invitrogen A21244), por 2hr a RT. Los núcleos fueron revelados con DAPI (4',6-diamidino-2-fenilindole) (1:20000, Sigma DÍA-8417), seguido por cubreobjetos diapositivas con medios de montura fluorescentes (DAKO S3023). Las imágenes fueron reveladas con el microscopio Eclipse de Nikon 90i a 200x de amplificación y capturadas con una cámara QImaging fluorescente de alta definición (Nikon, Tokio, Japón). El CSA de las fibras se cuantificó manualmente en una manera ciega usando un sotware Nikon NIS Elements AR 3.0 en imágenes de gran escala consistentes en >100 fibras.
Estadística
Los cambios de pre- a post-entrenamiento con un único promedio fueron evaluados usando los T-tests de Student apareados. Las relaciones entre las variables fueron determinadas con la correlación del producto del momento de Pearson. Los cambios en el área de la fibra muscular se evaluaron con un ANOVA de 2 sentidos de medidas repetidas (tiempo por el tipo de fibra). Un modelo de regresión lineal múltiple por pasos fue usado para evaluar la contribución de varias variables independientes al cambio en el área de fibra promedio. Sólo esas variables independientes que fueron significativamente correlacionadas con los cambios en el área de fibra promedio y tenían probabilidades F menos de 0.05 en el modelo. El modelo con la proporción más alta de variación, que encontró los criterios anteriores, fue reportado. El Alpha fue fijado en P <0.05 y los resultados son reportados como promedios ±SD. Todos los análisis fueron llevados a cabo con el software SPSS versión 20 (IBM, Armonk, Nueva York).
RESULTADOS
Dieciséis semanas de entrenamiento de la fuerza produjeron un 61% de aumento en la fuerza isotónica medida en el press de piernas, y un aumento significativo tanto en el área de las fibras musculares de tipo I (18%; rango -22 a 106%) como las de tipo II (23%; rango -4 a 67%), con un aumento significativamente mayor en el área de la fibra de tipo II (P=0.011).
Como resultado del entrenamiento, hubo reducciones significativas en las concentraciones de reposo de testosterona libre, GH, cortisol y IGF-1. No hubo ningún cambio en la concentración de reposo de IL-6 o TNF-α; hubo un aumento, sin embargo, en la concentración de CRP (Tabla 1). El AUC (área bajo la curva) post-ejercicio agudo para la testosterona libre, la GH, y el IGF-1 disminuyó de pre- a post-entrenamiento. La magnitud de la respuesta aguda del cortisol, la IL-6, el TNF-α y de CRP fue inalterada después de 16 semanas de entrenamiento de la fuerza (Tabla 2). El contenido promedio de proteína del AR muscular estuvo sin cambios después del período de entrenamiento; hubo una correlación significativa, sin embargo, entre el cambio en el contenido del AR y el aumento en el área de fibra promedio (Figura 1). La fosforilación de la p70S6K no se incrementó por encima del reposo a 1 hs después de un turno agudo de ejercicio de fuerza, pero fue significativamente mayor a las 5 hs post-ejercicio (Figura 2a). La fosforilación de la p70S6K (veces que cambió) a las 5h se correlacionó con los cambios en el área de la fibra muscular (Figura 2b). No hubo ninguna relación entre las respuestas post-ejercicio del AUC de la testosterona libre, la GH, y el IGF-1 medidas antes (Tabla 3) o después (testosterona libre: r=0.02, P = 0.932, GH: r=0.37, P = 0.079, IGF-1: r=-0.25, P = 0.249) de 16 semanas de entrenamiento de la fuerza y los cambios en el CSA de área de fibra muscular promedio (Tabla 3). Hubo una relación significativa entre la respuesta aguda de la IL-6 tanto pre- (Figura 3) como post-entrenamiento (r=0.47, P = 0.023) y los aumentos en el CSA de fibra de músculo promedio. Un modelo de regresión lineal múltiple por pasos reveló que sólo dos variables respondieron en una proporción significativa de variación relacionada al cambio inducido por el entrenamiento en el área de fibra promedio: el cambio en el contenido de proteína del AR y la magnitud de la fosforilación de la p70S6K a las 5h (Tabla 4). El R2 del modelo después del ajuste para las variables múltiples fue 0.46. Aunque el AUC de la IL-6 se correlacionó significativamente con los cambios en el área de fibra promedio, no fue incluido porque la probabilidad de F al ser incluido en el modelo, era mayor que 0.05.
Tabla 1. Valores pre- y post-entrenamiento de las concentraciones de hormonas y citocinas de reposo, del área del corte transversal de la fibra del músculo, y la fuerza
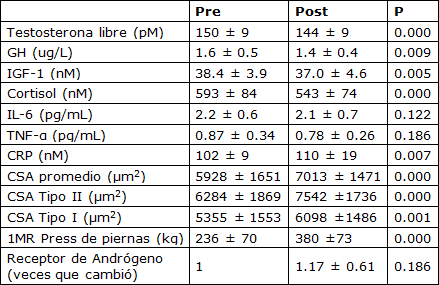
GH - hormona de crecimiento, IL-6 - interleucina 6, IGF-1 - factor-1 de crecimiento como la insulina, TNF-α factor de necrosis tumoral alfa, CRP - proteína C-reactiva, CSA - área del corte transversal, 1MR - fuerza de única repetición máxima.
Tabla 2. Valores pre- y post-entrenamiento del área bajo la curva de las respuestas agudas de las hormonas y las citocinas a un único turno de ejercicio de fuerza.CSV
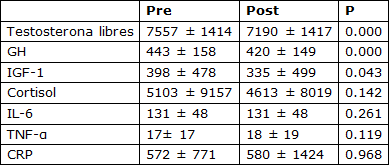
GH - hormona de crecimiento, IL-6 - interleucina 6, IGF-1 - factor-1 de crecimiento como la insulina, TNF-α factor de necrosis tumoral alfa, CRP - proteína C-reactiva. La zona bajo la curva fue calculada en base a las concentraciones en suero inmediatamente después del ejercicio y, 15, 30 y 60 minutos después del ejercicio con los valores básicos (de reposo) substraídos. Los valores del AUC están presentados en unidades arbitrarias.
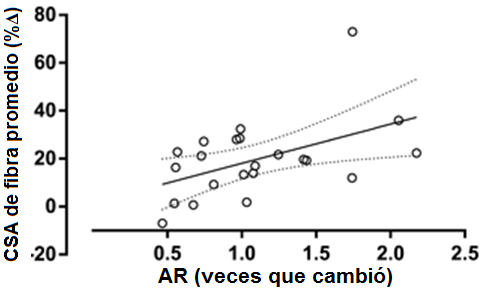
Figura 1. Correlación entre las veces que cambió en el contenido de proteína del AR muscular y los cambios en área de fibra de músculo esquelético después de 16 semanas de entrenamiento de la fuerza. r = 0.60, P=0.003.
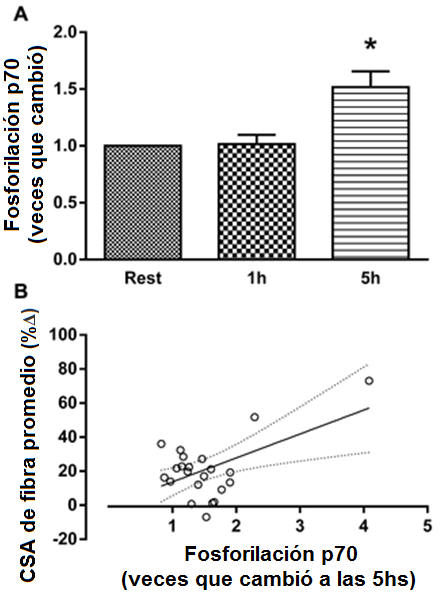
Figura 2. La fosforilación de la p70S6K después de un turno agudo de ejercicio de fuerza antes de las 16 semanas de entrenamiento de la fuerza y el porcentaje de cambio en el área de fibra promedio del músculo esquelético después del entrenamiento * P <0.05.
A) Veces que cambió la fosforilación de la P70S6K. B) Correlación entre las veces que cambió a las 5hs de la fosforilación de la P70S6K y el porcentaje de cambio en el área de fibra promedio del músculo esquelético después del período de entrenamiento. r = 0.54, P = 0.007.
Tabla 3. Correlaciones de Pearson entre las respuestas de pre-entrenamiento de hormonas, citocinas, y receptor del andrógeno (AR), y cambios en el área del corte transversal de la fibra del músculo (CSA) después del entrenamiento.
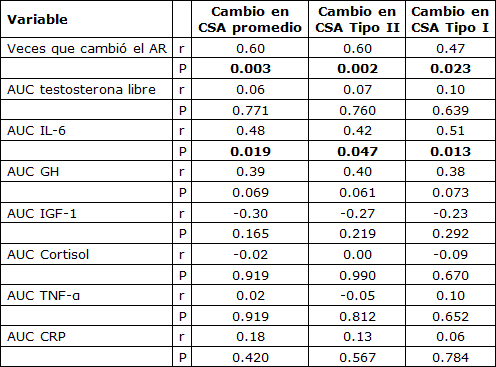
GH - hormona de crecimiento, IL-6 - interleucina 6, AR –receptor del andrógeno, IGF-1 - factor-1 de crecimiento como la insulina, TNF-α factor de necrosis tumoral alfa, CRP - proteína C-reactiva, CSA - área del corte transversal, 1MR - fuerza de única repetición máxima. CSV
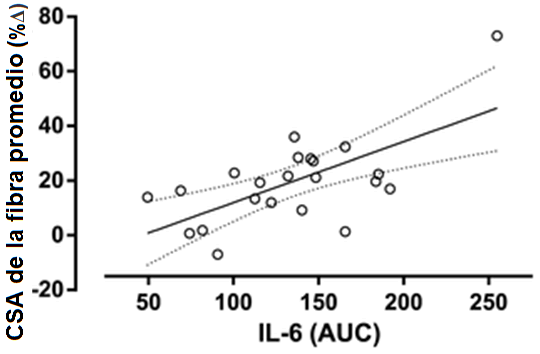
Figura 3. Correlación entre el AUC de la respuesta aguda de la IL-6 al ejercicio de fuerza antes de las 16 semanas de entrenamiento de la fuerza y el porcentaje de cambio en el área de fibra promedio del músculo esquelético después de 16 semanas de entrenamiento de la fuerza. r=0.48, P = 0.019.
Tabla 4. Modelo de regresión múltiple paso a paso.
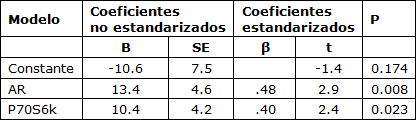
AR – Variable dependiente que fue el porcentaje de cambio en el área de fibra promedio.
DISCUSIÓN
Como con muchos cambios fenotípicos con el ejercicio físico, la hipertrofia muscular en respuesta al entrenamiento de la fuerza muestra un alto grado de variabilidad, el origen de eso es desconocido [10,11]. Nosotros descubrimos que el aumento en el contenido de proteína del AR con el entrenamiento de la fuerza, la magnitud del aumento agudo en la fosforilación de la p70S6K, y la respuesta de la IL-6 a un turno agudo de ejercicio de fuerza, se correlacionaron significativamente con la magnitud de la hipertrofia de la fibra muscular en una cohorte de tamaño moderado de hombres jóvenes después de 16 semanas de entrenamiento. Usando un análisis de regresión múltiple, encontramos que sólo los cambios en el contenido del AR y la fosforilación de la p70S6K fueron las variables significativas en un modelo que dio cuenta del 46% de la variación en la respuesta hipertrófica. Nuestros resultados también corroboran el trabajo previo de nuestro laboratorio que no muestra ninguna relación entre el aumento agudo en la testosterona libre circulante, IGF-1, o GH y la magnitud de la hipertrofia muscular después del entrenamiento [19].
El rol exacto del AR en la hipertrofia muscular tiene que ser aún elucidado. La abundancia del mARN del AR muscular no aumenta luego del ejercicio de fuerza agudamente pero tiende a aumentar 48h después de un turno agudo de ejercicio de fuerza [22,23]. Este patrón del mARN del AR en la regulación persiste por al menos tres sesiones de entrenamiento pero no parece ser conservado con el entrenamiento a largo plazo [31]. Nuestro estudio corrobora los resultados previos de que la expresión de proteína promedio del AR no fue aumentado luego del entrenamiento de la fuerza mayor; sin embargo, la respuesta tuvo una marcada heterogeneidad, con algunos sujetos que demuestran un marcado aumento (1.5 - 2.5 veces) en el contenido de proteína del AR [23]. A pesar de ningún cambio estadísticamente significativo en el contenido de proteína del receptor AR, hubo una correlación entre el contenido de proteína del AR con la hipertrofia de la fibra. Nuestros resultados indican que los cambios en el contenido del AR puede ser parte de una respuesta músculo-específica presente en un grado mayor en 'respondedores' y responsable de algo (~25%) de la variación en la hipertrofia de la fibra de músculo [32].
La vía proteína kinasa B (Akt) - diana de rapamicina en células de mamífero (mTOR) se piensa que es críticamente importante en la regulación de la síntesis de proteínas del músculo y la hipertrofia. Aunque el complejo de la mTOR es un regulador importante de la síntesis de proteínas, la fosforilación simple de la mTOR nunca se ha demostrado para correlacionarse con la síntesis de proteínas del músculo o hipertrofia, así que no fue medida en este estudio. La proteína kinasa p70S6K es un blanco de la mTOR y su fosforilación aguda luego del ejercicio de fuerza se ha reportado de correlacionarse con la hipertrofia muscular después del entrenamiento [27,33]; sin embargo, no todos los estudios han encontrado una relación [6,34]. Nosotros no vimos los aumentos en la fosforilación de la p70S6K 1hs después del ejercicio, sin embargo, la fosforilación fue elevada 5hs post-ejercicio. La fosforilación a las 5hs se correlacionó con la hipertrofia muscular indicando que los individuos que demostraron una fosforilación más tardía (5h) de la p70S6K pueden exhibir mayor hipertrofia. En este estudio, el estado de fosforilación en ayuno basal fue comparado al estado de fosforilación de cada 'blanco' después de un turno de ejercicio agudo y de la ingesta de una bebida que contenía 30g de proteínas. Es posible que los resultados observados fueran en parte debido a los efectos de la nutación sola [35]. Nosotros seleccionamos examinar la fosforilación aguda de proteínas en respuesta al ejercicio combinado y la nutrición porque la provisión de proteínas post-ejercicio produce una mayor hipertrofia luego del entrenamiento [28] y a los sujetos se les dio un suplemento de proteínas idéntico después de cada entrenamiento.
La falta de correlación entre la testosterona libre y la hipertrofia muscular está en línea con el trabajo previo de nuestro laboratorio [19,36]. Las dosis suprafisiológicas de testosterona dramáticamente mejoran la hipertrofia muscular inducida por el entrenamiento de la fuerza [37]; en contraste, hallazgos actuales y previos [19,36], podrían explicar los resultados de ninguna relación entre la elevación aguda en la testosterona y la hipertrofia muscular en una de dos maneras. Primero, otros factores locales son más importantes en la regulación de la hipertrofia muscular, y entonces la testosterona es meramente una hormona permisiva dentro de su rango fisiológico normal y sólo tiene efectos durante estados hipo- o hiper-testosteronémicos. La otra posible explicación es que la concentración intramuscular de testosterona, donde es más activa y ligada a su proteína receptora, se relaciona pobremente a su concentración en la circulación. Así, la medición después del ejercicio de las concentraciones de testosterona circulante no es un marcador para, o de alguna forma relaciona a, la hipertrofia del músculo esquelético; sin embargo, la testosterona intramuscular, o la formación del complejo testosterona-AR, puede ser un importante regulador de la síntesis de proteínas e hipertrofia muscular.
Se piensa que el IGF-1 es un regulador potencial de la hipertrofia muscular que actúa directamente a través de la vía Akt/mTOR [38] así como co-localizando con las células satélite después del ejercicio de fuerza [39]. Está propuesto que el IGF-1 parácrino o autócrino, juega un rol importante en la hipertrofia [40]. Hay poca evidencia, sin embargo, de que el IGF-1 derivado del hígado, mediado a través de la liberación vía el eje GH-IGF-1, y medido en la circulación, se relacione a los niveles en el músculo. De hecho, un reciente estudio de Nindl y colegas, demostró que no había ninguna relación entre el IGF-1 medido en sangre y el contenido de proteína del IGF-1 dentro del músculo [41]. La falta de correlación entre la hipertrofia muscular e el IGF-1 medido en la sangre observada en este estudio no es sorprendente en la luz del trabajo de Nindl y cols., que no ha mostrado ninguna relación entre la proteína del IGF-1 en el músculo o espacio intersticial y el IGF-1 en la sangre [41].
Nosotros observamos una correlación entre la magnitud de la respuesta de la IL-6 post-ejercicio y la hipertrofia de la fibra. Nosotros también encontramos que la IL-6 de reposo pre-entrenamiento se correlacionó inversamente con la hipertrofia de la fibra. La IL-6 está asociada con la degradación de proteína muscular y el señalamiento JAK/STAT en las células satélite, que está vinculado a la hipertrofia muscular [24]. Los niveles altos de IL-6 de reposo son visto con el envejecimiento, la inflamación sistémica y están asociados con los mayores niveles de adiposidad visceral [25,42,43]. Al contrario, la IL-6 es liberada después del ejercicio desde el músculo y aunque hay una subida pronunciada en la circulación sistémica, es probable que los principales efectos post-ejercicio sean autócrinos o parácrinos dentro del músculo [24,44]. A pesar de las correlaciones observadas de la respuesta aguda de la IL-6 en suero y la hipertrofia que nosotros reportamos aquí, cuando se agregó a un modelo de regresión múltiple, la influencia de la IL-6 circulante es menor por comparación a las medidas de factores músculo-específicos: el AR y la p70S6K. La respuesta de IL-6 en suero inmediatamente después del ejercicio puede ser una versión 'diluido' de la respuesta dentro del músculo activo; de esta manera, la medición de la IL-6 en el propio músculo sería preferible a las concentraciones sanguíneas.
El modelo de regresión lineal múltiple demostró que los términos significativos del modelo para la magnitud del aumento del área de la fibra muscular promedio fueron el cambio en el contenido de proteína del AR (ß=0.480) y el grado de fosforilación de la p70S6K 5 horas después de un turno agudo de ejercicio de fuerza (ß=0.404). Aunque la respuesta aguda de la IL-6 se correlacionó con los cambios en el área de fibra promedio, no agregó a la variación en la hipertrofia explicada por el modelo y por lo cual no fue incluida. Nuestro modelo muestra que los factores intrínsecos dentro del músculo explican más la única variación en la respuesta hipertrófica comparado con los factores circulantes. El modelo también mostró que la fosforilación de la p70S6K y el contenido de proteína del AR explicó la única variación en las ganancias del área de fibra promedio y así ellos, sin embargo, estén actuando probablemente sobre vías diferentes o ellos representan efectos agudos y crónicos en una vía vinculada puesto que la fosforilación de la p70S6K fue una medida aguda mientras que los cambios del receptor del AR representan un cambio durante las 16 semanas del período de entrenamiento.
Durante el período de estudio, los sujetos consumieron una bebida que contenía 30 g de proteína después de cada sesión de entrenamiento y con el desayuno en los días de no-entrenamiento. Los sujetos se abstuvieron de consumir cualquier suplemento adicional y nosotros les sugerimos que ingieran sus comidas que constituyen su dieta normal ad libitum. Parece poco probable que la energía total o la ingesta de proteínas sean contribuyentes sustanciales entre la variabilidad de los sujetos en la hipertrofia muscular después del entrenamiento de la fuerza; el trabajo previo no ha mostrado ninguna diferencia en la ingesta dietética auto-reportada entre respondedores extremos y no-respondedores al entrenamiento de la fuerza [45]. Sería ideal para los estudios a futuro, controlar la ingesta dietética herméticamente proporcionando la comida a los sujetos para eliminar cualquier efecto potencial de la ingesta dietética, sin embargo, esto sería logísticamente difícil, caro, y, nosotros proponemos, poco probablemente permitir a un 'no respondedor' volverse un 'sí respondedor' en términos de hipertrofia.
En el estudio actual, nosotros elegimos medir la hipertrofia muscular con el análisis del área de la fibra muscular. El patrón de los resultados fue idéntico para ambos tipo I y tipo II de las fibras musculares, por esta razón nosotros usamos el área de fibra promedio para nuestro modelo de regresión múltiple. Nosotros no pudimos diferenciar entre los subtipos de fibra (IIa o IIx) o fibra híbrida, lo cual es una pequeña limitación de este estudio. Un homogenato del músculo entero se usó para el análisis del AR y de la p70S6K para tener una mejor comprensión mecánica de la hipertrofia específica del tipo de fibra, por lo que los estudios futuros deberían comparar homogenatos aislados del tipo de fibra específico con la hipertrofia en solamente fibras del mismo tipo.
La hipertrofia muscular es principalmente, si no completamente, un proceso conducido por el músculo que se regula fundamentalmente por mecanismos intrínsecos al músculo en lugar de factores sistémicos que aparecen permisivos hasta que hiper- o hipo-estados extremos estén presentes. Los cambios en el contenido del AR y la fosforilación de la p70S6K, o como nosotros hemos reportado previamente que la expresión del microARN músculo-específico (miARN) mi451 [13], dentro del músculo da cuenta mayormente de la variabilidad en la hipertrofia muscular inducida por entrenamiento, comparado a medir las hormonas anabólicas putativas múltiples (la T, la GH, el IGF-1) en la circulación sistémica. Mientras nosotros observamos una correlación significativa entre la IL-6 circulante y la hipertrofia, cuando esto se agregó a un modelo que contenía las mediciones de la IL-6 de proteínas musculares, no dio cuenta de cualquier variación adicional en la respuesta hipertrófica. La capacidad para predecir una respuesta fenotípica al entrenamiento en base a las variables medidas después de una única sesión de ejercicio de fuerza, tiene algo de apoyo al medir las variables músculo-específicas [13,14]; sin embargo, los estudios futuros deben enfocarse en cuantificar los factores intrínsecos al músculo o rastros moleculares sistémicos, no de únicas o múltiples hormonas que podrían actuar como substitutos para los reguladores intrínsecos relevantes musculares de la hipertrofia. Los marcadores intrínsecos al músculo esquelético como el AR, la p70S6K, miARN, o perfiles transcriptómicos, explicarían mucho más la variación en la hipertrofia muscular luego de un entrenamiento de la fuerza, que los factores sistémicos como la T, la GH, el cortisol o el IGF-1.
Referencias
1. Phillips SM (2000). Short-term training: when do repeated bouts of resistance exercise become training? Can J Appl Physiol 25: 185-193.
2. Phillips SM (2004). Protein requirements and supplementation in strength sports. Nutrition 20: 689-695. doi:10.1016/j.nut.2004.04.009.
3. Burd NA, Holwerda AM, Selby KC, West DW, Staples AW et al. (2010). Resistance exercise volume affects myofibrillar protein synthesis and anabolic signalling molecule phosphorylation in young men. J Physiol 588: 3119-3130.
4. Burd NA, West DW, Staples AW, Atherton PJ, Baker JM et al. (2010). Low-load high volume resistance exercise stimulates muscle protein synthesis more than high-load low volume resistance exercise in young men. PLOS ONE 5: e12033.
5. Burd NA, Andrews RJ, West DW, Little JP, Cochran AJ et al. (2012). Muscle time under tension during resistance exercise stimulates differential muscle protein sub-fractional synthetic responses in men. J Physiol 590: 351-362.
6. Mitchell CJ, Churchward-Venne TA, West DW, Burd NA, Breen L et al. (2012). Resistance exercise load does not determine training-mediated hypertrophic gains in young men. J Appl Physiol 113: 71-77.
7. Ahtiainen JP, Pakarinen A, Alen M, Kraemer WJ, Häkkinen K (2005). Short vs. long rest period between the sets in hypertrophic resistance training: influence on muscle strength, size, and hormonal adaptations in trained men. J Strength Cond Res 19: 572-582.
8. Campos GE, Luecke TJ, Wendeln HK, Toma K, Hagerman FC et al. (2002). Muscular adaptations in response to three different resistance-training regimens: specificity of repetition maximum training zones. Eur J Appl Physiol 88: 50-60.
9. de Souza TP Jr, Fleck SJ, Simão R, Dubas JP, Pereira B et al. (2010). Comparison between constant and decreasing rest intervals: influence on maximal strength and hypertrophy. J Strength Cond Res 24: 1843-1850.
10. Hubal MJ, Gordish-Dressman H, Thompson PD, Price TB, Hoffman EP et al. (2005). Variability in muscle size and strength gain after unilateral resistance training. Med Sci Sports Exerc 37: 964-972.
11. Hartman JW, Tang JE, Wilkinson SB, Tarnopolsky MA, Lawrence RL et al. (2007). Consumption of fat-free fluid milk after resistance exercise promotes greater lean mass accretion than does consumption of soy or carbohydrate in young, novice, male weightlifters. Am J Clin Nutr 86: 373-381.
12. Bamman MM, Petrella JK, Kim JS, Mayhew DL, Cross JM (2007). Cluster analysis tests the importance of myogenic gene expression during myofiber hypertrophy in humans. J Appl Physiol 102: 2232-2239.
13. Davidsen PK, Gallagher IJ, Hartman JW, Tarnopolsky MA, Dela F et al. (2011). High responders to resistance exercise training demonstrate differential regulation of skeletal muscle microRNA expression. J Appl Physiol 110: 309-317.
14. Petrella JK, Kim JS, Mayhew DL, Cross JM, Bamman MM (2008). Potent myofiber hypertrophy during resistance training in humans is associated with satellite cell-mediated myonuclear addition: a cluster analysis. J Appl Physiol 104: 1736-1742.
15. Kraemer WJ, Dunn-Lewis C, Comstock BA, Thomas GA, Clark JE et al. (2010). Growth hormone, exercise, and athletic performance: a continued evolution of complexity. Curr Sports Med Rep 9: 242-252.
16. Kraemer WJ, Ratamess NA (2005). Hormonal responses and adaptations to resistance exercise and training. Sports Med 35: 339-361.
17. McCall GE, Byrnes WC, Fleck SJ, Dickinson A, Kraemer WJ (1999). Acute and chronic hormonal responses to resistance training designed to promote muscle hypertrophy. Can J Appl Physiol 24: 96-107.
18. Ahtiainen JP, Pakarinen A, Alen M, Kraemer WJ, Häkkinen K (2003). Muscle hypertrophy, hormonal adaptations and strength development during strength training in strength-trained and untrained men. Eur J Appl Physiol 89: 555-563.
19. West DW, Phillips SM (2012). Associations of exercise-induced hormone profiles and gains in strength and hypertrophy in a large cohort after weight training. Eur J Appl Physiol 112: 2693-2702.
20. Vingren JL, Kraemer WJ, Ratamess NA, Anderson JM, Volek JS et al. (2010). Testosterone physiology in resistance exercise and training: the up-stream regulatory elements. Sports Med 40: 1037-1053.
21. Kraemer WJ, Ratamess NA (2005). Hormonal Responses and Adaptations to Resistance Exercise and Training. Sports Med 35: 339-361.
22. Bamman MM, Shipp JR, Jiang J, Gower BA, Hunter GR et al. (2001). Mechanical load increases muscle IGF-I and androgen receptor mRNA concentrations in humans. Am J Physiol Endocrinol Metab 280: E383-E390.
23. Ahtiainen JP, Hulmi JJ, Kraemer WJ, Lehti M, Nyman K et al. (2011). Heavy resistance exercise training and skeletal muscle androgen receptor expression in younger and older men. Steroids 76: 183-192.
24. McKay BR, De Lisio M, Johnston AP, O’Reilly CE, Phillips SM et al. (2009). Association of interleukin-6 signalling with the muscle stem cell response following muscle-lengthening contractions in humans. PLOS ONE 4: e6027.
25. Fonseca JE, Santos MJ, Canhão H, Choy E (2009). Interleukin-6 as a key player in systemic inflammation and joint destruction. Autoimmun Rev 8: 538-542.
26. Orsatti FL, Nahas EA, Orsatti CL, de Oliveira EP, Nahas-Neto J et al. (2012). Muscle mass gain after resistance training is inversely correlated with trunk adiposity gain in postmenopausal women. J Strength Cond Res 26: 2130-2139.
27. Terzis G, Georgiadis G, Stratakos G, Vogiatzis I, Kavouras S et al. (2008). Resistance exercise-induced increase in muscle mass correlates with p70S6 kinase phosphorylation in human subjects. Eur J Appl Physiol 102: 145-152.
28. Cermak NM, Res PT, de Groot LC, Saris WH, van Loon LJ (2012). Protein supplementation augments the adaptive response of skeletal muscle to resistance-type exercise training: a meta-analysis. Am J Clin Nutr 96: 1454-1464.
29. Churchward-Venne TA, Burd NA, Mitchell CJ, West DW, Philp A et al. (2012). Supplementation of a suboptimal protein dose with leucine or essential amino acids: effects on myofibrillar protein synthesis at rest and following resistance exercise in men. J Physiol 590: 2751-2765.
30. Laemmli UK (1970). Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227: 680-685.
31. Willoughby DS, Taylor L (2004). Effects of sequential bouts of resistance exercise on androgen receptor expression. Med Sci Sports Exerc 36: 1499-1506.
32. Timmons JA (2011). Variability in training-induced skeletal muscle adaptation. J Appl Physiol 110: 846-853.
33. Baar K, Esser K (1999). Phosphorylation of p70(S6k). correlates with increased skeletal muscle mass following resistance exercise. Am J Physiol 276: C120-C127.
34. Phillips BE, Williams JP, Gustafsson T, Bouchard C, Rankinen T et al. (2013). Molecular Networks of Human Muscle Adaptation to Exercise and Age. PLOS Genet 9: e1003389.
35. Dickinson JM, Fry CS, Drummond MJ, Gundermann DM, Walker DK et al. (2011). Mammalian target of rapamycin complex 1 activation is required for the stimulation of human skeletal muscle protein synthesis by essential amino acids. J Nutr 141: 856-862. doi:10.3945/jn.111.139485.
36. West DW, Burd NA, Tang JE, Moore DR, Staples AW et al. (2010). Elevations in ostensibly anabolic hormones with resistance exercise enhance neither training-induced muscle hypertrophy nor strength of the elbow flexors. J Appl Physiol 108: 60-67.
37. Bhasin S, Storer TW, Berman N, Callegari C, Clevenger B et al. (1996). The effects of supraphysiologic doses of testosterone on muscle size and strength in normal men. N Engl J Med 335: 1-7.
38. Rommel C, Bodine SC, Clarke BA, Rossman R, Nunez L et al. (2001). Mediation of IGF-1-induced skeletal myotube hypertrophy by PI(3). K/Akt/mTOR and PI(3).K/Akt/GSK3 pathways. Nat Cell Biol 3: 1009-1013.
39. McKay BR, O’Reilly CE, Phillips SM, Tarnopolsky MA, Parise G (2008). Co-expression of IGF-1 family members with myogenic regulatory factors following acute damaging muscle-lengthening contractions in humans. J Physiol 586: 5549-5560.
40. Adams GR (2002). Invited Review: Autocrine/paracrine IGF-I and skeletal muscle adaptation. J Appl Physiol 93: 1159-1167.
41. Nindl BC, Urso ML, Pierce JR, Scofield DE, Barnes BR et al. (2012). IGF-I measurement across blood, interstitial fluid, and muscle biocompartments following explosive, high-power exercise. Am J Physiol Regul Integr Comp Physiol 303: R1080-R1089.
42. Park HS, Park JY, Yu R (2005). Relationship of obesity and visceral adiposity with serum concentrations of CRP, TNF-alpha and IL-6. Diabetes Res Clin Pract 69: 29-35.
43. Daynes RA, Araneo BA, Ershler WB, Maloney C, Li GZ et al. (1993). Altered regulation of IL-6 production with normal aging. Possible linkage to the age-associated decline in dehydroepiandrosterone and its sulfated derivative. J Immunol 150: 5219-5230.
44. Febbraio MA, Pedersen BK (2002). Muscle-derived interleukin-6: mechanisms for activation and possible biological roles. FASEB J 16: 1335-1347.
45. Thalacker-Mercer AE, Petrella JK, Bamman MM (2009). Does habitual dietary intake influence myofiber hypertrophy in response to resistance training? A cluster analysis. Appl Physiol Nutr Metab 34: 632-639.
Cita Original
Mitchell CJ, Churchward-Venne TA, Bellamy L, Parise G, Baker SK, Phillips SM (2013). Muscular and Systemic Correlates of Resistance Training-Induced Muscle Hypertrophy. PLoS ONE 8(10).: e78636. doi:10.1371/journal.pone.0078636
Cita en Rev Entren Deport
Cameron J. Mitchell, Tyler A. Churchward-Venne, Leeann Bellamy, Gianni Parise, Steven K. Baker Stuart M. Phillips (2019). Correlaciones Musculares y Sistémicas de la Hipertrofia Muscular Inducida por el Entrenamiento de la Fuerza. . (2).https://g-se.com/correlaciones-musculares-y-sistemicas-de-la-hipertrofia-muscular-inducida-por-el-entrenamiento-de-la-fuerza-2131-sa-K57cfb27281306
