Cinética de la Glucosa Durante el Ejercicio Prolongado en Sujetos Humanos Altamente Entrenados: Efecto de la de Glucosa
Asker Jeukendrup1, William H Saris1, Anton J Wagenmakers1, Anne Raben1, Annemie Gijsen1, Jos H Stegen1, Fred Brouns11 Nutrition Research Center, Department of Human Biology, Maastricht University, Maastricht, The Neterlands.
Resumen
1. Los objetivos de este estudio fueron: 1) investigar si la de glucosa
durante el ejercicio prolongado reduce la oxidación de glucógeno muscular
corporal total; 2) determinar el grado en el cual la glucosa que desaparece
del plasma es oxidada durante el ejercicio, con o sin de carbohidratos; y 3)
obtener una estimación de la gluconeogénesis.
2. Luego de un ayuno nocturno, seis ciclistas bien entrenados ejercitaron en
tres ocasiones, por 120 min, en una bicicleta ergométrica al 50% del consumo
máximo de O2, mientras ingerían agua (ayuno), una solución al 4% de
glucosa (Ba-Glu ) o una solución al 22 % de glucosa (Al-Glu), durante el
ejercicio.
3. Se les dio una infusión trazadora dual de [U-13C]- glucosa y
[6,6- 2H2]- glucosa para medir tasa de aparición (Ta) de
glucosa, oxidación de glucógeno muscular, reciclaje de carbonos de glucosa,
tasa de “clearance” metabólico (TCM), y la disponibilidad de glucosa no
oxidativa.
4. La ingesta de glucosa incrementó marcadamente la Ta total especialmente
con Al-Glu. Luego de 120 min la Ta y la tasa de desaparición (Td) de glucosa
fueron de 51-52 μmol/kg/min durante la condición Ayuno, 73-74 μmol/kg/min
durante Ba-Glu, y 117 μmol/kg/min durante Al-Glu. El porcentaje de Td oxidada
estuvo entre 96 y 100% en todas las pruebas.
5. La oxidación de glucógeno durante el ejercicio no fue reducida por la
ingesta de glucosa. La vasta mayoría de glucosa que desaparece del plasma es
oxidada, y la TCM se incrementa marcadamente con la ingesta de glucosa. El
reciclaje de carbonos de glucosa fue mínimo, sugiriendo que la gluconeogénesis,
en estas condiciones no es significativo.
Palabras Clave: oxidación de glucosa, ejercicio, suplementación con glucosa
INTRODUCCION
Durante los últimos 15 años muchos estudios demostraron que la suplementación con carbohidratos (CHO) durante el ejercicio prologado puede demorar el comienzo de la fatiga y mejorar el rendimiento durante en el ejercicio (Coyle et al. 1983, 1986 Hargreaves et al. 1984; Coggan & Coyle, 1987, 1988; Murray et al. 1987; Jeukendrup et al. 1997ą). Las mejorías observadas en el rendimiento con la ingesta de carbohidratos fueron atribuidas al mantenimiento de la disponibilidad de glucosa en plasma y de altas tasas de oxidación de carbohidratos durante las últimas etapas del ejercicio, cuando el glucógeno muscular está próximo a ser depletado (Coggan & Coyle, 1987, 1988). Sin embargo, otros estudios sugirieron que la ingesta de carbohidratos puede mejorar el rendimiento de resistencia haciendo más lenta la tasa de degradación de glucógeno (Coyle et al. 1984; Hargreaves et al.1984 Bjorkman et al. 1984; Tsintzas et al. 1995, 1996). Por ejemplo Tsintzas et al (1995, 1996) demostraron que la degradación neta de glucógeno muscular luego de la ingesta de carbohidratos durante la carrera al 70% del consumo máximo de O2 (VO2 máx) fue reducida, y ese “ahorro de glucógeno” se produjo casi exclusivamente en las fibras musculares tipo I. Estos resultados contrastan con los hallazgos de Coyle et al. (1986) quienes demostraron que la degradación de glucógeno no fue reducida por la ingesta de carbohidratos, en ciclistas entrenados que ejercitaban al 70% VO2 máx.
La síntesis neta de glucógeno durante el ejercicio podría implicar que la glucosa captada por el músculo desde la sangre sea utilizada par la síntesis de glucógeno en lugar de ser oxidada. Coggan et al. (1991) reportaron datos de un sujeto que mostraban que el 93% de la glucosa que desaparecía del plasma era oxidada, cuando se ingería glucosa durante la segunda hora de ejercicio al 70% VO2 máx. Sin embargo, otros han reportado tasas de oxidación que excedieron la tasa de Td de glucosa (Boch et al.1994), o valores que fueron considerablemente mas bajos (33-50 umol /kg/min) (Collberg et al.1994; Roberts et al.1996). El segundo propósito del presente estudio, por lo tanto, es investigar cuanta de la glucosa que desaparece del plasma es oxidada en presencia o ausencia de ingesta de glucosa.
Poco se sabe acerca del rol de la gluconeogénesis durante el ejercicio (MacRae et al.1995), y del efecto de la ingesta de la glucosa sobre la gluconeogénesis. El reciclaje de carbono de glucosa, medido por trazadores dobles fue utilizado como método para estimar la gluconeogénesis.
Para estudiar el reciclaje de carbonos de glucosa, comparamos la tasa de aparición de glucosa (Ta), medido con un trazador [6,6 – 2H2] – glucosa ( GC- MS ) y un marcador [U-13C]- glucosa (CG-IRMS) durante el ejercicio. Con la ingesta de glucosa, la gluconeogénesis puede estar suprimida y nosotros hipotetizamos que el reciclaje de carbonos de glucosa podría disminuir con la ingesta de glucosa.
En resumen, el propósito principal del presente estudio fue investigar si la ingesta de carbohidratos puede reducir la oxidación de glucógeno muscular, medida a nivel de todo el cuerpo con el método indirecto del trazador isotópico estable. El propósito secundario fue determinar el porcentaje de glucosa que desaparece del plasma es oxidada durante el ejercicio, y cuantificar la disponibilidad de glucosa no oxidada con y sin ingesta de carbohidratos. Un tercer propósito fue investigar el reciclaje de carbonos de glucosa como medida del proceso de gluconeogénesis y ver si la ingesta de glucosa podría suprimir la gluconeogénesis.
METODOS
Sujetos
Seis ciclistas altamente entrenados participaron de este estudio. Sus edades y pesos promedio fueron de 24 ± 2 años y 68 ± 1 kg. Luego de explicarles a los sujetos la naturaleza y los riesgos de los procedimientos experimentales, se obtuvo su consentimiento escrito. El estudio fue aprobado por el Comité Ético Médico local.
Evaluación previa
Se midió el VO2 máx de los sujetos en una bicicleta ergométrica (LODE Excalibur Sport, Groningen, Holanda) durante un test progresivo de ejercicio hasta el agotamiento (Kuipers et al. 1985), una semana antes de la primera prueba experimental, y se encontró que fue de 76 ± 1 ml/kg/min. La máxima tasa de trabajo durante el test de ejercicio progresivo fue de 397 ± 10 W. Los resultados de este test fueron utilizados para determinar la carga del 50 % VO2 máx, la que posteriormente fue empleada en las pruebas experimentales.
Pruebas experimentales
Cada sujeto realizó seis pruebas de ejercicio, cada una separada por al menos siete días. El orden de estas pruebas fue determinado por un diseño cuadrado Latino. Cada prueba consistió de 120 min de pedaleo al 50 % VO2 máx.
Los sujetos ingirieron bebidas que no contenían glucosa (Ayuno), una solución de 4,4 % de glucosa (Ba-Glu) o una solución al 22% de glucosa (Al-Glu). Cada prueba con una de estas bebidas fue repetida, una vez con la infusión isotópica, y una sin infusión, para permitir la corrección de los cambios en el enriquecimiento de 13CO2 en la respiración, durante el ejercicio.
Protocolo
Los sujetos se reportaron en el laboratorio a las 08:00 hs, luego de un ayuno nocturno. Se les insertó un catéter de Teflón (Baxter Quick Cath Dupont, Uden, Holanda) en la vena antecubital de un brazo, y a las 8.30 hs se les extrajo una muestra sanguínea de reposo de 10 ml. En la vena antecubital contra-lateral se les insertó un segundo catéter de Teflón para la infusión isotópica. Fueron recolectados los gases de respiración en reposo durante períodos de 5 min (Oxyconá. Mijnhardt, Mannheim, Alemania), y se llenaron tubos de vacío directamente desde la cámara mezcladora para determinar el cociente 13C/12C en el CO2 espirado. En todas las figuras, el punto de tiempo 0 se refiere a esta muestra de reposo. A las 8.55 hs los sujetos comenzaron un protocolo de entrada en calor de 5 min pedaleando con una carga de 100 W. Además, a las 8.55 hs se les dio un preparado de bicarbonato de sodio (5.5 μmol/kg Na H13CO3; Cambridge Isotope Laboratories, USA), y un preparado de [U-13C]- glucosa (Cambridge Isotope Laboratories, USA) (dosis equivalente a una hora de infusión). Luego de ello, se comenzó con una infusión continua de [6,6-2H2]- glucosa y [U-13C]- glucosa estéril, libre de pirógenos, utilizando una bomba calibrada IVAC 560 (San Diego, CA). Se midió la concentración de isótopos en la solución infundida para cada experimento, de manera tal que pudiera ser determinada la tasa exacta de infusión.
Las tasas de infusión fueron 0.234 ± 0.01 y 0-032 ± 0.02 μmol/kg/min para [6,6-2H2]- glucosa, y [U-13C]- glucosa, respectivamente.
A las 9.00 hs se incrementó la carga de trabajo al 50% VO2 máx por 120 min. Durante el primer minuto los sujetos bebieron un bolo inicial 8 mL/kg de una de las soluciones de glucosa (24 gr de glucosa durante Ba-Glu, y 120 gr de glucosa durante A-Glu). Luego de ello, fue provisto cada 15 min un volumen de bebidas de 2 mL/kg (6 gr de glucosa durante Ba-Glu, y 30 gr de glucosa durante Al-Glu). Se presentó esta organigrama de alimentación para que resulte en altas tasas de vaciamiento gástrico (Reherer et al.1990). La cantidad media de glucosa provista durante los 120 min de ejercicio fue de 72 ± l gr en la prueba Ba-Glu, y 360 ± 7 g en la prueba Al-Glu. Fueron extraídas muestras de sangre a intervalos de 15 min, hasta el final del ejercicio. Los gases espirados fueron recolectados cada 15 min.
Soluciones de glucosa
Los sujetos ingirieron soluciones de glucosa preparadas a partir de glucosa derivada de las papas (AVEBE, Holanda) las que contenían 44 o 220 gr/L de glucosa. Esta glucosa tuvo un enriquecimiento-13C de -26.1 partes por mil (δ por mil) versus PDB (la norma internacional Pee Dee Bellemnitella; determinada por combustión on-line IRMS, Carlo-Erba-Finnigan MAT 252, Bremen, Alemania) que es similar al enriquecimiento -13C del aire espirado de los europeos (Wagenmakers et al. 1993). Para minimizar los cambios en el enriquecimiento básico como resultado de los cambios en la utilización de sustratos endógenos, se siguieron procedimientos estándar (Jeukendrup et al. 1995; 1996b). Se instruyó a los sujetos para que no consumieran cualquier producto con alta abundancia natural de 13C, durante todo el período experimental. Además, se instruyó a los sujetos para mantener sus dietas lo más constante posible durante los días previos a las pruebas.
Análisis
La sangre (10 ml) se recolectó en tubos que contenían EDTA y se centrifugo durante 4 min a 4°C. Las alícuotas de plasma se congelaron inmediatamente en nitrógeno líquido y se almacenaron a - 40°C antes de procesar los análisis de glucosa (Roche, Uni Kit III, 0710970), lactato (Gutmann & Wahlefeld, 1974), y ácidos grasos libres (AGL, Wako NEFA- C test kit, Wako Chemicals, Neuss, Alemania), los cuales fueron realizados con análisis semi-automático COBAS BIO. La insulina se analizó por radioinmunoensayo (Nucliah Ultrasensitive Human Insulina RIA kit).
Las muestras por respiración fueron analizadas a la luz del cociente 13C/12C por cromatografía de gases de flujo continuo y cociente isotópico por espectrometría de masas (GC-IRMS, Finnigan MAT252, Bremen Alemania.
Para la determinación de los cocientes 13C-12C de glucosa en plasma, la glucosa fue derivada a su derivado trimetilsilil utilizado TriSil Z (Pierce). Luego de ese proceso, se midió el derivado por GC-IRMS (Finnigan MAT 252, Bremen, FRG). Se determinó el enriquecimiento de las muestras de glucosa en plasma, estableciendo las relaciones entre el enriquecimiento de series estándar de glucosa de enriquecimiento variable (por combustión IRMS; Carlo Erba-Finnigan MAT 252, Bremen Alemania), y el enriquecimiento del derivado trimetilsilil de la glucosa de estos estándares.
Se determinó el enriquecimiento de [2H]- glucosa en plasma por análisis de cromatografía de gases-espectrometría de masas (GC-MS) del derivado de glucosa penta-acetato en un Finnigan INCOS-XL (Bremen, Alemania). Fueron monitoreadas selectivamente las masas de iones de 200 a 202, para el enriquecimiento de [2H]- glucosa.
A partir de calorimetría indirecta se calcularon [mediante el índice de intercambio respiratorio (RER), tasa de consumo de oxígeno (VO2), y mediciones de isótopos estables (13CO2/12CO2) (IRMS, Finnigan MAT 252), gasto total de energía y tasas de oxidación de grasas totales, carbohidratos totales y glucosa exógena.
Cálculos
A partir del volumen de producción de CO2 por unidad de tiempo (L/min; VCO2) y VO2, se calcularon las tasas de oxidación total de carbohidratos y grasas (gr/min) utilizando el índice de intercambio respiratorio no proteico (Péronnet & Massicotte, 1991).
Oxidación de glucosa= [4.585 • VO2] - [3.226 • VO2] ( 1)
Oxidación de grasas = [1.695 • VO2] - [1.701 • VCO2] ( 2)
El enriquecimiento isotópico se expresó como la diferencia δ por mil entre el cociente 13C/12C de la muestra y un estándar de referencia del Laboratorio, conocido de acuerdo a la fórmula de Craig (1957):

El 13C estará δ relacionado entonces a un estándar internacional Pee Dee Bellemnitella (PDB).
La tasa total de aparición (i.e., Ta total) y las tasas de desaparición (i.e., Td total) de glucosa se calcularon utilizando el “pool” simple de ecuaciones sin estado estable de Steele (1959), adaptado para el uso con isótopos estables como fue descrito en otra fuente (Wolfe, 1992). La Ta total representa la Ta esplácnica del CHO ingerido, la glucogenólisis hepática y la gluconeogénesis
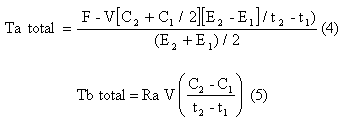
Donde F es la tasa de infusión (μmol/kg/min); V es el volumen de distribución ( = 160 mL/kg); C2 y C1 son las concentraciones de glucosa en los tiempos 2 y 1 respectivamente (i.e., t2, t1); y E2 y E1 son los enriquecimientos de glucosa en plasma en los tiempos 2 y 1 (i.e., t2, t1) respectivamente.
La producción de V13CO2 abajo partir de la infusión trazadora se calculó como:
V13CO2 (μmol/kg/min)= (ECO2- Ebkg) . VCO2, (6)
Donde ECO2 es el cociente 13C/12C respirado un momento dado, y Ebkg es el cociente 13C/12C respirado en el mismo momento durante la prueba, sin infusión trazadora para la corrección de los desplazamientos de base (i.e., bkg); VCO2 es la producción de CO2 por minuto por mililitro. El factor de conversión en 1 mol CO2= 22.41 L.
El porcentaje del trazador infundido [U-13C] que se oxidó, se calculó como:
% del trazador infundido oxidado = (V13CO2/K-1) tasa de infusión del trazador [U-13C] x 100. (7)
La oxidación de glucosa en plasma se calculó como:
Oxidación de glucosa en plasma (μmol/kg/min) = Tb de glucosa (μmol/kg/min) % marcador de glucosa infundida oxidado. (8)
La oxidación de glucosa muscular se calculo como:
Oxidación de glucógeno muscular (μmol/kg/min)= Oxidación total de CHO (μmol/kg/min) – oxidación de glucosa en plasma (μmol/kg/min) (9)
El reciclaje de carbono de glucosa se calculo como la diferencia entre Ta medido con un trazador [6,6-2H2] – glucosa y un trazador [U-13C]- glucosa:
Tasa de reciclaje de glucosa =Ta ([6,6-2H2]- glucosa) – Ta ([U-13C]- glucosa) (10)
La tasa de “clearance” metabólico (TCM) se calculó como la Td de glucosa dividida por la concentración media de glucosa durante ese período de tiempo.
TCM (mL/kg/min)= Td/ [C1 + C2)/2]. (11)
Estadística
Se utilizó el análisis de variancia para mediciones repetidas para estudiar diferencias entre las tres condiciones. Se utilizó el test post hoc de Scheffe en el caso de un cociente-F significativo (p<0.05) para ubicar las diferencias. Los resultados de los dos métodos diferentes de trazadores fueron comparados utilizando la prueba t de Student para datos apareados. Todos los resultados se expresan como medias EEM.
RESULTADOS
Glucosa Plasmática, Insulina, Lactato, Ácidos Grasos Libres y Glicerol
En la condición de Ayuno, las concentraciones de glucosa en plasma estuvieron en el rango de 4.2-4. 6 mM en reposo y a lo largo del de ejercicio (Figura 1). Con la ingesta de glucosa en las pruebas Al-Glu y Ba-Glu las concentraciones de glucosa en el plasma llegaron al pico a los 10-20 minutos, con valores de 5.5-5.8 mM. Las concentraciones de glucosa en plasma fueron más altas a lo largo del ejercicio con ingesta de glucosa comparado con Ayuno, aunque solo en Al-Glu versus Ayuno alcanzaron significancia estadística en todos los momentos (P<0.05).
La insulina en plasma se mantuvo baja en reposo y durante el ejercicio cuando se realizó ayuno (i.e., 5-7 μU/mL; Figura 1), pero estuvo significativamente elevada con la ingesta de glucosa durante el ejercicio. Los mayores valores de insulina se observaron luego de 30 min (9 ± 2 μU/ml con Ba-Glu, y 17 ± 4 μU/mL con Al-Glu).La insulina en plasma decreció en todas las pruebas pero permaneció elevada en las pruebas con Glu en comparación con Ayuno. En todas las condiciones, la insulina en plasma se redujo hasta, o por debajo, del nivel de reposo en la condición ayuno, hacia el final de las pruebas. El lactato en plasma en reposo fue de 0.9 ± 0.1, 0.9 ± 0.1 y 0.8 ± 0.2 mM para las condiciones de Ayuno, Ba-Glu y Al-Glu, respectivamente, y no cambió durante el ejercicio (datos no mostrados en la Figura 1). Luego de 120 min de ejercicio, los valores fueron 0.9 ± 0.1,0.8 ± 0.1 y 0.8 ± 0.1 mM, respectivamente.
Durante la prueba Ayuno, la concentración de ácidos grasos libres (AGL) disminuyó inicialmente durante los primeros 10 minutos, y luego de ese período se incrementó gradualmente durante el ejercicio hasta aproximadamente tres veces el nivel inicial (914 ± 99 μM a los 120 min.; Figura 1).
Los AGL en plasma en ambos condiciones Glu siguieron un patrón similar pero estuvieron significativamente suprimidos durante Ba-Glu (hasta 522 ± 79 μM a los 120 min, p<0.05), comparando con Ayuno, y aun más cuando se ingirió Al-Glu (hasta 301 ± 51 μM a los 120 min, p<0.05).
Las concentraciones de glicerol en plasma estuvieron incrementadas durante el ejercicio, desde valores de reposo en el rango de 55-97 μM hasta 406 ± 39 μM a los 120 min durante Ayuno, 238 ± 35 μM durante Ba-Glu, y 152 ± 38 μM durante Al-Glu (Figura 1; p<0.05)
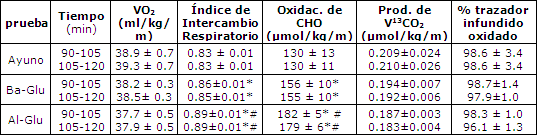
Tabla 1. Consumo de oxigeno corporal total (VO2), índice de
intercambio respiratorio, oxidación total de carbohidratos, V13CO2,
tasas de producción y oxidación del trazador endovenoso infundido [U13C]-
glucosa, durante el periodo de ejercicio de 90-120 min. Los valores son medias ±
EEM. La producción de V13CO2
es el producto del enriquecimiento de la respiración con
13CO2 por encima
de la línea de base y de la producción de VCO2. El porcentaje del
trazador infundido oxidado se calcula como (producción de V13CO2/tasa
de infusión de trazador endovenoso). (*)Pruebas Glu significativamente
diferentes de Ayuno en ese momento; p<0.05. (#)Pruebas Al-Glu significativamente
diferente de pruebas Ba-Glu en ese momento; p<0.05.
Grasas Corporales Totales y Oxidación de Carbohidratos
El VO2 fue similar durante cada sesión de ejercicio (38-39 mL/kg/min) y produjo aproximadamente 51 ± 2 % del VO2 máx (Tabla 1).El RER decreció en la prueba Ayuno (p<0.05) y permaneció estable con la ingesta de Glu. El RER fue significativamente mayor en la condición Al-Glu (Tabla 1).La oxidación de carbohidratos se redujo durante la condición de Ayuno, disminuyo menos con Ba-Glu, y permaneció estable con Al-Glu (Figura 2). Luego de 120 min de ejercicio, las tasas de oxidación total de CHO fueron 130 ± 11, 154 ± 10 y 179 ± 6 μmol/kg/min para las condiciones de Ayuno, Ba-Glu y Al-Glu, respectivamente (Figura 2). La oxidación total de grasas se vió marcadamente suprimida por las ingestas de Glu (Figura 2; p< 0.05).Luego de 120 min de ejercicio las tasas de oxidación total de grasas fueron 40 ± 2, 33 ± 3 y 26 ± 2 μmol/kg/min para las condiciones de Ayuno, Ba-Glu y Al-Glu, respectivamente (p<0.05).
Cociente Respiratorio 13CO2/12CO2
En las pruebas de ejercicio sin infusión de trazador, utilizadas para medir cambios en la producción de base o en la producción endógena de 13CO2, los sujetos presentaron solo una leve elevación no significativa en el cociente respiratorio 13CO2/12CO2, tanto cuando ayunaron como cuando recibieron glucosa (Figura 3). La ingesta y oxidación de glucosa no alteró el cociente respiratorio 13CO2/12CO2 durante la prueba de base (e.g., sin infusión de trazador).
Los cocientes respiratorios durante las pruebas experimentales con infusión de trazadores [U13C]- glucosa se muestran en Figura 3. El preparado de NaH13CO2, dado solo previo al comienzo del ejercicio durante cada prueba, como se esperaba, elevó marcadamente el 13CO2/12CO2 en la respiración durante los primeros 10 min. Sin embargo los cocientes respiratorios 13CO2/12CO2 alcanzaron un una meseta luego de 60 min (Figura 3)
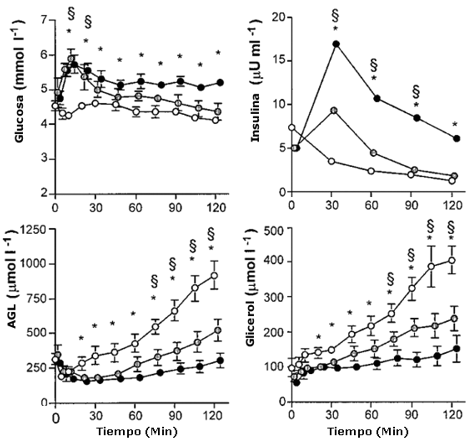
Figura 1. Glucosa en plasma, insulina, AGL y glicerol. Los valores son
medias ± EEM Concentraciones de glucosa, insulina, AGL y Glicerol plasmático,
durante 120 min de ejercicio al 50% VO2 máx, con administración de
agua (Ayuno ○), una baja dosis de glucosa (Ba-glu ○) , o una alta dosis de
glucosa (Al-Glu ● ). (*)Denota una diferencia significativa entre Ayuno y Al-Glu
(p<0.05). § Denota una diferencia significativa entre Ayuno y Ba-Glu (p<0.05).
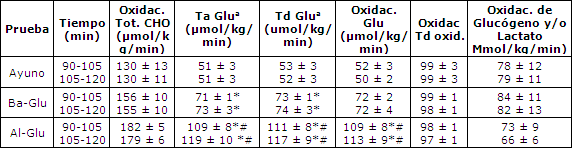
Tabla 2. Efectos de de una baja dosis de glucosa (BA-Glu) o una alta
dosis (Al-Glu), durante el ejercicio, comparado con el ayuno (Ayuno), sobre
varios aspectos del metabolismo de CHO durante el ejercicio que incluye la
oxidación total de CHO, la tasa de aparición de glucosa en plasma (Ta de
glucosa), la tasa de desaparición de glucosa en plasma (Tb de glucosa),
oxidación de glucosa en plasma, oxidación de glucógeno y/o oxidación de lactato.
Los valores son medias ± EEM para seis sujetos. La oxidación de glucosa en
plasma es calculada como el producto de la Td de glucosa y el porcentaje del
trazador infundido [U13C]- glucosa oxidado. El glucógeno y la
oxidación directa e indirecta, vía lactato, son calculados como la diferencia
entre la oxidación total de CHO y la oxidación de glucosa en plasma. (a) Las Ta
y Td de glucosa son calculadas utilizando el trazador [6,62H2].
(*)Las pruebas Glu son significativamente diferentes de la prueba Ayuno; p<
0.05. (#) La prueba Al-Glu es significativamente diferente de Ba-Glu; p<0.05
Oxidación del Trazador [U13C]
No se observaron diferencias entre las tasas de producción de 13CO2 en las tres pruebas (Tabla 1). Durante el período de 105-120 min de ejercicio, el porcentaje medio de oxidación del trazador infundido fue de 90 ± 3% para Ayuno, 98 ± 1% para Ba-Glu, y 96 ± 1% para Al-Glu. Los valores exactos del porcentaje de oxidación del trazador infundido para los períodos de 90-105 y 105-120 min son presentados en la Tabla 1.
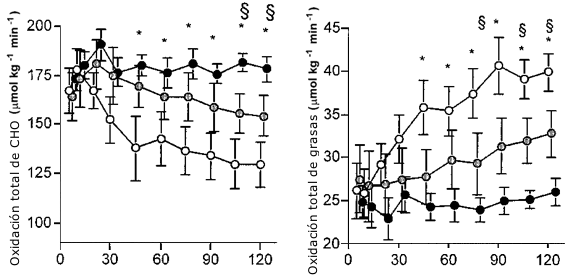
Figura 2. Oxidación de carbohidratos y grasas. Los valores son medias ±
EEM. Las tasas de oxidación total de CHO y grasas durante 120 min de ejercicio
al 50 % VO2 máx, con de agua (Ayuno O), una baja dosis de glucosa (Ba-Glu
O), o una alta dosis de glucosa (Al-Glu ●). (*) Denota una diferencia
significativa entre Ayuno y Al-glu; p< 0.05. § Denota una diferencia
significativa entre Ayuno y Ba-glu; p< 0.05.
Tasas de Aparición y Desaparición de Glucosa en Plasma, Reciclaje de Carbonos de Glucosa y Tasa de “Clearance” Metabólico (TCM)
El incremento en el cociente 13CO2/12CO2 de glucosa en plasma y el enriquecimiento de 2H2 como resultado de la infusión trazadora fue estable durante el período de 60-120 min en todas las pruebas (Figura 3). La Ta y Td de glucosa fueron calculadas a partir de ambos trazadores ([6,6-2H2]- glucosa y [U13C]-glucosa), y fueron levemente más bajas cuando se utilizó el enriquecimiento de 13C- glucosa en plasma (Tabla 3, Figura 4). Tanto la Ta como la Td de glucosa estuvieron marcadamente elevadas con la ingesta de glucosa (44 % con Ba-Glu y 125 % con Al-Glu; P < 0,05; Tabla 2).
El reciclaje de carbonos de glucosa fue similar en todas las condiciones. A los 105-120 min las tasas de reciclaje fueron 5 ± 3,6 ± 6 y 6 ± 8 μmol/kg/min durante las condiciones Ayuno, Ba- Glu y Al-Glu, respectivamente, representando entre el 4-10 % del total de la Ta de glucosa.
La TCM fue significativamente más alta con la de glucosa (Ayuno vs. Ba-Glu), y se incrementó adicionalmente cuando se ingirieron grandes cantidades de glucosa (Al-Glu; Tabla 3). Durante Al-Glu, la TCM fue casi el doble de la TCM durante Ayuno.
Oxidación de glucosa en plasma
La oxidación de glucosa en plasma mostró un patrón idéntico a aquel de las Ta y Td de glucosa. Ba-Glu causó un incremento del 44 % en la oxidación de glucosa en plasma comparado con Ayuno, y Al-Glu produjo un incremento del 126 %. La tasa de desaparición (trazador [6,6 -2H2]- glucosa) y la tasa de oxidación (trazador [U 13C]- glucosa), durante la segunda hora de ejercicio, son presentadas en Figura 5. La oxidación plasmática no fue significativamente diferente de la Ta de glucosa.
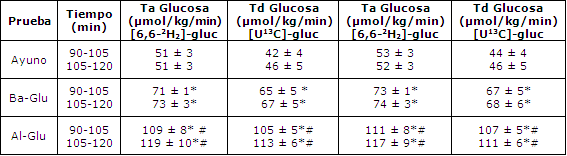
Tabla 3. Comparación de trazadores. Tasa de aparición y desaparición de
glucosa en plasma (Ta de glucosa) calculadas a partir del trazador
[6,6-2H2]-glucosa, comparadas con el trazador [U13C]-glucosa. Los
valores son medias ± EEM para 6 sujetos. (*)Pruebas Glu significativamente
diferentes de pruebas Ayuno; p<0.05. (#)Pruebas Al-Glu significativamente
diferente de prueba Ba-Glu; p<0.05.
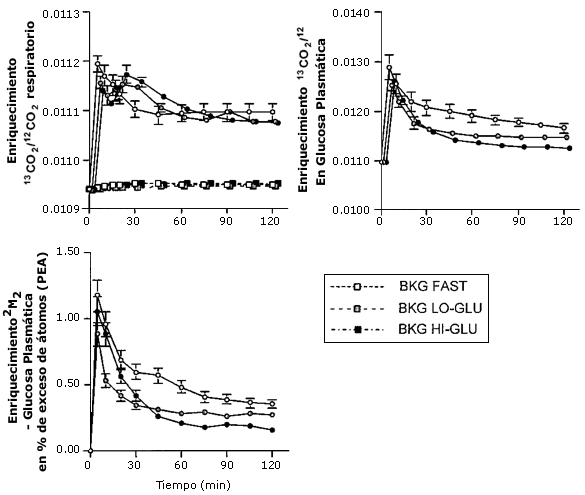
Figura 3.
Enriquecimiento en la respiración y en glucosa plasmática. Los valores son
medias ± EEM. Estabilización en el enriquecimiento 13C de glucosa
plasmática, y el enriquecimiento 2H2 de glucosa
plasmática, durante el ejercicio el 50% VO2 máx con de agua (Ayuno
○), una baja dosis de glucosa (Ba-Glu), o una alta dosis de glucosa (Al-Glu ●).
El enriquecimiento 13CO2/12CO2
también esta presentado para las pruebas de corrección de base (AMB)
(cuadrados).
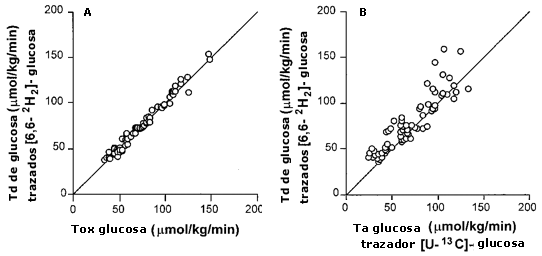
Figura 4. Ta y Tb de glucosa. Todos los valores
son medias ± EEM. (A). Comparación de la tasa de desaparición de glucosa (Tb)
medida por un trazador [2H2]-glucosa, y la tasa de
oxidación de glucosa (Tox). (B) Comparación de dos trazadores diferentes para
medir la tasa de aparición de glucosa (Ta). La línea representa la relación 1:
1.
Oxidación de Glucógeno Muscular
Además, la oxidación de glucógeno corporal total (oxidación total de CHO menos oxidación de glucosa en plasma) no se redujo por la ingesta de CHO. La Figura 6 describe los cambios en la utilización de sustratos como resultado de la ingesta de glucosa. Debería mencionarse que las ingestas de glucosa redujeron marcadamente la oxidación de grasas, e incrementaron la oxidación de glucosa en plasma, pero no alteraron la tasa de oxidación de glucosa muscular (y de lactato)
DISCUSION
Efecto de la Ingesta de Carbohidratos sobre la Oxidación de Glucógeno Muscular
Aquí nosotros reportamos que la oxidación de glucógeno muscular durante el ejercicio, medida utilizando una aproximación de trazador indirecto, no fue reducida por la ingesta de glucosa. Aun cuando se ingirieron grandes cantidades de glucosa (180 gr/h) y los niveles de glucosa en plasma e insulina fueron pequeños, pero significativamente elevados, la oxidación de glucógeno fue similar a la condición de ayuno. Esto concuerda con diversas mediciones directas de concentraciones de glucógeno muscular en biopsias musculares antes y después del ejercicio de pedaleo continuo, con o sin ingesta de carbohidratos (Fielding et al. 1985; Coyle et al. 1986; Flynn et al. 1987; Hargreaves & Briggs, 1988; Bosch et al. 1994) Sin embargo, estudios en corredores demostraron que la ingesta de carbohidratos redujo la ruptura neta de glucógeno en fibras de tipo I, y esto pudo haber sido responsable de las mejorías observadas en capacidad de resistencia (Tsintzas et al. 1995, 1996).Tsintzas & Willams (1998) surgieron que el pedaleo continuo podria causar un cambio menos marcado en la concentración de la glucosa e insulina plasmáticas, comparado con la carrera, y que estas diferencias podrían desempeñar un rol importante que se observa en el efecto sobre la utilización de glucógeno. Sin embargo, en el presente estudio observamos una gran respuesta de la insulina ante las ingesta de carbohidratos, y además se incrementó la concentración de glucosa en plasma. No obstante, esto no resultó en un “ahorro de glucógeno” como propusieron Tsintzas & Williams (1998). Por lo tanto, nosotros percibimos que otros factores (que no es la insulina) son los responsables de la discrepancia entre los hallazgos realizados utilizando la carrera como ejercicio (Tsintzas et al. 1995, 1996) y los realizados utilizando el ciclismo (Fielding et al 1985; Coyle et al. 1986; Flynn et al. 1987; Hargreaves & Briggs, 1988; Bosch et al. 1994).
Se podría argumentar que en el presente estudio la intensidad de ejercicio fue demasiado baja para incrementar la ruptura de glucógeno, y por lo tanto, los efectos de la de glucosa sobre la glucogenólisis fueron pequeños y no mensurables. Sin embargo, otros estudios (Coyle et al. 1986; Bosch et al. 1994) demostraron que intensidades de ejercicio al 70-75 % VO2 máx no resultaron en un ahorro de glucógeno con la ingesta de glucosa.
Además, intensidades de ejercicio más altas podrían haber suprimido el efecto de la insulina y, por lo tanto, es mas probable que se haya observado el ahorro de glucógeno a menores intensidades de ejercicio.
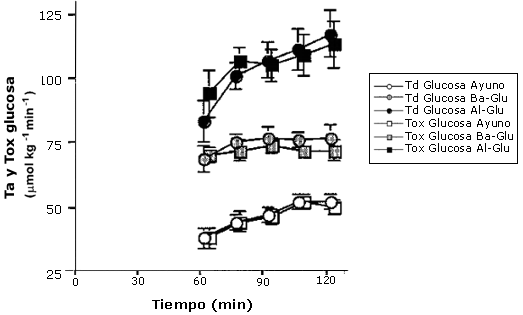
Figura 5. Tb de
glucosa vs. oxidación de glucosa plasmática. Los valores son medias ± EEM. La
tasa de desaparición de glucosa (Tb) y la tasa de oxidación de glucosa
plasmática (Tox), durante el periodo de 60-120 min. con la ingesta de agua
(Ayuno; círculos y cuadros abiertos), una baja dosis de glucosa (Ba-Glu círculos
y cuadros sombreados), y una alta dosis de glucosa (Al-Glu circulo y cuadros
rellenos). La Tb presentada es calculada a partir de mediciones de [6,6-2H2]-glucosa
con GCMS.
Porcentaje de Td Oxidado
Otro hallazgo importante de este estudio fue que la tasa de desaparición (Tb) de glucosa estuvo cercanamente equiparada con la tasa de oxidación de glucosa en plasma (Figuras 4 y 5). Los porcentajes de Td de glucosa oxidada fueron muy altos en el presente estudio (96-100%), pero concuerdan con los resultados de Coggan et al. (1991, 1992), quienes observaron que el 93% de la Td de glucosa fue oxidada durante el ejercicio al 70% VO2 máx (Coggan et al. 1991). Otros hallaron que porcentajes más bajos de Td de glucosa fueron oxidados durante el ejercicio a intensidades comparables con la intensidad del presente estudio (50% VO2 máx) (Colberg et al. 1994, Roberts et al. 1996; Friedlander et al. 1997). Por ejemplo Roberts et al. (1996) observaron que solo 33-38% de la Td de glucosa fue oxidada, y Colberg et al. (1994) reportaron que 33-50 % de la Td fue oxidada. Sin embargo, estos estudios fueron realizados a menores intensidades absolutas de ejercicio y no prepararon el “pool” de bicarbonato como se hizo en el presente estudio, y por lo tanto, es posible que una buena cantidad de 13CO2 estuviera temporalmente atrapado en el “pool” de bicarbonato lo cual pudo haber causado un subestimación de la verdadera oxidación de glucosa plasmática. Otros estudios en los cuales se dio el preparado de bicarbonato mostraron valores más comparables con aquellos del presente estudio (88-94%) (Coggan et al. 1992).
Se reportó que al utilizar un trazador 13C para el estudio del metabolismo de los ácidos grasos, parte del trazador puede ser atrapado en reacciones de intercambio con el ciclo del ácido tricarboxílico (CAT) (Sidossis et al. 1995; Schrauwen un cols. 1998) Pos ejemplo, algo del trazador 13C puede estar incorporado en el “pool” glutamato-glutamina vía alfa-cetoglutarto, o en el fosfoenolpiruvato, vía oxalacetato. Esta fijación del trazador resulta en una menor recuperación del mismo en los gases espirados, y con el objeto de corregir estas pérdidas, se propuso el factor de corrección de acetato (Sidossis et al. 1995). La pérdida de trazador depende de la tasa metabólica; a altos consumos de oxígeno (38-39 mL/kg en el presente estudio) se mostró que la recuperación del trazador de acetato es del 85-90% (Sidossis et al. 1995).
Aparte de esto, el [U13C]-glucosa tiene seis carbonos “marcados” de los cuales dos aparecerán directamente en 13CO2 y, por lo tanto, no entra en ciclo CAT. Solo dos tercios (66%) de los carbonos de glucosa son sujetos a fijación de trazadores. Por lo tanto, la recuperación de carbono desde [U13C]-glucosa será más alto que la recuperación de [1-13C]-palmitato (Sidossis et al. 1995), o [U13C]- palmitato (Schrauwen et al. 1998), explicando por que hallamos que el 96-100% del trazador de glucosa infundida es oxidado. La pequeña diferencia desde el 100% puede ser explicada por el factor de corrección de acetato implicando que toda molécula de glucosa que desaparece del plasma podría haber sido oxidada, tanto en presencia como en ausencia de de glucosa.
El Recambio (“Turnover”) de Glucosa en Plasma y Tasa de Ingesta
Se demostró que la glucosa en plasma es un importante sustrato durante el ejercicio, especialmente durante las ultimas etapas cuando los niveles de glucógeno muscular están reducidos (Coggan, 1991). Aquí observamos que la glucosa en plasma contribuyó en un 19% al gasto de energía durante el ayuno, y este valor se incrementó hasta 42% durante la ingesta de Al-Glu (Figura 6). Durante la ingesta de Al-Glu, la glucosa plasmática fue el sustrato más importante desde el punto de vista cuantitativo.
El recambio (“turnover”) de glucosa fue incrementado marcadamente por la ingesta de glucosa como fue evidenciado por Ta y Tb de glucosa incrementada, la oxidación de glucosa en plasma aumentada, y la tasa de «clearance» metabólico (TCM).
La ingesta de Ba-Glu incrementó la Ta de glucosa en un 44% y la de Al-Glu incrementó la Ta de glucosa en 126%. Sin embargo, en tanto la ingesta de glucosa durante la condición Al-Glu fue cinco veces mayor que durante la condición Ba-Glu, la Ta de glucosa se incremento solo menos del doble (72 μmol/kg/min durante Ba-Glu y 109-113 μmol/kg/min durante Al-Glu).La media de ingesta durante la segunda hora de ejercicio fue de 0.3 gr/min en la prueba Ba-Glu y de 1.5 gr/m en la Al-Glu. Las tasas totales de aparición de glucosa fueron 0.84 y 1.36 gr/min, respectivamente, sugiriendo que con la ingesta de Ba-Glu el hígado siguió produciendo glucosa mientras que con la ingesta de Al-Glu es teóricamente posible que la producción de glucosa hepática estuviera completamente suprimida. Se necesitan estudios con trazadores duales con infusión de un marcador de glucosa e ingesta de otro para distinguir entre Ta derivada del intestino y la producción de glucosa hepática. Sin ingesta de glucosa, la producción de glucosa hepática fue de aproximadamente de 0.5 gr/min indicando que el hígado pudo haber producido aproximadamente 30 gr de glucosa durante la segunda hora de ejercicio. Esta es una cantidad relativamente grande dado que se cree que el hígado contiene aproximadamente 80 gr de glucógeno (Hultman & Nilsson, 1971). La de glucosa durante el ejercicio puede reducir la producción de glucosa hepática (e.g., ahorra glucógeno hepático) al 70% VO2 máx como lo demostraron Bosch et al. (1994) y McConell et al (1994)
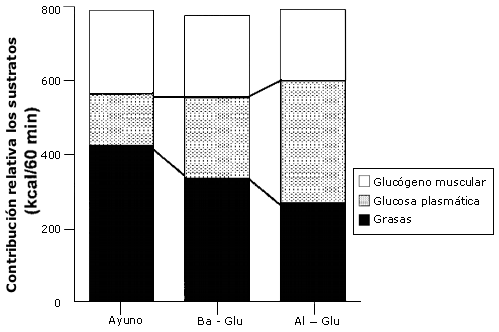
Figura 6. Contribución energética de los sustratos. Los valores son
medias ± EEM. La contribución energética de los sustratos durante el periodo de
ejercicio de 60-120 min al 50% VO2 máx con la ingesta de agua
(Ayuno), una baja dosis de glucosa (Ba-glu), o una alta dosis de glucosa (Al-Glu).
Limitación de la Oxidación de Carbohidratos Exógenos
Estos resultados también indican que, con grandes dosis de glucosa ingerida (360 gr en el período de 2 hs de ejercicio), no toda la glucosa aparece en el plasma. Esto concuerda con sugerencias previas acerca de que la tasa de oxidación de glucosa endógena puede estar limitada por la tasa de digestión, absorción, máxima producción de glucosa dentro de la provisión a la sangre sistémica, más que por consumo de glucosa y oxidación por músculo (Hawley et al. 1994). Diversos estudios demostraron que la oxidación de carbohidratos orales está limitada en aproximadamente 1 gr/min (Hawley t cols. 1992). Aun cuando se ingirieron grandes cantidades de carbohidratos, las tasas de oxidación no excedieron de 1 gr/min (Rehrer et al. 1992; Wagenmakers et al. 1993)
Efectos de la Ingesta de Carbohidratos sobre la Oxidación de Grasas y la Oxidación de Carbohidratos
La ingesta de glucosa también suprimió parcialmente la oxidación de grasas, en comparación con el ayuno, y este efecto fue dosis dependiente; Al-Glu suprimió más la oxidación de grasas que Ba-Glu. Las tasas de oxidación de grasas más bajas pueden ser, al menos en parte, medidas por la insulina (Fig. 1). Se demostró que la insulina es un potente inhibidor de lipólisis y de Ta de FFA (Montain et al. 1991; Campbell et al, 1992; Horowitz et al. 1997). Aquí, los niveles más altos de insulina luego de la ingesta de glucosa redujeron la lipólisis corporal total, tal como fue indicado indirectamente por concentraciones más bajas de glicerol en plasma y AGL (Figura 1). Se demostró que la disponibilidad de AGL reducida y las altas concentraciones de insulina en plasma junto con un incrementado flujo glucolítico, reducen la oxidación de AGL en reposo (Sidossis y Wolfe, 1996) y durante el ejercicio (Coyle et al, 1997). Aunque en este estudio observamos que la ingesta de glucosa durante el ejercicio incrementó la oxidación total de CHO, McConell et al. (1994) y Bosch et al. (1994) no observaron tasas de oxidación de CHO incrementadas con la ingesta de CHO durante el ejercicio. Esto puede, en parte, ser explicado por las diferencias en la intensidad de ejercicio y posiblemente por la diferencia de concentración de insulina en plasma, la cual puede haber sido más alta en el presente estudio. Mientras que en sus estudios las intensidades de ejercicio fueron del 70% VO2 máx nosotros empleamos una intensidad de ejercicio al 50 % VO2 máx. Con intensidades de ejercicio bajas a moderadas (50% del VO2 máx) la utilización de glucosa puede ser mejorada por la ingesta de CHO, mientras que durante el ejercicio más intenso (> 70% VO2 máx) los CHO endógenos simplemente parecen sustituirse por glucosa producida en forma endógena, sin incremento total en la oxidación de CHO (Bosch et al. 1994; McConell et al. 1994).
Gluconeogénesis (Reciclaje de Carbonos de Glucosa)
Cuando se mide por GC-IRMS, el carbono [U13C)-glucosa puede reciclarse durante el proceso de gluconeogénesis, y esto puede conducir a una subestimación de la Ta de glucosa. La razón para esto es la siguiente: Una molécula de glucosa uniformemente “marcada” produce dos moléculas de piruvato que puede ser convertido en lactato o alanina (predominantemente lactato) los cuales son precursores de la gluconeogénesis, y este hecho puede conducir a la incorporación de trazadores en la glucosa nuevamente sintetizada. Cincuenta por ciento de los átomos de carbono serán 13C en la glucosa nuevamente sintetizada. En el análisis GC-combustión-IRMS la molécula entera es oxidada a CO2 previo a la medición del enriquecimiento, y por lo tanto, se mide el incremento en el cociente 13C/12C de todos los carbonos de la molécula de glucosa. Las mediciones de dilución del trazador, por lo tanto excluyen la gluconeogénesis y consecuentemente representa una posible subestimación de la verdadera Ta de glucosa. Se cree que un método más apropiado de medir la Ta de glucosa total es el uso de un marcador [6,6-2H2]-glucosa el cual mide la producción total de glucosa cuando el enriquecimiento es medido por GC-MS, tanto como que los átomos trazadores no se reciclan durante la gluconeogénesis (Wolfe, 1992) Para comparar los métodos mencionados previamente también infundimos un trazador [6,6-2H2]-glucosa.
La diferencia entre los dos métodos teóricamente nos da una estimación grosera de gluconeogénesis (Tserng & Calan, 1983). En este estudio hallamos que la Ta y Td de glucosa fueron iguales, independientemente del marcador utilizado (e.g., [U13C]-glucosa medido por GC-IRMS o [6,6-2H2]-glucosa medido por GC-MS) (Tabla 3). En la Figura 4, la Ta de glucosa calculada a partir del trazador [6,6-2H2 ]-glucosa está graficada vs. la Ta de glucosa calculada por el trazador [U13C]-glucosa (enriquecimiento total). Esta figura muestra que, generalmente, la Ta de glucosa da números levemente más bajos, lo que concuerda con las expectativas. La tasa de reciclaje de 13C fue lenta (4-10 % de la Ta total de glucosa) y no se produjo con las ingestas por glucosa, sugiriendo que independientemente de la cantidad de glucosa ingerida, la gluconeogénesis fue mínima.
Estas bajas tasas de reciclaje pueden haber resultado por baja disponibilidad del precursor (e.g., bajas concentraciones de lactato como fue observado en estudios previos con diseños similares; Jeukendrunp et al. 1996 a,c, 1997b). La gluconeogénesis también puede ser más bajas en individuos entrenados (Coggan, 1997), y dado que el nivel de entrenamiento de los sujetos en el presente estudio fue muy alto, las tasas de gluconeogénesis pudieron haber sido muy bajas. Friedlander et al. (1997), también sugirieron que los adrenoreceptores estuvieran sub-regulados en respuesta al entrenamiento de resistencia, y esto puede ser un mecanismo para la gluconeogénesis mitigada. Con el alto nivel de entrenamiento de los atletas en el presente estudio esto podría ser una explicación para los bajos niveles de reciclaje de carbonos de glucosa también.
Revisión General: Efecto de la Ingesta de Carbohidratos sobre el Metabolismo de los Sustratos
Los resultados del presente estudio indican que la ingesta de glucosa durante el ejercicio conduce a una reducción de la oxidación de grasas, en parte debido a una inhibición de la lipólisis (Horowitz et al. 1997) y a una oxidación de carbohidratos incrementada. La oxidación de carbohidratos aumentada fue explicada por un recambio acelerado de glucosa plasmática. La aparición de glucosa en el torrente sanguíneo se incrementó con la ingesta de carbohidratos, y este incremento fue dosis-dependiente. Sin embargo, a tasas muy altas de ingesta la aparición de glucosa plasmática se niveló hacia abajo.
La tasa de aparición de glucosa incrementada no condujo a un gran aumento en la concentración de glucosa plasmática debido a que la tasa de desaparición también se incrementó. Las mayores concentraciones de glucosa pudieron haber sido parcialmente responsables del consumo de glucosa incrementado durante la condición Al-Glu, simplemente por acción de masas. Sin embargo, el consumo aumentado de glucosa fue explicado principalmente por un “clearance” incrementado de glucosa desde el torrente sanguíneo. Esto parece sugerir que el transporte de glucosa estuvo activado por mecanismos que involucran el desplazamiento de GLUT-4, la activación de las enzimas oxidativas (fosfofructoquinasa, PFK) y/o la activación del complejo piruvato dehidrogenasa (PDH).
La glucosa que desapareció del plasma (y que probablemente fue tomada por los músculos esqueléticos activos) se oxidó y no se utilizó para la síntesis de glucógeno. La oxidación de glucógeno muscular no se redujo con la ingesta de glucosa. La gluconeogénesis en el hígado no alcanzó significancia estadística en todas las condiciones.
En resumen, se desarrolló un método para medir Ta de glucosa y oxidación de glucosa en plasma utilizando pequeñas cantidades de un marcador [U13C]-glucosa y midiendo el enriquecimiento del marcador en plasma con GC-IRMS.
El método parece ser válido para hacer estimaciones del recambio (“turnover”) de glucosa y para estimaciones indirectas del consumo de glucógeno muscular a nivel corporal total. Los resultados de este estudio indican que la alimentación con carbohidratos durante el ejercicio de ciclismo al 50% VO2 máx, en sujetos altamente entrenados redujo la oxidación de grasas e incrementó la Ta de glucosa, la TCM y la oxidación de glucosa en plasma.
La oxidación de glucógeno muscular no se redujo aún cuando fueron ingeridas grandes cantidades de glucosa, y la disponibilidad de glucosa no oxidada fue insignificante.
Un gran porcentaje (96-100%) de la glucosa desaparecida del plasma se oxidó. La comparación de la Ta de glucosa calculada a partir de los trazadores [6,6-2H2] –y [U13C] –glucosa reveló que solo una pequeña cantidad de carbonos de glucosa es reciclada en el proceso de gluconeogénesis
Referencias
1. Bjorkman, O., Sahlin, K., Hagenfeldt, L. & Wahren, J (1984). Influence of glucose and fructose ingestion on the capacity for long term exercise in well trained men. Clinical Physiology 4, 483-494
2. Bosch, A. N., Dennis, S. C. & Noakes, T. D (1994). Influence of carbohydrate ingestion on fuel substrate turnover and oxidation during prolonged exercise. Journal of Applied Physiology 76, 2364-2372
3. Campbell, P. J., Carlson, M. G., Hill, J. O. & Nurjhan, N (1992). Regulation of free fatty acid metabolism by insulin in humans: role of lipolysis and reesterification. American Journal of Physiology 26, E1063-1069
4. Coggan, A. R (1991). Plasma glucose metabolism during exercise in humans. Sports Medicine 11, 102-124
5. Coggan, A. R (1997). Plasma glucose metabolism during exercise: effect of endurance training in humans. Medicine and Science in Sports and Exercise 29, 620-627
6. Coggan, A. R. & Coyle, E. F (1987). Reversal of fatigue during prolonged exercise by carbohydrate infusion or ingestion. Journal of Applied Physiology 63, 2388-2395
7. Coggan, A. R. & Coyle, E. F (1988). Effect of carbohydrate feedings during high-intensity exercise. Journal of Applied Physiology 65, 1703-1709
8. Coggan, A. R., Kohrt, W. M., Spina, R. J., Kirwan, J. P., Bier, D. M. & Holloszy, J. O (1992). Plasma glucose kinetics during exercise in subjects with high and low lactate thresholds. Journal of Applied Physiology 73, 1873-1880
9. Coggan, A. R., Spina, R. J., Kohrt, W. M., Bier, D. M. & Holloszy, J. O (1991). Plasma glucose kinetics in a well trained cyclist fed glucose throughout exercise. International Journal of Sport Nutrition 1, 279-288
10. Colberg, S. R., Casazza, G. A., Horning, M. A. & Brooks, G. A. (1994). Increased dependence on blood glucose in smokers during rest and sustained exercise. Journal of Applied Physiology 76, 26-32
11. Coyle, E. F., Coggan, A. R., Hemmert, M. K. & Ivy, J. L (1986). glycogen utilization during prolonged strenuous exercise when fed carbohydrate. Muscle. Journal of Applied Physiology 61, 165-172
12. Coyle, E. F., Hagberg, J. M., Hurley, B. F., Martin, W. H., Ehsani, A. A. & Holloszy, J. O (1983). Carbohydrate feeding during prolonged strenuous exercise. Journal of Applied Physiology 55, 230-235
13. Coyle, E. F., Jeukendrup, A. E., Wagenmakers, A. J. M. & Saris, W. H. M (1997). Fatty acid oxidation is directly regulated by carbohydrate metabolism during exercise. American Journal of Physiology 273, E268-275
14. Craig, H (1957). Isotopic standards for carbon and oxygen and correction factors. Geochimica Cosmochimica Acta 12, 133-149
15. Fielding, R. A., Costill, D. L., Fink, W. J., King, D. S., Hargreaves, M. & Kovaleski, J. E (1985). Effect of carbohydrate feeding frequencies and dosage on muscle glycogen use during exercise. Medicine and Science in Sports and Exercise 17, 472-476
16. Flynn, M. G., Costill, D. L., Hawley, J. A., Fink, W. J., Neufer, P. D., Fielding, R. A. & Sleeper, M. D (1987). Influence of selected carbohydrate drinks on cycling performance and glycogen use. Medicine and Science in Sports and Exercise 19, 37-40
17. Friedlander, A. L., Casazza, G. A., Ma, H., Huie, M. J. & Brooks, G. A (1997). Training induced alterations of glucose flux in men. Journal of Applied Physiology 82, 1360-1369
18. Gutmann I. & Wahlefeld A. W (1974). L-(+)-Lactate, determination with lactate dehydrogenase and NAD. In Methods in Enzymatic Analysis: 2nd edn, ed. Bergmeyer, H. U., pp. 1464-1468, Academic Press, New York
19. Hargreaves, M. & Briggs, C. A (1988). Effect of carbohydrate ingestion on exercise metabolism. Journal of Applied Physiology 65, 1553-1555
20. Hargreaves, M., Costill, D. L., Coggan, A., Fink, W. J. & Nishibata, I (1984). Effect of carbohydrate feedings on muscle glycogen utilisation and exercise performance. Medicine and Science in Sports and Exercise 16, 219-222
21. Hawley, J. A., Bosch, A. N., Weltan, S. M., Dennis, S. D. & Noakes, T. D (1994). Effects of glucose ingestion or glucose infusion on fuel substrate kinetics during prolonged exercise. European Journal of Applied Physiology 68, 381-389
22. Hawley, J. A., Dennis, S. C. & Noakes, T. D (1992). Oxidation of carbohydrate ingested during prolonged endurance exercise. Sports Medicine 14, 27-42
23. Horowitz, J. F., Mora-Rodriguez, R., Byerley, L. O. & Coyle, E. F (1997). Lipolytic suppression following carbohydrate ingestion limits fat oxidation during exercise. American Journal of Physiology 273, E768-775
24. Hultman, E. & Nilsson, L. H (1971). Liver glycogen in man: effects of different diets and muscular exercise. In Muscle Metabolism During Exercise, II, ed. Pernow, B. & Saltin, B., pp. 143-151. Plenum, New York
25. Jeukendrup, A. E., Borghouts, L., Saris, W. H. M. & Wagenmakers, A. J. M (1996). Reduced oxidation rates of orally ingested glucose during exercise after low CHO intake and low muscle glycogen. Journal of Applied Physiology 81, 1952-1957
26. Jeukendrup, A. E., Brouns, F., Wagenmakers, A. J. M. & Saris, W. H. M (1997). Carbohydrate feedings improve 1 H time trial cycling performance. International Journal of Sports Medicine 18, 125-129
27. Jeukendrup, A. E., Mensink, M., Saris, W. H. M. & Wagenmakers, A. J. M (1997). Exogenous glucose oxidation during exercise in endurance-trained and untrained subjects. Journal of Applied Physiology 82, 835-840
28. Jeukendrup, A. E., Saris, W. H. M., Schrauwen, P., Brouns, F. & Wagenmakers, A. J. M (1995). Metabolic availability of medium chain triglycerides co-ingested with carbohydrates during prolonged exercise. Journal of Applied Physiology 79, 756-762
29. Jeukendrup, A. E., Saris, W. H. M., Van Diesen, R., Brouns, F. & Wagenmakers, A. J. M (1996). Effect of endogenous carbohydrate availability on oral medium-chain triglyceride oxidation during prolonged exercise. Journal of Applied Physiology 80, 949-954
30. Jeukendrup, A. E., Wagenmakers, A. J. M., Brouns, F., Halliday, D. & Saris, W. H. M (1996). Effects of carbohydrate (CHO) and fat supplementation on CHO metabolism during prolonged exercise. Metabolism 45, 915-921
31. Kuipers, H., Verstappen, F. T. J., Keizer, H. A., Geurten, P. & van Kranenburg, G (1985). Variability of aerobic performance in the laboratory and its physiologic correlates. International Journal of Sports Medicine 6, 197-201
32. McConell, G., Fabris, S., Proietto, J. & Hargreaves, M (1994). Effect of carbohydrate ingestion on glucose kinetics during exercise. Journal of Applied Physiology 77, 1537-1541
33. MacRae, H. H.-S., Noakes, T. D. & Dennis, S. C (1995). Effects of endurance training on lactate removal by oxidation and gluconeogenesis during exercise. Pflügers Archiv 430, 964-970
34. Montain, S. J., Hopper, M. K., Coggan, A. R. & Coyle, E. F (1991). Exercise metabolism at different time intervals after a meal. Journal of Applied Physiology 70, 882-888
35. Murray, R., Eddy, D. E., Murray, T. W., Seifert, J. G., Paul, G. L. & Halaby, G. A (1987). The effect of fluid and carbohydrate feedings during intermittent cycling ecxercise. Medicine and Science in Sports and Exercise 19, 597-604
36. Rehrer, N. J., Brouns, F., Beckers, E. J., ten Hoor, F. & Saris, W. H. M (1990). Gastric emptying with repeated drinking during running and bicycling. International Journal of Sports Medicine 11, 238-243
37. Rehrer, N. J., Wagenmakers, A. J. M., Beckers, E. J., Halliday, D., Leiper, J. B., Brouns, F., Maugham, R. J., Westerterp, K. & Saris, W. H. M (1992). Gastric emptying, absorption and carbohydrate oxidation during prolonged exercise. Journal of Applied Physiology 72, 468-475
38. Roberts, A. C., Reeves, J. T., Butterfield, G. E., Mazzeo, R. S., Sutton, J. R., Wolfel, E. E. & Brooks, G. A (1996). Altitude and -blockade augment glucose utilisation during submaximal exercise. Journal of Applied Physiology 80, 605-615
39. Schrauwen, P., van Aggel-Leijssen, D. P. C., van Marken Lichtenbelt, W. D., van Baak, M. A., Gijsen, A. P. & Wagenmakers, A. J. M (1998). Validation of the [1,2-13C]-acetate recovery factor for correction of [U-13C]-palmitate oxidation rates. The Journal of Physiology 513, 215-223
40. Sidossis, L. S., Coggan, A. R., Gastadelli, A. & Wolfe, R. R (1995). Pathways of free fatty acid oxidation in human subjects: implications for tracer studies. Journal of Clinical Investigation 95, 278-284
41. Sidossis, L. S. & Wolfe, R. R (1996). Glucose and insulin-induced inhibition of fatty acid oxidation: the glucose-fatty acid cycle reversed. American Journal of Physiology 270, E733-738
42. Steele, R (1959). Influences of glucose loading and of injected insulin on hepatic glucose output. Annals of the New York Academy of Sciences 82, 420-430
43. Tserng, K.-Y. & Kalhan, S. C (1983). Estimation of glucose carbon recycling and glucose turnover with [U-13C]-glucose. American Journal of Physiology 245, E476-482
44. Tsintzas, K. & Williams, C (1998). Human muscle glycogen metabolism during exercise; effect of carbohydrate supplementation. Sports Medicine 25, 7-23
45. Tsintzas, O. K., Williams, C., Boobis, L. & Greenhaff, P (1995). Carbohydrate ingestion and glycogen utilization in different muscle fibre types in man. The Journal of Physiology 489, 243-250
46. Tsintzas, O.-K., Williams, C., Boobis, L. & Greenhaff, P (1996). Carbohydrate ingestion and single muscle fiber glycogen metabolism during prolonged running in men. Journal of Applied Physiology 81, 801-809
47. Wagenmakers, A. J. M., Brouns, F., Saris, W. H. M. & Halliday, D (1993). Oxidation rates of orally ingested carbohydrates during prolonged exercise in man. Journal of Applied Physiology 75, 2774-2780
48. Wolfe, R. R (1992). and Stable Isotope Tracers in Biomedicine. Radioactive e. Wiley-Liss, New York
Cita Original
Asker E. Jeukendrup, Anne Raben, Annemie Gijsen, Jos H.C.H Stegen, Fred Brouns, Wim H. Saris y Antón J. M. Wagenmakers Cinética de la Glucosa durante el Ejercicio Prolongado en Sujetos Humanos Altamente Entrenados: Efecto de la de Glucosa Resúmenes del Simposio Internacional de Actualización en Ciencias Aplicadas al Deporte, Biosystem, 182-193 (1999)
Cita en PubliCE
Asker Jeukendrup, William H Saris, Anton J Wagenmakers, Anne Raben, Annemie Gijsen, Jos H Stegen Fred Brouns (1999). Cinética de la Glucosa Durante el Ejercicio Prolongado en Sujetos Humanos Altamente Entrenados: Efecto de la de Glucosa. .https://g-se.com/cinetica-de-la-glucosa-durante-el-ejercicio-prolongado-en-sujetos-humanos-altamente-entrenados-efecto-de-la-de-glucosa-839-sa-d57cfb271903d6
