Ácido Láctico y Rendimiento en el Ejercicio: ¿Culpable o Amigo?
Simeon P Cairns1,21 Institute of Sport and Recreation Research New Zeland Faculty of Health and Envioromental Sciences, Auckland, Nueva Zelanda.
2 University of Technology, Auckland, Nueva Zelanda.
Resumen
Este artículo discute críticamente si la acumulación de ácido láctico, o en realidad lactato y/o iones hidrógeno (H+), es una causa principal de fatiga del músculo esquelético, i.e., disminución de la fuerza muscular o la producción de potencia que conducen a una desmejora del rendimiento en el ejercicio. Existe una larga historia de estudios acerca de los efectos del incremento de las concentraciones de lactato/H+ en el músculo o el plasma sobre el rendimiento contráctil del músculo esquelético. La evidencia que sugiere que el lactato/H+ es el culpable proviene de estudios basados en la correlación, la cual revela relaciones temporales cercanas entre el lactato intramuscular o la acumulación de H+ y la declinación de la fuerza durante la estimulación de la fatiga en el músculo de rana, roedor o humano. Además, una acidosis inducida puede afectar la contractilidad del músculo en los humanos no fatigados o preparados musculares aislados, y han sido proporcionados diversos mecanismos para explicar tales efectos. Sin embargo, una serie de estudios recientes de alto perfil han desafiado seriamente la “hipótesis del ácido láctico”. En los 90’, estos hallazgos implicaron principalmente una disminución de los efectos negativos de una acidosis inducida en fibras musculares aisladas o intactas, a temperaturas experimentales elevadas y más fisiológicas. A principios de 2000, fue demostrado de manera concluyente que el lactato tiene poco efecto perjudicial sobre las fibras musculares mecánicamente aisladas, activadas a través de estimulación artificial. Quizás más sorprendentemente, actualmente hay reportes acerca de efectos protectores de la exposición al lactato o la acidosis inducida sobre las contracciones musculares deprimidas por potasio en músculos de roedor aislados. Además, la exposición al lactato sódico puede atenuar la fatiga severa en músculo de ratón estimulado in situ, y la ingesta de lactato sódico puede incrementar el tiempo hasta el agotamiento durante esprints en humanos. En conjunto, estos últimos hallazgos han conducido a la idea que plantea que el lactato/H+ es ergogénico durante el ejercicio. No debería ser tomado como un hecho que el ácido láctico es el factor que afecta el rendimiento durante el ejercicio. Los experimentos realizados en músculo aislado sugieren que la acidosis tiene pocos efectos perjudiciales o puede incluso mejorar el rendimiento muscular durante el ejercicio de alta intensidad. De manera contraria, la acidosis inducida puede exacerbar la fatiga durante el ejercicio dinámico para todo el cuerpo y la alcalosis puede mejorar el rendimiento en el ejercicio en eventos que durante de 1 a 10 minutos. Para transferir estos hallazgos encontrados en fibras musculares aisladas hacia ejercicios para todo el cuerpo, se plantea como hipótesis que una acidosis plasmática severa en los humanos podría afectar el rendimiento en el ejercicio causando una reducción de la conducción del SNC hacia los músculos.
Palabras Clave: rendimiento en el ejercicio, acidosis láctica, fatiga muscular, bicarbonato de sodio, uso terapeútico
INTRODUCCION
Con la contracción repetida del músculo esquelético hay una declinación eventual de la fuerza muscular o producción de potencia que conduce a una desmejora del rendimiento en el ejercicio para todo el cuerpo, esto es, se desarrolla la fatiga. La etiología de la fatiga es controversial, aunque ha sido asociada con una disminución de la conducción motora desde el SNC y/o a cambios de metabolitos, electrolitos y daño ultraestructural dentro del músculo (1-7). La contribución relativa de estos factores parece depender de la naturaleza del ejercicio o el modelo de fatiga empleado (5, 6, 8). Durante el ejercicio de alta intensidad, la acumulación intramuscular de ácido láctico ha sido considerada por mucho tiempo como uno de los factores más importante en la fatiga (5, 6, 9-12). En 1907, Fletcher y Hopkins (13) fueron los primeros en demostrar que el lactato era producido en músculo de anfibio estimulado eléctricamente bajo condiciones anaeróbicas. El concepto que implica que este metabolito tiene un rol principal en la fatiga fue así desarrollado por su alumno, A V Hill, con estudios acerca del músculo de rana aislado y con mediciones del lactato plasmático en humanos en ejercicio (14-16). Debería ser señalado que prácticamente no existe ácido láctico en el cuerpo en su forma neutra; en cambio el mismo está representado por dos especies iónicas: iones lactato e iones hidrógeno (H+) (10, 12, 17-19). De este modo, cuando se evalúa la “hipótesis del ácido láctico para la fatiga muscular” (ver sección 1), se debe tener en cuenta que es un constructo y que el posible rol, tanto de los iones lactato como de los H+ debería ser establecido en forma separada.
Con el advenimiento de la técnica de biopsia muscular y luego la espectroscopia de resonancia magnética nuclear en 1960 y 1970, aparecieron estudios detallados acerca del lactato y los H+ (i.e. acidosis) en el músculo esquelético (12, 20-23), y el apoyo para esta hipótesis creció. Es en gran parte debido a estos primeros hallazgos, que el ácido láctico y la fatiga han sido íntimamente relacionados, estando la idea adoctrinada en nosotros (24).
Además, un enfoque hecho popular por Arthur Lydiard (el gran entrenador de larga distancia de Nueve Zelandia) es que el lactato y la acidosis asociada durante el ejercicio anaeróbico, pueden ser extremadamente perjudiciales, tanto para el rendimiento en el ejercicio como para la salud (25).
Por estas razones, el punto de vista común para muchos científicos del deporte y entrenadores en todo el mundo es que el ácido láctico es el mayor villano limitante del rendimiento durante el ejercicio intenso.
A pesar de estos hallazgos históricos, un cuerpo creciente de evidencia que ha aparecido desde principios de 1990, sugiere que el lactato acumulado y la acidosis tienen poco efecto perjudicial sobre el rendimiento muscular. A principios de 2000, algunos experimentos elegantes plantearon que el lactato era verdaderamente ergogénico. Claramente, la validez de la hipótesis de la acidosis láctica ha sido cuestionada. El objetivo de este artículo es proporcionar una actualización acerca del rol del ácido láctico en la fatiga. El trabajo va a incluir una breve visión de la evidencia clave que apoya el rol del ácido láctico y la fragilidad de algunas interpretaciones, una discusión y crítica de algunos estudios recientes de alto perfil que no coinciden con un rol del ácido láctico y algunas ideas especulativas acerca de los roles del ácido láctico en el ejercicio.
LA HIPOTESIS DEL ACIDO LACTICO PARA LA FATIGA MUSCULAR
Lactato y Producción de H+
Durante la contracción muscular, la molécula energética adenosín trifosfato (ATP) es usada por la adenosín trifosfatasa (ATPasa) para permitir que se produzca el ciclo de puentes cruzados entre los filamentos de actina y miosina, resultando en producción de fuerza. Sin embargo, las concentraciones de ATP son normalmente bajas, de modo que con contracciones repetidas, las reservas de fosfocreatina (PCr) en el músculo son usadas para resintetizar y mantener las concentraciones de ATP.
Con un número incremental de contracciones, la concentración de PCr disminuye, lo cual resulta en una necesidad de utilizar otros combustibles.
Consecuentemente, el glucógeno muscular comienza a ser utilizado cuando la glucólisis es activada, lo cual conduce a un incremento en el flujo a través de la vía glucolítica con formación de pirutavo y ATP.
Con el ejercicio dinámico e intenso, esta vía debe ser usada para producir el ATP necesario para alcanzar las demandas de los ciclos de puentes cruzados (incremento de la actividad de la miosín-ATPasa) y las bombas musculares de iones (incremento de las actividades de Ca2+-ATPasa y Na+-K+-ATPasa). Con el ejercicio de baja intensidad, el piruvato es destinado a la oxidación por medio de procesos metabólicos aeróbicos en la mitocondria.
Desafortunadamente, la mitocondria no es capaz de oxidar todo el piruvato producido durante el ejercicio intenso, de modo que el incremento moderado en el piruvato conduce a su conversión en lactato en el mioplasma (10). Generalmente se piensa que esta acumulación de lactato está directamente asociada con la producción de H+ y que conduce a una disminución en el pH intramuscular (pHm) o acidosis (23, 26). Sin embargo, una reciente revisión que estimula al análisis (17) y una publicación complementaria (18) discutieron la formación del H+ y concluyeron que no se debe a la acidosis láctica, i.e. los H+ no se forman durante la producción de lactato a partir del piruvato. En vez de esto, los autores propusieron que la formación de H+ ocurre durante las reacciones glucolíticas que implican la hidrólisis del ATP (17, 18). Una explicación alternativa basada en principios de fisicoquímica es que la producción de lactato, como un anión ácido fuerte, conduce a la formación de H+ a partir de agua (19). Dentro de la fibra muscular, los H+ son principalmente amortiguados, pero se piensa que parte del lactato junto con los H+ son expulsados a través de las proteínas transportadoras de lactato-protones en la membrana celular (27).
Esto conduce a la hipótesis del ácido láctico para la fatiga muscular, la cual sostiene que “la acumulación de lactato o la acidosis en los músculos que trabajan causa la inhibición de los procesos contráctiles, ya sea directamente o por medio del metabolismo, lo cual resulta en una disminución del rendimiento de ejercicio”. Indudablemente, es una idea atractiva y conceptualmente simple tener a los productos metabólicos finales como la causa principal de la fatiga. Hay similitudes entre esta idea y la inhibición de los productos de enzimas como ocurre en muchas reacciones bioquímicas, y estudios acerca del músculo cardíaco han sugerido que el lactato/H+ puede causar un deterioro de la contractilidad y arritmias durante la isquemia del miocardio (28-31).
Observaciones a partir de Estudios Basados en la Correlación
Muchos de los primeros estudios encontraron que el lactato se había incrementado en el músculo de rana fatigado en el punto final, o en la sangre luego de un ejercicio agotador en los humanos (5, 7, 13-16), lo cual coloca al lactato como un candidato potencial inductor de la fatiga. En 1976, Fitts y Hollozsy (32) fueron los primeros en reforzar esta afirmación, revelando una estrecha relación lineal entre la acumulación de lactato y la pérdida de fuerza de la contracción a medida que la fatiga progresaba en el músculo de rana. Esta observación fue pronto repetida usando una variedad de protocolos de estimulación (20) y luego en mamíferos, usando músculos esqueléticos aislados de ratas (33) o en el músculo cuadriceps humano activado por medio de estimulación eléctrica (26, 34). Además, las relaciones temporales también fueron aparentes entre la declinación de la fuerza y la acumulación de H+ en cada uno de estos estudios (20, 26, 33, 34).
Dos correlaciones más, usadas para apoyar la hipótesis del ácido láctico son las que sostienen que la acumulación de lactato o H+ intramusculares, y la declinación de la fuerza, ocurren ambas más lentamente después del entrenamiento físico (33) y en las fibras musculares de contracción lenta más resistentes a la fatiga, que en las de contracción rápida (33, 35, 36). Aunque estos estudios correlacionales son sugestivos, no prueban causa y efecto. De hecho, los mismos estudios muestran que las correlaciones también existen entre la disminución de la fuerza y la disminución del ATP (32), el incremento del fosfato inorgánico (Pi) (20), el incremento en el adenosín difosfato (ADP) (20), y el agotamiento de la PCr (20, 33). Si los argumentos de la correlación permanecieron fijos, entonces estos otros cambios metabólicos deberían con seguridad ser considerados como factores causantes de la fatiga.
Además, un punto importante es que todos los estudios arriba mencionados implicaron un ambiente anaeróbico impuesto, ya sea introduciendo gases en el músculo, como el N2 en vez de O2 (20, 32), usando cianida (20), produciendo una isquemia en el músculo con un manguito (cuff) (26, 34) o utilizando músculos enteros aislados, donde las restricciones de la difusión probablemente producen una hipoxia en las fibras centrales (33). Esta condición muy probablemente tiene una conexión importante con los mecanismos de fatiga (8).
Adams et al. (35) compararon la fatiga durante la estimulación tetánica repetida de los músculos soleo de gato con y sin perfusión. Los autores observaron una pérdida de fuerza 60% mayor y una acidosis de 0,3 unidades de pH mayor en la situación de isquemia. En contraste, debería haber un buen aporte de O2 y un flujo sanguíneo adecuado durante muchas formas de ejercicios dinámicos en los humanos. De este modo, la única conclusión real que puede ser tomada a partir de estos estudios particulares de correlación es que el lactato o los iones H+ son candidatos potenciales para causar la fatiga.
¿PUEDEN LOS IONES LACTATO O LA ACIDOSIS SER LOS CULPABLES?
Acumulación Intramuscular de Lactato
Durante el ejercicio intenso en los humanos, la concentración de lactato puede incrementarse hasta 40 mmol.L-1 en las fibras musculares y hasta 25 mmol.L-1 en el plasma (5, 7, 23, 26). Los incrementos en el lactato extracelular no parecen influenciar directamente la producción de fuerza (37, 38), por lo que ha habido más interés acerca de los efectos del lactato intramuscular sobre la función de los miofilamentos o el acoplamiento excitación-contracción. Cuando son realizados experimentos sobre fibras musculares aisladas (en donde la membrana celular ha sido removida), las proteínas de los miofilamentos pueden ser expuestas al medio, imitando lo que ocurre durante la fatiga, e.g., cuando aumenta el lactato. En este tipo de experimentos ha sido demostrado que el lactato no influye apreciablemente sobre la función máxima de los puentes cruzados (39-41). Otros estudios indican que el lactato puede afectar la liberación de calcio (Ca2+) desde el retículo sarcoplásmico aislado (42) y cuando se usan métodos artificiales para iniciar la liberación de Ca2+ en las fibras aisladas (40). Sin embargo bajo condiciones más fisiológicas, la aplicación de lactato en concentración 20-30 mmol.L-1 afecta solo ligeramente (<10%) la liberación de Ca2+ y la fuerza (40, 41). No se ha señalado que tales efectos tengan alguna importancia en la fatiga.
Acidosis Intramuscular
Un prerrequisito para apoyar la idea que indica que la acidosis mioplasmática es responsable de la fatiga es que la concentración intramuscular de H+ debe incrementarse (o el pHm debe disminuir) durante el ejercicio (Tabla 1). Esto requiere que se hagan muestreos invasivos con biopsias tomadas de músculos grandes que trabajan, cuando el interés es el ejercicio dinámico. En 1972, Hermansen y Osnes (21) fueron los primeros en demostrar, usando análisis de biopsias, que durante el ciclismo o la carrera a máxima intensidad se produce una gran acidosis en el músculo cuadriceps. En la Tabla 1 son presentados datos de estudios similares acerca de otros tipos de eventos de ejercicio. Durante el ejercicio prolongado submáximo, el pHm solo es ligeramente afectado (43, 44) y con el ejercicio máximo de corta duración (<30 segundos) ocurren cambios pequeños a moderados en el pHm (45, 46).
Así, es improbable que los H+ jueguen un rol principal en este tipo de eventos. La mayor acidosis ocurre con el ejercicio máximo continuo o intermitente de 1-10 minutos de duración; el pHm puede caer en 0,5 unidades hasta ~6,5, aunque hay una gran variación en estos valores (12, 21-23, 46, 47). Esta variación posiblemente se ha debido a las diferentes proporciones de fibras de contracción rápida y lenta que son reclutadas por los sujetos (48, 49) y a que se produce una mayor acidosis en las fibras de contracción rápida (33, 35, 36). Cuando son estudiadas las contracciones estáticas, la técnica de resonancia magnética nuclear puede ser usada para medir el pHm de forma no invasiva; el pHm puede caer hasta ~6,5, dependiendo de la duración de la contracción (12, 49-51). La mayor acidosis en las fibras musculares humanas que parece ser realista está cerca de un pHm de 6,2 (5, 22, 48).
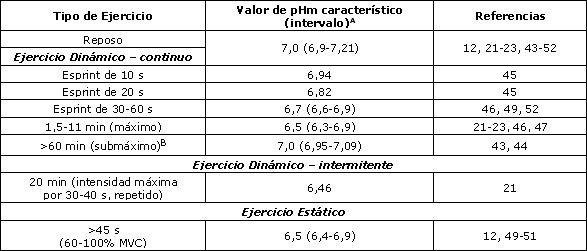
Tabla 1. Valores de pH intramusculares (pHm) obtenidos en reposo y luego de diferentes tipos de ejercicios. A: pHm = -log10[H+]m (valorado en homogenatos de muestras de biopsias a partir de los músculos cuadriceps o gastrocnemio después de pedalear o correr en humanos). El intervalo es dado para valores medios. B Las intensidades de ejercicio características corresponden al 60-90% del consumo de oxígeno pico. MVC=contracción isométrica voluntaria máxima.
Las mediciones de pHm también han sido realizadas al nivel de una sola fibra durante la fatiga usando microelectrodos de vidrio selectivos al pH o indicadores fluorescentes en ranas (37, 53, 54) o fibras musculares de ratón (27, 38, 55, 56). Una observación clave es que la acidosis es más pronunciada en las fibras de anfibio que en las de mamífero, aun usando un régimen de estimulación idéntico (38, 54-56). Esto sugeriría que las ideas formuladas cuando se usa músculo de anfibio implican muy probablemente una acidosis excesiva (5, 13, 32, 37, 53, 54). También, algunos protocolos para inducir fatiga no implican prácticamente ningún cambio del pHm en fibras de mamífero y por lo tanto puede ser eliminado el rol de la acidosis (38, 56).
Además, diferentes estudios pueden tener una acidosis artificialmente mayor que durante los ejercicios normales, debido a las concisiones experimentales impuestas. En los ejercicios auténticamente dinámicos, el pHm muy pocas veces cae <6,7, debido ya sea a que la duración es muy corta o la intensidad muy baja. Es solo durante los ejercicios máximos de aproximadamente 1-10 min, que puede ocurrir acidosis severa (Tabla 1).
Acidosis Plasmática
El balance ácido-base del plasma puede también ser alterado con ejercicio de moderada a alta intensidad; el pH del plasma puede caer desde ~ 7,4 hasta 6,9-7,0 con el ejercicio de intensidad máxima (21, 22, 57).
Los cambios en el pH intersticial pueden ser mayores que los del pH del plasma (58), aunque una acidosis de 0,1-0,2 unidades de pH es mucho más común (44-46, 52, 57, 58). De manera notable, la mayor acidosis extracelular frecuentemente ocurre minutos después de la finalización del ejercicio (21, 52, 58), cuando la fuerza con frecuencia se está recuperando. Los investigadores han valorado el efecto de la acidosis extracelular inducida sobre el músculo fresco y generalmente han demostrado que la fuerza tetánica pico no disminuye (37, 38, 53, 59). De aquí, que se piensa que la acidosis extracelular no causa la fatiga.
Teniendo en cuenta que el foco de muchos estudios está centrado sobre la acidosis intramuscular, algunos de estos estudios y la solidez de sus conclusiones va a ser discutida ahora.
EFECTOS PERJUDICIALES DE LA ACIDOSIS SOBRE EL RENDIMIENTO MUSCULAR
Relación entre el pH Intramuscular y la Producción de Fuerza en la Fatiga Muscular
Diferentes grupos han medido el pHm y la fuerza a través del transcurso de una actividad fatigante en músculos humanos o animales (1, 20, 26, 33-36). La Figura 1 muestra la relación entre el pHm y la reducción de la fuerza debido al proceso de la fatiga, en base a datos de dos de estos estudios realizados en sujetos humanos (1, 26, 34). En ambos casos, el pHm podría caer en 0,3-0,4 unidades de pH hasta ~ 6,7 solamente con una pérdida de fuerza moderada, y cuando la acidosis fue más severa, hubo una marcada reducción de la fuerza. Estas relaciones pueden indicar que existe algún tipo de margen de seguridad más allá del cual la fuerza disminuye abruptamente con mayores disminuciones del pHm. En línea con esta idea de margen de seguridad, está un trabajo que estudió al ciclismo y que demostró que una acidosis hasta un pH de 6,9 no tuvo efecto sobre el pico de potencia, y que a un pH de 6,8 solo hubo efectos pequeños (<10 % de disminución) (45). Cuando ocurrió una acidosis severa, hubo una mayor pérdida de la fuerza en el cuadriceps que en el primer músculo dorsal interóseo (Figura 1). Esto puede deberse a que el músculo cuadriceps tiene una mayor proporción de fibras de contracción rápida que el primer músculo dorsal interóseo, ya que las fibras de contracción rápida son más susceptibles a la disminución de la fuerza con la acidosis (29, 33, 35, 36, 39). También, se espera que la relación se desplace hacia arriba si otros factores diferentes a los H+, contribuyen a la disminución de la fuerza con la fatiga en estos estudios, i.e., es generada más fuerza a cada pHm. Además, la fuerza puede ser parcialmente recuperada luego de la finalización del ejercicio cuando el pH continua siendo acidótico (1, 36, 50), una observación usada para cuestionar la hipótesis del ácido láctico. Sin embargo, es plausible que los H+ puedan disminuir la fuerza a través de la interacción con otros factores que cambien en las células musculares (e.g., electrolitos), pero estos factores se recuperan más rápidamente que el pH después del ejercicio, por lo que los efectos de interacción se pierden. Sin embargo, la fatiga puede estar asociada con una acidosis intracelular (Figura 1), aunque la relación entre el pHm y la fatiga no parece ser simple y puede requerir efectos de interacción con otros factores de la fatiga.
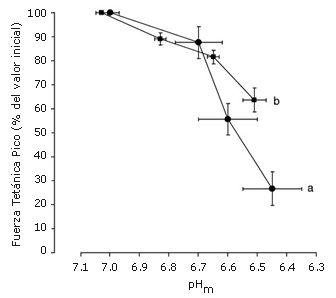
Figura 1. Relación entre la fuerza tetánica pico y el pH intramuscular (pHm) durante la fatiga en músculos humanos. Los puntos de los datos están representados como valores medios±desvíos estándar. (a) La fatiga fue evocada por estimulación tetánica repetida (20 Hz para 1,6 s, con períodos de recuperación de 1,6 s, para 100 contracciones) en el músculo cuadriceps (n=7), el pHm fue determinado a partir de las muestras de biopsias (26, 34); (b) La fatiga fue evocada por tres contracciones voluntarias máximas repetidas (15 s cada una) del primer músculo dorsal interóseo. La fuerza tetánica pico fue evocada a 100 Hz por 0,5 s, el pH fue medido usando espectroscopia de resonancia magnética nuclear (n=4). Tanto en (a) como en (b), el aporte de sangre al músculo fue ocluido con un manguito.
Efecto de la Acidosis Inducida sobre la Producción de Fuerza en el Músculo Fresco
Otra prueba para la hipótesis del ácido láctico es imponer una acidosis sobre el músculo fresco de magnitud similar a la observada durante actividades fatigantes. Si la hipótesis es válida, entonces esta intervención debería disminuir la fuerza en un grado similar al de la fatiga. Tales experimentos pueden ser llevados a cabo fácilmente con preparados de músculo aislado. Efectivamente, incrementar el contenido de CO2 en la solución de baño causa una disminución del pH (12, 38, 53, 56) y reduce la fuerza en el anfibio intacto (53) y en el músculo esquelético de mamífero (29, 39, 60, 61). De manera notable, este efecto parece ser pequeño en fibras aisladas (<10% de reducción) cuando se usan métodos de activación más fisiológicos (62).
También ha sido planteado a partir de este tipo de experimentos, que una gran acidosis per se es insuficiente para explicar toda la pérdida de fuerza durante la fatiga (53). Una modificación de estos experimentos implica que una pequeña acidosis extracelular (inducida por cloruro de amonio o CO2) puede exacerbar la pérdida de fuerza que ocurre con la estimulación tetánica repetida de los músculos de los miembros traseros en animales (59) y en los músculos cuadriceps en los humanos (63) o pueden acortar el tiempo hasta el agotamiento durante el ejercicio máximo (64, 65). Sin embargo, una acidosis impuesta no causa una fatiga significativa en el ejercicio de intensidad máxima y corta duración (30 s) (66).
Mecanismo (s) del Deterioro Contráctil Inducido por la Acidosis
También debe haber mecanismos celulares, a través de los cuales la acidosis pueda disminuir la producción de fuerza y potencia muscular. Un gran número de procesos celulares pueden contribuir a tales efectos (Tabla 2). Estos procesos han sido frecuentemente investigados siendo alterada solo la concentración de H+ en preparados de músculo aislado, e.g., fibras musculares aisladas, vesículas de retículo sarcoplásmico, canales de iones o enzimas aisladas. Sin embargo, en sistemas más intactos, los efectos negativos no siempre se ven. Por ejemplo, la acidosis puede reducir el movimiento de cargas (67) o directamente afectar la liberación de Ca2+ desde el retículo sarcoplásmico aislado con una activación con voltaje normal en fibras aisladas mecánicamente (62) o intactas (9). También, el incremento de la concentración de H+ puede inhibir la actividad de la fosfofructoquinasa cuando la enzima está aislada (69), pero no en el ejercicio de todo el cuerpo, cuando diferentes activadores enzimáticos pueden contrarrestar este efecto (12, 26, 70). La región más popular propuesta de deterioro, la constituyen las proteínas de los miofilamentos, donde las reducciones de la actividad máxima de los puentes cruzados (29, 39, 53, 60-62, 71-73), la activación de la troponina mediada por el Ca2+ (5, 9, 29, 56) y la actividad de la ATPasa de la miosina (5, 9, 72, 74), podrían permitir que los H+ sean los culpables (Tabla 2). De todos modos, se debería tener cuidado con la interpretación de estos estudios por dos razones.
Primero, muchos de estos estudios implican trabajar en condiciones extremadamente ácidas (pH<6,5), lo cual ocurre en pocas situaciones de ejercicio (Tabla 1) y segundo, rara vez han sido estudiados los efectos de interacción con otros factores causantes de la fatiga, ya que solo se modifican los H+ y otros factores son mantenidos constantes. Nosek et al. (61) demostraron que los H+ y el Pi podrían interactuar para reducir la fuerza, y la implicancia de esto es que las especies de Pi que han perdido protones funcionan como el metabolito perjudicial.

Tabla 2. Mecanismos propuestos para la disminución del rendimiento muscular con la acidosis intramuscular. A: la fuerza máxima es aquella evocada cuando se usa una muy alta concentración de Ca2+, de modo que la troponina es saturada con Ca2+. ATP: trifosfato de adenosina; ATPasa: adenosín trifosfatasa; AMPc: adenosín monofosfato cíclico; GP: glucógeno fosforilasa; KATP: canal de K+ dependiente de ATP; PFK: fosfofructoquinasa; SR: retículo sarcoplásmico;
↑ indica incremento;
↓ indica disminución.
Consenso al Final de los 80’
En este punto del tiempo, diferentes revisiones expresaron su visión acerca de que los H+ eran probablemente la causa principal de la fatiga, cuando hay una acidosis intramuscular inducida por el ejercicio (5, 9, 11, 12, 71). La evidencia que apoya esto es la siguiente: (i) el ejercicio intenso o la estimulación eléctrica conducen a una acidosis intracelular en el músculo fatigado; (ii) existe una relación temporal entre el lactato mioplasmático o la acumulación de H+ y la disminución de la fuerza durante la fatiga; (iii) los estudios basados en la correlación demuestran que la tasa y grado de acidosis intramuscular es atenuada y la fatiga es disminuida después del entrenamiento o es menor en las fibras musculares de contracción lenta respecto a las de contracción rápida; (iv) una acidosis inducida reduce la fuerza muscular y la velocidad de acortamiento en el músculo y exacerba la fatiga durante una actividad contráctil subsiguiente; y (v) existen mecanismos donde la elevación de los H+ podría perjudicar los procesos contráctiles y metabólicos.
LA ACIDOSIS EN REALIDAD NO ES MALA
En los 90’, diferentes hallazgos han desafiado fuertemente la hipótesis del ácido láctico, todos estos descubrimientos implican efectos menos perjudiciales de la acidosis sobre la función muscular a temperaturas más fisiológicas. Serán presentados tres tipos de estos experimentos. En primer lugar, los primeros estudios que mostraron efectos perjudiciales de los H+ sobre las fibras aisladas fueron frecuentemente realizados a 10-20°C, en donde el preparado fue más estable. Cuando los métodos permiten la investigación a 25-30°C, los efectos relativos de la acidosis sobre la fuerza isométrica y la velocidad de acortamiento desaparecieron o se atenuaron (72, 73). En segundo lugar, los efectos relativos de la acidosis inducida por CO2 sobre el rendimiento muscular en el músculo fueron atenuados a 25-37°C (35, 36, 73, 74), mientras que durante la fatiga ocurrieron cambios similares en el pHm en asociación con una disminución importante de la fuerza (35). En tercer lugar, una exposición a CO2 de preacondicionamiento a 28°C, no parece acelerar la fatiga en fibras aisladas de ratón, aunque resultó en una mayor acidosis durante la fatiga (55).
Tomados en conjunto, estos experimentos de la fisiología muscular demuestran que la acidosis no ejerce grandes efectos inotrópicos negativos y no puede en si misma, causar una fatiga severa.
Consecuentemente, estos experimentos han sido usados para desacreditar la hipótesis del ácido láctico, al menos a través de los efectos directos de los H+ sobre el músculo (10, 76). No obstante, los menores efectos negativos de la acidosis sobre el rendimiento muscular (<10% de disminución) pueden ser todavía suficientes para limitar el rendimiento de todo el cuerpo en competición (77).
Además, una acidosis inducida puede exacerbar la fatiga en animales y humanos intactos (63-65), de manera contraria a lo que observado en los resultados de las fibras musculares aisladas (55). De aquí, es concebible que los H+ puedan interaccionar con algún otro cambio en el músculo (e.g. con una disminución de la liberación de Ca2+ a partir del retículo sarcoplásmico) o en el cuerpo para afectar el rendimiento en el ejercicio.
EL LACTATO Y LA ACIDOSIS TIENEN EFECTOS MEJORADOTES DEL RENDIMIENTO
Posibles Beneficios con el Lactato/H+
Muchas observaciones sugieren que la producción de lactato/ H+ probablemente tiene valor en vez de ser perjudicial, pero los efectos beneficiosos rara vez son mencionados. Los efectos bien documentados de la acidosis, incluyendo una mayor liberación de O2 a partir de la hemoglobina para las fibras musculares que trabajan (el Efecto Bohr), la estimulación de la ventilación, el incremento del flujo sanguíneo muscular y el feedback aferente hacia el SNC para incrementar la conducción cardiovascular (27, 58, 64, 78), pueden ayudar durante el ejercicio. El lactato también puede ser ventajoso, teniendo en cuenta que Brooks propuso su “hipótesis de transporte del lactato”, donde el lactato liberado por los músculos que trabajan es tomado y utilizado por otras células o fibras musculares como un combustible metabólico (10, 24). También, ha sido recientemente demostrado que la ingesta de lactato mejora el rendimiento durante el ejercicio intenso en los humanos (79) y durante la estimulación hasta la fatiga de los músculos perfundidos de las patas traseras de ratas (80). Finalmente, la producción de lactato está asociada con un potencial (redox) de oxidación-reducción que ayuda a sostener la producción intramuscular de ATP y el rendimiento (81, 82). Esto se revela claramente en los pacientes con la enfermedad de McArdle, quienes no tienen a la enzima glucógeno fosforilasa y no pueden producir lactato/H+, por lo que se fatigan más rápidamente que los sujetos normales, quienes efectivamente se enfrentan a la acidosis (1, 82). Esta situación clínica muestra categóricamente que la glucólisis ayuda a preservar el rendimiento humano y que otros procesos diferentes a la acumulación de lactato/H+ contribuyen para que se instale la fatiga.
Ácido Láctico: Interacción con el Potasio
Los científicos frecuentemente se esfuerzan para hacer experimentos por medio del cambio sistemático de un factor y manteniendo todos los otros aspectos constantes, pero esta no es la situación durante el ejercicio de todo el cuerpo. Dos grandes y prominentes cambios que ocurren simultáneamente durante el ejercicio de alta intensidad, implican a los iones H+ y al potasio (K+) (5, 7, 22, 30, 31, 47, 70).
Leitch y Paterson (30) y Paterson (31) usaron esta información y demostraron que la hiperpotasemia (incremento de la concentración extracelular de K+) y la acidosis presentan efectos perjudiciales aditivos sobre el rendimiento del músculo cardíaco. Sin embargo, con el músculo esquelético, la respuesta de estos cambios iónicos es notablemente diferente. En 1992, Renaud y Light (83) fueron los primeros en mostrar que la acidosis presenta una influencia protectora contra la disminución de la fuerza inducida por el K+ en el músculo esquelético de rana. Sin embargo, no fue hasta que Nielsen et al. (84) realizaron en 2001 experimentos similares en músculo esquelético de mamífero (pero con exposición al lactato), hasta que ganaron importancia las noticias acerca de que la acidosis protege contra la parálisis de la fuerza inducida por el K+ (ver Figura 2). Estos estudios han sido actualmente reproducidos y extendidos (85-88) con efectos beneficiosos similares de la acidosis, observados en el desmejoramiento de la liberación de Ca2+ y de la fuerza en fibras musculares de contracción rápida aisladas mecánicamente (88). Estas observaciones recientes efectivamente han causado un gran dolor de cabeza a los que apoyan la hipótesis del ácido láctico (24). Actualmente existe controversia para explicar el mecanismo por el cual la acidosis restituye la contractilidad en los músculos agotados de K+.
Pedersen et al. (87) demostraron que la acidosis restituye la excitabilidad en conjunto con una reducción de la conductancia de cloruro (Cl-) en las membranas musculares. Sin embargo la incubación en soluciones bajas en Cl- puede restituir (87-89) o disminuir la fuerza en condiciones de incremento del K+ extracelular (4), lo cual implica que el mecanismo es incierto.
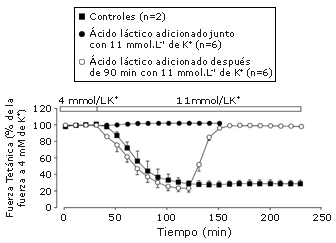
Figura 2. Efecto protector de la exposición a 20 mmol.L-1 de lactato sobre la fuerza tetánica en el músculo soleo de rata expuesto a una [K+] extracelular de 11 mmol.L-1. Las contracciones tetánicas fuero evocadas cada 10 min (30 Hz, 1,5 s) a 30°C. Los puntos de los datos son presentados como valores medios±error estándar de la media (reproducido de Nielsen (84) con permiso).
Los dramáticos hallazgos anteriormente mencionados han producido un impacto tan grande que Allen y Westerblad (90) titularon su reciente publicación en Science: “Ácido láctico – la última droga para mejorar el rendimiento”. Esta idea naturalmente hace que uno piense acerca de esta posibilidad, pero uno piensa si la extrapolación de la interacción acidosis-K+ en músculos aislados al rendimiento en el ejercicio no es muy extrema. La exposición al lactato o la acidosis no tiene efecto sobre la fatiga inducida con la estimulación tetánica repetida de preparados de músculo aislado (55, 85), aunque disminuye la fatiga in situ (80), este aparente enigma puede ser atribuido a los diferentes modelos de fatiga empleados (8). Nunca ha sido demostrado que la acidosis inducida en humanos mejore el rendimiento en el ejercicio, y por el contrario, los efectos son frecuentemente negativos (63-65). Además, la estimulación hasta la fatiga de músculos aislados demuestra que en las mismas fibras se producen de manera conjunta una gran acidosis intracelular y una gran despolarización (lo cual representa efectos sobre el K+), y en esta situación, la fuerza tetánica se reduce considerablemente (37, 53). Esta observación y pensamiento tradicional utilizando un tipo de enfoque de correlación podría ser utilizada para plantear que tanto los H+ como el K+, constituyen factores causantes de la fatiga. Este hallazgo podría ser interpretado de dos formas: (i) tanto la acidosis como el K+ causan la fatiga, pero interaccionando con algún otro factor; (ii) que la acidosis efectivamente protege contra los efectos deletéreos del K+ y algo más causa la fatiga. Hay pocas dudas respecto a que los H+ y el K+, solos pueden explicar gran parte de la fatiga, y diferentes estudios recientes se han centrado más cuidadosamente sobre el rol de diversos otros factores interaccionantes (3, 4, 30, 31, 67, 86-89). El mensaje importante que debe ser extraído a partir de estos últimos hallazgos (84-88) es que hay una necesidad genuina para tener cuidado acerca de si el lactato/ H+ son perjudiciales durante la fatiga.
¿CUAL ES EL POTENCIAL PARA EL INCREMENTO DEL RENDIMIENTO DEL BICARBONATO?
Ha sido postulado que la ingesta de amortiguadores de H+, tales como el bicarbonato de sodio, podría disminuir la acidosis durante el ejercicio y de este modo atenuar la fatiga (11, 44, 64-66, 71). Aunque la literatura acerca de este tópico parece ser contradictoria, al parecer el bicarbonato aumenta el rendimiento, pero está principalmente restringido al ejercicio de alta intensidad con una duración de 1-10 minutos (11, 57, 64, 65, 71) o cuando ocurren grandes alteraciones ácido-base (91), pero no hay ningún efecto protector sin una gran acidosis.
Además, tales efectos beneficiosos no están limitados al bicarbonato, ya que la ingestión de otros amortiguadores de H+ también mejora el rendimiento en el ejercicio (79). El amortiguador de H+ aparece en el plasma, pero no entra en el músculo (71, 79, 92) y está postulado que el efecto ergogénico es mediado por una mayor expulsión de H+ a partir de las fibras musculares que trabajan (27, 91, 92), para retrasar o atenuar la caída en el pHm (91). Hay evidencia que sugiere que el bicarbonato puede actuar sobre el músculo para mejorar el rendimiento contráctil (92), pero existe disparidad, ya que este no siempre es el caso (93). La posibilidad de que una gran acidosis extracelular pueda ejercer efectos negativos a través del SNC es consistente con los últimos hallazgos.
Efectivamente, la carga de bicarbonato puede amortiguar la acidosis plasmática en el ejercicio (57) y mejorar el rendimiento en asociación con menores índices de fatiga percibida (11, 57, 94) o a través de una disminución de la desaturación arterial de la hemoglobina (disminuyendo la presión parcial de O2), que ocurre durante el remo de competición (57).
Las condiciones hipóxicas pueden ejercer efectos perjudiciales a través del SNC (95, 96), lo cual podría ser posiblemente aliviado con bicarbonato. Estas ideas conducen al intrigante pensamiento que indica que el bicarbonato puede trabajar, disminuyendo la fatiga central. Esto claramente, no puede ser investigado en experimentos con preparados reducidos de músculo (8) y de este modo, un más completo entendimiento acerca del rol del lactato y la acidosis en el rendimiento necesitaría estudios en el ejercicio y realizados sobre todo el cuerpo.
DIRECCIONES FUTURAS
Para desarrollar un mayor entendimiento acerca del rol del lactato/H+ sobre el rendimiento, se requiere mucho más que un tipo de experimentos o el uso de un modelo de fatiga (8). En el futuro podrían estar disponibles estudios para responder a las siguientes preguntas:
¿Influencian la acidosis o alcalosis inducidas diferentes mecanismos de fatiga mecánica (e.g., producción de potencia), que son relevantes para los diferentes tipos de ejercicio en humanos.
¿Causan la acidosis plasmática o la alteración del feedback aferente muscular debido al lactato o la acidosis (78), un incremento en la percepción del esfuerzo, disminución a partir del SNC, disminución de la concentración o de la estabilidad en los humanos?.
¿Qué efectos de interacción negativos ocurren entre la elevación de los H+ y otros factores que cambian durante el ejercicio intenso?. Esto necesita ser extendido desde el H+ (83-88), para incluir el Na+ (2, 22, 57), Cl- (4, 22, 87-89), Ca2+ (3, 5, 22, 57, 67) y metabolitos de fosfato (1, 5, 6, 33, 45, 46, 50), para nombrar algunos.
Estos estudios necesitan estar basados tanto en mecanismos como en rendimiento, y teniendo en mente posibles efectos de contribución a partir de cambios hormonales que ocurren simultáneamente durante el ejercicio, tales como con el incremento de las catecolaminas (30, 31, 46, 86).
CONCLUSIONES
No hay absolutamente ninguna duda que la vía glucolítica es extremadamente importante para la función muscular. Efectivamente, los pacientes con la enfermedad de McArdle, quienes no pueden usar esta vía, no son capaces de sostener el ejercicio intenso (1, 82) y es bien desarrollada con el entrenamiento de esprint (33, 46). Además, la concentración de lactato constituye un marcador muy útil de la intensidad del ejercicio y de la adaptación al entrenamiento. Sin embargo, un rol del “ácido láctico”en la fatiga es más controversial, habiendo una variedad de trabajos que discutieron este tópico, y que implican trabajo sobre preparados musculares aislados y con sujetos humanos. Los puntos principales discutidos en este artículo son los siguientes:
Los estudios basados en la correlación han planteado que la acumulación de lactato/ H+ es la causa de la fatiga, lo cual se ha fijado en nuestra psiquis. Muchos de los estudios fueron realizados en músculos de anfibio (bajo condiciones anaeróbicas) que generan lactato/H+ más fácilmente que en el músculo de mamífero.
Algunos efectos del incremento del lactato y la acidosis durante el ejercicio probablemente pueden ser beneficiosos por medio de ya sea efectos sistémicos o directos sobre el músculo.
El trabajo reciente realizado por los fisiólogos musculares, que demuestra que la acidosis inducida tiene efectos limitados sobre la función muscular contráctil a temperaturas corporales y protege contra la hiperpotasemia, ha hecho que volvamos a pensar si los H+ son perjudiciales y que pueden ser ergogénicos.
Muchas formas de ejercicio implican poco o ningún cambio en el lactato o el pHm (Tabla 1). Solo unos pocos tipos de ejercicio dinámico implican acidosis severa, lo cual es necesario para causar una disminución en la fuerza (Figura 1). Esto posiblemente implica la interacción de los H+ con otros cambios celulares, y es más importante en las fibras de contracción rápida que en las de contracción lenta.
Los estudios de todo el cuerpo demuestran que la acidosis inducida puede afectar el rendimiento muscular o en el ejercicio y que la alcalosis inducida puede ser ergogénica para eventos que duran entre 1 y 10 minutos.
Estos últimos puntos parecen proporcionar el más fuerte apoyo a la proposición que indica que el ácido láctico es uno de los culpables de la disminución del rendimiento. Lo que es absolutamente cierto es que el lactato/H+ no constituyen la única causa de la fatiga, y aun con una severa acidosis inducida por el ejercicio, no podemos ser dogmáticos planteando que el “ácido láctico” juega el rol principal en la fatiga.
Dirección para Envío de Correspondencia
Simeon P. Cairns, Division of Sport and Recreation, Faculty of Health and Environmental Sciences, Auckland University of Technology, Private Bag 92006, Auckland 1020, New Zealand. E-mail: simeon.cairns@aut.ac.nz
Agradecimientos
El autor agradece enormemente a los Drs Will Hopkins, Graham Lamb, Mike Lindinger y Chris Whatman por sus provechosos comentarios y discusiones acerca del manuscrito. No fueron utilizadas fuentes de subsidios para ayudar a la preparación de esta revisión. El autor no tiene ningún conflicto de interés que sea directamente relevante para el contenido de esta revisión.
Referencias
1. Cady E. B., Jones D. A., Lynn J. et al (1989). Changes in force and intracellular metabolites during fatigue of human skeletal muscle. J Physiol 418: 311-25
2. Cairns S. P., Buller S. J., Loiselle D. S. et al (2003). Changes of action potentials and force at lowered [Na+] o in mouse skeletal muscle: implications for fatigue. Am J. Physiol 285: C1529-36
3. Cairns S. P., Hing W. A., Slack J. R. et al (1998). Role of extracellular [Ca2+] in fatigue of isolated mammalian skeletal muscle. J Appl Physiol 84: 1395-406
4. Cairns S. P., Ruzhynsky V., Renaud J. M (2004). Protective role of extracellular chloride in fatigue of isolated mammalian skeletal muscle. Am J Physiol 287: C762-70
5. Fitts R. H (1994). Cellular mechanisms of muscle fatigue. Physiol Rev 1994; 74: 49-94
6. Green H. J (1997). Mechanisms of muscle fatigue in intense exercise. J Sports Sci 15: 247-56 Enlaces Bibliográficos Solicitud de Documentos
7. Lindinger M. I., McKelvie R. S., Heigenhauser G. J (1995). K+ and Lac- distribution in humans during and after high-intensity exercise: role in fatigue attenuation. J Appl Physiol 78: 765-77 Enlaces Bibliográficos Recursos de Internet Solicitud de Documentos
8. Cairns S. P., Knicker A. J., Thompson M. W., et al (2005). Evaluation of models used to study neuromuscular fatigue. Exerc Sport Sci Rev 33 (1): 9-16
9. Gladden L. B (2004). Lactate metabolism: a new paradigm for the third millennium. J Physiol 558: 5-30
10. Heigenhauser G. J. F., Jones N. L (1991). Bicarbonate loading. In: Lamb DR, Williams MH, editors. Vol. 4. Perspectives in exercise science and sports medicine. Carmel (MI): Cooper Publishing Group, 183-207
11. Sahlin K (1986). Muscle fatigue and lactic acid accumulation. Acta Physiol Scand Suppl 1986; 556: 83-91
12. Fletcher W. M., Hopkins G (1907). Lactic acid in amphibian muscle. J Physiol 35: 247-309
13. Hill A. V., Kupalov P (1929). Anaerobic and aerobic activity in isolated muscle. Proc R Soc Lond B 105: 313-22
14. Hill A. V., Lupton H (1923). Muscular exercise, lactic acid, and the supply and utilization of oxygen. Q J Med 16: 135-71
15. Bassett D. R (2002). Scientific contributions of A.V. Hill: exercise physiology pioneer. J Appl Physiol 93: 1567-82
16. Robergs R. A., Ghiasvand F., Parker D (2004). Biochemistry of exercise-induced acidosis. Am J Physiol 287: R502-16
17. Robergs R. A., Ghiasvand F., Parker D (2005). Lingering construct of lactic acidosis. Am J Physiol 289: R904-10
18. Lindinger M. I., Kowalchuk J. M., Heigenhauser G. J. F (2005). Applying physiochemical principles to skeletal muscle acid-base status. Am J Physiol 289: R891-4
19. Dawson M. J., Gadian D. G., Wilkie D. R (1978). Muscular fatigue investigated by phosphorus nuclear magnetic resonance. Nature 274: 861-6
20. Hermansen L., Osnes J. B (1972). Blood and muscle pH after maximal exercise in man. J Appl Physiol 32: 304-8
21. Sahlin K., Alvestrand A., Brandt R., et al (1978). Intracellular pH and bicarbonate concentration in human muscle during recovery from exercise. J Appl Physiol 45: 474-80
22. Sahlin K., Harris R. C, Nylind B., et al (1976). Lactate content and pH in muscle samples obtained after dynamic exercise. Pflügers Arch 367: 143-9
23. Brooks G. A (2001). Lactate doesnt necessarily cause fatigue: why are we surprised?. J Physiol 536: 1
24. Lydiard A., Gilmour G (1983). Running with Lydiard. Auckland: Hodder & Stroughton
25. Juel C (1997). Lactate-proton cotransport in skeletal muscle. Physiol Rev 77: 321-58
26. Cairns S. P., Westerblad H., Allen D. G (1993). Changes in myoplasmic pH and calcium concentration during exposure to lactate in isolated rat ventricular myocytes. J Physiol 464: 561-74
27. Donaldson S. K. B., Hermansen L (1978). Differential, direct effects of H+ on Ca2+-activated force of skinned fibers from the soleus, cardiac and adductor magnus muscles of rabbits. Pflügers Arch 376: 55-65
28. Leitch S. P., Paterson D. J (1994). Interactive effects of K+, acidosis, and catecholamines on isolated rabbit heart: implications for exercise. J Appl Physiol 77: 1164-71
29. Paterson D. J (1996). Antiarrhythmic mechanisms during exercise. J Appl Physiol 80: 1853-62
30. Fitts R. H., Holloszy J. O (1972). Lactate and contractile force in frog muscle during development of fatigue and recovery. Am J Physiol 231: 430-3
31. Troup J. P., Metzger J. M., Fitts R. H (1986). Effect of high-intensity exercise training on functional capacity of limb skeletal muscle. J Appl Physiol 60: 1743-51
32. Adams G. R., Fisher M. J., Meyer R. A (1991). Hypercapnic acidosis and increased H2PO4- concentration do not decrease force in cat skeletal muscle. Am J Physiol 260: C805-12
33. Meyer R. A., Adams G. R., Fisher M. J., et al (1991). Effect of decreased pH on force and phosphocreatine in mammalian skeletal muscle. Can J Physiol Pharmacol 69: 305-10
34. Renaud J. M (1989). The effect of lactate on intracellular pH and force recovery of fatigued sartorius muscles of the frog, Rana pipiens. J Physiol 416: 31-47
35. Westerblad H., Allen D. G (1992). Changes of intracellular pH due to repetitive stimulation of single fibres from mouse skeletal muscle. J Physiol 449: 49-71
36. Chase P. B., Kushmerick M. J (1988). Effects of pH on contraction of rabbit fast and slow skeletal muscle fibers. Biophys J 53: 935-46
37. Dutka T. L., Lamb G. D (2000). Effect of lactate on depolarization-induced Ca2+ release in mechanically skinned skeletal muscle fibers. Am J Physiol 278: C517-25
38. Posterino G. S., Fryer M. W (2000). Effects of high myoplasmic L-lactate concentration on E-C coupling in mammalian skeletal muscle. J Appl Physiol 89: 517-28
39. Favero T. G., Zable A. C., Bowman M. B., et al (1995). Metabolic end products inhibit sarcoplasmic reticulum Ca2+ release and [3H] ryanodine binding. J Appl Physiol 78: 1665-72
40. Booth J., McKenna M. J., Ruell P. A., et al (1997). Impaired calcium pump function does not slow relaxation in human skeletal muscle after prolonged exercise. J Appl Physiol 83: 511-21
41. Stephens T. J., McKenna M. J., Canny B. J., et al (2002). Effect of sodium bicarbonate on muscle metabolism during intense endurance cycling. Med Sci Sports Exerc 34: 614-21
42. Bogdanis G. C., Nevill M. E., Lakomy H. K. A., et al (1998). Power output and muscle metabolism during and following recovery from 10 and 20 s of maximal sprint exercise in humans. Acta Physiol Scand 163: 261-72
43. Nevill M. E., Boobis L. H., Brooks S., et al (1989). Effect of training on muscle metabolism during treadmill sprinting. J Appl Physiol 67: 2376-82
44. Nielsen J. J., Mohr M., Klarskov C. et al (2003). Effects of high-intensity intermittent training on potassium kinetics and performance in human skeletal muscle. J Physiol 554 (Pt 3): 857-70
45. Achten E., Van Cauteren M., Willem R., et al (1990). 31P-NMR spectroscopy and the metabolic properties of different muscle fibers. J Appl Physiol 68: 644-9
46. Mannion A. F., Jakeman P. M., Willan P. L. T (1995). Skeletal muscle buffer value, fibre type distribution and high intensity exercise performance in man. Exp Physiol 80: 89-101
47. DeGroot M., Massie B. M., Boska M., et al (1993). Dissociation of [H+] from fatigue in human muscle detected by high time resolution 31P-NMR. Muscle Nerve 16: 91-8
48. Chasiotis D., Hultman E., Sahlin K (1982). Acidotic depression of cyclic AMP accumulation and phosphorylase b to a transformation in skeletal muscle of man. J Physiol 335: 197-204
49. Costill D. L., Barnett A., Sharp R., et al (1983). Leg muscle pH following sprint running. Med Sci Sports Exerc 15: 325-9
50. Mainwood G. W., Renaud J. M (1985). The effect of acid-base balance on fatigue of skeletal muscle. Can J Physiol Pharmacol 63: 403-16
51. Chin E. R., Allen D. G (1998). The contribution of pH-dependent mechanisms to fatigue at different intensities in mammalian single muscle fibres. J Physiol 512: 831-40
52. Street D., Bangsbo J., Juel C (2001). Interstitial pH in human skeletal muscle during and after dynamic graded exercise. J Physiol 537: 993-8
53. Spriet L. L., Matsos C. G., Peters S. J., et al (1985). Effects of acidosis on rat metabolism and performance during heavy exercise. Am J Physiol 248: C337-47
54. Cooke R., Franks K., Luciani G. B., et al (1988). The inhibition of rabbit skeletal muscle contraction by hydrogen ions and phosphate. J Physiol 395: 77-97
55. Nosek T. M., Fender K. Y., Godt R. E (1987). It is diprotonated inorganic phosphate that depresses force in skinned skeletal muscle fibers. Science 236: 191-3
56. Lamb G. D., Stephenson D. G (1994). Effects of intracellular pH and [Mg2+] on excitation-contraction coupling in skeletal muscle fibres of the rat. J Physiol 478: 331-9
57. Kowalchuk J. M., Heigenhauser G. J. F., Jones N. L (1984). Effect of pH on metabolic and cardiorespiratory responses during progressive exercise. J Appl Physiol 57: 1558-63
58. Sutton J. R., Jones N. L., Toews C. J (1981). Effect of pH on muscle glycolysis during exercise. Clin Sci 61: 331-8
59. McCartney N., Heigenhauser G. J. F., Jones N. L (1983). Effects of pH on maximal power output and fatigue during short-term dynamic exercise. J Appl Physiol 55: 225-9
60. Balog E. M., Fitts R. H (2001). Effects of depolarization and low intracellular pH on charge movement currents of frog skeletal muscle fibers. J Appl Physiol 90: 228-34
61. Rousseau E., Pinkos E (1990). pH modulates conducting and gating behaviour of single calcium release channels. Pflügers Arch 415: 645-7
62. Trivedi B., Danforth W. H (1966). Effect of pH on the kinetics of frog muscle phosphofructokinase. J Biol Chem 241: 4110-4
63. Bangsbo J., Madsen K., Kiens B., et al (1996). Effect of muscle acidity on muscle metabolism and fatigue during intense exercise in man. J Physiol 495: 587-96
64. Linderman J., Fahey T. D (1991). Sodium bicarbonate ingestion and exercise performance: an update. Sports Med 11: 71-7
65. Pate E., Bhimani M., Franks-Skiba K., et al (1995). Reduced effect of pH on skinned rabbit psoas muscle mechanics at high temperatures: implications for fatigue. J Physiol 486: 689-94
66. Wiseman R. W., Beck T. W., Chase P. B (1996). Effect of intracellular pH on force development depends on temperature in intact skeletal muscle from mouse. Am J Physiol 271: C878-86
67. Davies N. W (1990). Modulation of ATP-sensitive K+ channels in skeletal muscle by intracellular protons. Nature 343: 375-7
68. Sprague P., Mann R. V (1983). The effects of muscular fatigue on the kinetics of sprint running. Res Q Exerc Sport 54: 60-6
69. Darques J. L., Decherchi P., Jammes Y (1998). Mechanisms of fatigue-induced activation of group IV afferents: the roles played by lactic acid and inflammatory mediators. Neurosci Lett 257: 109-12
70. Van Montfoort M. C. E., Van Dieren L., Hopkins W. G. et al (2004). Effects of ingestion of bicarbonate, citrate, lactate, and chloride on sprint running. Med Sci Sports Exerc 36: 1239-43
71. Sahlin K., Katz A., Henriksson J (1987). Redox state and lactate accumulation in human skeletal muscle during dynamic exercise. Biochem J 245: 551-6
72. Lewis S. F., Haller R. G (1986). The pathophysiology of McArdles disease: clues to regulation in exercise and fatigue. J Appl Physiol 61: 391-401
73. Renaud J. M., Light P (1992). Effects of K+ on the twitch and tetanic contraction in the sartorius muscle of the frog, Rana pipiens: implication for fatigue in vivo. Can J Physiol Pharmacol 70: 1236-46
74. Nielsen O. B., de Paoli F., Overgaard K (2001). Protective effects of lactic acid on force production in rat skeletal muscle. J Physiol 536 (Pt 1): 161-6
75. Kristiensen M., Albertsen J., Rentsch M., et al (2005). Lactate and force production in skeletal muscle. J Physiol 562 (Pt 2): 521-6
76. Pedersen T. H., Clausen T., Nielsen O. B (2003). Loss of force induced by high extracellular [K+] in rat muscle: effect of temperature, lactic acid and ß2-agonist. J Physiol 551: 277-86
77. Pedersen T. H., De Paoli F., Nielsen O. B (2005). Increased excitability of acidified skeletal muscle: role of chloride conductance. J Gen Physiol 125: 237-46
78. Pedersen T. H., Nielsen O. B., Lamb G. D., et al (2004). Intracellular acidosis enhances the excitability of working muscle. Science 305: 1144-7
79. Van Emst M., Klarenbeek S., Schot A., et al (2000). Reducing chloride conductance prevents hyperkalaemia-induced loss of twitch force in rat slow-twitch muscle. J Physiol 561: 169-81
80. Allen D. G., Westerblad H (2004). Lactic acid the latest performance-enhancing drug. Science 305: 1112-3
81. Raymer G. H., Marsh G. D., Kowalchuk J. M. et al (2004). Metabolic effects of induced alkalosis during progressive forearm exercise to fatigue. J Appl Physiol 96: 2050-6
82. Verbitsky O., Mizrahi J., Levin M. et al (1997). Effect of ingested sodium bicarbonate on muscle force, fatigue, and recovery. J Appl Physiol 83: 333-7
83. Spriet L. L., Lindinger M. I., Heigenhauser G. J. F. et al (1986). Effects of alkalosis on skeletal muscle metabolism and performance during exercise. Am J Physiol 251: R833-9
84. Swank A., Robertson R. J (1989). Effect of induced alkalosis on perception of exertion during intermittent exercise. J Appl Physiol 67: 1862-7
85. Dousset E., Steinberg J. G., Balon N. et al (2001). Effects of acute hypoxemia on force and surface EMG during sustained handgrip. Muscle Nerve 24: 364-71
86. Garner S. H., Sutton J. R., Burse R. L. et al (1990). Operation Everest II: neuromuscular performance under conditions of extreme simulated altitude. J Appl Physiol 68: 1167-72
Cita Original
Cairns, S. P. Lactic Acid and Exercise Performance: Culprit or Friend?. Sports Med.; 36 (4), 279-291, 2006.
Cita en PubliCE
Simeon P Cairns (2006). Ácido Láctico y Rendimiento en el Ejercicio: ¿Culpable o Amigo?. .https://g-se.com/cido-lactico-y-rendimiento-en-el-ejercicio-culpable-o-amigo-1158-sa-H57cfb271ceb7e
