Cetonas Para la Recuperación Después del Ejercicio: Posibles Aplicaciones y Mecanismos
Latt Shahril Mansor, Geoffrey Hubert Woo0 Health Via Modern Nutrition Inc. (H.V.M.N.), San Francisco, CA, United States
Resumen
La dieta cetogénica se ha introducido en áreas terapéuticas durante más de un siglo, pero el papel de las cetonas en el rendimiento del ejercicio sólo se ha explorado en la última década. Una de las principales razones que permite investigar el papel de las cetonas en el rendimiento del ejercicio es la aparición de cetonas exógenas, lo que permite a los atletas alcanzar el estado de cetosis de forma aguda e independiente de sus estados metabólicos. Si bien hay resultados mixtos que muestran que las cetonas exógenas mejoran el rendimiento del ejercicio o ningún efecto, los mecanismos de acción aún se están investigando intensamente. Además, estos primeros datos de los estudios de fisiología del ejercicio sugirieron que las cetonas exógenas pueden desempeñar un papel más destacado en la recuperación posterior al ejercicio, lo que lleva a un impacto acumulativo más pronunciado sobre el rendimiento posterior del ejercicio. Esta revisión analizará la evidencia existente sobre el papel de las cetonas en la recuperación e intentará identificar las mejores prácticas actuales y los posibles mecanismos que impulsan una mejor recuperación.
INTRODUCCIÓN
El impacto de la cetosis, inducida endógenamente a través de una dieta cetogénica (Prado y cols., 2011; Huang y cols., 2018; Ma y cols., 2018a, b) o exógenamente a través de cetonas exógenas (Cox y cols., 2016; Evans y Egan, 2018; Evans y cols., 2019; Poffe y cols., 2020a, b) sobre el rendimiento físico es un área de investigación activa y en rápida evolución. La mayoría de los estudios hasta la fecha se han centrado en sondear un posible impacto ergogénico de la ingesta aguda de cetonas exógenas antes del ejercicio. Los contenidos sobre el tema están mezclados hasta la fecha y la utilidad potencial depende de la especificidad del contexto, desde la forma de cetona exógena, la dosificación, la co-suplementación y el protocolo. Sin embargo, un trabajo reciente que investiga el papel de las cetonas en la recuperación después del ejercicio sugiere otra aplicación más duradera y clara de las cetonas en el rendimiento deportivo. Identificamos y revisamos todos los estudios relevantes usando la frase clave "recuperación de cetonas y ejercicio" en PubMed (Figura 1) para identificar los cuerpos de investigación actuales en la recuperación post-ejercicio que involucren cetonas. Aunque algunos estudios iniciales en animales mostraron que las cetonas endógenas, que se logran al alimentar a los animales con una dieta cetogénica, pueden proteger contra el daño oxidativo y mejorar la recuperación (Huang y cols., 2018; May cols., 2018a), también existe la preocupación de que la falta de carbohidratos en el cuerpo puede dificultar el rendimiento, especialmente en los episodios de ejercicio de mayor intensidad (Cox y cols., 2016). Según el ciclo de Randle, el aumento de la oxidación de los ácidos grasos disminuye la vía metabólica de la glucosa (Randle y cols., 1965) y, por lo tanto, la dieta cetogénica que sobreestimula el metabolismo de los ácidos grasos, puede inhibir las tasas glucolíticas y, posteriormente, la capacidad de producir ATP independientemente de la disponibilidad de oxígeno. Esto es especialmente importante para ejercicios anaeróbicos explosivos y de alta intensidad. Ésta siempre ha sido la preocupación de los investigadores sobre la utilización de una dieta cetogénica para el rendimiento o la recuperación. Sin embargo, con la aparición de cetonas exógenas, los atletas pueden aumentar sus concentraciones de β-hidroxibutirato (BHB) en sangre y estar en cetosis, independientemente de la dieta que sigan, además de poder acumular diferentes sustratos con cetonas para optimizar sus efectos en el rendimiento y la recuperación.
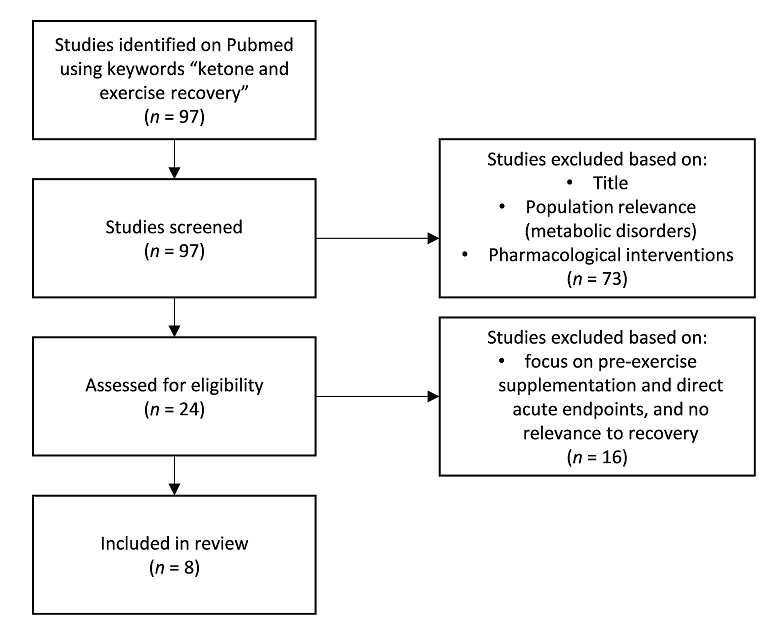
Figura 1. Diagrama de flujo de la colección de estudios.
Esta revisión tiene como objetivo dilucidar los hallazgos en el trabajo clínico y animal sobre el impacto de las cetonas en la recuperación posterior al ejercicio, los posibles mecanismos de acción y la interacción metabólica con otras vías metabólicas relevantes para la recuperación. También examinamos las fortalezas y limitaciones entre la cetosis endógena y exógena en una indicación de recuperación posterior al ejercicio.
Dieta cetogénica y recuperación después del ejercicio
El objetivo de la dieta cetogénica es lograr una cetosis nutricional óptima, que se define dentro del rango de 0.5 a 3.0 mM de BHB en sangre, pero que también podría alcanzar potencialmente hasta 5-8 mM de BHB, dependiendo de la ceto-adaptabilidad del individuo (Volek y Phinney, 2011; Poff y cols., 2020). Los primeros estudios sobre cetonas se realizaron con una dieta cetogénica, con la investigación de si las cetonas endógenas a partir de la cetogénesis tienen un efecto ergogénico sobre el rendimiento del ejercicio y, posteriormente, durante la recuperación después del ejercicio. En estudios con animales, los ratones adaptados a grasas y cetogénicos con dieta cetogénica durante 8 semanas (Tabla 1) mostraron un rendimiento mejorado sin agravar la lesión muscular, al tiempo que ejercen un efecto protector potencial sobre la lesión orgánica causada por el ejercicio (May cols., 2018b). Los autores sugirieron que esto puede atribuirse a la mayor eficiencia en el metabolismo de las grasas y de las cetonas en el grupo de ratones con dieta cetogénica como Ma y cols. mostraron una disminución de BHB, ácidos grasos no esterificados (NEFA) y triglicéridos durante el ejercicio mientras que la lipasa no se modificó, lo que indica una manera más eficiente en la que estos metabolitos se movilizaron y se utilizaron en el grupo de la dieta cetogénica. El mismo grupo de investigadores, en otro estudio, mostró que una dieta cetogénica de 8 semanas no sólo mejoraba el rendimiento del ejercicio, sino que también atenuaba el daño muscular causado por el ejercicio exhaustivo. Además de eso, el grupo de ratones con dieta cetogénica había mejorado la recuperación de la fatiga después de un ejercicio exhaustivo, lo que puede haber contribuido al rendimiento general mejorado (Huang y cols., 2018). Los autores también investigan más para determinar los posibles mecanismos y marcadores adicionales que pueden indicar cómo la dieta cetogénica puede ayudar con el rendimiento y la recuperación. Anteriormente se informó que la interleucina (IL)-6 en plasma aumentaba más de 100 veces después de un ejercicio intenso (Suzuki y cols., 1999, 2000, 2003), y esta secreción excesiva de IL-6 inducida por el ejercicio puede inducir daño muscular y ser perjudicial para la salud y el rendimiento del deportista (Suzuki y cols., 1999, 2003). También se demostró que la IL-6 inducida por el ejercicio estimula la lipólisis tanto en la reserva de triglicéridos intramusculares como en los adipocitos (Path y cols., 2001; Carey y cols., 2006; May cols., 2018a). Sin embargo, aún no se ha determinado el mecanismo de acción directo que conecta la cetona con estos cambios de biomarcadores. Dada la función general de la IL-6 sobre el metabolismo de los lípidos y el ejercicio extenuante, se ha convertido en un biomarcador relevante para ilustrar la relación entre la dieta cetogénica y el ejercicio. Los modelos animales mostraron que la dieta cetogénica puede prevenir el daño muscular en tipos específicos de fibras musculares al mitigar la síntesis y la secreción excesiva de la IL-6 durante el ejercicio (May cols., 2018a). Otro biomarcador que a menudo se asocia con el daño muscular y la interferencia con el desequilibrio energético muscular es la creatina quinasa (CK). La dieta cetogénica puede desempeñar un papel importante en la disminución de los marcadores de daño oxidativo como la CK y la lactato-deshidrogenasa (LDH) causados por el ejercicio exhaustivo (May cols., 2018b).
Tabla 1. Lista de estudios que investigaron los efectos de la dieta cetogénica y las cetonas en la recuperación posterior al ejercicio.
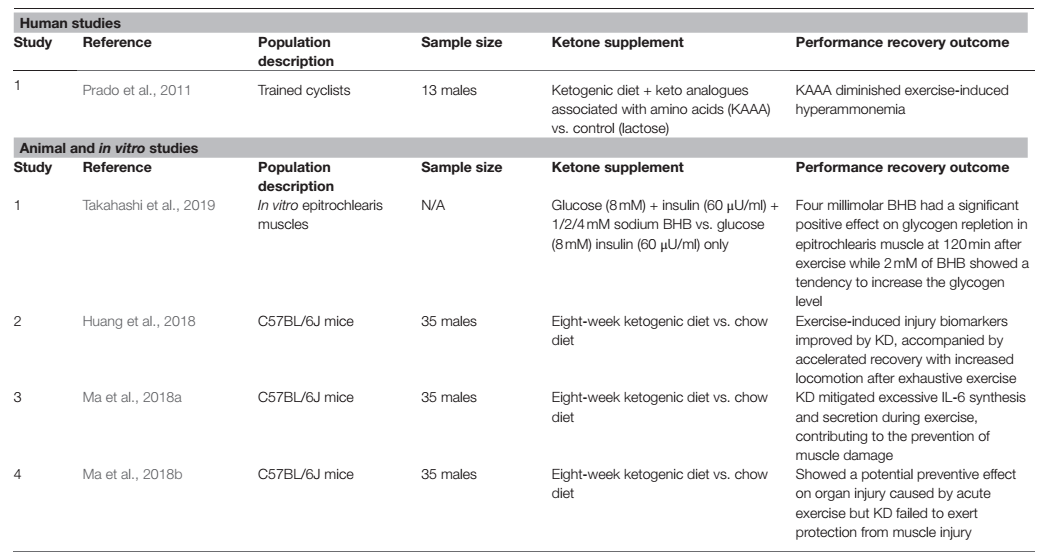
Varios estudios han demostrado que se produce un aumento de amonemia durante varios tipos de ejercicio (Wagenmakers y cols., 1990; Carvalho-Peixoto y cols., 2007; Bassini-Cameron y cols., 2008). De hecho, se confirmó que durante el ejercicio submáximo prolongado, se ha observado un aumento de la amonemia (0,160 mmol/L) en varios estudios (Graham y MacLean, 1992; Bassini-Cameron y cols., 2008). Se ha sugerido que el amoníaco promueve la fatiga tanto central como periférica y que un mejor control de la producción de amoníaco mejorará el rendimiento del ejercicio (Banister y Cameron, 1990). La producción de amoníaco aumenta a medida que se produce la desaminación del monofosfato de adenosina (AMP) y el catabolismo de los aminoácidos durante el ejercicio y estos procesos están impulsados por la intensidad y duración del ejercicio (Wilkinson y cols., 2010; Prado y cols., 2011). Mientras que los sustratos, como la glucosa y los ácidos grasos, se metabolizan durante el ejercicio para producir energía, los aminoácidos sufren procesos reversibles, como la desaminación o transaminación, produciendo cetoácidos a través de la liberación del grupo amino, que posteriormente contribuye a la formación de amoníaco y amonemia en la sangre. Dado que estas reacciones son reversibles, proporcionar análogos de ceto podría reducir potencialmente la concentración de amoníaco en sangre al formar aminoácidos con los grupos amino (Prado y cols., 2011). Prado y cols. mostraron que el aumento relacionado con el ejercicio en la concentración de amoníaco en sangre se atenuó en el grupo de participantes con un suplemento de cetoácido y aminoácidos en combinación con una dieta cetogénica, mientras se mantenía la concentración disminuida de amoníaco en sangre durante el período de recuperación. Aunque los autores no señalaron los mecanismos exactos que tuvieron lugar, se especuló que las cetonas y la suplementación de aminoácidos reponen los intermediarios del ciclo de Krebs a través de la anaplerosis, disminuyendo así la tasa de catabolismo de los aminoácidos, o podría ser la quelación del amoníaco por el análogo de ceto (Prado y cols., 2011). Además, el nivel de amoníaco durante el ejercicio se correlacionó con el nitrógeno ureico en sangre (BUN), el producto final del amoníaco en sangre. Huang y cols. utilizaron el BUN como marcador de daño renal, indicador de tolerancia al ejercicio y marcador de degradación de proteínas. En su estudio, el BUN fue significativamente más bajo en los grupos de dieta cetogénica después de 24 h después del ejercicio en comparación con el grupo de comida normal (Huang y cols., 2018). Esto muestra que la presencia de cetonas y la capacidad metabólica adaptada a las grasas pueden mejorar la fatiga central y periférica después del ejercicio, lo que sugiere que las cetonas pueden ser una estrategia potencial para una mejor recuperación y una mejora del rendimiento a largo plazo. Sin embargo, se necesitan más investigaciones para determinar el mecanismo de acción exacto que conecta el metabolismo de los lípidos y la fatiga impulsada por el sistema nervioso.
Brecha experimental con dieta cetogénica para la recuperación
El objetivo de una estrategia de recuperación post-ejercicio óptima es asegurar que el cuerpo se adapte a los estímulos externos en forma de mejorar la eficiencia metabólica y la adaptación fisiológica para la velocidad, fuerza y resistencia, sin incurrir en daño oxidativo excesivo y prevenir lesiones a partir de un entrenamiento con sobrecarga progresiva. Posteriormente, debido a estos procesos de adaptación que interactúan entre sí en el cuerpo, uno necesitará menos tiempo para recuperarse y volver a la condición física máxima, seguido de un mejor rendimiento con el tiempo. Los carbohidratos y las proteínas se han establecido desde hace mucho tiempo como sustratos importantes para ayudar a la recuperación del glucógeno y la reparación muscular después de ejercicios exhaustivos (Zawadzki y cols., 1992; Ivy y cols., 2008). Por lo tanto, restringir uno o ambos de estos grupos de alimentos en una intervención de recuperación puede ser contraproducente. Esta es la mayor desventaja de la dieta cetogénica o el uso de cetonas endógenas como estrategia de recuperación. La introducción de glucosa sustancial o exceso de proteínas en la dieta sacará a los participantes del estado de cetosis nutricional óptimo y reducirá los niveles de cetonas en sangre. Por lo tanto, esto disminuye los beneficios que las cetonas pueden proporcionar durante la recuperación. Este dilema ahora se puede resolver mediante el uso de cetonas exógenas, ya que el aumento agudo de las concentraciones de cetonas en sangre causado por las cetonas exógenas no se inhibe por la ingesta de glucosa ni por el pico menor de insulina que sigue, lo que permite que el efecto aditivo de acumular múltiples tipos de sustrato mejore los efectos ergogénicos sobre la recuperación. Ciertamente es vital que las concentraciones de BHB en sangre alcancen un cierto nivel antes de que se observen los beneficios y las cetonas exógenas puedan elevar las concentraciones de BHB en sangre de manera significativa en un entorno agudo. Por ejemplo, en múltiples estudios se ha demostrado que un monoéster de cetona, el monoéster de R-β-hidroxibutirato-R 1,3-butanodiol, aumenta las concentraciones de BHB en sangre hasta 3 mM y más dentro de los 60 minutos de la ingesta, independientemente del estado metabólico del individuo (Cox y cols., 2016; Myette-Cote y cols., 2019; Stubbs y cols., 2019; Poffe y cols., 2020a, b).
Cetonas exógenas en recuperación
La introducción de cetonas exógenas disponibles comercialmente permitió una herramienta de investigación para probar un estado fisiológico de cetosis en presencia de consumo de carbohidratos y proteínas. Este paradigma de investigación permite una comprensión más profunda del impacto de las cetonas en el metabolismo y su interacción con otros sustratos metabólicos. Hasta la fecha, tres estudios se han centrado en la recuperación posterior al ejercicio tras la ingesta de monoéster de cetonas como criterio de valoración principal (Holdsworth y cols., 2017; Vandoorne y cols., 2017; Poffe y cols., 2019). Aunque existen discrepancias entre estos estudios, los tres estudios han encontrado algún tipo de beneficio del monoéster de cetona, cuando se toma con los macronutrientes recomendados, como carbohidratos y proteínas, después del entrenamiento, y una mejor recuperación (Tabla 2). Holdsworth y cols. (2017) mostraron que en sujetos con un 'clamp' hiperglucémico (fijación), que mantiene la glucosa a 10 mM, que se encuentra en una concentración suprafisiológica, el monoéster de cetona aumentó la captación de glucosa en un 32% en el brazo de intervención en comparación con el control. Esto se asoció con un aumento de 2 veces en la concentración de insulina en el grupo de monoéster de cetonas en comparación con el grupo de control, lo que indica que cuando la glucosa y las cetonas están presentes juntas después del ejercicio, las cetonas pueden desempeñar un papel en el aumento de la secreción de insulina (Beylot y cols., 1986). y aumentar directamente la actividad del transportador de glucosa tipo 4 (GLUT4; Yu y cols., 2016) para ayudar a las células a absorber más glucosa para su recuperación y reparación. Esto fue evidente ya que el glucógeno muscular fue un 50% más alto en el grupo de cetonas en comparación con el grupo de control, explicando los controladores ascendentes que son el aumento de la secreción de insulina y la absorción de glucosa. Esto es consistente con el trabajo in vitro de Takahashi y cols. (2019) que mostraron una mejor repleción de glucógeno después del ejercicio mediante la incubación de los músculos epitroclearis de ratones con concentraciones fisiológicas de glucosa, insulina y BHB 4 mM. La pregunta sigue siendo, ¿la cetona aumenta la sensibilidad y la capacidad de respuesta a la insulina per se o simplemente magnifica los efectos del ejercicio en ambos parámetros como lo explica Zorzano y cols. (1986)? Si bien la insulina se ha asociado convencionalmente con la regulación de la glucosa, es un poderoso regulador del metabolismo que va más allá de regular un sólo sustrato. De hecho, la insulina juega un papel vital en la síntesis de proteínas y el anabolismo, que es extremadamente importante en la recuperación de los músculos esqueléticos después del ejercicio para reparar y adaptarse para mejorar el rendimiento con el tiempo (Fryburg y cols., 1995; Timmerman y cols., 2010).
Tabla 2. Lista de estudios que utilizan monoéster de cetonas (en combinación con otros sustratos) como estrategia de recuperación después del ejercicio.
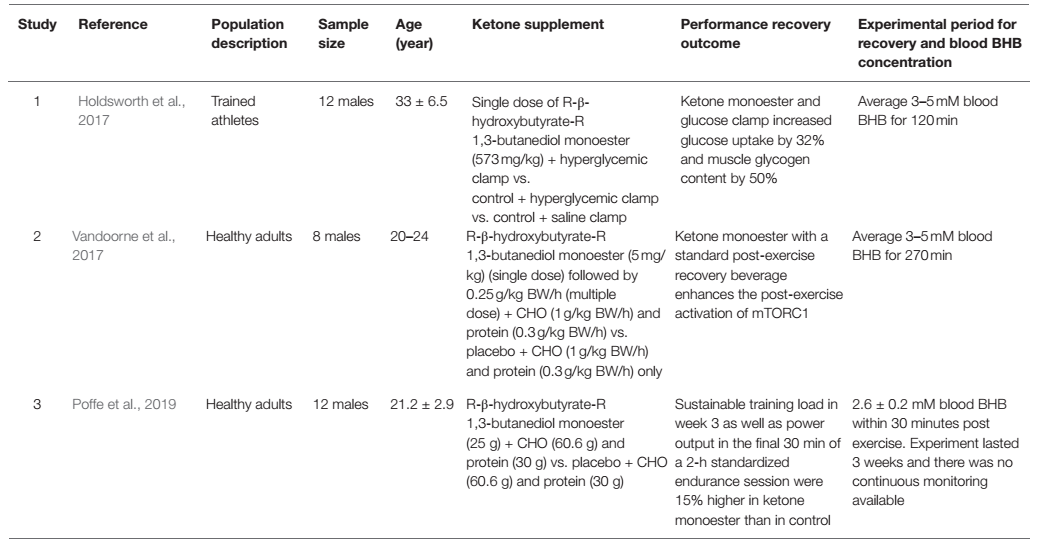
En términos de resíntesis de proteínas como parte de la recuperación después del ejercicio, Vandoorne y cols. no mostraron ningún aumento de glucógeno en su estudio, quizás debido a una ingesta fisiológica de carbohidratos por vía oral en comparación con los estudios de Holdsworth y cols. Sin embargo, Vandoorne y cols. indicaron que el monoéster de cetona promueve la señalización del complejo de rapamicina 1 en mamíferos (mTORC1) en la recuperación después del ejercicio. Se midieron dos objetivos descendentes de la mTOR involucrados en la síntesis de proteínas, que son el estado de fosforilación de P70S6k1 en Thr389 (p-S6K1Thr389), y el porcentaje de 4E-BP1 en la forma γ fosforilada (4E-BP1% γ) y ambos fueron significativamente aumentados en el grupo de monoéster de cetonas (Vandoorne y cols., 2017). Un punto especialmente importante es destacar el protocolo de Vandoorne y cols., que es la inclusión de proteínas junto con carbohidratos y monoéster de cetonas. Como se demostró en su trabajo in vitro, la combinación de leucina y cuerpos cetónicos aumentó p-S6K1Thr389 ~6 veces y 4E-BP1% γ 2 veces vs línea de base, lo que indica los efectos sinérgicos de la leucina y los cuerpos cetónicos en la mejora de la síntesis de proteínas musculares mediada por la leucina y potencialmente a nivel sistémico, amplificando la estimulación del ejercicio y la suplementación en la recuperación. Además, previamente se demostró que los cuerpos cetónicos disminuyen la proteólisis en la inanición, ya que pueden suprimir las tasas de degradación de proteínas para atender la gluconeogénesis (Owen y cols., 1967; Cahill, 2006). Se ha demostrado que después de un ejercicio intenso, es necesario restaurar el equilibrio energético a través del mecanismo de detección de la proteína quinasa activada por la AMP (AMPK) en los músculos esqueléticos antes de que la activación de la mTOR pueda tener lugar para regular al alza la síntesis de proteínas (Dreyer y cols., 2006). Por lo tanto, la ingesta de monoéster de cetona para la recuperación puede proporcionar el sustrato adicional que ayuda a la generación oxidativa de ATP y posteriormente disminuye la activación de la AMPK para permitir la síntesis de proteínas. Esto está de acuerdo con Thomsen y cols. (2018) quienes sugirieron que BHB juega un papel vital como potente agente anticatabólico en niveles específicos del músculo esquelético y sistémico, donde la reducción de la degradación de proteínas catalizada por BHB anula la inhibición de la síntesis. Hay algunos estudios que mostraron evidencia de que es probable que la mTORC1 también sea activada por un movimiento de proteínas independiente del factor de crecimiento hacia y desde el lisosoma, a través de la fosforilación inducida por ejercicios de fuerza del gen supresor de tumores, el Complejo de Esclerosis Tuberosa 2 (TSC2) (Watson y Baar, 2014). Otros estudios con otras formas de ésteres de cetonas han mostrado resultados similares, donde la atrofia del músculo esquelético y el catabolismo inducido por inflamación se previnieron mediante la administración de diéster de acetoacetato en ratones (Koutnik y cols., 2019, 2020).
Queda mucho por estudiar sobre la relación entre mTOR y diferentes sustratos tanto en entornos sistémicos como locales. La ausencia de mTOR en modelos de ratones knockout (modificado genéticamente) mostró intolerancia a la glucosa y resistencia a la insulina caracterizada por una captación reducida de glucosa en el músculo y una deposición reducida de glucógeno y lípidos en el hígado en condiciones de dieta alta en grasas (Guridi y cols., 2016) mientras que la hiperactivación o activación sostenida de mTOR puede contribuir a la hiperglucemia y la resistencia a la insulina a través de la inhibición de la fosforilación de la proteína quinasa B (AKT) inducida por insulina, bloqueando la captación de glucosa en los músculos esqueléticos (Williamson y cols., 2015). Esto indica que el delicado control de la mTOR, tanto en la precisión en la activación de la mTOR como en la sensibilidad de sus objetivos, es necesario para obtener beneficios óptimos en situaciones específicas.
Más recientemente, Poffe y cols. (2019) publicaron datos que indican que el monoéster de cetonas puede desempeñar un papel en la prevención de síntomas excesivos e incluso ayudar a los atletas a mejorar el rendimiento en el transcurso de 3 semanas después de incorporar el monoéster de cetonas como parte de su intervención nutricional para la recuperación. En comparación con las publicaciones anteriores sobre el monoéster de cetona en recuperación, este estudio extendió el período del experimento para investigar el impacto del monoéster de cetona, lo que nos dio una mejor comprensión de cómo el monoéster de cetona puede ayudar con la recuperación a mediano plazo y también los efectos compuestos en este período sobre el rendimiento. Después de todo, el objetivo de una recuperación óptima es desarrollar una adaptación positiva para mejorar la velocidad, la fuerza y la resistencia. A pesar de los síntomas de extralimitación, que es la disminución del rendimiento en las pruebas de velocidad, el grupo de monoéster de cetonas logró mejorar su rendimiento de trabajo general y la prueba de rendimiento de resistencia en un 15% en comparación con el grupo de control, lo que se refleja en el aumento gradual de la ingesta de energía y gasto en el primer grupo (Poffe y cols., 2019). Sin embargo, al igual que Vandoorne y cols., Poffe y cols. tampoco vieron ninguna diferencia en las tasas de resíntesis de glucógeno en la recuperación después de la ingesta de monoéster de cetonas en comparación con los hallazgos de Holdsworth y cols., lo que sugiere que la resíntesis de glucógeno puede no ser obligatoria para aumentar la recuperación del ejercicio inducida por cetonas. Una razón es que la glucosa se infundió por vía intravenosa en Holdsworth y cols. estudio, que conduce a un mayor nivel de glucosa en sangre y la correspondiente secreción de insulina. Sin embargo, la adición de proteínas como parte de la intervención posterior al ejercicio en Vandoorne y cols. y Poffe y cols. puede jugar un rol también. La activación de los objetivos descendentes de mTOR es significativamente más pronunciada cuando están presentes la leucina y los cuerpos cetónicos (Vandoorne y cols., 2017), lo que indica que la adición de proteínas a la suplementación de carbohidratos y monoéster de cetonas para la recuperación activará la mTOR y aumentará la síntesis de proteínas. Además, cuando se activa la mTORC1, la S6K1 podría fosforilar directamente el sustrato 1 del receptor de insulina (IRS1; S307 y S636/S639) y promover su degradación, lo que posteriormente mitiga la activación de la fosfoinositido 3-quinasa (PI3K)-AKT y sus efectos posteriores, como la captación de glucosa y acumulación de glucógeno (Laplante y Sabatini, 2012; Mao y Zhang, 2018). Esto sugiere que la activación de la mTORC1 a través de la ingesta conjunta de proteína y de monoéster de cetona puede inhibir la síntesis mejorada de glucógeno observada en estudios anteriores, pero no hasta el punto de ser perjudicial para la recuperación. Después de un ejercicio exhaustivo, las necesidades de resíntesis de glucógeno muscular de ~100 mmol·kg-1 ocurren a una tasa promedio de ~5 mmol·kg-1·h-1, en el transcurso de ~20 h para la recuperación completa de las reservas de glucógeno y si se le administra una gran cantidad de carbohidratos al comienzo del período de recuperación, la tasa de resíntesis de glucógeno puede aumentar de 2 a 3 mmol·kg-1·h-1 (Coyle, 1991; Burke y cols., 2004). De hecho, la co-ingesto de carbohidratos con proteínas, cuando se administra al comienzo del período de recuperación, es eficaz para aumentar la reposición del almacenamiento de glucógeno (Ivy y cols., 2002). Dado que Poffe y cols. no vieron ninguna diferencia significativa en la tasa de resíntesis de glucógeno entre el grupo de control y el grupo de monoéster de cetona, puede implicar que el monoéster de cetona no impacta negativamente la resíntesis de glucógeno y aumenta los procesos de síntesis y reparación de proteínas.
Otro de los posibles beneficios de las cetonas exógenas en la recuperación es aliviar la sensación de fatiga. Durante el ejercicio, los niveles de triptófano libre que ingresan al cerebro aumentan, lo que provoca un aumento de la 5-hidroxitriptamina (5-HT), que contribuye a la sensación de fatiga (Watson y cols., 2004; Hormoznejad y cols., 2019). Anteriormente se demostró que el monoéster de cetona reduce los AGL en sangre (Cox y cols., 2016). Los AGL compiten por los sitios de unión de la albúmina con el triptófano, y cuando los niveles de AGL en la sangre disminuyen, la concentración de triptófano libre también disminuye ya que más triptófano se unirá a la albúmina. Esto deja que ingrese menos triptófano al cerebro y aumenta la sensación de fatiga como resultado del esfuerzo. Por lo tanto, además de los beneficios fisiológicos para mejorar la recuperación, las cetonas exógenas también pueden proporcionar una vía para mejorar la fuerza mental y el bienestar, lo que en última instancia puede contribuir a mejorar la adaptación y el rendimiento a largo plazo.
En base a los datos hasta ahora, podemos concluir que el monoéster de cetona cuando se toma junto con glucosa solamente, puede aumentar la secreción de insulina, la absorción de glucosa y/o la síntesis de glucógeno, mientras que el monoéster de cetona tomado con proteína (especialmente que contenga leucina) y glucosa, no cambia la síntesis de glucógeno, pero en su lugar activan las dianas de la mTOR y regulan positivamente la síntesis de proteínas mediada por la leucina. En casos muy específicos, donde el período de recuperación es escaso (por ej., el ultramaratón con descansos mínimos entre segmentos o casos de uso militar, que necesitan resistencia y rendimiento óptimos con un descanso mínimo), la administración de glucosa y monoéster de cetonas puede proporcionar una opción para garantizar que el glucógeno se reponga en un período de tiempo más corto antes de que el individuo necesite gastar energía para el rendimiento físico nuevamente. De lo contrario, si se administra una cantidad suficiente de carbohidratos que supere el umbral de almacenamiento máximo de glucógeno durante 24 h, las reservas de glucógeno se repondrán a los niveles de referencia (Ivy y cols., 2002; Burke y cols., 2004). Por lo tanto, para una mejor estrategia nutricional para la recuperación, el monoéster de cetona con glucosa y proteína sería una mejor opción, ya que uno aún repondrá sus niveles de glucógeno como se ve en (Vandoorne et al., 2017), mientras se beneficia de la reparación y recuperación de proteínas, vía sobreregulación de la síntesis mediante la activación de la mTOR.
Conclusión: umbral de recuperación, aplicaciones potenciales y mecanismos
Los datos actuales sugieren que las cetonas exógenas tomadas después del ejercicio junto con carbohidratos y/o proteínas ejercen un efecto ergogénico en la recuperación posterior al ejercicio. Las cetonas exógenas también eliminan la desventaja de la dieta cetogénica al permitir la acumulación de múltiples sustratos y suplementos para mejorar la velocidad y la calidad del período de recuperación. En el futuro, además de las proteínas y los carbohidratos, se pueden agregar otros suplementos, como la carnitina, la creatina o incluso el bicarbonato de sodio, a una estrategia de recuperación para maximizar lo que el cuerpo necesita para adaptarse y crecer. Recientemente, un estudio mostró que el bicarbonato de sodio mitiga la acidosis leve causada por el monoéster de cetona en los atletas, desbloqueando así el potencial ergogénico del uso agudo del monoéster de cetona en la mejora del rendimiento (Poffe y cols., 2020a). Esto sugiere que el bicarbonato de sodio puede usarse para ayudar al cuerpo a lograr un pH óptimo más rápido durante la recuperación y proporcionar el entorno óptimo para que las enzimas y hormonas comiencen los procesos de recuperación y de reparación. Se deben realizar más estudios para observar el papel del pH en la recuperación, especialmente junto con la amonemia que acompaña al ejercicio y que genera fatiga.
Los tres estudios que utilizaron monoéster de cetona como parte de su estrategia de recuperación lograron entre 2.5 y 5 mM de BHB en sangre después de la ingesta de monoéster de cetona. Los datos sugieren además un beneficio de recuperación con una dieta cetogénica sola, que normalmente produce niveles de BHB en sangre de 1 a 2 mM. Por lo tanto, planteamos la hipótesis de la existencia de un umbral de recuperación de BHB, y postulamos que este umbral se encuentra entre 1-3 mM de BHB. Si bien la introducción de cetonas exógenas en el campo aumenta enormemente las opciones y combinaciones de composiciones nutricionales para mejorar la recuperación, todavía es demasiado pronto para sacar una conclusión definitiva, ya que los estudios relevantes aún son pocos y distantes entre sí. El resumen de los posibles roles y mecanismos de las cetonas en la recuperación después del ejercicio basado en los estudios hasta la fecha se puede ver en la Figura 2. La mayor limitación de este artículo de revisión es la falta de estudios que examinen el efecto de las cetonas en la recuperación después del ejercicio, ya que la mayoría de los estudios se han centrado en los efectos ergogénicos agudos de las cetonas sobre el rendimiento del ejercicio. También reconocemos que los estudios de recuperación después del ejercicio son más difíciles de realizar ya que la recuperación cubre aspectos multifacéticos de la fisiología y lleva más tiempo medir los efectos combinados de una mejor recuperación. Esperamos que este artículo de revisión pueda estimular a más grupos de investigación a darse cuenta del potencial de las cetonas en la recuperación y, por lo tanto, embarcarse en más estudios para iluminar a la comunidad científica y al público en general sobre los mecanismos involucrados. Se necesitan más estudios para determinar con mayor precisión el umbral de BHB en sangre necesario para un impacto de recuperación positivo. También se necesita más trabajo para determinar si otras formas de cetonas exógenas, como (R,S)-1,3-butanodiol acetoacetato diéster, 1,3-butanodiol o sales de BHB o precursores de cetonas como el ácido caprílico y otros de cadena media. Las composiciones de los triglicéridos son capaces de inducir un beneficio de recuperación similar al elevar los niveles de BHB a través del umbral hipotético. La determinación de la existencia y el valor de este hipotético "umbral de recuperación de cetonas" permitirá a los médicos administrar cetonas exógenas de manera más precisa junto con las proporciones óptimas de carbohidratos y proteínas y sus subtipos constituyentes.
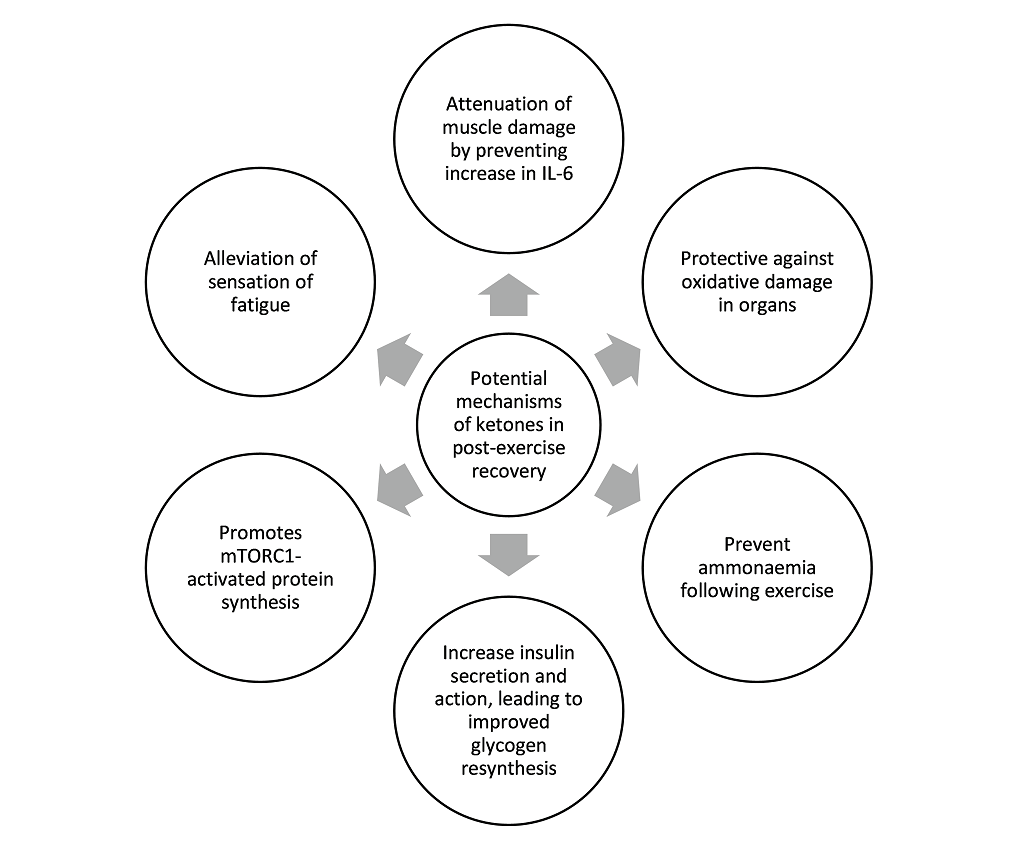
Figura 2. Resumen de los posibles mecanismos de las cetonas en la recuperación del ejercicio.
Financiamiento
La financiación para este trabajo fue proporcionada por Health Via Modern Nutrition Inc. (H.V.M.N.).
Conflicto de intereses
LM es el líder de investigación de Salud Via Modern Nutrition Inc. (H.V.M.N.), que desarrolla y comercializa productos basados en cetosis. GW es el fundador y presidente ejecutivo de Health Via Modern Nutrition Inc. (H.V.M.N.). Los autores declaran que los resultados del estudio se presentan de forma clara, honesta y sin elaboración, falsificación o manipulación inadecuada de los datos.
Agradecimientos
Nos gustaría agradecer a Andrew Koutnik y Brianna Stubbs por sus valiosas contribuciones a esta investigación.
Referencias
1. Banister, E. W., and Cameron, B. J. (1990). Exercise-induced hyperammonemia: peripheral and central effects. Int. J. Sports Med. 11(Suppl. 2), S129–S142.
2. Bassini-Cameron, A., Monteiro, A., Gomes, A., Werneck-de-Castro, J. P., and Cameron, L. (2008). Glutamine protects against increases in blood ammonia in football players in an exercise intensity-dependent way. Br. J. Sports Med. 42, 260–266.
3. Beylot, M., Khalfallah, Y., Riou, J. P., Cohen, R., Normand, S., and Mornex, R. (1986). Effects of ketone bodies on basal and insulin-stimulated glucose utilization in man. J. Clin. Endocrinol. Metab. 63, 9–15.
4. Burke, L. M., Kiens, B., and Ivy, J. L. (2004). Carbohydrates and fat for training and recovery. J. Sports Sci. 22, 15–30.
5. Cahill, G. F. Jr. (2006). Fuel metabolism in starvation. Annu. Rev. Nutr. 26, 1–22.
6. Carey, A. L., Steinberg, G. R., Macaulay, S. L., Thomas, W. G., Holmes, A. G., Ramm, G., et al. (2006). Interleukin-6 increases insulin-stimulated glucose disposal in humans and glucose uptake and fatty acid oxidation in vitro via AMP-activated protein kinase. Diabetes 55, 2688–2697.
7. Carvalho-Peixoto, J., Alves, R. C., and Cameron, L. C. (2007). Glutamine and carbohydrate supplements reduce ammonemia increase during endurance field exercise. Appl. Physiol. Nutr. Metab. 32, 1186–1190.
8. Cox, P. J., Kirk, T., Ashmore, T., Willerton, K., Evans, R., Smith, A., et al. (2016). Nutritional ketosis alters fuel preference and thereby endurance performance in athletes. Cell Metab. 24, 256–268.
9. Coyle, E. F. (1991). Timing and method of increased carbohydrate intake to cope with heavy training, competition and recovery. J. Sports Sci. 9, 29–51, discussion 51–52.
10. Dreyer, H. C., Fujita, S., Cadenas, J. G., Chinkes, D. L., Volpi, E., and Rasmussen, B. B. (2006). Resistance exercise increases AMPK activity and reduces 4E-BP1 phosphorylation and protein synthesis in human skeletal muscle. J. Physiol. 576, 613–624.
11. Evans, M., and Egan, B. (2018). Intermittent running and cognitive performance after ketone ester ingestion. Med. Sci. Sports Exerc. 50, 2330–2338.
12. Evans, M., McSwiney, F. T., Brady, A. J., and Egan, B. (2019). No benefit of ingestion of a ketone monoester supplement on 10-km running performance. Med. Sci. Sports Exerc. 51, 2506–2515.
13. Fryburg, D. A., Jahn, L. A., Hill, S. A., Oliveras, D. M., and Barrett, E. J. (1995). Insulin and insulin-like growth factor-I enhance human skeletal muscle protein anabolism during hyperaminoacidemia by different mechanisms. J. Clin. Invest. 96, 1722–1729.
14. Graham, T. E., and MacLean, D. A. (1992). Ammonia and amino acid metabolism in human skeletal muscle during exercise. Can. J. Physiol. Pharmacol. 70, 132–141.
15. Guridi, M., Kupr, B., Romanino, K., Lin, S., Falcetta, D., Tintignac, L., et al. (2016). Alterations to mTORC1 signaling in the skeletal muscle differentially affect whole-body metabolism. Skelet. Muscle 6:13
16. Holdsworth, D. A., Cox, P. J., Kirk, T., Stradling, H., Impey, S. G., and Clarke, K. (2017). A ketone ester drink increases postexercise muscle glycogen synthesis in humans. Med. Sci. Sports Exerc. 49, 1789–1795.
17. Hormoznejad, R., Zare Javid, A., and Mansoori, A. (2019). Effect of BCAA supplementation on central fatigue, energy metabolism substrate and muscle damage to the exercise: a systematic review with meta-analysis. Sport Sci. Health 15, 265–279.
18. Huang, Q., Ma, S., Tominaga, T., Suzuki, K., and Liu, C. (2018). An 8-week, low carbohydrate, high fat, ketogenic diet enhanced exhaustive exercise capacity in mice part 2: effect on fatigue recovery, post-exercise biomarkers and anti-oxidation capacity. Nutrients 10:1339.
19. Ivy, J. L., Ding, Z., Hwang, H., Cialdella-Kam, L. C., and Morrison, P. J. (2008). Post exercise carbohydrate-protein supplementation: phosphorylation of muscle proteins involved in glycogen synthesis and protein translation. Amino Acids 35, 89–97.
20. Ivy, J. L., Goforth, H. W. Jr., Damon, B. M., McCauley, T. R., Parsons, E. C., and Price, T. B. (2002). Early postexercise muscle glycogen recovery is enhanced with a carbohydrate-protein supplement. J. Appl. Physiol. 93, 1337–1344.
21. Koutnik, A. P., D’Agostino, D. P., and Egan, B. (2019). Anticatabolic effects of ketone bodies in skeletal muscle. Trends Endocrinol. Metab. 30, 227–229.
22. Koutnik, A. P., Poff, A. M., Ward, N. P., DeBlasi, J. M., Soliven, M. A., Romero, M. A., et al. (2020). Ketone bodies attenuate wasting in models of atrophy. J. Cachexia. Sarcopenia Muscle 11, 973–996.
23. Laplante, M., and Sabatini, D. M. (2012). mTOR signaling in growth control and disease. Cell 149, 274–293.
24. Ma, S., Huang, Q., Tominaga, T., Liu, C., and Suzuki, K. (2018a). An 8-week ketogenic diet alternated interleukin-6, ketolytic and lipolytic gene expression, and enhanced exercise capacity in mice. Nutrients 10:1696.
25. Ma, S., Huang, Q., Yada, K., Liu, C., and Suzuki, K. (2018b). An 8-week ketogenic low carbohydrate, high fat diet enhanced exhaustive exercise capacity in mice. Nutrients 10:673.
26. Mao, Z., and Zhang, W. (2018). Role of mTOR in glucose and lipid metabolism. Int. J. Mol. Sci. 19:2043.
27. Myette-Cote, E., Caldwell, H. G., Ainslie, P. N., Clarke, K., and Little, J. P. (2019). A ketone monoester drink reduces the glycemic response to an oral glucose challenge in individuals with obesity: a randomized trial. Am. J. Clin. Nutr. 110, 1491–1501.
28. Owen, O. E., Morgan, A. P., Kemp, H. G., Sullivan, J. M., Herrera, M. G., and Cahill, G. F. Jr. (1967). Brain metabolism during fasting. J. Clin. Invest. 46, 1589–1595.
29. Path, G., Bornstein, S. R., Gurniak, M., Chrousos, G. P., Scherbaum, W. A., and Hauner, H. (2001). Human breast adipocytes express interleukin-6 (IL-6) and its receptor system: increased IL-6 production by beta-adrenergic activation and effects of IL-6 on adipocyte function. J. Clin. Endocrinol. Metab. 86, 2281–2288.
30. Poff, A. M., Koutnik, A. P., and Egan, B. (2020). Nutritional ketosis with ketogenic diets or exogenous ketones: features, convergence, and divergence. Curr. Sports Med. Rep. 19, 251–259.
31. Poffe, C., Ramaekers, M., Bogaerts, S., and Hespel, P. (2020a). Bicarbonate unlocks the ergogenic action of ketone monoester intake in endurance exercise. Med. Sci. Sports Exerc. [Epub ahead of print]
32. Poffe, C., Ramaekers, M., Bogaerts, S., and Hespel, P. (2020b). Exogenous ketosis impacts neither performance nor muscle glycogen breakdown in prolonged endurance exercise. J. Appl. Physiol. 128, 1643–1653.
33. Poffe, C., and Ramaekers, M., Van Thienen, R., and Hespel, P. (2019). Ketone ester supplementation blunts overreaching symptoms during endurance training overload. J. Physiol. 597, 3009–3027.
34. Prado, E. S., de Rezende Neto, J. M., de Almeida, R. D., Doria de Melo, M. G., and Cameron, L. C. (2011). Keto analogue and amino acid supplementation affects the ammonaemia response during exercise under ketogenic conditions. Br. J. Nutr. 105, 1729–1733.
35. Randle, P. J., Garland, P. B., Newsholme, E. A., and Hales, C. N. (1965). The glucose fatty acid cycle in obesity and maturity onset diabetes mellitus. Ann. N. Y. Acad. Sci. 131, 324–333.
36. Stubbs, B. J., Cox, P. J., Kirk, T., Evans, R. D., and Clarke, K. (2019). Gastrointestinal effects of exogenous ketone drinks are infrequent, mild and vary according to ketone compound and dose. Int. J. Sport Nutr. Exerc. Metab. 1–23. [Epub ahead of print]
37. Suzuki, K., Nakaji, S., Yamada, M., Liu, Q., Kurakake, S., Okamura, N., et al. (2003). Impact of a competitive marathon race on systemic cytokine and neutrophil responses. Med. Sci. Sports Exerc. 35, 348–355.
38. Suzuki, K., Totsuka, M., Nakaji, S., Yamada, M., Kudoh, S., Liu, Q., et al. (1999). Endurance exercise causes interaction among stress hormones, cytokines, neutrophil dynamics, and muscle damage. J. Appl. Physiol. 87, 1360–1367.
39. Suzuki, K., Yamada, M., Kurakake, S., Okamura, N., Yamaya, K., Liu, Q., et al. (2000). Circulating cytokines and hormones with immunosuppressive but neutrophil-priming potentials rise after endurance exercise in humans. Eur. J. Appl. Physiol. 81, 281–287.
40. Takahashi, Y., Terada, S., Banjo, M., Seike, K., Nakano, S., and Hatta, H. (2019). Effects of beta-hydroxybutyrate treatment on glycogen repletion and its related signaling cascades in epitrochlearis muscle during 120 min of postexercise recovery. Appl. Physiol. Nutr. Metab. 44, 1311–1319
41. Thomsen, H. H., Rittig, N., Johannsen, M., Moller, A. B., Jorgensen, J. O., Jessen, N., et al. (2018). Effects of 3-hydroxybutyrate and free fatty acids on muscle protein kinetics and signaling during LPS-induced inflammation in humans: anticatabolic impact of ketone bodies. Am. J. Clin. Nutr. 108, 857–867.
42. Timmerman, K. L., Lee, J. L., Dreyer, H. C., Dhanani, S., Glynn, E. L., Fry, C. S., et al. (2010). Insulin stimulates human skeletal muscle protein synthesis via an indirect mechanism involving endothelial-dependent vasodilation and mammalian target of rapamycin complex 1 signaling. J. Clin. Endocrinol. Metab. 95, 3848–3857.
43. Vandoorne, T., De Smet, S., and Ramaekers, M., Van Thienen, R., De Bock, K., and Clarke, K., et al. (2017). Intake of a ketone ester drink during recovery from exercise promotes mTORC1 signaling but not glycogen resynthesis in human muscle. Front. Physiol. 8:310.
44. Volek, J. S., and Phinney, S. D. (2011). The art and science of low carbohydrate living. 1st Edn. Beyond obesity LLC (19 May 2011).
45. Wagenmakers, A. J., Coakley, J. H., and Edwards, R. H. (1990). Metabolism of branched-chain amino acids and ammonia during exercise: clues from McArdle’s disease. Int. J. Sports Med. 11(Suppl. 2), S101–S113.
46. Watson, K., and Baar, K. (2014). mTOR and the health benefits of exercise. Semin. Cell Dev. Biol. 36, 130–139.
47. Watson, P., Shirreffs, S. M., and Maughan, R. J. (2004). The effect of acute branched-chain amino acid supplementation on prolonged exercise capacity in a warm environment. Eur. J. Appl. Physiol. 93, 306–314.
48. Wilkinson, D. J., Smeeton, N. J., and Watt, P. W. (2010). Ammonia metabolism, the brain and fatigue; revisiting the link. Prog. Neurobiol. 91, 200–219.
49. Williamson, D. L., Dungan, C. M., Mahmoud, A. M., Mey, J. T., Blackburn, B. K., and Haus, J. M. (2015). Aberrant REDD1-mTORC1 responses to insulin in skeletal muscle from type 2 diabetics. Am. J. Physiol. Regul. Integr. Comp. Physiol. 309, R855–R863.
50. Yu, J., Zheng, J., Liu, X. F., Feng, Z. L., Zhang, X. P., Cao, L. L., et al. (2016). Exercise improved lipid metabolism and insulin sensitivity in rats fed a high-fat diet by regulating glucose transporter 4 (GLUT4) and musclin expression. Braz. J. Med. Biol. Res. 49:e5129.
51. Zawadzki, K. M., Yaspelkis, B. B. 3rd., and Ivy, J. L. (1992). Carbohydrate-protein complex increases the rate of muscle glycogen storage after exercise. J. Appl. Physiol. 72, 1854–1859.
52. Zorzano, A., Balon, T. W., Goodman, M. N., and Ruderman, N. B. (1986). Glycogen depletion and increased insulin sensitivity and responsiveness in muscle after exercise. Am. J. Phys. 251, E664–E669.
Cita en PubliCE
Latt Shahril Mansor Geoffrey Hubert Woo (2021). Cetonas Para la Recuperación Después del Ejercicio: Posibles Aplicaciones y Mecanismos. .https://g-se.com/cetonas-para-la-recuperacion-despues-del-ejercicio-posibles-aplicaciones-y-mecanismos-2844-sa-c6026db055634f
