Adaptaciones Músculo-Tendinosas Asociadas al Género para el Entrenamiento de la Fuerza
Gerard McMahon, Christopher I. Morse, Keith Winwood, Adrian Burden, Gladys L. OnambéléResumen
Objetivo
Comparar los cambios relativos en las propiedades del complejo músculo-tendón (MTC) después del entrenamiento de la fuerza de alta carga (RT) en hombres y mujeres jóvenes, y determinar cualquier relación con los niveles circulatorios de TGFβ-1 e IGF-I.
Métodos
Veintiocho participantes fueron asignados a un grupo de entrenamiento y subdivididos por sexo (T hombres [TM] de 20±1 años, n = 8, T mujeres [TF] de 19±3 años, n = 8), mientras que 6 hombres y 6 mujeres fueron asignados a grupos control (ConM/F). Los grupos de entrenamiento completaron 8 semanas de entrenamiento de fuerza (RT). Las propiedades del MTC (Vasto Lateral, VL), el área de sección transversal fisiológica (pCSA), el torque del cuádriceps, la rigidez (stiffness) del tendón rotuliano [K], el módulo de Young, el volumen, el área de la sección transversal y la longitud, los niveles circulatorios de TGFβ-1 y IGF-I fueron evaluados al inicio y después del RT.
Resultados
Después del RT, hubo un aumento significativo en las propiedades mecánicas y morfológicas del MTC en ambos grupos de entrenamiento, en comparación con el ConM/F (p<0,001). Sin embargo, no hubo cambios significativos específicos del sexo en la mayoría de las variables del MTC. Sin embargo, hubo diferencias significativas de sexo en los cambios en la K, con las mujeres exhibiendo mayores cambios que los hombres en los niveles de fuerza de la MVC (Contracción Voluntaria Máxima) más bajos (10% p = 0,030 y 20% MVC p = 0,032) y el efecto opuesto visto en niveles de fuerza más altos (90% p = 0,040 y 100% MVC p = 0,044). Hubo aumentos significativos (p<0,05) en el IGF-I tanto en el TF como en el TM después del entrenamiento, sin cambios en el TGFβ-1. No hubo diferencias de género (p>0,05) en el IGF-I o el TGFβ-1. De manera interesante, los datos poblacionales combinados mostraron que el TGFβ-1 se correlacionó con la K al inicio del estudio, sin que se identificaran correlaciones entre las propiedades del IGF-I y el MTC.
Conclusiones
Los niveles más altos de reposo del TGFβ-1 están asociados con propiedades mecánicas superiores de los tendones. El RT puede impactar en extremos opuestos de la relación fuerza-elongación del tendón rotuliano en cada sexo. Por lo tanto, pueden ser necesarios diferentes patrones de carga para maximizar las adaptaciones del entrenamiento de la fuerza en cada sexo.
Palabras Clave: Adaptaciones musculotendinosas, género, sexo, fuerza
Abstract
Purpose: To compare the relative changes in muscle-tendon complex (MTC) properties following high load resistance training (RT) in young males and females, and determine any link with circulating TGFβ-1 and IGF-I levels. Methods: Twenty-eight participants were assigned to a training group and subdivided by sex (T males [TM] aged 20±1 year, n = 8, T females [TF] aged 19±3 year, n = 8), whilst age-matched 6 males and 6 females were assigned to control groups (ConM/F). The training groups completed 8 weeks of resistance training (RT). MTC properties (Vastus Lateralis, VL) physiological cross-sectional area (pCSA), quadriceps torque, patella tendon stiffness [K], Young’s modulus, volume, cross-sectional area, and length, circulating levels of TGFβ-1 and IGF-I were assessed at baseline and post RT. Results: Post RT, there was a significant increase in the mechanical and morphological properties of the MTC in both training groups, compared to ConM/F (p0.05) in IGF-I or TGFβ-1. Interestingly, pooled population data showed that TGFβ-1 correlated with K at baseline, with no correlations identified between IGF-I and MTC properties. Conclusions: Greater resting TGFβ-1 levels are associated with superior tendon mechanical properties. RT can impact opposite ends of the patella tendon force-elongation relationship in each sex. Thus, different loading patterns may be needed to maximize resistance training adaptations in each sex.
Keywords: Musculotendinous adaptations, gender, sex, strength
INTRODUCCIÓN
El complejo músculo-tendón (MTC) presenta múltiples características fisiológicas que influyen diferencialmente en las capacidades físicas de hombres y mujeres a lo largo de la vida [1-3], siendo las mujeres jóvenes y entrenadas posiblemente más susceptibles a las lesiones por sobreuso (como las tendinopatías) que los hombres [4].
En particular, hay cada vez más pruebas de adaptaciones crónicas específicas del sexo del componente elástico en serie al entrenamiento de la fuerza (RT), más allá de las diferencias intrínsecas de género tanto en las propiedades absolutas del MTC en reposo como en su respuesta aguda al ejercicio. De hecho, se han demostrado diferencias en las propiedades viscoelásticas del tendón libre y de la aponeurosis del tendón entre hombres y mujeres jóvenes [5-7], donde las mujeres presentan menor rigidez, módulo, histéresis y mayor tensión. La combinación de datos de estudios anteriores [8,9] destaca la diferencia en la tasa de síntesis fraccional de colágeno del tendón (FSR) tanto en reposo como post-ejercicio entre hombres y mujeres, con la FSR permaneciendo significativamente elevada 72 horas después de 60 minutos de patadas de piernas, tipo de ejercicio de fuerza en los hombres. Investigaciones posteriores también han demostrado que el género influye adicionalmente en la expresión post-ejercicio de fuerza de los componentes reguladores de la matriz estructural y extracelular del tendón (ECM) [10].
La diferencia de sexo en la respuesta al entrenamiento en términos de respuesta crónica se destaca en Westh et al. [11], quienes demostraron que las jóvenes corredoras entrenadas habitualmente, a largo plazo mostraban una rigidez del tendón significativamente menor en comparación con los corredores hombres entrenados de forma similar. Sin embargo, estas corredoras entrenadas crónicamente no difirieron significativamente en términos de morfología del tendón o propiedades mecánicas de las no corredoras, lo que plantea dudas con respecto a cualquier cambio en la calidad intrínseca del tendón con entrenamiento crónico en las mujeres. También es notable que las diferencias de sexo se han demostrado en la adaptabilidad de las propiedades del MTC después de un largo período de entrenamiento físico en individuos mayores [12,13], enfatizando así la naturaleza persistente de la capacidad de respuesta superior y la adaptabilidad en los hombres. Aunque las investigaciones sugieren firmemente que las mujeres presentan perfiles de adaptación relativos diferentes a los estímulos mecánicos de los tendones en comparación con sus homólogos masculinos de igual edad, la adaptabilidad y los vínculos endocrinos asociados con esta observación después del entrenamiento de fuerza dinámica de carga pesada de los tendones, por ejemplo, aún no se han aclarado.
El trabajo in vitro sugiere que los factores de crecimiento: Factor de Crecimiento Transformante Beta 1 (TGFβ-1) y Factor de Crecimiento Tipo Insulina Uno (IGF-I) son de particular importancia para la adaptación endocrina del tendón. Sus funciones principales en el tendón incluyen la proliferación y migración de fibroblastos, aumentando posteriormente la producción de colágenos y otras estructuras de matriz extracelular en estas células durante las etapas de remodelación [14,15]. En humanos [16] la administración directa de IGF-I aumentó la tasa de síntesis fraccional de colágeno en hombres jóvenes y mayores. Paralelamente, la administración conjunta de IGF-I y TGFβ-1 mejoró significativamente las propiedades mecánicas del tendón de conejo [17]. Trabajos recientes de Astill et al. [18] demuestran que después de un período agudo de RT, tanto hombres como mujeres muestran niveles de IGF-I significativamente elevados 3 horas post-RT. Sin embargo, sólo las mujeres tuvieron niveles peritendinosos significativamente elevados de IGF-I a las 4 horas después, mientras que los hombres no. Además, los hombres mostraron mayores cambios post-RT en los niveles de la Metaloproteinasa de la Matriz 9 (MMP-9) que las mujeres, y las mujeres tuvieron elevaciones más prolongadas inducidas por el ejercicio en el inhibidor tisular de metaloproteinasas-I (TIMP-I) que los hombres.
Los datos no muestran diferencias normativas cuando se comparan los niveles circulatorios de TGFβ-1 en hombres, mujeres pre- y post-menopáusicas y mujeres embarazadas [19,20]. Además, que los autores sepan, no hay evidencia que demuestre que en una población joven y sana, hay marcadas fluctuaciones en los niveles sistémicos de TGFβ-1 [21]. En la actualidad, la bibliografía sobre cualquier relación entre la respuesta aguda in vivo de la TGFβ-1 previamente informada [22] a la carga mecánica, y la magnitud o naturaleza de las adaptaciones del MTC al entrenamiento humano es limitada. Un estudio actual es el de Heinemeier et al. [22] quienes encontraron elevación en los niveles sistémicos de TGFβ-1 (30%) después de 1 hora de carrera en subida (3%) a 12 km/h en personas jóvenes, lo que los autores propusieron que podría estar relacionado con el cambio observado en los niveles de peritendinosos de TGFβ-1 y por lo tanto con la regulación de la síntesis de colágeno tipo I. Sin embargo, en este estudio de Heinemeier et al., el protocolo de ejercicio implicaba una carrera de resistencia y, por lo tanto, una modalidad de entrenamiento menos que óptima (en comparación con el ejercicio de fuerza intenso) en el que el resultado buscado es inducir adaptaciones del MTC [23].
Teniendo en cuenta las diferencias observadas entre los sexos en la respuesta/adaptabilidad del MTC a los estímulos físicos, ningún estudio hasta la fecha ha caracterizado las adaptaciones del MTC específicas para cada sexo, después de un período de entrenamiento de fuerza dinámica intenso. Además, sigue sin estar claro si alguna diferencia se asociaría con los principales candidatos a factores de crecimiento que supuestamente influyen en las propiedades del MTC y en las adaptaciones al entrenamiento. Por lo tanto, los objetivos de este estudio fueron 1) caracterizar la adaptación del MTC a un período de entrenamiento de fuerza dinámica a cargas pesadas en hombres y mujeres, 2) identificar cualquier diferencia relacionada con el sexo en las propiedades del MTC y 3) investigar si alguna de las respuestas adaptativas podría reflejarse en cambios en dos factores clave de crecimiento circulatorios relacionados con el MTC.
MÉTODOS
Participantes
Veintiocho jóvenes participantes reclutados en el campus universitario local dieron su consentimiento informado por escrito para participar en el estudio. Todos los procedimientos y protocolos experimentales fueron aprobados por el comité de ética del Campus de Cheshire de la Universidad Metropolitana de Manchester. Los criterios de exclusión incluyeron la presencia de cualquier trastorno o lesión conocida de tipo musculoesquelético, neurológico, inflamatorio o metabólico. Los sujetos participaban en actividades recreativas como deportes de equipo y nunca habían participado en el entrenamiento de la fuerza de los miembros inferiores o no lo habían hecho en los últimos 12 meses. Cada participante completó un diario de actividad física, indicando que cada uno de ellos realizaba habitualmente de 3 a 5 horas a la semana de actividad física moderada no basada en la fuerza. Dieciséis participantes fueron subdivididos equitativamente por sexo y asignados aleatoriamente a un grupo de entrenamiento (T hombres [TM] de 20±1 años de edad, masa 81±4Kg, T mujeres [TF] de 19±3 años de edad, masa 69±3Kg), mientras que 6 hombres ([ConM] de 22±2 años de edad, masa 82±2Kg) y 6 mujeres ([ConF] de 23±4 años de edad, masa 63±4Kg) fueron asignados a un grupo de control (CON). Todas las mujeres eran eumenorreicas (duración del ciclo menstrual de 26 a 30 días) y ninguna usó ninguna forma de píldora anticonceptiva oral, ya que se ha demostrado que esta última tiene un impacto sobre las propiedades del MTC en las mujeres [24].
Diseño del estudio
El diseño del estudio fue un muestreo de conveniencia, con los participantes separados en grupos según el sexo seguido de una asignación aleatoria a uno de dos grupos (es decir, entrenamiento o control). Después de familiarizarse con los procedimientos de laboratorio al menos una semana antes de la prueba propiamente dicha, se evaluaron las propiedades morfológicas/funcionales del MTC y los factores de crecimiento de los participantes al inicio (semana 0). Las mediciones se repitieron después de 8 semanas de entrenamiento de fuerza (post-entrenamiento).
Área de sección transversal fisiológica del músculo (pCSA)
Las técnicas de medición utilizadas para el cálculo del área de sección transversal fisiológica del músculo Vasto Lateral (VL) en el presente estudio han sido documentadas en otra parte [25,26]. Brevemente, se realizaron múltiples mediciones anatómicas de área de sección transversal (aCSA) mediante ecografía en modo brillo (7,5-MHz, sonda de matriz de 40mm, AU5, Esoate Biomedica, Génova, Italia) al 25%, 50% y 75% a lo largo de la longitud del músculo VL (desde inserción a origen), junto con ángulos de penación y longitudes del fascículo. El volumen muscular se calculó entonces utilizando el método del cono truncado, que ha sido validado en varios estudios previos [27,28]. El pCSA del VL se calculó dividiendo el volumen muscular por la longitud del fascículo [28].
Torque del cuádriceps
Se midió el torque máximo de extensión isométrica de la rodilla con la rodilla a una flexión de 50° (extensión total de rodilla = 0°) en la pierna derecha de todos los participantes. Este ángulo se eligió para que cayera al 50% del rango de movimiento cubierto durante las rutinas de ejercicio, minimizando así el efecto de la especificidad de la longitud del músculo sobre los incrementos de torque muscular informados. Después de una serie de pruebas de calentamiento que consistieron en diez contracciones isocinéticas a 60°·s−1 con un esfuerzo máximo autopercibido del 50-85%, se instruyó a los participantes para que ejercieran rápidamente fuerza isométrica máxima (contracción voluntaria máxima, MVC) contra el brazo de palanca del dinamómetro (Cybex, Phoenix Healthcare, Reino Unido). En la pantalla de un ordenador MacBook Air (Apple Computer, Cupertino, CA, EEUU), que estaba conectado a un sistema A/D (Acknowledge, Biopac Systems, Santa Barbara, CA, EEUU) con una frecuencia de muestreo de 2000 Hz, se mostraban rastros de los datos del torque articular. Se realizaron contracciones isométricas para ∼2 s en la plateau con un período de descanso de 60 s entre contracciones. El torque máximo se expresó como el promedio de los puntos de datos durante un período de 500 ms en la fase plateau (es decir, 250 ms a cada lado del torque máximo instantáneo). Se utilizó el torque máximo de tres extensiones como medida de torque en cada participante.
Estimación de la co-contracción de la actividad electromiográfica
Se colocó un par de electrodos de Ag-AgCl (Neuroline 720, Ambu, Dinamarca) sobre la piel limpia y rasurada, al 50% de la longitud del fémur, en el plano sagital medio del bíceps femoral. El electrodo de referencia (Blue sensor L, Ambu, Dinamarca) se colocó en el cóndilo tibial lateral. La señal EMG en bruto fue preamplificada (MP100, Biopac Systems Inc., EEUU), amplificada ×1000 (MP100, Biopac Systems Inc., EEUU), filtrada por paso banda entre 10-500 Hz (Biopac Systems, EEUU) con una marca a 50 Hz, y muestreada a 2000 Hz. Todas las señales EMG y de torque se visualizaron en tiempo real en el software AcqKnowledge (Biopac systems Inc., EEUU) a través de una PC. Se realizaron dos contracciones máximas de flexión de rodilla para obtener la EMG al torque máximo de flexión. La actividad EMG de la media cuadrática (RMS) se promedió durante un período de 500 ms (promedio de ventanas móviles de 1,5 ms) que coincidió con la plateau del torque máximo.
Para reiterar, se midió la EMG de la cabeza larga del músculo bíceps femoral para determinar el nivel de co-contracción muscular antagonista durante las contracciones isométricas requeridas de extensión de rodilla. El torque del bíceps femoral durante una contracción de flexión de rodilla se calculó según lo descrito por McMahon et al. [25], quienes suponen una relación lineal entre la EMG del BF y el torque, lo que permite cuantificar el "pull back torque" durante las extensiones de rodilla y, en última instancia, las fuerzas totales experimentadas por el tendón rotuliano [29,30].
Propiedades del tendón
Las mediciones de las propiedades tendinosas utilizadas en la presente investigación se han descrito en otra parte [31]. Brevemente, la elongación del tendón se determinó usando imágenes por ecografía en modo brillo sobre el vértice de la rótula en el plano sagital, con la rodilla fijada a 90° de flexión según la norma de evaluación de las propiedades de los tendones in vivo. Se realizaron cinco ensayos de pre-acondicionamiento para asegurar la reproducibilidad. Después de esto, se monitorearon tres contracciones isométricas de 6 segundos con rampa para determinar la distancia entre la posición original del tejido bajo la piel, en relación con la nueva posición del tejido, utilizando imágenes de ecografía captadas en una computadora personal a 25 Hz. La salida de la ecografía fue sincronizada usando un generador de señal de onda cuadrada para permitir la alineación temporal con los datos de torque y EMG. El desplazamiento del tendón se determinó a intervalos del 10% de la fuerza máxima (del 10% al 100%) utilizando la imagen J. Se analizaron tres esfuerzos y se informó el promedio como el perfil de la fuerza del tendón versus la elongación para el participante. La relación fuerza-elongación graficada se colocó con una función polinómica de segundo orden, forzada a través de cero. Los valores de rigidez instantánea del tendón (K) se calcularon a partir de la pendiente de las tangentes a intervalos de fuerza del 10% [30]. La rigidez media del tendón fue el valor promedio de rigidez de 10-100% de la MVC.
También se evaluó la longitud en reposo (TL) del tendón rotuliano (PT) y el área de sección transversal (Tcsa) con la articulación de la rodilla a 90° de flexión. La TL se midió desde el polo inferior de la rótula hasta el lado superior de la tuberosidad de la tibia determinado a partir de imágenes de ecografía en el plano sagital. La Tcsa se determinó a partir de la media de las imágenes de ecografía en el plano transversal tomadas a 25%, 50% y 75% de la TL. El módulo de Young (E) se calculó como rigidez instantánea multiplicada por la relación TL/Tcsa en reposo. La rigidez media del tendón fue el valor promedio de rigidez de 10-100% de la MVC.
El volumen del PT (TVol) se calculó utilizando los valores de la TL y la Tcsa a lo largo de la longitud del tendón utilizando el método del cono truncado, que utilizó los mismos principios que los demostrados en las evaluaciones del volumen muscular [27].
Niveles de factores de crecimiento circulatorios (IGF-I y TGFβ-1)
Pre- y post-entrenamiento, después de un ayuno nocturno (~10 horas), los participantes se presentaron en el laboratorio entre las 9 y las 11 de la mañana. Se tomaron muestras de sangre de 5 ml de la vena antecubital del antebrazo, se colocaron en un lecho de hielo triturado durante 1,5 a 2 horas, y luego se centrifugaron a 4°C durante 10 min a 4.800 rpm, retirándose el sobrenadante y almacenándose en al menos dos alícuotas a -20° Celsius para su posterior análisis. El IGF-I y el TGFβ-1 se analizaron utilizando el procedimiento estándar de ensayo por inmunoabsorción ligado a enzimas (ELISA), descrito por McMahon et al. [31], con la incubación nocturna para la primera opción de fase de unión de anticuerpos para el TGFβ-1 (aumentando así la sensibilidad de las lecturas). Las muestras post-entrenamiento se tomaron 3-4 días después de la última sesión de entrenamiento, a la misma hora que el muestreo pre-entrenamiento para cada participante.
Las pruebas de laboratorio se programaron para evitar la variabilidad diurna o las fluctuaciones agudas del factor de crecimiento inducidas por el ejercicio.
Entrenamiento de la fuerza
El entrenamiento de la fuerza (RT) se realizó tres veces por semana durante 8 semanas al 80% de 1 repetición máxima (1RM) en el complejo extensor de rodilla. Los ejercicios incluyeron sentadilla, prensa de piernas, extensión de piernas (Technogym, Berkshire, Reino Unido), estocada, sentadilla búlgara y silla Sampson. Todas las sesiones de ejercicios fueron supervisadas por un miembro del equipo de investigación. Los participantes completaron dos sesiones de familiarización al 70%1RM antes de comenzar el programa de entrenamiento de fuerza. Se midieron las 1RMs al inicio del estudio y cada 2 semanas, con el progreso del peso de la carga. El volumen (es decir, repeticiones y series) fue idéntico para cada grupo de entrenamiento, y cada sesión de entrenamiento consistió en cuatro ejercicios y tres series de 10 repeticiones por ejercicio durante las primeras cuatro semanas, y cuatro series de ocho repeticiones por ejercicio a partir de entonces. Las sesiones de entrenamiento suelen durar unos ~60 minutos, y los registros del entrenamiento se completan diligentemente durante las sesiones.
Estadísticas
El análisis estadístico se llevó a cabo utilizando el IBM SPSS v19 (IBM Inc, EEUU). Los datos se analizaron mediante un ANCOVA 4×2 con medidas iniciales utilizadas como covariables. El factor dentro del grupo fue la fase de entrenamiento (inicio, post-entrenamiento) y el factor entre grupos fue el grupo de entrenamiento (es decir, TM, TF, ConM, ConF). Las comparaciones post-hoc son corregidas por Bonferroni y los ajustes por comparaciones múltiples se aplican en las tablas de correlación. Todos los datos se presentan como media ± error estándar de la media (SEM). La significación estadística se estableció con alfa en ≤ 0,05. La potencia (β) y el tamaño del efecto (ES) se informan para aquellos cambios que mostraron diferencias significativas de sexo, donde la potencia se calculó post hoc usando los supuestos del t-test independiente. El tamaño de la muestra requerida para identificar las diferencias de sexo en las propiedades morfológicas y mecánicas del MTC se consideró adecuado dado que la potencia de estudio alcanzada fue ≥0,8.
Resultados
Diferencias de sexo al inicio
No hubo diferencias significativas de sexo (p>0,05) en pCSA, Tvol, Tcsa, TL, PT K, PT E, TGFβ-1 o IGF-I. Sin embargo, como era de esperar, el TM produjo un torque significativamente mayor (p<0,01) que el TF.
Cambios en las propiedades del MTC
Hubo aumentos significativos en pCSA, fuerza, PT Vol, PT K y E, e IGF-I (Tabla 1) en cada grupo de entrenamiento, sin diferencias de sexo. Sin embargo, cuando se analizó el PT K en regiones de fuerza discreta, se identificaron diferencias significativas específicas del sexo (Fig. 1). El TF tuvo incrementos significativamente mayores en la rigidez en comparación con el TM después del entrenamiento con fuerzas de MVC más bajas (10% (p = 0,030, β 0,94, ES 0,29) y 20%MVC (p = 0,032, β 0,93, ES 0,28)), mientras que el TM tuvo tendones significativamente más rígidos en comparación con el TF con fuerzas de MVC más altas (90% (p = 0,040, β 0,92, ES 0,24) y 100% (p = 0,044, β 0,79, ES 0,26)). No hubo cambios en el TGFβ-1 ni en los grupos de entrenamiento (Tabla 1), ni en ninguno de los grupos de control en la semana 8 (p>0,05). Hubo un aumento significativo en el IGF-I tanto en los grupos de entrenamiento masculino como femenino post-entrenamiento (p<0,05), sin embargo, no se detectaron diferencias entre los grupos (p>0,05, Tabla 1).
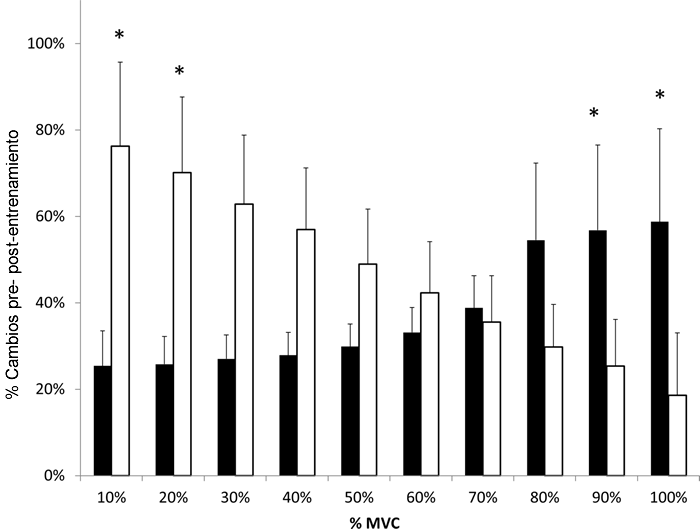
Figura 1. Cambios relativos en la rigidez del tendón rotuliano (K) en cada nivel de fuerza de la curva fuerza-elongación.
Hombres (barras negras) y mujeres (barras blancas) después del entrenamiento. *Diferencia significativa (P<0,05) entre los sexos. Los datos son media ± SEM.
Tabla 1. Valores iniciales y post-entrenamiento de las propiedades del complejo músculo-tendón y de los factores de crecimiento circulatorios en cada sexo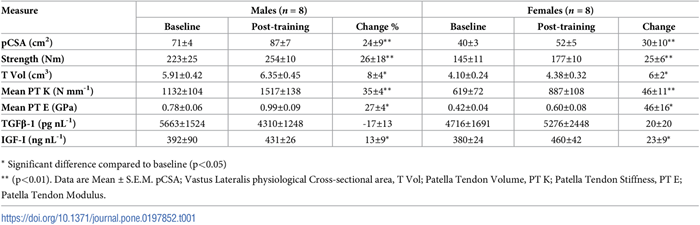
Asociaciones entre IGF-I y TGFβ-1 con las características del MTC
Hubo una correlación positiva significativa entre la rigidez media del tendón y los niveles de TGFβ-1 (r = 0,554; p = 0,026) en la población agrupada al inicio del estudio. Los niveles agrupados iniciales (no específicos del sexo) de TGFβ-1 también se correlacionan con la rigidez inicial en algunos (30, 50 y 60%MVC), pero no en todos los niveles de torque (Tabla 2). Los niveles de TGFβ-1 de población agrupada de la semana 8 se correlacionaron con la rigidez del tendón inicial de 10% a 80%MVC. Los valores iniciales del IGF-I de población agrupada se correlacionan con la rigidez inicial a altos niveles de fuerza (es decir, de 60-100%MVC), así como con la rigidez media. En la semana 8, sin embargo, las correlaciones de IGF-I eran de hecho con regiones de menor fuerza (es decir, 10-50%MVC).
Tabla 2. Asociaciones de género diferenciales entre el TBG-β y el IGF-I circulatorios y la K del tendón.
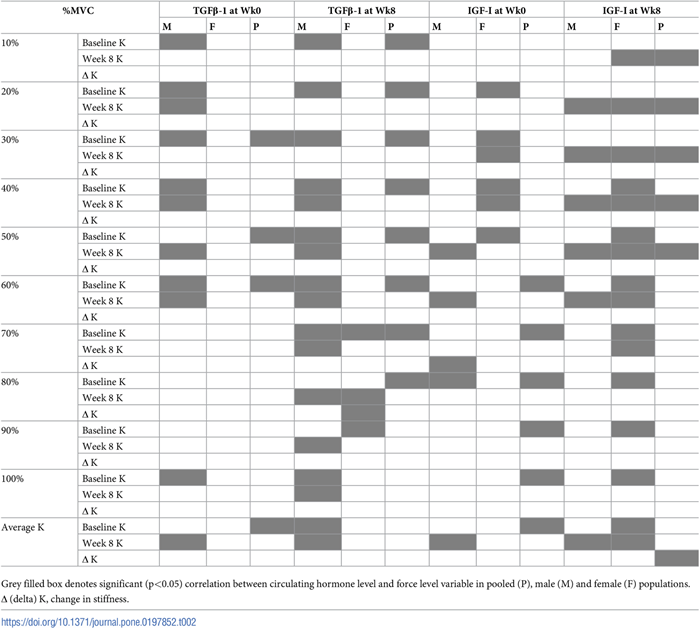
Nuestras observaciones específicas de sexo mostraron que en los hombres, el TGFβ-1 inicial se asoció con la rigidez del tendón a bajas fuerzas (10-60%MVC). Los niveles post-entrenamiento del TGFβ-1 se correlacionaron significativamente con la rigidez del tendón post-entrenamiento en todos los niveles de fuerza >30%MVC. Interesantemente, los niveles post-entrenamiento del TGFβ-1 también se correlacionaron con la rigidez inicial del tendón, aunque a niveles de fuerza más moderados (10-70%MVC). Mientras que el valor inicial del IGF-I no se asoció con la rigidez del tendón, en la semana 8, los niveles del IGF-I se correlacionaron con la rigidez de la semana 8 en los niveles de fuerza media (es decir, en los rangos de 20-60%MVC), así como con la rigidez media.
En contraste con los hallazgos en los hombres, el TGFβ-1 inicial de las mujeres no se correlacionó con la rigidez ni en el inicio ni en el post-entrenamiento. Los niveles post-entrenamiento del TGFβ-1 sólo se correlacionaron con la rigidez del tendón post-entrenamiento al 80-90%MVC. Las únicas relaciones aparentes/estadísticamente significativas observadas en las mujeres fueron con los niveles de IGF-I post-entrenamiento que se correlacionaron con la rigidez del tendón al 40-70%MVC y la rigidez del tendón en todos los niveles de fuerza (10-100%MVC) post-entrenamiento.
Discusión
Nuestros principales hallazgos actuales son: 1) somos los primeros en demostrar la especificidad del sexo en la naturaleza adaptativa inducida por la sobrecarga de las propiedades mecánicas del tendón en una población joven. 2) Aunque los niveles de TGFβ-1 y IGF-I pueden no reflejar la totalidad de la magnitud de la adaptación, todavía parecen jugar un papel importante en las características crónicas del MTC. 3) El entrenamiento de la fuerza dinámica de alta carga puede no ser óptimo para mejorar las características del MTC en las mujeres en las porciones más altas de la curva de fuerza-elongación del tendón.
Anteriormente se han identificado diferencias relacionadas con el sexo en los mecanismos mecánicos, estructurales y reguladores del tejido tendinoso humano [5,7]. Se ha demostrado que las diferencias en las tasas agudas de síntesis fraccional de colágeno del tendón [8,9], la cantidad de masa seca del tendón por peso de tendón húmedo [32] y los niveles de ARNm de colágeno tipo III [10] varían entre los sexos. Además, el trabajo proteómico de Little et al. [33] demostró que el alcohol deshidrogenasa 1B, la MMP-3 y la tromboesponsina-1 (TSP-1) se enriquecen en los tendones rotulianos de las mujeres en comparación con los tendones de los hombres, lo que sugiere tal vez una reducción de la función reguladora o de remodelación de la matriz extracelular, y la alteración de las propiedades mecánicas en las mujeres. Esto tendería a sugerir que, ya sea en reposo, o cuando se les proporciona un estímulo físico similar a los hombres, el tendón de la mujer no responde de manera similar. A medida que las sucesivas respuestas agudas a los estímulos físicos se combinan para producir la adaptación crónica, esto conduce al posible escenario de un tendón de la mujer mal adaptado (es decir, morfológica o mecánicamente) en relación con el tendón del hombre después de un período de entrenamiento.
Morfología y propiedades mecánicas
En el estudio actual, encontramos que el volumen del tendón rotuliano aumentó significativamente en ambos sexos en un 8±4% y un 6±2% en hombres y mujeres respectivamente, con una pequeña diferencia entre sexos que no es estadísticamente significativa. Tampoco hubo diferencias en el cambio de la rigidez media inducida por el entrenamiento del tendón rotuliano, entre hombres y mujeres. Esto contrasta con los hallazgos de Onambele-Pearson y Pearson [12] y Seynnes et al. [13] que encontraron en individuos mayores (>70 años), que los cambios en la rigidez del tendón rotuliano en hombres mayores fueron significativamente más grandes que los observados en mujeres mayores después de actividades de esquí alpino y de tipo-fuerza. Lo que es interesante, al comparar la investigación actual y el estudio de Onambele-Pearson y Pearson [12], es que ambos informan que la “naturaleza” o “carácter” de los cambios en la rigidez de los tendones son inherentemente diferentes entre hombres y mujeres después del entrenamiento de fuerza, independientemente de la edad. En su estudio, Onambele-Pearson y Pearson describen un "punto de corte" de ~40%MVC, donde por debajo de esta coyuntura, las mujeres mostraron sus mayores cambios de rigidez, y por encima de ella, los hombres mostraron sus mayores cambios de rigidez. De manera similar, describimos aquí por primera vez en una población joven, que a niveles de fuerza de 10-20%MVC, y a 90-100%MVC, las mujeres tienen un cambio de rigidez inducido por el RT significativamente mayor o menor, respectivamente, que los hombres, con un punto de corte de ~55%MVC (Figura 2). Aunque no se sabe inmediatamente por qué, una explicación plausible es que el tendón se adapta a las necesidades de carga a las que se enfrenta con más frecuencia, lo que, en relación con los tendones de los hombres, es una carga absoluta más baja en las mujeres. Evidente a partir de los datos de torque en el estudio actual, el torque medio asociado con el entrenamiento de la fuerza habría sido mucho mayor en los hombres (las MVCs post-entrenamiento fueron 254±10 Nm vs. 177±10 Nm en hombres y mujeres respectivamente y fueron significativamente diferentes al inicio), a pesar de que ambos grupos entrenaron con la misma carga relativa (pero con cargas absolutas distintas).
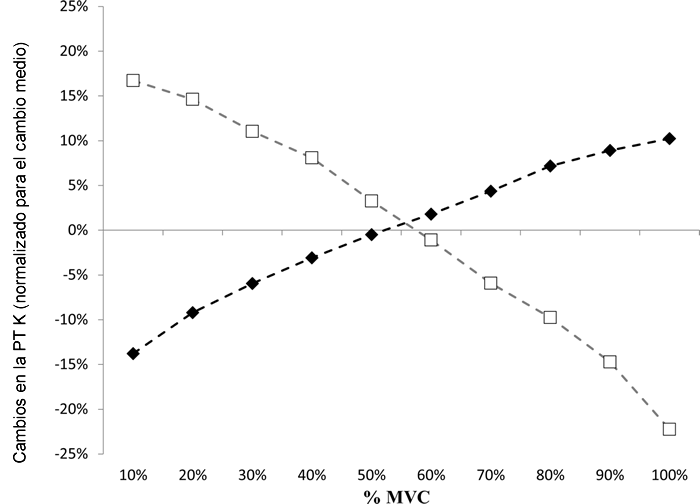
Figura 2. Cambio normalizado de la rigidez de los tendones a la rigidez media después del entrenamiento.
Hombres (diamantes rellenos negros) y mujeres (cuadrados rellenos blancos).
Programa de entrenamiento de la fuerza
Otro mecanismo fisiológico potencial para nuestras observaciones es la naturaleza del programa de entrenamiento de fuerza. Los ejercicios realizados fueron dinámicos (salvo uno isométrico), y de naturaleza isotónica. Las adaptaciones al entrenamiento excéntrico, como los factores microcirculatorios y la reducción del dolor, han demostrado ser específicas del sexo en una cohorte con tendinopatía de Aquiles, y los hombres han demostrado una vez más una mejor respuesta [34]. Además, durante el ejercicio excéntrico máximo entre 20°-90° de extensión de rodilla, previamente [7] mostramos que el tendón rotuliano de la mujer mostraba una rigidez reducida en comparación con los hombres, y atribuimos a esta observación una gran parte de la reducción del alargamiento fascicular observado en las mujeres en comparación con los hombres. Un estudio posterior de nuestro grupo [35] también mostró que siguiendo el mismo protocolo de ejercicio, los hombres mostraron una magnitud significativamente mayor de daño muscular. Esto demuestra que la respuesta específica de cada sexo y las adaptaciones a las variables asociadas con la manipulación de un programa de entrenamiento de fuerza aún no han sido dilucidadas, y esperan ser estudiadas más a fondo. Por lo tanto, los resultados del presente estudio plantean la siguiente pregunta: ¿Es el entrenamiento de fuerza dinámica a cargas pesadas (actualmente la forma más convencional y popular), el mejor método de entrenamiento para las mujeres que operan rutinariamente en los niveles de fuerza más altos de la curva de fuerza-elongación del tendón, donde las adaptaciones a este tipo de entrenamiento se minimizan en relación con las adaptaciones en las siguientes porciones inferiores de la curva de Fuerza-Elongación del tendón?
IGF-I/ TGFβ-1 circulatorios
Otro aspecto novedoso de la presente investigación fue determinar los cambios en los factores de crecimiento circulatorios relacionados con las respuestas/adaptaciones del tendón y de la ECM. Los estudios in vitro han demostrado la potencia de los efectos mediatos del TGFβ-1 sobre el colágeno, y su relación con la magnitud de la tensión mecánica [14,15]. A pesar de la amplia gama de datos de los estudios in vitro que describen las funciones del TGFβ-1 en el mantenimiento/reparación del tendón y la ECM, los datos de los estudios de ejercicio humano in vivo son escasos. Lo que también es sorprendente es que hasta la fecha, sólo un estudio había descrito previamente el efecto del entrenamiento de la fuerza en comparación con el ejercicio tipo patada de resistencia, en el TGFβ-1 y las propiedades mecánicas del tendón, a pesar de que el entrenamiento de la fuerza es un estímulo mecánico más potente para la adaptación de los tendones. También hemos demostrado anteriormente en una población joven [31], que el entrenamiento de la fuerza no resultó en niveles de TGFβ-1 crónicamente elevados después de 8 semanas de entrenamiento de fuerza intenso con diferentes niveles de tensión. Este también fue el caso en el estudio actual, en el que no hubo cambios significativos ni en hombres ni en mujeres después del entrenamiento de la fuerza, a pesar de las mejoras significativas en las propiedades mecánicas de los tendones. Aunque se ha documentado un aumento del ~30% post-ejercicio en los niveles circulatorios del TGFβ-1 asociado con una mayor síntesis local de colágeno tipo I y niveles peritendinosos de TGFβ-1 [22], puede ser que el TGFβ-1 no permanezca crónicamente elevado para mantener un perfil de tejido conectivo sano (no fibrótico). Por lo tanto, dentro de los límites del diseño experimental del estudio actual, la medición pre- y post- de las 8 semanas de entrenamiento de fuerza puede no haber facilitado el descubrimiento de la función mecanicista del TGFβ-1. A pesar de esto, hemos demostrado una fuerte y positiva correlación entre los niveles iniciales del TGFβ-1 y la rigidez de los tendones. Esto tendría sentido, desde el punto que un nivel fisiológico natural más alto de TGFβ-1 podría producir y preservar un MTC más rígido. Investigaciones anteriores han demostrado que los niveles más bajos de TGFβ-1 y la desregulación del eje TGF-β están presentes en los tendones enfermos en comparación con los tendones sanos [36]. No obstante, debe tenerse en cuenta que la medición del TGFβ-1 en sangre es un tema complejo, con muchas variaciones grandes medidas entre los estudios. Sin embargo, en una población joven y sana, como en el presente estudio, se ha demostrado que no hay diferencias entre hombres y mujeres en los niveles de TGFβ-1 circulatorio [19,20]. Además, nuestros niveles circulatorios de TGFβ-1 informados son consistentes con los datos previamente publicados en una revisión usando el mismo kit ELISA (sistemas R&D) y una metodología de muestreo robusta de TGFβ-1 [20].
Los niveles de IGF-I aumentaron significativamente como resultado del entrenamiento intenso de fuerza en ambos sexos. Se han hecho observaciones similares, con niveles peritendinosos de IGF-I significativamente elevados a las 3 horas después del RT tanto en hombres como en mujeres, pero sólo en mujeres, permaneciendo elevados a las 4 horas post-RT [18]. En un modelo de defecto del tendón rotuliano en conejos, la administración directa de IGF-I y TGFβ-1 juntos mejoraron significativamente las propiedades mecánicas del tendón, tales como la fuerza al fallo, la tensión final y la rigidez [17]. Los resultados de los estudios de Doessing y colaboradores [37] y Nielson et al. [16] demuestran que el IGF-I, y la función reguladora del eje de la hormona de crecimiento/IGF-I, son factores importantes para la tasa de síntesis fraccional de colágeno de la matriz, la expresión del colágeno tipo I y la función del tendón. Los niveles circulatorios de IGF-I no permiten distinguir entre los efectos sobre el músculo y/o el tendón. En el estudio actual, hombres y mujeres mostraron cambios relativos muy similares en IGF-I, tamaño muscular, torque, volumen del tendón y propiedades mecánicas del tendón. Por lo tanto, el IGF-I puede haber jugado un papel en el proceso de adaptación, con el trabajo de Doessing et al. [37] sugiriendo que el IGF-I puede jugar un rol más prominente en la adaptación tendinosa que en la adaptación muscular.
Aplicación práctica
Se ha sugerido que las mujeres jóvenes que hacen ejercicio están posiblemente en mayor riesgo de sufrir lesiones en los tendones que los hombres [4]. Las implicaciones prácticas del estudio actual son que las mujeres que operan hacia el extremo máximo del espectro de la MVC, pueden experimentar un aumento relativamente reducido de la rigidez de los tendones después del RT. Anteriormente se ha observado un retraso electromecánico específico del sexo [38], y las mujeres muestran un mayor retraso en comparación con los hombres. Paralelamente, también hemos demostrado previamente que durante las contracciones excéntricas máximas [7], existen diferencias de sexo en la rigidez absoluta del tendón rotuliano, que a su vez moduló el alargamiento del fascículo del Vasto Lateral, afectando la producción de fuerza. Estos hechos anteriores aumentan la evidencia y la necesidad de considerar la diferencia de sexo en las aplicaciones de entrenamiento de fuerza. Por lo tanto, las atletas femeninas involucradas en actividades de sprint/potencia pueden encontrar que la transferencia de fuerza contráctil a los huesos durante un esfuerzo intenso de fuerza puede estar comprometida en términos de cantidad de fuerza y/o tasa de desarrollo de fuerza debido a cambios subóptimos en la rigidez, o de hecho, un desarrollo de fuerza reducido debido a la modulación del acortamiento fascicular. Por lo tanto, es posible que los estudios futuros deseen centrarse en la elucidación de métodos para aumentar la rigidez a mayores fuerzas de la MVC en poblaciones femeninas jóvenes.
Conclusión
En conclusión, hemos demostrado que tanto hombres como mujeres muestran la misma adaptabilidad relativa en términos de mejorar la morfología músculo-tendón y la función después del entrenamiento de fuerza. Sin embargo, la naturaleza de estas adaptaciones tiene implicaciones para la función músculo-tendón durante diferentes tareas para cada sexo. Finalmente, para las mujeres, el entrenamiento de fuerza dinámica de alta carga puede no ser óptimo para mejorar la función del MTC en producciones de alta fuerza.
Agradecimientos
Los autores desean agradecer a los participantes del estudio por su compromiso con el programa de entrenamiento.
Referencias
1. Sipilä S, Narici M, Kjaer M, Pöllänen E, Atkinson RA, Hansen M, et al. (2013). Sex hormones and skeletal muscle weakness. Biogerontology. 2013;14(3):231–45. pmid:23636830
2. Hansen M, Kjaer M. (2014). Influence of sex and estrogen on musculotendinous protein turnover at rest and after exercise. Exerc Sport Sci Rev. 2014;42(4):183–92. pmid:25062001
3. Smith FW, Smith PA. (2002). Musculoskeletal differences between males and females. Sports Medicine and Arthroscopy Review. 2002;10(1):98–100.
4. Maffulli N, Wong J, Almekinders LC. (2003). Types and epidemiology of tendinopathy. Clin Sports Med. 2003;22(4):675–92. pmid:14560540
5. Kubo K, Kanehisa H, Fukunaga T. (2003). Gender differences in the viscoelastic properties of tendon structures. European Journal of Applied Physiology. 2003;88(6):520–6. pmid:12560950
6. Onambele GN, Burgess K, Pearson SJ. (2007). Gender-specific in vivo measurement of the structural and mechanical properties of the human patellar tendon. J Orthop Res. 2007;25(12):1635–42. Epub 2007/06/15. pmid:17568426.
7. Hicks K, Onambele‐Pearson G, Winwood K, Morse C. (2013). Gender differences in fascicular lengthening during eccentric contractions: the role of the patella tendon stiffness. Acta physiologica. 2013;209(3):235–44. pmid:23964725
8. Miller BF, Hansen M, Olesen JL, Schwarz P, Babraj JA, Smith K, et al. (2007). Tendon collagen synthesis at rest and after exercise in women. J Appl Physiol. 2007;102(2):541–6. pmid:16990502
9. Miller BF, Olesen JL, Hansen M, Døssing S, Crameri RM, Welling RJ, et al. (2005). Coordinated collagen and muscle protein synthesis in human patella tendon and quadriceps muscle after exercise. The Journal of physiology. 2005;567(3):1021–33.
10. Sullivan BE, Carroll CC, Jemiolo B, Trappe SW, Magnusson SP, Døssing S, et al. (2009). Effect of acute resistance exercise and sex on human patellar tendon structural and regulatory mRNA expression. J Appl Physiol. 2009;106(2):468–75. pmid:19023016
11. Westh E, Kongsgaard M, Bojsen‐Moller J, Aagaard P, Hansen M, Kjaer M, et al. (2008). Effect of habitual exercise on the structural and mechanical properties of human tendon, in vivo, in men and women. Scand J Med Sci Sports. 2008;18(1):23–30. pmid:17490462
12. Onambele-Pearson GL, Pearson SJ. (2012). The magnitude and character of resistance-training-induced increase in tendon stiffness at old age is gender specific. Age. 2012;34(2):427–38. pmid:21505764
13. Seynnes OR, Koesters A, Gimpl M, Reifberger A, Niederseer D, Niebauer J, et al. (2011). Effect of alpine skiing training on tendon mechanical properties in older men and women. Scand J Med Sci Sports. 2011;21:39–46. pmid:21679322
14. Molloy T, Wang Y, Murrell GAC. (2003). The roles of growth factors in tendon and ligament healing. Sports Med. 2003;33(5):381–94. pmid:12696985
15. Yang G, Crawford RC, Wang JHC. (2004). Proliferation and collagen production of human patellar tendon fibroblasts in response to cyclic uniaxial stretching in serum-free conditions. J Biomech. 2004;37(10):1543–50. pmid:15336929
16. Nielsen RH, Holm L, Malmgaard-Clausen NM, Reitelseder S, Heinemeier KM, Kjaer M. (2014). Increase in tendon protein synthesis in response to insulin-like growth factor-I is preserved in elderly men. J Appl Physiol. 2014;116(1):42–6. pmid:24265284
17. Lyras DN, Kazakos K, Verettas D, Chronopoulos E, Folaranmi S, Agrogiannis G. (2010). Effect of combined administration of transforming growth factor-b1 and insulin-like growth factor I on the mechanical properties of a patellar tendon defect model in rabbits. Acta Orthop Belg. 2010;76(3):380. pmid:20698461
18. Astill BD, Katsma MS, Cauthon DJ, Greenlee J, Murphy M, Curtis D, et al. (2017). Sex-based difference in Achilles peritendinous levels of matrix metalloproteinases and growth factors after acute resistance exercise. J Appl Physiol. 2017;122(2):361–7. pmid:27881671
19. Wakefield LM, Letterio JJ, Chen T, Danielpour D, Allison R, Pai LH, et al. (1995). Transforming growth factor-beta1 circulates in normal human plasma and is unchanged in advanced metastatic breast cancer. Clin Cancer Res. 1995;1(1):129–36. pmid:9815895
20. Grainger DJ, Mosedale DE, Metcalfe JC. (2000). TGF-β in blood: a complex problem. Cytokine Growth Factor Rev. 2000;11(1):133–45.
21. Heinemeier K, Langberg H, Kjaer M. (2003). Exercise-induced changes in circulating levels of transforming growth factor-β-1 in humans: methodological considerations. European Journal of Applied Physiology. 2003;90(1–2):171–7. pmid:14504950
22. Heinemeier K, Langberg H, Olesen JL, Kjaer M. (2003). Role of TGF-β1 in relation to exercise-induced type I collagen synthesis in human tendinous tissue. J Appl Physiol. 2003;95(6):2390–7. pmid:12923117
23. Albracht K, Arampatzis A. (2013). Exercise-induced changes in triceps surae tendon stiffness and muscle strength affect running economy in humans. European Journal of Applied Physiology. 2013;113(6):1605–15. pmid:23328797
24. Bryant AL, Clark RA, Bartold S, Murphy A, Bennell KL, Hohmann E, et al. (2008). Effects of estrogen on the mechanical behavior of the human Achilles tendon in vivo. J Appl Physiol. 2008;105(4):1035–43. pmid:18566188
25. McMahon G, Morse CI, Burden A, Winwood K, Onambélé GL. (2014). Muscular adaptations and insulin‐like growth factor‐1 responses to resistance training are stretch‐mediated. Muscle Nerve. 2014;49(1):108–19. pmid:23625461
26. Reeves N, Maganaris C, Narici M. (2004). Ultrasonographic assessment of human skeletal muscle size. European journal of applied physiology. 2004;91(1):116–8. pmid:14639480
27. Esformes JI, Narici MV, Maganaris CN. (2002). Measurement of human muscle volume using ultrasonography. European journal of applied physiology. 2002;87(1):90–2. pmid:12012082
28. Reeves ND, Narici MV, Maganaris CN. (2004). Effect of resistance training on skeletal muscle-specific force in elderly humans. J Appl Physiol. 2004;96(3):885–92. pmid:14578365
29. Pearson SJ, Onambele GNL. (2006). Influence of time of day on tendon compliance and estimations of voluntary activation levels. Muscle Nerve. 2006;33(6):792–800. pmid:16523507
30. Pearson SJ, Onambele GNL. (2005). Acute changes in knee-extensors torque, fiber pennation, and tendon characteristics. Chronobiol Int. 2005;22(6):1013–27. pmid:16393705
31. McMahon GE, Morse CI, Burden A, Winwood K, Onambélé‐Pearson GL. (2013). The manipulation of strain, when stress is controlled, modulates in vivo tendon mechanical properties but not systemic TGF‐β1 levels. Physiological reports. 2013;1(5):e00091. pmid:24303165
32. LeMoine JK, Lee JD, Trappe TA. (2009). Impact of sex and chronic resistance training on human patellar tendon dry mass, collagen content, and collagen cross-linking. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 2009;296(1):R119–R24. pmid:18945950
33. Little D, Thompson JW, Dubois LG, Ruch DS, Moseley MA, Guilak F. (2014). Proteomic differences between male and female anterior cruciate ligament and patellar tendon. PloS one. 2014;9(5):e96526. pmid:24818782
34. Knobloch K, Schreibmueller L, Kraemer R, Jagodzinski M, Vogt PM, Redeker J. (2010). Gender and eccentric training in Achilles mid-portion tendinopathy. Knee Surg Sports Traumatol Arthrosc. 2010;18(5):648–55. pmid:19997901
35. Hicks K, Onambélé G, Winwood K, Morse C. (2016). Muscle damage following maximal eccentric knee extensions in males and females. PloS one. 2016;11(3):e0150848. pmid:26986066
36. Goodier HC, Carr AJ, Snelling SJ, Roche L, Wheway K, Watkins B, et al. (2016). Comparison of transforming growth factor beta expression in healthy and diseased human tendon. Arthritis research & therapy. 2016;18(1):1.
37. Doessing S, Heinemeier KM, Holm L, Mackey AL, Schjerling P, Rennie M, et al. (2010). Growth hormone stimulates the collagen synthesis in human tendon and skeletal muscle without affecting myofibrillar protein synthesis. The Journal of physiology. 2010;588(2):341–51.
38. Bell DG, Jacobs I. (1986). Electro-mechanical response times and rate of force development in males and females. Med Sci Sports Exerc. 1986;18(1):31–6. pmid:3959861
Cita Original
McMahon G, Morse CI, Winwood K, Burden A, Onambe´le´ GL (2018) Gender associated muscle-tendon adaptations to resistance training. PLoS ONE 13(5): e0197852. https://doi.org/ 10.1371/journal.pone.0197852
Cita en Rev Edu Fís
Gerard McMahon, Christopher I. Morse, Keith Winwood, Adrian Burden Gladys L. Onambélé (2019). Adaptaciones Músculo-Tendinosas Asociadas al Género para el Entrenamiento de la Fuerza. . (153).https://g-se.com/adaptaciones-musculo-tendinosas-asociadas-al-genero-para-el-entrenamiento-de-la-fuerza-2495-sa-f5c5ddc74062c2
