Rol de la Acidosis en la Fatiga: Argumentos a Favor
Robert H. Fitts0 Department of Biological Sciences, Marquette University Milwaukee, WI
Resumen
La etiología de la fatiga muscular definida como pérdida de fuerza, velocidad y potencia en respuesta a la actividad contráctil ha sido estudiada y debatida durante más de cien años, pero aún existen importantes cuestionamientos que aún no han sido respondidos o son controversiales (2, 7, 10). Tal como se observa claramente en las revisiones publicadas por Fitts (7) y más tarde por Allen et al. (2) y Kent-Braun et al. (10), las causas de la fatiga muscular son complejas e involucran múltiples factores inherentes al sistema nervioso central y a los músculos que están realizando actividad. Los principales factores del debate sobre la importancia del bajo pH celular como agente causal de la fatiga son la definición de fatiga muscular, el grado de acidosis intracelular y los cambios en el entorno celular que se producen junto con el aumento de la concentración de H+. Los hechos más importantes establecidos son: 1) la actividad contráctil de alta intensidad puede hacer que el pH muscular baje de 7,0 hasta un valor tan bajo como 6,3-6,2 en varias especies animales entre las que se incluye ranas, gatos, ratas y humanos (7); 2) la acidosis inducida por la actividad contráctil puede correlacionarse con la fatiga muscular (7); y 3) los efectos inductores de fatiga del pH bajo son exacerbados por otros cambios celulares que se producen con la fatiga, especialmente el aumento de fosfato inorgánico (Pi) y a la menor amplitud del transitorio de Ca2+ (10). Claramente, la fatiga durante las actividades de resistencia, como correr maratones, no es causada por un bajo pH muscular (7). El principal argumento contra un papel de la elevada concentración de H+ en la fatiga a temperaturas fisiológicas proviene de estudios donde solo se evaluó la fuerza isométrica máxima y la velocidad, la acidosis fue modesta (pH>6,7) y/o el Ca2+ intracelular se encontraba en un nivel de saturación (2, 17, 21). En estas condiciones, la acidosis tiene un papel reducido pero importante en la fatiga. Los estudios realizados con fibras únicas apoyan el argumento de que a temperaturas musculares fisiológicas, la concentración de H+ no tiene un papel significativo en la fatiga si el grado de acidosis es limitado (pH celular 6,7-7,0), el Pi permanece por debajo de 5 mM y la fatiga se define como una disminución en fuerza isométrica máxima en condiciones de saturación de Ca2+ (2). Sin embargo, esas condiciones no reflejan el estado de fatiga que se produce in vivo, donde los valores de pH celular inferiores a 6,4 van acompañados de aumentos en Pi que alcanzan los 30 mM, y la amplitud del transitorio de Ca2+ disminuye hasta valores µM (pCa 6,0) (1, 7). Además, el indicador más importante de la fatiga y de la capacidad para realizar trabajo es la fuerza máxima y no la fuerza isométrica, y una elevada concentración de H+ inhibe significativamente la potencia máxima incluso en presencia de una concentración de saturación de Ca2+ y de temperaturas musculares fisiológicas (9, 11). En este trabajo revisaré las evidencias más sólidas que sostienen que el pH bajo es un importante agente causal de la fatiga muscular durante la contracción intensa.
Palabras Clave: Fatiga, acidosis, pH celular, fuerza, fibras, inhibición
Abstract
The etiology of muscle fatigue defined as a loss of force, velocity, and power in response to contractile activity has been studied and debated for over a hundred years, yet important questions remain either unresolved or controversial (2,7,10). As clearly shown in published reviews by Fitts (7) and later by Allen et al. (2) and Kent-Braun et al. (10), the causes of muscle fatigue are complex and involve multiple factors within the central nervous system and the active muscles. The factors central to the debate on the importance of low cell pH as a causative fatiguing agent are the definition of muscle fatigue, the extent of intracellular acidosis, and the changes in the cellular environment that occur in conjunction with the increase in H+. The most pertinent established facts are that: 1) high-intensity contractile activity can cause muscle pH to decline from 7.0 to as low as 6.3–6.2 in multiple species, including frogs, cats, rats, and humans (7); 2) acidosis induced by contractile activity can be correlated with muscle fatigue (7); and 3) the fatigue-inducing effects of low pH are exacerbated by other cell changes with fatigue, especially the increase in inorganic phosphate (Pi) and the reduced amplitude of the Ca2+transient (10). Clearly, fatigue during endurance activities, such as marathon running, are not caused by low muscle pH (7). The primary argument against a role for high H+ in fatigue at physiological temperatures centers on studies where only peak isometric force and velocity were evaluated, acidosis was modest (pH > 6.7), and/or intracellular Ca2+ was saturating (2,17,21). Under those conditions, acidosis plays a reduced albeit still significant role in fatigue. Single fiber studies support the argument that at physiological muscle temperatures, H+ does not have a significant role in fatigue if the degree of acidosis is limited (cell pH 6.7–7.0), Pi remains below 5 mM, and fatigue is defined as a decline in peak isometric force under conditions of saturating Ca2+ (2). However, those conditions do not reflect the fatigue state that occurs in vivo, where cell pH values < 6.4 are accompanied by increases in Pi to as high as 30 mM, and the amplitude of the Ca2+ transient declines to μM (pCa 6.0) (1,7). Furthermore, the more important indicator of fatigue and one’s ability to perform work is peak power not isometric force, and high H+ significantly inhibits peak power even in the presence of saturating Ca2+ and physiological muscle temperatures (9,11). Here, I will review the key evidence that low pH is an important causative agent in muscle fatigue during intense contractile activity.
Keywords: Fatigue, acidosis, cellular pH, strength, fibers, inhibition
La etiología de la fatiga muscular definida como pérdida de fuerza, velocidad y potencia en respuesta a la actividad contráctil ha sido estudiada y debatida durante más de cien años, pero aún existen importantes cuestionamientos que aún no han sido respondidos o son controversiales (2, 7, 10). Tal como se observa claramente en las revisiones publicadas por Fitts (7) y más tarde por Allen et al. (2) y Kent-Braun et al. (10), las causas de la fatiga muscular son complejas e involucran múltiples factores inherentes al sistema nervioso central y a los músculos que están realizando actividad. Los principales factores del debate sobre la importancia del bajo pH celular como agente causal de la fatiga son la definición de fatiga muscular, el grado de acidosis intracelular y los cambios en el entorno celular que se producen junto con el aumento de la concentración de H+. Los hechos más importantes establecidos son: 1) la actividad contráctil de alta intensidad puede hacer que el pH muscular baje de 7,0 hasta un valor tan bajo como 6,3-6,2 en varias especies animales entre las que se incluye ranas, gatos, ratas y humanos (7); 2) la acidosis inducida por la actividad contráctil puede correlacionarse con la fatiga muscular (7); y 3) los efectos inductores de fatiga del pH bajo son exacerbados por otros cambios celulares que se producen con la fatiga, especialmente el aumento de fosfato inorgánico (Pi) y a la menor amplitud del transitorio de Ca2+ (10). Claramente, la fatiga durante las actividades de resistencia, como correr maratones, no es causada por un bajo pH muscular (7).
El principal argumento contra un papel de la elevada concentración de H+ en la fatiga a temperaturas fisiológicas proviene de estudios donde solo se evaluó la fuerza isométrica máxima y la velocidad, la acidosis fue modesta (pH>6,7) y/o el Ca2+ intracelular se encontraba en un nivel de saturación (2, 17, 21). En estas condiciones, la acidosis tiene un papel reducido pero importante en la fatiga. Los estudios realizados con fibras únicas apoyan el argumento de que a temperaturas musculares fisiológicas, la concentración de H+ no tiene un papel significativo en la fatiga si el grado de acidosis es limitado (pH celular 6,7-7,0), el Pi permanece por debajo de 5 mM y la fatiga se define como una disminución en fuerza isométrica máxima en condiciones de saturación de Ca2+ (2). Sin embargo, esas condiciones no reflejan el estado de fatiga que se produce in vivo, donde los valores de pH celular inferiores a 6,4 van acompañados de aumentos en Pi que alcanzan los 30 mM, y la amplitud del transitorio de Ca2+ disminuye hasta valores µM (pCa 6,0) (1, 7). Además, el indicador más importante de la fatiga y de la capacidad para realizar trabajo es la fuerza máxima y no la fuerza isométrica, y una elevada concentración de H+ inhibe significativamente la potencia máxima incluso en presencia de una concentración de saturación de Ca2+ y de temperaturas musculares fisiológicas (9, 11). En este trabajo revisaré las evidencias mas sólidas que sostienen que el pH bajo es un importante agente causal de la fatiga muscular durante la contracción intensa.
Relación entre el pH celular y la fuerza isométrica
Para defender el rol del pH bajo como agente causal de la fatiga, debemos observar que se produce una acidosis considerable y que la misma presenta cierta relación con la fatiga. La magnitud de la disminución en el pH celular está bien documentada y depende de la intensidad de la actividad contráctil y es más alta en las fibras rápidas que en las fibras lentas (7). Por ejemplo, hay una serie de estudios entre los que se incluyen estudios realizados en seres humanos realizados por Hermansen y Osnes (8), Taylor et al. (18) y Wilson et al. (23) que demostraron que el pH muscular desciende a valores tan bajos como 6,2. Además, una observación común es que el grado de fatiga muscular (es decir, la disminución de la fuerza) y la tasa de recuperación están relacionados con el grado de acidosis (7, 12). La correlación no es perfecta debido a que otros factores además del pH bajo contribuyen con la aparición de fatiga, en particular la despolarización del sarcolema debido a aumentos en la concentración de K+ extracelular y disminuciones en la liberación de Ca2+ por parte del RS (2,7). No obstante, incluso estos factores tienen a menudo un componente de pH debido a la inhibición de las ATPasas celulares por parte de los H+ (ver a continuación).
Desde fines del siglo XIX hasta mediados de la década de 1980, varios estudios señalaron al bajo pH como un importante agente de fatiga (7). Entre ellos, se destacaron los estudios con fibras únicas que demostraron que una alta concentración de H+ podía disminuir significativamente la fuerza máxima (7). Esos estudios fueron cuestionados porque fueron realizados a temperaturas no fisiológicas (12 °C-15 °C) y estudios más recientes realizados a 30 °C (entre los que se encuentra nuestro estudio) demostraron que un pH bajo tendría un efecto más modesto sobre la fuerza isométrica máxima (2, 11, 15). Sin embargo, a partir de estos datos, no podemos concluir que el pH bajo sea un agente de fatiga sin importancia, sino que solamente tendría un efecto atenuado sobre la fuerza máxima en condiciones de saturación de Ca2+. Las condiciones de saturación de Ca2+ no son similares a las que se observan durante la fatiga, y además, estos datos no consideran el efecto que los H+ tienen sobre la velocidad de acortamiento de las fibras y sobre la potencia máxima. Es importante destacar que se ha demostrado que un pH bajo reduce la velocidad y la potencia a 30 °C en un 30% y 35% e incluso la fuerza isométrica máxima en condiciones de concentraciones subóptimas Ca2+ (11,14), y estos efectos se exacerban presencia de una concentración elevada de Pi.
Interacción entre un bajo pH, una elevada concentración de Pi y una baja concentración de Ca2+.
En 1988, Cooke at al. (4) demostraron que el efecto depresivo del pH bajo se exacerbaba con concentraciones de Pi=20 mM, y recientemente, observamos que esto es cierto incluso a 30 °C y en condiciones de saturación de Ca2+ (14). Aunque tanto el pH bajo como la alta concentración de Pi tienen un efecto más modesto (aunque significativo) sobre la fuerza isométrica máxima a 30 ºC, juntos (pH 6,2 y Pi 30 mM), estos iones producen una inhibición de la fuerza máxima de aproximadamente 35% y 50% en los tipos de fibra lentas y rápidas, respectivamente (14). Además, tanto el H+ como el Pi individualmente producen una disminución de la sensibilidad miofibrilar por el Ca2+ mayor a 30 ºC que a 15ºC, y el mayor efecto se produce en presencia de ambos iones (15). Dado que Allen et al. (1) observaron disminuciones intracelulares de Ca2+ con la fatiga, el efecto del bajo pH celular sobre la fuerza máxima es considerablemente peor en condiciones de fatiga donde la concentración intracelular de Ca2+ es subóptima y la concentración de Pi se aproxima a 30 mM.
Efecto inhibidor del bajo pH sobre la velocidad y potencia de las fibras
Podríamos afirmar que el caso más fuerte sobre la importancia del bajo pH como agente de fatiga es la observación de que una elevada concentración de H+ reduce significativamente la potencia máxima (11). Aunque el pH bajo disminuye significativamente la Vmax (pero no el Pi), ambos iones redujeron individualmente la potencia máxima de las fibras de tipo II en un 18% (5, 11). En combinación, estos iones redujeron la Vmax de las fibras en un 31% y la potencia máxima en un 59% (Figura 1) (14). Estos resultados concuerdan con los obtenidos por Karatzaferi et al. (9) quienes observaron una disminución del 55% en la potencia máxima de las fibras rápidas en condiciones similares. Curiosamente, cuando la cadena ligera de miosina 2 se fosforilaba, una condición que probablemente se puede observar en las fibras fatigadas, la inhibición de la potencia máxima se incrementó a 70% (9). Además, similarmente a lo observado en la fuerza isométrica máxima, existe la posibilidad de que la disminución en la velocidad de acortamiento de la fibra y la potencia máxima producidas por el pH se potencien por las condiciones subóptimas de Ca2+ que existen en las fibras fatigadas. Por ejemplo, con un acortamiento de fibra >10%, se sabe que la baja concentración de Ca2+ reduce la velocidad de acortamiento de la fibra (13).
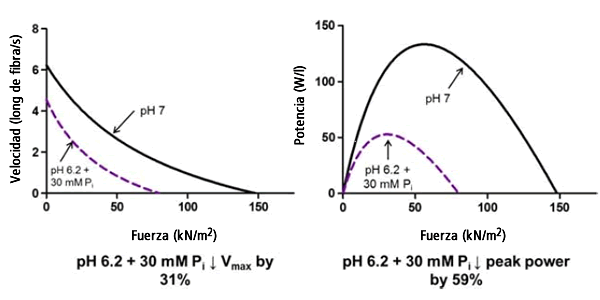
Figura 1. Curvas fuerza-velocidad y fuerza-potencia obtenidas a partir de fibras de tipo II de rata en condiciones control pH 7,0 y pH 6,2 + Pi 3,0 a 30ºC. La velocidad de acortamiento (longitudes de fibra por segundo) y la potencia (watts por litro) se grafica en función de la fuerza expresada en relación con el área de sección transversal de la fibra (kN m-2). Los datos fueron obtenidos y adaptados de Nelson et al. Am. J. Physiol. Cell. Physiol. 2014; 307: C939-50.
Diferentes factores que intervienen en la participación del bajo pH en la fatiga
Los efectos inhibidores del bajo pH sobre la sensibilidad al Ca2+, la velocidad y la potencia máxima por si solos apoyan la conclusión de que la acidosis es un importante agente productor de fatiga. Sin embargo, estas no son las únicas razones por las cuales los H+ inducen fatiga; otros importantes factores que intervienen son la inhibición de las ATPasas de las fibras, entre las que se incluyen las ATPasas de las miofibrillas, del RS y la bomba Na+-K+. Específicamente, la inhibición de la ATPasa miofibrilar participa en la reducción de la Vmax de las fibras, mientras que la inhibición de las bombas RS y Na+-K+ produce la reducción en la captación del Ca2+ del RS y una menor despolarización de la membrana superficial, respectivamente (2, 10). La primera reduce la [Ca2+] en el lumen del RS y, como consecuencia reduce la liberación de Ca+ con la activación, mientras que la segunda provoca la falla del acoplamiento excitación-contracción. Finalmente, el pH bajo reduce la eficiencia de las fibras rápidas y hace que la célula use más ATP para una determinada producción de fuerza dada (10). Esto aceleraría el desarrollo y aumentaría el nivel de fatiga (10).
En resumen, el pH muscular bajo es un importante agente de fatiga durante el ejercicio de alta intensidad, donde el pH de las células cae por debajo de 6,6, y los efectos se ven agravados por una disminución simultánea en el Ca2+ intracelular y por un aumento de Pi. Aunque estos efectos se observaron en fibras peladas, sería importante confirmar, en estudios futuros, su importancia en modelos humanos que contemplen paradigmas de fatiga in vivo.
Respuestas y Refutaciones
En su artículo, Westerblad (19) sostiene que cualquier agente inductor de fatiga debería cambiar paralelamente a la disminución de la función contráctil, algo que no siempre se produce en condiciones de acidosis. Sin embargo, este criterio solo sería cierto si la única causa de la fatiga fuera la elevada concentración de iones hidrógeno, que no es el caso (2, 7). Otros factores, como la despolarización del sarcolema y la reducción de la liberación de Ca2+ por parte del RS producen fatiga y reducen la correlación entre el pH y la fuerza y/o la potencia. En el estudio de Degroot et al. (6) citado por el Dr. Westerblad (19), el pH disminuyó inmediatamente después del ejercicio mientras que la fuerza se recuperó parcialmente. Claramente, la recuperación inicial fue independiente de cualquier efecto directo del pH. Por lo tanto, tal como los autores concluyeron en este paradigma particular, el pH no fue la única causa de la fatiga. En otro ejemplo de la naturaleza multifacética de la fatiga, demostramos que la fuerza del músculo esquelético frente a la estimulación de alta frecuencia, presenta una recuperación en dos fases, una fase rápida inicial no relacionada con el pH y una segunda fase más lenta altamente correlacionada (P=0,94) con la recuperación del pH (12). Otra consideración importante es que la inhibición de las ATPasas Na+-K+ y RS inducida por el pH que favorece la aparición de la fatiga no sigue siendo relevante durante la recuperación, donde incluso un funcionamiento bajo de las bombas puede mantener los gradientes de Na+ y K+ y la captación de Ca2+ del RS en toda la célula. Por lo tanto, en un contexto de fatiga, donde estas bombas están inhibidas, se esperaría una recuperación temprana de la fuerza a pesar de que no se haya recuperado el pH.
El Dr. Westerblad (19) cita dos artículos como evidencia en contra el pH bajo como agente productor de fatiga, en los cuales se observó fatiga en fibras individuales aisladas en ausencia de cambio significativo en el pH, o no se observó una aceleración cuando las fibras se acidificaron, (3, 20). Sin embargo, se ha demostrado que el protocolo utilizado para inducir la fatiga en estos estudios interrumpe el acoplamiento excitación-contracción y provoca pérdida de fuerza en bajas frecuencias (22). Estos estudios demostraron que la fatiga puede ser el resultado de otros factores diferentes a una [H+] elevada, pero no refutan un papel importante de los H+ en las condiciones de ejercicio donde se produce una acidosis significativa (7).
El Dr. Westerblad señala que el pH bajo tiene un efecto depresivo menor sobre la fuerza isométrica máxima a una temperatura cercana a la fisiológica, que va desde aproximadamente el 50% a 10ºC hasta aproximadamente el 20% a 30ºC (17). No obstante, la pérdida de fuerza sigue siendo significativa y, en condiciones donde existe fatiga, se vuelve considerablemente más importante. Por ejemplo, el efecto de un pH bajo sobre la fuerza y la potencia se exacerba en presencia de un alto contenido de fosfato inorgánico (Pi); en tal sentido, nosotros y Karatzaferi et al. (9) demostramos que la potencia disminuye aproximadamente un 60%. Este último estudio observó una disminución de hasta 70% en la potencia en una condición de pH 6,2, Pi 30 mM cuando la cadena liviana de miosina 2 estaba fosforilada, un efecto no observado en condiciones de elevada concentración de Pi y pH=7, lo que demuestra la importancia del bajo pH en la disminución de la potencia máxima.
Al considerar la importancia de la acidosis en la fatiga, es importante considerar el efecto que tienen los H+ sobre la disminución de la sensibilidad de las miofibrillas por el Ca2+. Recientemente, observamos que la disminución de la sensibilidad al Ca2+ inducida por los H+ es considerablemente mayor a una temperatura de 30 °C que a 15 °C (15). Este efecto adquiere una importancia adicional en la fatiga donde la amplitud de los transitorios de Ca2+ se reduce, y las fibras están operando en la porción empinada de la relación fuerza-[Ca2+] (2). Esto significa que la inhibición de la fuerza inducida por los H+ es considerablemente mayor a la observada bajo condiciones de saturación de Ca2+ ya que el pH 6,2 ha reducido el pCa50 de 6,58 a 5,36 en las fibras de tipo rápido IIx (15). El Dr. Westerblad cuestiona nuestros resultados señalando que la concentración de Ca2+ necesaria para alcanzar el pCa50 se incrementó aproximadamente 5 veces a 30 °C, un aumento mucho mayor que el aumento de 3,6 veces informado por Palmer y Kentish (16). Sin embargo, la diferencia principal entre los dos estudios fue la sensibilidad al Ca2+ en la condición de pH 7,0 donde pCa50 fue de 6,58 y 5,86, y esta diferencia puede ser atribuida, al menos en parte, a la mayor temperatura que utilizamos en nuestro estudio, porque la temperatura aumenta la sensibilidad miofibrilar por el Ca2+ (15). Es importante destacar que los valores de pCa50 informados a pH 6,2, que representan el Ca2+ necesario para producir el 50% de la fuerza máxima, fueron esencialmente similares en las fibras psoas rápidas utilizadas en el estudio Palmer y Kentish (16) y en las fibras rápidas del gastrocnemio de rata de nuestro estudio, donde sus valores fueron 5,30 y 5,36, respectivamente (15). Además, el aumento de Ca2+ libre requerido para obtener pCa50 bajo condiciones de fatiga en ambos estudios fue similar (3,63 y 4,36 µM), y la diferencia podría ser atribuida a una mayor sensibilidad por el Ca2+ a pH=7 a 30 °C en comparación con 25 °C (15). El Dr. Westerblad sugiere que nuestro aumento de aproximadamente 15 veces en la concentración de Ca2+ necesaria para alcanzar pCa50 bajo condiciones de fatiga, requeriría un aumento aproximado de 7,5 veces en el ,Ca2+ tetánico algo que es incompatible con la disminución medida en el Ca2+ tetánico en el estado de fatiga (2). Su razonamiento para esta afirmación no está claro, porque el criterio importante no es el cambio delta en pCa50 entre pH 7 y 6.2, sino la concentración real de Ca2+ necesaria en condiciones de fatiga para alcanzar un cierto % de fuerza máxima. En nuestro estudio y en el estudio de Palmer y Kentish (16), la concentración de Ca2+ necesaria para alcanzar pCa50 a pH 6,2 es esencialmente idéntica. En nuestro trabajo y en el de Palmer y Kentish (16), la disminución inducida por H+ en la sensibilidad miofibrillar por el Ca2+ haría que la fuerza disminuyera 50% por debajo del valor observado en la condición de ausencia de fatiga.
CONCLUSIONES
La acidosis produce fatiga a través de efectos directos sobre la fuerza de extrecruzamiento, la velocidad y la potencia y además suprime la sensibilidad miofibrilar por el Ca2+.. Esto último es particularmente importante en casos de fatiga donde la amplitud de los transitorios de Ca2+ se reduce y las fibras trabajan en la porción empinada de la relación fuerza-[Ca2+]i. Los efectos inhibidores de fuerza y potencia que tiene el pH bajo son mayores que los observados en condiciones de saturación de Ca2+ y se agravan aún más por el aumento asociado de Pi.Referencias
1. Allen D.G., Clugston E., Petersen Y., et al. (1985). Interactions between intracellular calcium and phosphate in intact mouse muscle during fatigue. J. Appl. Physiol. 2011;111(2):358–66.
2. Allen D.G., Lamb G.D., Westerblad H. (2008). Skeletal muscle fatigue: cellular mechanisms. Physiol. Rev. 88(1):287–332.
3. Bruton J.D., La¨nnergren J., Westerblad H. (1985). Effects of CO2-induced acidification on the fatigue resistance of single mouse muscle fibers at 28-C. J. Appl. Physiol. 1998;85(2): 478–83.
4. Cooke R., Franks K., Luciani G.B, et al. (1988). The inhibition of rabbit skeletal muscle contraction by hydrogen ions and phosphate. J. Physiol.395:77–97.
5. Debold E.P., Dave H., Fitts R.H. (2004). Fiber type and temperature dependence of inorganic phosphate: implications for fatigue. Am. J. Physiol. Cell. Physiol. 287:C673–81.
6. Degroot M., Massie B.M., Boska M., et al. (1993). Dissociation of [H+] from fatigue in human muscle detected by high time resolution 31P-NMR. Muscle Nerve. 16(1):91–8.
7. Fitts R.H. (1994). Cellular mechanisms of muscle fatigue. Physiol. Rev.74(1):49–94.
8. Hermansen L., Osnes J.B. (1972). Blood and muscle pH after maximal exercise in man. J. Appl. Physiol.;32(3):304–8.
9. Karatzaferi C., Franks-Skiba K., Cooke R. (2008). Inhibition of shortening velocity of skinned skeletal muscle fibers in conditions that mimic fatigue. Am. J. Physiol. Regul. Integr. Comp. Physiol.294(3):R948–55.
10. Kent-Braun J.A., Fitts R.H., Christie A. (2012). Skeletal muscle fatigue. Compr. Physiol.2:997–1044.
11. Knuth S.T., Dave H., Peters J.R., et al. (2006). Low cell pH depresses peak power in rat skeletal muscle fibres at both 30 degrees C and 15 degrees C: implications for muscle fatigue. J. Physiol.575(3): 887–99.
12. Metzger J.M., Fitts R.H. (1985). Role of intracellular pH in muscle fatigue. J. Appl. Physiol. 1987;62(4):1392–7.
13. Moss R.L. (1986). Effects on shortening velocity of rabbit skeletal muscle due to variations in the level of thin-filament activation. J. Physiol.377:487–505.
14. Nelson C.R., Debold E.P., Fitts R.H. (2014). Phosphate and acidosis act synergistically to depress peak power in rat muscle fibers. Am. J. Physiol. Cell. Physiol.307(10):C939–50.
15. Nelson C.R., Fitts R.H. (2014). Effects of low cell pH and elevated inorganic phosphate on the pCa-force relationship in single muscle fibers at near-physiological temperatures. Am. J. Physiol. Cell Physiol.;306(7):C670–8.
16. Palmer S., Kentish J.C. (1994). The role of troponin C in modulating the Ca2+ sensitivity of mammalian skinned cardiac and skeletal muscle fibres. J. Physiol.480(1):45–60.
17. Pate E., Bhimani M., Franks-Skiba K., et al. (1995). Reduced effect of pH on skinned rabbit psoas muscle mechanics at high temperatures: implications for fatigue. J. Physiol.486(3):689–94.
18. Taylor D.J., Styles P., Matthews P.M., et al. (1986). Energetics of human muscle: exercise-induced ATP depletion. Magn. Reson. Med. 3(1):44–54.
19. Westerblad H. (2016). Acidosis is not a significant cause of skeletal muscle fatigue. Med. Sci. Sports Exerc.48(11):2339–42.
20. Westerblad H., Allen D.G. (1992). Changes of intracellular pH due to re-petitive stimulation of single fibres from mouse skeletal muscle. J. Physiol. 449:49–71.
21. Westerblad H., Bruton J.D., La¨nnergren J. (1997). The effect of intracellular pH on contractile function of intact, single fibres of mouse declines with increasing temperature. J. Physiol.500(1):193–204.
22. Westerblad H., Duty S., Allen D.G. (1985). Intracellular calcium concentration during low-frequency fatigue in isolated single fibers of mouse skeletal muscle. J. Appl. Physiol. 1993;75:382–8.
23. Wilson J.R., McCully K.K., Mancini D.M., et al. (1985). Relationship of muscular fatigue to pH and diprotonated Pi in humans: a 31P-NMR study. J. Appl. Physiol. 1988;64(6):2333–9.
Cita Original
Robert H. Fitts. (2016).The Role of Acidosis in Fatigue:. Medicine & Science in Sports & Exercise. 48(11): 2335–2338
Cita en Rev Entren Deport
Robert H. Fitts (2017). Rol de la Acidosis en la Fatiga: Argumentos a Favor. . (4).https://g-se.com/rol-de-la-acidosis-en-la-fatiga-argumentos-a-favor-2338-sa-H5a0a191a6eefb
