Regulación de los Elementos de la Matriz Extracelular y la Sarcomerogénesis en Respuesta a Diferentes Períodos de Estiramiento Pasivo en el Músculo Sóleo de las Ratas
Sabrina M. Peviani, Vinicius Guzzoni, Clara M. Pinheiro-Dardis, Yara P. da Silva, Alisson C. R. Fioravante, Adriana H. Sagawa, Gabriel B. Delfino, João L. Q. Durigan, Tania F. SalviniResumen
El estiramiento es un método común utilizado para prevenir el acortamiento muscular y mejorar la movilidad limitada. Sin embargo, aún no se ha investigado el efecto de los diferentes períodos de tiempo sobre la adaptación inducida por el estiramiento de la matriz extracelular y sus elementos reguladores. El objetivo fue evaluar la expresión de los colágenos fibrilares, la sarcomerogénesis, la actividad de la metaloproteinasa (MMP) y la expresión génica de los reguladores de la matriz extracelular (ECM) en el músculo sóleo (SOL) de ratas sometidas a diferentes períodos de estiramiento. Los músculos sóleos fueron sometidos a 10 series de estiramiento pasivo durante 10 (St 10d) o 15 días (St 15d) (1 minuto por serie, con 30 segundos de descanso entre series). Se analizó la sarcomerogénesis, el área de sección transversal del músculo (CSA), la actividad de la MMP y los niveles de ARNm en colágeno (tipo I, III y IV), el factor de crecimiento del tejido conectivo (CTGF), el factor de crecimiento beta (TGF-β) y la lisil-oxidasa (LOX). El estiramiento pasivo durante ambos períodos de tiempo mitigó la deposición de COL-I en el músculo SOL de las ratas. Paradójicamente, 10 días de estiramiento pasivo indujeron la síntesis de COL-I y COL-III, con el consiguiente aumento de TGF-β1 y CTGF a nivel transcripcional. Estas respuestas pueden estar asociadas con niveles más bajos de ARNm de LOX en los músculos SOL sometidos a 10 sesiones de estiramiento pasivo. Además, la sarcomerogénesis se observó después de 15 días de estiramiento, lo que sugiere que las adaptaciones musculares inducidas por el estiramiento son respuestas dependientes del tiempo.
INTRODUCCIÓN
El estiramiento es un método común utilizado en actividades deportivas y programas de rehabilitación para prevenir el acortamiento muscular1-4 y mejorar la movilidad limitada5. Las adaptaciones del músculo esquelético han sido demostradas a través de diferentes vías en respuesta al estiramiento pasivo6-9. Los mecanismos potenciales implicados en las adaptaciones del músculo esquelético inducidas por el estiramiento se basan en la prevención de la atrofia muscular10-12 y la deposición de nuevas unidades de sarcómeros en los músculos de las ratas13. Además, la frecuencia y la duración del estiramiento parecen jugar un papel crucial en las adaptaciones del músculo esquelético, como se ha observado en nuestros estudios previos8,14. Como tal, las diferencias en los métodos de estiramiento aplicados (continuo vs. intermitente) afectan el crecimiento muscular6 y las propiedades viscoelásticas de las estructuras tendinosas15. Además, se han investigado los métodos de inmovilización16-18 y las técnicas de estiramiento en el músculo denervado de las ratas19. Sin embargo, hay pruebas limitadas con respecto al efecto de los diferentes períodos de estiramiento sobre la homeostasis de la ECM.
El tejido conectivo está formado principalmente por proteínas de la ECM, incluidos los colágenos, y desempeña un papel importante en la transmisión de fuerza de las fibras musculares20 y en la protección contra el daño contráctil21. Los colágenos fibrilares tipo I (COL-I) y tipo III (COL-III) son la principal proteína estructural de la ECM del músculo esquelético21, mientras que las membranas basales consisten principalmente en redes de colágeno tipo IV (COL-IV)20. La degradación de la matriz extracelular es un proceso enzimático regulado por la actividad de la MMP y los inhibidores de tejido endógeno de las metaloproteinasas (TIMP)22, mientras que las MMP-2 y MMP-9 son gelatinasas expresadas en el músculo esquelético que degradan los colágenos, la fibronectina, el proteoglicano y la laminina23. El factor de crecimiento transformante-beta (TGF-β) es una citoquina crucial responsable de producir COL-I, fibronectina y factor de crecimiento del tejido conectivo (CTGF)24,25, además de suprimir las MMPs20. De hecho, un TGF-β elevado provoca una respuesta fibrótica26,27. Además, la lisil-oxidasa (LOX) se ha asociado con el desarrollo de la ECM y desempeña un papel fundamental en la estabilización del colágeno fibroso mediante la formación de enlaces covalentes cruzados28. De hecho, el entrecruzamiento del colágeno es importante para producir fuerza durante el estiramiento pasivo29.
La inmovilización induce la atrofia muscular y la proliferación del tejido conectivo, causada por cambios en la síntesis de colágeno y degradación del tejido muscular30,31. Mientras investigaciones anteriores han demostrado que el estiramiento muscular minimiza la acumulación de tejido conectivo1,32, los resultados relacionados con el efecto del estiramiento sobre la deposición de tejido conectivo y la remodelación de la ECM siguen siendo polémicos33. Por ejemplo, Zotz et al.34 encontraron que el estiramiento pasivo (3 veces a la semana durante 1 semana) aumentaba el contenido de colágeno tipo I (COL-I) y simultáneamente reducía los niveles de colágeno tipo III (COL-III) y TGFβ1 en el músculo sóleo de ratas hembras mayores. Además, Faturi et al.18 observaron un aumento del contenido de tejido conectivo en los músculos SOL denervados de las ratas en respuesta a 7 sesiones de estiramiento intermitente. En nuestro estudio, tanto la expresión génica como la actividad de la MMP-2 aumentaron en respuesta al estiramiento del músculo SOL denervado en ratas14, aunque una sola sesión de estiramiento no provocó cambios en la actividad de la MMP-2 y la MMP-99. Sin embargo, no se ha investigado el efecto de los diferentes períodos de tiempo sobre las adaptaciones de la ECM inducidas por el estiramiento.
Así, el objetivo de este estudio fue evaluar la expresión de colágenos fibrilares (COL-I, III y IV), la sarcomerogénesis, la actividad de la MMP y la expresión génica de los principales reguladores de la ECM en el músculo SOL de ratas sometidas a diferentes períodos de estiramiento pasivo. Se plantea la hipótesis de que un gran número de sesiones de estiramientos pasivos reducirán el contenido y la síntesis de colágeno, con un aumento concomitante de la actividad de la MMP-2 y una mayor multiplicación de los sarcómeros (sarcomerogénesis) en el músculo SOL de las ratas.
RESULTADOS
Sarcomerogénesis, actividad de la MMP-2 y expresión de colágeno en los músculos SOL sometidos a 10 o 15 días de estiramiento pasivo.
El número de sarcómeros en los músculos SOL aumentó en el grupo St 15d en comparación con los controles (Fig. 1A; p < 0,05). No hubo cambios intergrupales en los niveles de CSA y pro-MMP-2 (Fig. 1B y C). La actividad de la MMP-2 disminuyó en las ratas de St 10d en relación con los controles (Fig. 1D; p < 0,05). La figura 2 muestra el análisis cualitativo de la tinción por inmunofluorescencia para COL-I, III y IV. La deposición de COL-I (% por área de fibra muscular) disminuyó en los músculos SOL de los grupos St 10d y St 15d en comparación con los controles (Fig. 2A; p < 0,0001). No hubo diferencias intergrupales en los niveles de COL-III y COL-IV (Fig. 2B y C).
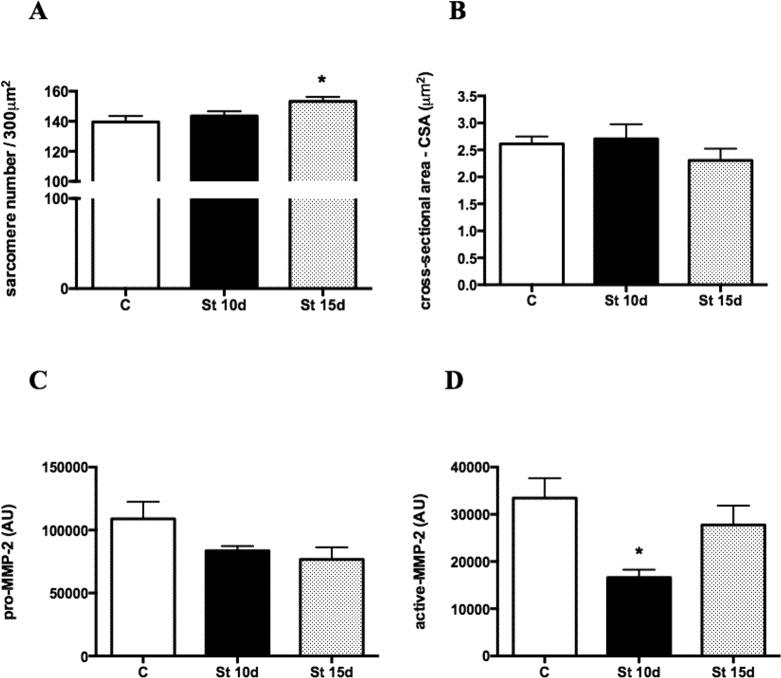
Figura 1. Número de sarcómero (A), área de sección transversal - CSA (B), niveles pro-MMP-2 (C) y actividad de MMP-2 (D) en el músculo SOL. Grupos: control (C), 10 días de estiramiento pasivo (St 10d) y 15 días de estiramiento pasivo (St 15d). Los valores se expresan como media ± SEM. ANOVA unidireccional, p < 0,05: * vs. C; ** vs. St 10d n = 6/grupo.
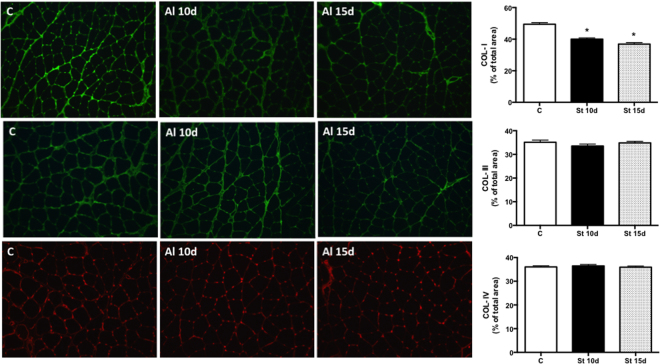
Figura 2. Imágenes representativas y cuantificación de los niveles de COL-I (línea A), COL-III (línea B) y COL-IV (línea C) en el músculo SOL. Grupos: control (C), 10 días de estiramiento pasivo (St 10d) y 15 días de estiramiento pasivo (St 15d). Los valores se expresan como % del total del área ± SEM. ANOVA unidireccional, p < 0,05: * vs. C; ** vs. St 10d n = 6/grupo.
Niveles de ARNm de COL-I, III y IV, TGF-β1, CTGF y LOX en los músculos SOL sometidos a 10 o 15 días de estiramiento pasivo.
El COL-I, III y IV (Fig. 3A-C; p < 0,0001), TGF-β1 y las transcripciones de CTGF (Fig. 3D,E; p < 0,0001) aumentaron significativamente en los músculos SOL del grupo St10d en comparación con las ratas control. Se observaron niveles inferiores de COL-III, IV, TGF-β1 y ARNm del CTGF en el grupo St15d en comparación con las ratas de St10d (Fig. 3B-E; p < 0,0001). Los niveles de ARNm de LOX disminuyeron en el grupo St 10d en relación con los controles, mientras que las transcripciones de LOX no fueron estadísticamente diferentes del grupo control, pero fueron más altas en las ratas de St 15d en comparación con el grupo St 10d (Fig. 3F; p = 0,0002).
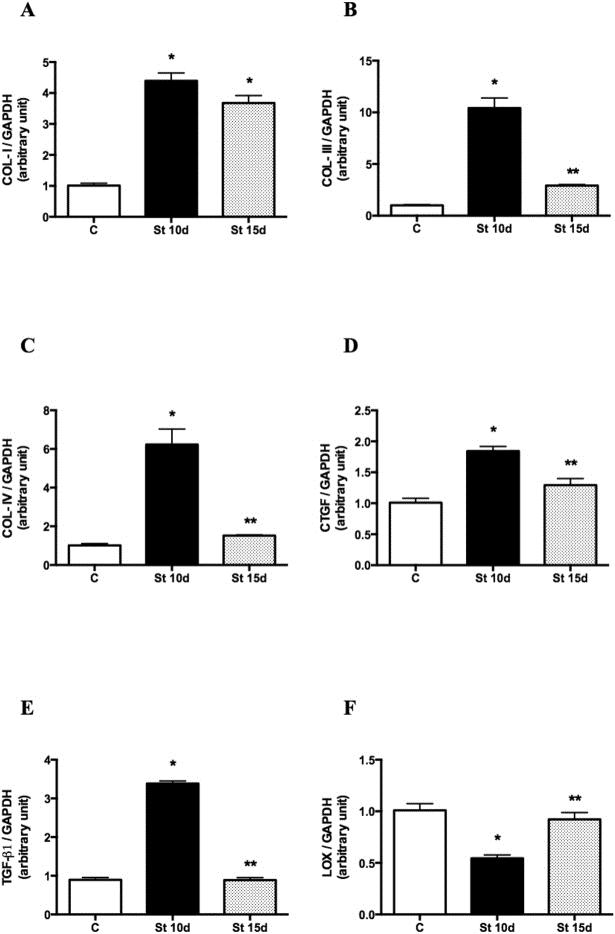
Figura 3. Expresión génica por qPCR. Los datos se expresan como ratios de los genes diana COL-I (A), COL-III (B), COL-IV (C), CTGF (D), TGF-β (E) y LOX (F) a GAPDH en el músculo SOL. Grupos: control (C), 10 días de estiramiento pasivo (St 10 d) y 15 días de estiramiento pasivo (St 15d). Los valores se expresan como media ± SEM. ANOVA unidireccional, p < 0,05: * vs. C; ** vs. St 10d n = 6/grupo.
Discusión
El presente estudio demostró que 10 y 15 días de estiramiento pasivo mitigaron el contenido de COL-I en los músculos SOL de las ratas, aunque la actividad de la MMP-2 disminuyó después de 10 sesiones. Paradójicamente, 10 días de estiramiento pasivo indujeron la síntesis de COL-I y COL-III, con la consiguiente aumento de regulación de la transducción de la señal ascendente (CTGF y TGF-β1) a nivel transcripcional. A pesar de la clara indicación de la síntesis de colágeno después de 10 días de estiramiento, la estabilización del entrecruzamiento del colágeno no acompañó este proceso, ya que se observaron bajos niveles de ARNm de LOX después de 10 sesiones de estiramiento. Hasta donde sabemos, este es el primer estudio que demuestra la expresión génica de los elementos reguladores de la ECM en respuesta al estiramiento pasivo. Aunque los resultados obtenidos en los estudios que utilizan la denervación y la inmovilización no son concluyentes, nuestros hallazgos indicaron que los períodos más largos de estiramiento aliviaron la deposición de colágeno en los músculos esqueléticos, concomitantes con las diferentes respuestas reguladoras de la ECM a nivel transcripcional.
La sarcomerogénesis se observó después de 15 días de estiramiento pasivo, lo que sugiere que la frecuencia y la duración del estiramiento pueden llevar a adaptaciones musculares y efectos paralelos sobre la homeostasis de la ECM (Fig. 1A). Mientras que una sesión de estiramiento de 40 minutos a la semana no alteraba el número de sarcómeros en serie en los músculos SOL de las ratas35, estirar cada 3 días durante 40 minutos aumentaba el número de sarcómeros en serie en comparación con el músculo contralateral36. En un estudio anterior, encontramos que los músculos SOL denervados de las ratas sometidos a diferentes períodos de estiramiento intermitente no mostraron cambios en el número de sarcómeros en serie18. En este estudio, 15 sesiones de estiramiento pasivo indujeron sarcomerogénesis en los músculos SOL. El número total de sarcómeros en serie aumentó en los músculos SOL estirados dos veces por semana durante 40 minutos, durante ocho semanas consecutivas, lo que corrobora parcialmente nuestros hallazgos37. Se ha sugerido que el estiramiento pasivo podría promover la adición de sarcómeros si el músculo se alarga lo suficiente como para aumentar la liberación de calcio a través de los canales de calcio activados38.
El estiramiento pasivo alivia la stiffness del tejido muscular38. Como tal, se ha informado una reducción de la stiffness de la unidad músculo-tendón en respuesta a 5 minutos de estiramiento estático en los músculos gastrocnemios en humanos, lo que sugiere cambios en las propiedades del tejido conectivo5,15. De hecho, la resistencia pasiva está influenciada por la deformación (alargamiento) del tejido conectivo (endomisio, perimisio y epimisio) del vientre muscular en respuesta al estiramiento4. Además, un protocolo de estiramiento (diez repeticiones de 15 s con 30 s de descanso entre repeticiones, aplicadas después de la inmovilización durante 10 días consecutivos) condujo a la acumulación de tejido conectivo intersticial en los músculos SOL de las ratas hembras33. Los autores sugirieron que la proliferación del tejido conectivo es un mecanismo de protección para prevenir el daño en el músculo inmovilizado. Por otro lado, el contenido de COL-I disminuyó en los músculos SOL sometidos a estiramiento durante 10 y 15 días (Fig. 2), corroborando los resultados de un estudio anterior34. Sin embargo, es necesario comprender mejor los mecanismos moleculares inducidos por el estiramiento que intervienen en la homeostasis del tejido conectivo.
Se ha demostrado que la MMP-2 desempeña un papel en la fase de remodelación prolongada del músculo esquelético23. Mientras la actividad de la MMP-2 disminuyó en el grupo de St 10 en el presente estudio, los niveles de la MMP-2 aumentaron después de 2, 4 y 7 días de contracciones de alargamiento39. Sin embargo, aunque un estudio previo no mostró cambios en la actividad de MMP-2 y MMP-9 y en la expresión génica en los músculos SOL de las ratas después de una sola sesión de estiramiento9, cuatro series de estiramientos diarios aumentaron la actividad de MMP-2 en el músculo tibial anterior14. En el presente estudio, la actividad de la MMP-2 disminuyó después de 10 sesiones de estiramiento pasivo, lo que sugiere que el número de sesiones es un factor clave en la modulación de la renovación de la ECM. Las diferencias observadas en los distintos estudios pueden deberse a los diferentes métodos utilizados. Además, la reducción de la actividad de la MMP-2 puede estar relacionada con el aumento de las transcripciones de colágeno (I, III y IV), observadas después de 10 sesiones de estiramiento. De hecho, 10 y 15 sesiones de estiramiento pasivo redujeron el contenido de COL-I (Fig. 2A), aunque los niveles intergrupales de COL-III y IV permanecieron sin cambios (Fig. 2B,C). Esto puede deberse a la participación de otros subtipos de MMP en la degradación por COL-I, incluidas las colagenasas (MMP-1 y 13)40,41, a diferencia de la MMP-2 sola. Además, mientras el COL-IV de la lámina basal de la membrana muscular ha sido identificado como un objetivo de la MMP-942, no hubo cambios en la actividad de la MMP-9 después de 10 ó 15 sesiones de estiramiento del músculo SOL (datos no mostrados). Además, la MMP-9 se asoció con la activación del TGF-β1 latente en una forma madura, que induce la fibrosis en los músculos distróficos43. Por otra parte, la expresión génica de MMP-9 aumentó en los músculos SOL de las ratas sometidos a denervación, seguidos de 10 sesiones de estiramiento18. Considerando las diferencias entre los estudios, la expresión de la MMP parece depender más de los procesos de degeneración y regeneración en los músculos esqueléticos de las ratas39.
En el presente estudio, 10 sesiones de estiramiento pasivo provocaron un aumento de las transcripciones de COL-I y IV, mientras que 15 sesiones produjeron aumentos marcados en los niveles de ARNm de COL-I y III en los músculos SOL de las ratas (Fig. 3A,B). De hecho, en un estudio previo demostramos que las sesiones diarias de estiramiento inducen una reorganización molecular de las fibrillas de colágeno después de la inmovilización del músculo SOL de la rata44. Las contracciones de alargamiento y/o deformación mecánica de los tejidos conectivos extracelulares probablemente inducen la síntesis de colágeno en el músculo esquelético, lo que lleva a una mayor resistencia pasiva cuando el músculo está estirado4,39. En otro estudio, tanto el contenido de COL-I como la expresión del gen TGF-β aumentaron en los músculos sóleo denervados de las ratas después de 10 sesiones de estiramiento intermitente en días alternos18. Los mecanismos involucrados en estas respuestas pueden estar asociados con la señalización pro-fibrótica (CTGF y TGF-β1). De hecho, el aumento de los niveles de ARNm de CTGF y TGF-β1 se observó después de 10 sesiones de estiramiento pasivo, pero no hubo cambios en estas transcripciones después de 15 sesiones (Fig. 3D,E). El estrés mecánico parece estimular el CTGF, que está implicado en la fibrosis muscular inducida por el estiramiento45. Se ha demostrado que los ciclos repetitivos de estiramiento-relajación inducen la liberación del factor de crecimiento similar a la insulina (IGF-1) en las células musculares diferenciadas46, lo que sugiere que los "factores de crecimiento" son objetivos importantes relacionados con la remodelación de la ECM y la homeostasis del músculo esquelético47,48, y que también pueden ser regulados mediante el estiramiento18. Por el contrario, los modelos de estiramiento ex vivo e in vivo resultaron en mayores niveles de TGF-β y procolágeno tipo 1 en los tejidos de los ratones48.
Nuestros hallazgos con respecto a la reducción de la deposición de COL-I (Fig. 2A) pueden estar asociados con la disminución de los niveles de ARNm de LOX (Fig. 3F). Por otro lado, se ha descubierto que la carga mecánica (contracciones concéntricas, excéntricas e isométricas) aumenta las transcripciones de la LOX en los tendones y los músculos gastrocnemios de las ratas49. Sin embargo, con respecto al tejido muscular esquelético, los efectos de los diferentes períodos de estiramiento sobre los niveles de LOX aún no se comprenden completamente. Nuestro estudio es el primero en examinar los efectos del estiramiento pasivo sobre la expresión genética de la LOX en los músculos de las ratas. La disminución de los niveles de ARNm de LOX se observó después de 10 sesiones de estiramiento pasivo, pero las transcripciones de LOX volvieron a los valores basales (ratas control) después de 15 sesiones. Se cree que la LOX es importante en la formación de enlaces cruzados derivados de la lisina entre y dentro de las moléculas de colágeno, contribuyendo a estabilizar y fortalecer las fibrillas de colágeno28. Por lo tanto, en contraste con el aumento inducido por el estiramiento de las moléculas relacionadas con la síntesis de colágenos (Fig. 3A-E), el estiramiento pasivo parece desempeñar un papel significativo en la prevención de los enlaces covalentes cruzados y la estabilización de las fibrillas de colágeno en paralelo con su deposición intramuscular (Fig. 3F). Esto se observó después de 10 sesiones de estiramiento del músculo SOL de las ratas, sin cambios después de 15 sesiones. Es importante señalar que nuestros hallazgos no apoyan una relación mecanicista entre la deposición intramuscular de colágeno y los cambios en la expresión génica de los factores relacionados con la síntesis de colágeno.
Conclusiones
En conclusión, el estiramiento pasivo durante 10 y 15 días mitigó la deposición de COL-I en el músculo SOL de las ratas. Por el contrario, 10 días de estiramiento pasivo indujeron la síntesis de COL-I y COL-III, con el consiguiente aumento de regulación de la transducción de la señal ascendente (CTGF y TGF-β) a nivel transcripcional. Estas respuestas pueden estar asociadas con niveles más bajos de ARNm de LOX en los músculos SOL sometidos a 10 sesiones de estiramiento pasivo. Además, la sarcomerogénesis se observó después de 15 días de estiramiento pasivo, lo que sugiere que las adaptaciones musculares inducidas por el estiramiento son respuestas dependientes del tiempo.
MÉTODOS
Grupos Experimentales
Se utilizaron 18 ratas Wistar macho de 3 meses de edad (peso 350 ± 25 g). Los animales se alojaron en jaulas de plástico en condiciones ambientales controladas, con libre acceso al agua y a los alimentos corrientes. Los procedimientos experimentales se aprobaron por el Comité de Ética Universitario (Número 25/2012) y de acuerdo con las Directrices para el Cuidado y Uso de los Animales de Laboratorio. Las ratas se dividieron aleatoriamente en tres grupos de seis animales y se anestesiaron mediante inyecciones intraperitoneales de xilacina (12 mg.kg-1) y ketamina (95 mg.kg-1) para aplicar el protocolo de estiramiento. Los animales fueron sacrificados por una sobredosis del anestésico8.
Protocolo de Estiramiento
El protocolo de estiramiento se basó en un método previamente validado8,9. Una sola sesión de estiramiento pasivo (flexión dorsal) consistió en 10 series de estiramiento del músculo sóleo (SOL) del tobillo izquierdo durante 1 minuto, con un descanso de 30 segundos entre series. Las ratas se sometieron a estiramiento pasivo durante 10 (St 10d; n = 6) o 15 días (St 15d; n = 6). El músculo SOL ha sido ampliamente utilizado en nuestros estudios previos sobre estiramiento del músculo esquelético8,50.
Recolección de Muestras de Músculo
Los animales se pesaron al final del período de experimentación. Los músculos izquierdos SOL fueron diseccionados y pesados 24 horas después de la última sesión de estiramiento. Cada músculo SOL se dividió longitudinalmente en dos segmentos: la porción lateral se utilizó para las mediciones del sarcómero y la porción media se dividió en dos partes (porción proximal y distal)7,8,14. La porción proximal se congeló inmediatamente en isopentano pre-enfriado en nitrógeno líquido, almacenado a -80 °C y utilizado para determinar la morfología y el área de sección transversal (CSA), y en el análisis de inmunofluorescencia del colágeno I, III y IV (COL-I, COL-III y COL-IV). La porción distal se dividió en dos segmentos iguales, rápidamente congelados en nitrógeno líquido, almacenados a -80 °C y utilizados para zimografías y análisis de ARNm.
CSA del Músculo
Se adquirieron imágenes de cinco regiones diferentes con un aumento de 20x, utilizando un microscopio de luz (Axiolab, Carl Zeiss, Jena, Alemania) equipado con una cámara digital (Sony DSC S75, Tokio, Japón). En cada imagen, se midió el CSA de 70 fibras aleatorias utilizando el software Axiovision 4.7.1.0 (Carl Zeiss, Jena, Alemania), con un total de 350 fibras musculares por animal (n = 6/grupo)14.
Número de Sarcómeros en Serie (sarcomerogénesis)
El número de sarcómeros dentro de una sola fibra muscular se determinó según lo descrito por Williams y Goldspink51. La porción lateral de los músculos SOL se sumergió en glutaraldehído al 2,5% (2,5%) durante 3 h, se transfirió a una solución de óxido nítrico (30%) durante dos días y luego se almacenó en glicerol (50%). Cinco fibras musculares individuales fueron extraídas y fijadas en gelatina-glicerina en un portaobjetos histológico (n = 6/grupo)52.
Las imágenes fueron adquiridas con un aumento de 20x. El número de sarcómeros en serie se determinó utilizando un microscopio de luz (objetivo de inmersión 100x; Axiolab, Carl Zeiss, Jena, Alemania), equipado con una cámara digital (Sony DSC S75, Tokio, Japón). El número de sarcómeros se cuantificó con el software Axiovision 4.7.1.0 (Carl Zeiss, Jena, Alemania). El número total de sarcómeros en serie se estimó en base a la correlación entre el número de sarcómeros identificados en tres campos de 100 μm, totalizando 300μm a lo largo de la fibra muscular (n = 6/grupo)53.
Zimografía
Se lavaron 25 miligramos de músculo con solución salina fría y se incubaron en 2 mL de buffer de extracción (10 mM de ácido cacodílico, pH 5,0, 150 mM de NaCl, 1 μM ZnCl2, 20 mM de CaCl2, 1,5 mM de NaN3 y 0,01% de Triton X-100) a 4 °C, con mezcla continua durante 24 h. La concentración de proteína se determinó utilizando un kit de análisis de proteína BCATM (Pierce, Rockford, IL, EEUU), de acuerdo con las instrucciones del fabricante.
Brevemente, cantidades iguales de proteína total (30 μg/ml) consistentes en un grupo de seis animales por grupo (6 μg por animal) fueron sometidas a electroforesis por triplicado. Los geles de zimografía consistieron en un 10% de poliacrilamida impregnada con gelatina en una concentración final de 100 mg/ml de H2O en presencia de dodecilsulfato sódico (SDS), en condiciones no reductoras. Después de 2 h de electroforesis (100 V), los geles se lavaron dos veces durante 20 min en una solución de Triton X-100 al 2,5% y se incubaron a 37 °C durante 20 h en un buffer de sustrato (50 mM Tris-HCl, pH 8,5, 5 mM CaCl2 y 0,02% NaN3). A continuación, los geles se tiñeron con Coomassie azul brillante R-250 durante 30 minutos y luego en metanol y ácido acético durante 20 minutos. Las enzimas que degradan la gelatina se visualizaron como bandas blancas claras sobre un fondo azul, indicando proteólisis de la proteína del sustrato. Las muestras también se analizaron en presencia de 15 mM EDTA, lo que inhibió la actividad de la MMP. La masa molecular de la actividad gelatinolítica se determinó por comparación con un estándar de proteína PageRulerTM Prestained Protein Ladder (Fermentas Life Sciences, Burlington, ON, Canadá). Las bandas de actividad se identificaron como se describió anteriormente, según sus pesos moleculares (72 kDa: Pro-MMP-2; 66 kDa: intermedia-MMP-2). La actividad de la MMP se cuantificó mediante análisis de densitometría, utilizando el software Gene Tools, versión 3.06 (Syngene, Cambridge, Reino Unido)9,14,54.
Aislamiento y Análisis de ARN
Se homogeneizó un fragmento congelado de cada músculo y se aisló el ARN total con el reactivo Trizol (Invitrogen, Carlsbad, CA, EEUU), de acuerdo con las instrucciones del fabricante. El ARN extraído se disolvió en tris-HCl y ácido etileno-diamino tetracético (TE) (pH 7,6) y se cuantificó por espectrofotometría. La pureza se evaluó determinando la relación de absorbancia a 260 nm y a 280 nm55. La integridad del ARN fue confirmada por la inspección en gel de agarosa al 1% teñido con bromuro de etidio (Invitrogen, Carlsbad, CA, EEUU), bajo luz ultravioleta.
Transcripción Inversa
Se realizó una transcripción inversa de 1 µg de ARN para sintetizar el ADNc. Una mezcla de reacción de transcripción inversa (RT) que contiene 1 µg de ARN celular, buffer de transcripción inversa de 5x, una mezcla de dNTP (Promega, Madison, WI) con 0,2 mmol · L−1 cada uno de dATP, dCTP, dGTP y 0,1 mol · L−1 de dTTP, 1 µl de oligo (dT) primer (Invitrogen, Carlsbad, CA, EEUU) y 200U de enzima M-MLV RT (Promega, Madison, WI) se incubó a 70 °C durante 10 min, a 42 °C durante 60 min, y luego se calentó a 95 °C durante 10 min antes de enfriarse rápidamente en hielo19.
Primers Oligonucleótidos
Los primers oligonucleótidos fueron diseñados para GAPDH (AF106860) y Colágeno IV (colágeno tipo IV alfa-1 - J04694) usando Primer Express Software 2.0 (Applied Biosystems, Foster City, CA, EEUU). Los primers oligonucleótidos para COL1, COL3, TGFβ-1, CTGF y LOX fueron descritos de acuerdo con otro estudio49. Los primers oligonucleótidos se enumeran en la Tabla 1.
Tabla 1. Lista de primers oligonucleótidos.

COL-I: colágeno tipo I; COL-III: colágeno tipo III; TGF-β1, factor de crecimiento transformante beta-1; CTGF: factor de crecimiento del tejido conectivo; LOX: lisil-oxidasa; GAPDH: gliceraldehído-3-fosfato deshidrogenasa.
Análisis Cuantitativo de la Reacción en Cadena de la Polimerasa (qPCR)
La detección de ARNm para las diferentes muestras experimentales y de control se realizó en un instrumento Rotor Gene 3000 (Cobert's, Sydney, Australia). Las mezclas de amplificación contenían 1 μl de muestra de ADNc, 25 μl de tinte fluorescente verde SYBR, mezcla Master (Applied Biosystems, Foster City, CA, EEUU) y 180 nM de cada primer, para un volumen final de 50 μl. Las condiciones de ciclo térmico para COL-I, COL-III, COL-IV, TGF-β1, CTGF, LOX y GAPDH consistían en 10 min a 95 °C, 40 ciclos de 15 s cada uno a 94 °C y 30 s a 48 °C para COL-I, COL-III, COL-IV, TGF-β1, CTGF y LOX y 56 °C para GAPDH, seguidos de 1 min a 72 °C y luego 10 min a 72 °C. Para cada gen, todas las muestras se amplificaron simultáneamente por duplicado, en un análisis. Los datos se analizaron mediante el método comparativo del umbral de ciclo (Ct). Los genes diana se normalizaron con GAPDH8. Además, los controles negativos contenían ARN y ningún M-MLV RT, lo que garantizaba que el producto de la PCR no procedía de ADN genómico amplificado. También se realizó un blank, sin muestra de plantilla y utilizando únicamente agua, primers y SYBR verde56.
Análisis de Inmunofluorescencia
Se fijaron secciones transversales histológicas (10 μm) de los músculos SOL con 4% de paraformaldehído (Sigma P6148) en buffer fosfato (PB) de 0,2 M durante 10 min a temperatura ambiente, se bloquearon con glicina de 0,1 M en PB durante 5 min y se permeabilizaron en 0,2% de Tritón X-100-PB durante 10 min. A continuación, las secciones se incubaron en albúmina de suero bovino (BSA) al 1% durante 20 minutos a temperatura ambiente para bloquear la unión inespecífica, y se incubaron durante la noche con el anticuerpo primario (diluido en BSA al 1%) a 4 °C. Los portaobjetos se lavaron con 0,1 MPB (3 veces durante 10 minutos cada uno) y se incubaron con el anticuerpo secundario (diluido en BSA al 1%) durante 2 horas en una habitación oscura. Los portaobjetos se lavaron en 0,1 M PB (3 veces durante 10 minutos cada uno) y se montaron con el medio de montaje Vectashield que contiene 4,6-diamidino-2-fenilindole (nº de catálogo H-1200; Vector Laboratories)18. Las secciones de control negativas no se incubaron con el anticuerpo primario y los resultados experimentales sólo se consideraron si los controles no mostraron inmunorreactividad. Los anticuerpos primarios utilizados para la inmunotinción fueron el anti-colágeno I monoclonal para ratones (dilución 1:100, número de catálogo C2456; Sigma-Aldrich, St. Louis, MO, EEUU.), el anti-colágeno III monoclonal para ratones (dilución 1:100, número de catálogo C7805; Sigma-Aldrich, St. Louis, MO, EEUU.) y el anti-colágeno IV para conejos (dilución 1:200, número de catálogo AB-19808; Abcam, Cambridge, MA, EEUU.). El anticuerpo secundario fue Alexa Fluor 488 goat antimouse IgG, IgA, IgM (dilución 1:300, número de catálogo A10667; Molecular Probes, Eugene, OR, EEUU); y rhodamine red goat anti-rabbit IgG (dilución 1:200, número de catálogo Rb394; Molecular Probes, Eugene, OR, EEUU). Para las mediciones cuantitativas de inmunorreactividad (inmunofluorescencia), se tomaron imágenes de cinco regiones diferentes en el vientre medio del músculo SOL (Axiocam, Carl Zeiss, Jena, Alemania) con un aumento de 20x57. Las imágenes se cuantificaron usando el software de análisis ImageJ (NIH, Bethesda, MD, EEUU) y se expresaron como porcentaje (%) del área total18,56.
Análisis Estadístico
La prueba de Levene se aplicó para evaluar la homogeneidad de los resultados. Los resultados se expresan como media ± SEM. Se utilizaron pruebas paramétricas porque los datos se distribuían normalmente (prueba Shapiro-Wilk) con varianzas homogéneas. El análisis estadístico se realizó mediante un análisis de varianza unidireccional (ANOVA), seguido de la prueba post hoc de Bonferroni. La significancia se fijó en 5% (p ≤ 0,05).
Agradecimientos
Este estudio fue apoyado por la Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP; número de proceso: 08/03499-8 y número de proceso: 2011/11563-0). También agradecemos a la Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) por la beca postdoctoral (número de proceso CAPES 23038.039396/2008-19). Yara P. da Silva In memoriam (12 de enero de 2016).
Contribuciones de los Autores
Peviani Sabrina M. realizó los experimentos así como los datos analizados. Guzzoni Vinicius analizó los datos y escribió el manuscrito. Pinheiro-Dardis Clara M., Silva Yara P. da, Fioravante Alisson C.R., Sagawa Adriana H. y Delfino Gabriel B. realizaron los experimentos. Peviani Sabrina M., Durigan João L.Q. y Salvini Tania F. diseñaron la investigación, analizaron los datos y contribuyeron a la redacción del manuscrito.
Conflicto de Intereses
Los autores declaran que no existen intereses contrapuestos.
Referencias
1. Williams PE. (1988). Effect of intermittent stretch on immobilised muscle. Ann. Rheum. Dis. 1988;47:1014–6. doi: 10.1136/ard.47.12.1014.
2. Williams PE. (1990). Use of intermittent stretch in the prevention of serial sarcomere loss in immobilised muscle. Ann. Rheum. Dis. 1990;49:316–317. doi: 10.1136/ard.49.5.316.
3. Ikeda S, Yoshida A, Matayoshi S, Horinouchi K, Tanaka N. (2004). Induction of Myogenin Messenger Ribonucleic Acid in Rat Skeletal Muscle after 1 Hour of Passive Repetitive Stretching. Arch. Phys. Med. Rehabil. 2004;85:166–167. doi: 10.1016/S0003-9993(03)00406-4.
4. Gajdosik RL. (2001). Passive extensibility of skeletal muscle: Review of the literature with clinical implications. Clinical Biomechanics. 2001;16:87–101. doi: 10.1016/S0268-0033(00)00061-9.
5. Nakamura M, Ikezoe T, Takeno Y, Ichihashi N. (2011). Acute and prolonged effect of static stretching on the passive stiffness of the human gastrocnemius muscle tendon unit in vivo. J. Orthop. Res. 2011;29:1759–1763. doi: 10.1002/jor.21445.
6. Kamikawa, Y., Ikeda, S., Harada, K., Ohwatashi, A. & Yoshida, A. (2013). Passive repetitive stretching for a short duration within a week increases myogenic regulatory factors and myosin heavy chain mRNA in rats’ skeletal muscles. Sci. World J.
7. Gomes AR, et al. (2006). The effect of 30 minutes of passive stretch of the rat so leus muscle on the myogenic differentiation, myostatin, and atrogin-1 gene expressions. Arch. Phys. Med. Rehabil. 2006;87:241–246. doi: 10.1016/j.apmr.2005.08.126.
8. Peviani SM, Gomes ARS, Moreira RFC, Moriscot AS, Salvini TF. (2009). Short bouts of stretching increase myo-D, myostatin and atrogin-1 in rat soleus muscle. Muscle and Nerve. 2007;35:363–370. doi: 10.1002/mus.20695.
9. Peviani SM, Gomes ARS, De Araujo HSS, Salvini TF. (2009). MMP-2 is not altered by stretching in skeletal muscle. Int. J. Sports Med. 2009;30:550–554. doi: 10.1055/s-0029-1202342.
10. Loughna P, Goldspink G, Goldspink DF. (1986). Effect of inactivity and passive stretch on protein turnover in phasic and postural rat muscles. J. Appl. Physiol. 1986;61:173–9.doi: 10.1152/jappl.1986.61.1.173.
11. Goldspink, G., Williams, P. & Simpson, H. (2002). Gene expression in response to muscle stretch. Clin. Orthop. Relat. Res. S146–S152, 10.1097/01.blo.0000031972.69509.68
12. Freitas SR, Mil-Homens P. (2015). Effect of 8-Week High-Intensity Stretching Training on Biceps Femoris Architecture. J. Strength Cond. Res. 2015;29:1737–1740. doi: 10.1519/JSC.0000000000000800.
13. Zöllner, A. M., Abilez, O. J., Böl, M. & Kuhl, E. (2012). Stretching Skeletal Muscle: Chronic Muscle Lengthening through Sarcomerogenesis. Plos One7
14. Peviani SM, et al. (2010). Stretching and electrical stimulation regulate the metalloproteinase-2 in rat denervated skeletal muscle. Neurol. Res. 2010;32:891–896. doi: 10.1179/174313209X459093.
15. Kubo K, Kanehisa H, Fukunaga T. (2002). Effects of transient muscle contractions and stretching on the tendon structures in vivo. Acta Physiol. Scand. 2002;175:157–164. doi: 10.1046/j.1365-201X.2002.00976.x.
16. Cação-Benedini LO, Ribeiro PG, Prado CM, Chesca DL, Mattiello-Sverzut AC. (2014). Immobilization and therapeutic passive stretching generate thickening and increase the expression of laminin and dystrophin in skeletal muscle. Brazilian J. Med. Biol. Res. 2014;47:483–491. doi: 10.1590/1414-431X20143521.
17. Cornachione, A. S., Cação-Benedini, L. O., Benedini-Elias, P. C. O., Martinez, E. Z. & Mattiello-Sverzut, A. C. (2013). Effects of 40 min of maintained stretch on the soleus and plantaris muscles of rats applied for different periods of time after hindlimb immobilization. Acta Histochem., 10.1016/j.acthis.2012.11.008
18. Faturi FM, et al. (2016). Intermittent stretching induces fibrosis in denervated rat muscle. Muscle and Nerve. 2016;53:118–126. doi: 10.1002/mus.24702.
19. Russo TL, et al. (2010). Stretching and electrical stimulation reduce the accumulation of MyoD, myostatin and atrogin-1 in denervated rat skeletal muscle. J. Muscle Res. Cell Motil. 2010;31:45–57. doi: 10.1007/s10974-010-9203-z.
20. Gillies AR, Lieber B, Lieber RL. (2012). Structure and Function of the Skeletal Muscle Extracellular Matrix. Muscle Nerve. 2012;44:318–331.
21. Kragstrup TW, Kjaer M, Mackey AL. (2011). Structural, biochemical, cellular, and functional changes in skeletal muscle extracellular matrix with aging. Scandinavian Journal of Medicine and Science in Sports. 2011;21:749–757. doi: 10.1111/j.1600-0838.2011.01377.x.
22. Alameddine HS, Morgan JE. (2016). Matrix Metalloproteinases and Tissue Inhibitor of Metalloproteinases in Inflammation and Fibrosis of Skeletal Muscles. J. Neuromuscul. Dis. 2016;3:455–473. doi: 10.3233/JND-160183.
23. Kherif S, et al. (1999). Expression of matrix metalloproteinases 2 and 9 in regenerating skeletal muscle: a study in experimentally injured and mdx muscles. Dev. Biol. 1999;205:158–170. doi: 10.1006/dbio.1998.9107.
24. Verrecchia F, Chu ML, Mauviel A. (2001). Identification of Novel TGF-β/Smad Gene Targets in Dermal Fibroblasts using a Combined cDNA Microarray/Promoter Transactivation Approach. J. Biol. Chem. 2001;276:17058–17062. doi: 10.1074/jbc.M100754200.
25. Leask A, Holmes A, Abraham DJ. (2002). Connective tissue growth factor: a new and important player in the pathogenesis of fibrosis. Curr. Rheumatol. Rep. 2002;4:136–42. doi: 10.1007/s11926-002-0009-x.
26. Leask A, Abraham DJ. (2004). TGF-beta signaling and the fibrotic response. FASEB J. 2004;18:816–27. doi: 10.1096/fj.03-1273rev.
27. Mendias CL, et al. (2012). Transforming growth factor-beta induces skeletal muscle atrophy and fibrosis through the induction of atrogin-1 and scleraxis. Muscle and Nerve. 2012;45:55–59. doi: 10.1002/mus.22232.
28. Kagan HM, Li W. (2001). Lysyl oxidase: Properties, specificity, and biological roles inside and outside of the cell. J. Cell. Biochem. 2003;88:660–672. doi: 10.1002/jcb.10413.
29. Willems MET, Miller GR, Stauber WT. (2001). Force deficits after stretches of activated rat muscle-tendon complex with reduced collagen cross-linking. Eur. J. Appl. Physiol. 2001;85:405–411. doi: 10.1007/s004210100480.
30. Karpakka J, Vaananen K, Orava S, Takala TE. (2007). The effects of preimmobilization training and immobilization on collagen synthesis in rat skeletal muscle. Int. J. Sports Med. 1990;11:484–488. doi: 10.1055/s-2007-1024842.
31. Järvinen TAH, Józsa L, Kannus P, Järvinen TLN, Järvinen M. (2002). Organization and distribution of intramuscular connective tissue in normal and immobilized skeletal muscles. J. Muscle Res. Cell Motil. 2002;23:245–254. doi: 10.1023/A:1020904518336.
32. Williams PE, Catanese T, Lucey EG, Goldspink G. (1988). The importance of stretch and contractile activity in the prevention of connective tissue accumulation in muscle. J. Anat. 1988;158:109–14.
33. Mattiello-Sverzut AC, et al. (2006). Morphological effects of electrical stimulation and intermittent muscle stretch after immobilization in soleus muscle. Histol. Histopathol. 2006;21:957–964.
34. Zotz TG, et al. (2004). Acute effects of stretching exercise on the soleus muscle of female aged rats. Acta Histochem. 2016;118:1–9. doi: 10.1016/j.acthis.2015.10.004.
35. Gomes ARS, Coutinho EL, França CN, Polonio J, Salvini TF. (2004). Effect of one stretch a week applied to the immobilized soleus muscle on rat muscle fiber morphology. Brazilian J. Med. Biol. Res. 2004;37:1473–1480. doi: 10.1590/S0100-879X2004001000005.
36. Coutinho EL, Gomes ARS, França CN, Oishi J, Salvini TF. (2004). Effect of passive stretching on the immobilized soleus muscle fiber morphology. Brazilian J. Med. Biol. Res. 2004;37:1853–1861. doi: 10.1590/S0100-879X2004001200011.
37. Secchi KV, Morais CP, Cimatti PF, Tokars E, Gomes ARS. (2008). Effects of stretching and resistive exercise in rat skeletal muscle. Rev. Bras. Fisioter. 2008;12:228–234. doi: 10.1590/S1413-35552008000300011.
38. Riley DA, Van Dyke JM. (2012). The Effects of Active and Passive Stretching on Muscle Length. Phys. Med. Rehabil. Clin. N. Am. 2012;23:51–57. doi: 10.1016/j.pmr.2011.11.006.
39. Koskinen SOA, et al. (2002). Short-term effects of forced eccentric contractions on collagen synthesis and degradation in rat skeletal muscle. Pflugers Arch. 2002;444:59–72. doi: 10.1007/s00424-002-0792-2.
40. Singh A, Nelson-Moon ZL, Thomas GJ, Hunt NP, Lewis MP. (2000). Identification of matrix metalloproteinases and their tissue inhibitors type 1 and 2 in human masseter muscle. Arch. Oral Biol. 2000;45:431–440. doi: 10.1016/S0003-9969(00)00020-0.
41. Wu N, Jansen ED, Davidson JM. (2003). Comparison of Mouse Matrix Metalloproteinase 13 Expression in Free-Electron Laser and Scalpel Incisions during Wound Healing. J. Invest. Dermatol. 2003;121:926–932. doi: 10.1046/j.1523-1747.2003.12497.x.
42. Li H, et al. (2009). Tumor Necrosis Factor-related Weak Inducer of Apoptosis Augments Matrix Metalloproteinase 9 (MMP-9) Production in Skeletal Muscle through the Activation of Nuclear Factor-κB-inducing Kinase and p38 Mitogen-activated Protein Kinase. J. Biol. Chem. 2009;284:4439–4450. doi: 10.1074/jbc.M805546200.
43. Li H, Mittal A, Makonchuk DY, Bhatnagar S, Kumar A. (2009). Matrix metalloproteinase-9 inhibition ameliorates pathogenesis and improves skeletal muscle regeneration in muscular dystrophy. Hum. Mol. Genet. 2009;18:2584–2598. doi: 10.1093/hmg/ddp191.
44. Coutinho EL, DeLuca C, Salvini TF, Vidal BC. (2006). Bouts of passive stretching after immobilization of the rat soleus muscle increase collagen macromolecular organization and muscle fiber area. Connect. Tissue Res. 2006;47:278–286. doi: 10.1080/03008200600995940.
45. Schild C, Trueb B. (2002). Mechanical Stress Is Required for High-Level Expression of Connective Tissue Growth Factor. Exp. Cell Res. 2002;274:83–91. doi: 10.1006/excr.2001.5458.
46. Perrone CE, Fenwick-Smith D, Vandenburgh HH. (1995). Collagen and stretch modulate autocrine secretion of insulin-like growth factor-1 and insulin-like growth factor binding proteins from differentiated skeletal muscle cells. J. Biol. Chem. 1995;270:2099–2106. doi: 10.1074/jbc.270.5.2099.
47. Burks TN, Cohn RD. (2011). Role of TGF-β signaling in inherited and acquired myopathies. Skelet. Muscle. 2011;1:19. doi: 10.1186/2044-5040-1-19.
48. Bouffard NA, et al. (2008). Tissue stretch decreases soluble TGF-β1 and type-1 procollagen in mouse subcutaneous connective tissue: Evidence from ex vivo and in vivo models. J. Cell. Physiol. 2008;214:389–395. doi: 10.1002/jcp.21209.
49. Heinemeier KM, et al. (2007). Expression of collagen and related growth factors in rat tendon and skeletal muscle in response to specific contraction types. J. Physiol. 2007;582:1303–1316. doi: 10.1113/jphysiol.2007.127639.
50. Koskinen SO, et al. (2001). Acute exercise induced changes in rat skeletal muscle mRNAs and proteins regulating type IV collagen content. Am. J. Physiol. Regul. Integr. Comp. Physiol. 2001;280:R1292–R1300. doi: 10.1152/ajpregu.2001.280.5.R1292.
51. Williams PE, Goldspink G. (1971). Longitudinal Growth of Striated Muscle Fibres. J. Cell Sci. 1971;9:751–767.
52. Goldspink G, Goldspink G. (1968). Sarcomere Length during Post-Natal Growth of Mammalian Muscle Fibres. J. Cell Sci. 1968;3:539.
53. Williams PE, Goldspink G. (1978). Changes in sarcomere length and physiological properties in immobilized muscle. J. Anat. 1978;127:459–468.
54. Guzzoni V, et al. (2016). Reduced collagen accumulation and augmented MMP-2 activity in left ventricle of old rats submitted to high-intensity resistance training. J. Appl. Physiol. 2017;123:655–663. doi: 10.1152/japplphysiol.01090.
55. Durigan JLQ, et al. (2014). Neuromuscular electrical stimulation alters gene expression and delays quadriceps muscle atrophy of rats after anterior cruciate ligament transection. Muscle Nerve. 2014;49:120–8. doi: 10.1002/mus.23883.
56. Durigan JLQ, et al. (2014). Neuromuscular Electrical Stimulation Induces Beneficial Adaptations in the Extracellular Matrix of Quadriceps Muscle After Anterior Cruciate Ligament Transection of Rats. Am. J. Phys. Med. Rehabil. 2014;93:948–961. doi: 10.1097/PHM.0000000000000110.
57. Vieira Ramos, G. et al. (2016). Cryotherapy reduces inflammatory response without altering muscle regeneration process and extracellular matrix remodeling of rat muscle. Sci. Rep. 6
Cita en PubliCE
Sabrina M. Peviani, Vinicius Guzzoni, Clara M. Pinheiro-Dardis, Yara P. da Silva, Alisson C. R. Fioravante, Adriana H. Sagawa, Gabriel B. Delfino, João L. Q. Durigan Tania F. Salvini (2019). Regulación de los Elementos de la Matriz Extracelular y la Sarcomerogénesis en Respuesta a Diferentes Períodos de Estiramiento Pasivo en el Músculo Sóleo de las Ratas. .https://g-se.com/regulacion-de-los-elementos-de-la-matriz-extracelular-y-la-sarcomerogenesis-en-respuesta-a-diferentes-periodos-de-estiramiento-pasivo-en-el-musculo-soleo-de-las-ratas-2531-sa-p5cd5dae782114
