Entrenamiento del Intestino para Atletas
Asker E. Jeukendrup1 School of Sport, Exercise and Health Sciences, Loughborough University, Ashby Road, Loughborough, Leicestershire LE11 3TU, UK
Resumen
El tracto gastrointestinal (GI) desempeña un papel fundamental en el aporte de carbohidratos y líquidos durante el ejercicio prolongado y por lo tanto, puede ser un determinante fundamental del rendimiento. La incidencia de problemas GI en los atletas que participan en eventos de resistencia es elevada, lo que indica que la función GI no siempre es óptima en esas condiciones. Una cantidad sustancial de pruebas sugiere que el sistema GI es altamente adaptable. Tanto el vaciamiento gástrico como el confort estomacal pueden ser "entrenados" y también es posible disminuir la percepción de plenitud; algunos estudios han sugerido que pueden producirse incrementos de nutrientes específicos en el vaciamiento gástrico. La evidencia también demuestra que la dieta tiene un impacto en la capacidad del intestino para absorber nutrientes. Nuevamente, las adaptaciones que se producen parecen ser nutriente específicas. Por ejemplo, una dieta alta en carbohidratos produce un incremento en la densidad de los transportadores de glucosa dependientes de sodio 1 (SGLT1) en el intestino y en la actividad del transportador, lo que permite una mayor absorción y oxidación de carbohidratos durante el ejercicio. También es probable que, cuando se producen tales adaptaciones disminuyen las posibilidades de padecer incomodidad gastrointestinal. Los estudios futuros deberían incluir mas estudios realizados en seres humanos y deberían enfocarse en una serie de áreas, entre las que se incluyen los métodos más efectivos para inducir adaptaciones intestinales y la evolución en el tiempo de las adaptaciones. Para desarrollar estrategias eficaces es importante una mejor comprensión de los mecanismos precisos que son los responsables de estas adaptaciones. Está claro que el "entrenamiento nutricional" puede mejorar el vaciamiento gástrico y la absorción, y probablemente podría reducir las posibilidades y/o la gravedad de los problemas gastrointestinales, mejorando así el rendimiento de resistencia y proporcionando una mejor experiencia para el atleta. El intestino es un órgano importante para los atletas de resistencia y debe ser entrenado para las condiciones en las que deberá funcionar de manera óptima.
1 Entrenamiento del intestino
Frecuentemente los atletas subestiman la importancia del tracto gastrointestinal (GI). El suministro de fluidos exógenos y de fuentes de carbohidratos puede ser fundamental para el rendimiento, especialmente durante el ejercicio prolongado [1]. Además, los síntomas gastrointestinales como hinchazón, calambres, diarrea y vómitos son comunes en muchos deportes, especialmente en los deportes de resistencia [2]. Sin un buen funcionamiento del sistema gastrointestinal, se verá afectada la entrega de nutrientes y se producirán una amplia gama de síntomas gastrointestinales. Claramente, el tracto intestinal es altamente adaptable, y se ha sugerido que el entrenamiento selectivo del tracto intestinal puede mejorar el suministro de nutrientes durante el ejercicio y al mismo tiempo puede aliviar algunos (o todos) los síntomas [3]. Este tipo de entrenamiento, a veces llamado "entrenamiento del intestino", ha recibido relativamente poca atención en la literatura y, hasta donde yo sé, no hay artículos de revisión sobre este tema. Proporciono una visión más detallada de la evidencia que sostiene que el sistema GI puede ser adaptado a través del entrenamiento nutricional.
2 Vaciamiento gástrico y "Entrenamiento del estómago"
El vaciamiento gástrico es un paso fundamental para la liberación de carbohidratos y fluidos exógenos hacia el músculo activo. Anecdóticamente, los atletas se quejan de que los fluidos se acumulan en el estómago y de que padecen una sensación de hinchazón, especialmente durante los ejercicios de alta intensidad [4] o ejercicios muy prolongados en condiciones de calor. La deshidratación puede favorecer este fenómeno y empeorar los síntomas [4, 5]. La evidencia anecdótica también demuestra que el estómago puede adaptarse al consumo de grandes volúmenes de líquido, sólidos o a combinaciones de ambos. Por ejemplo, se sabe que los concursantes experimentados de competencias de alimentación "entrenan" sus estómagos para que puedan contener grandes volúmenes de comida con menos molestias y, mediante entrenamiento regular, son capaces de comer volúmenes de comida en un pequeño lapso de tiempo que son impensables para un individuo promedio no entrenado El récord actual de todos los tiempos es de 69 hot dogs (con pan) en 10 min. Para lograr esto, los comedores competitivos entrenan usando una variedad de métodos: masticar grandes trozos de goma de mascar durante largos períodos de tiempo o experimentan una distensión estomacal bebiendo líquidos o comiendo los alimentos que deberán consumir en la competencia. Incrementan los volúmenes progresivamente, y demoran varias semanas en alcanzar un nivel en el que puedan ser competitivos. Esto demuestra la adaptabilidad del estómago. Realizar este "entrenamiento estomacal" tiene dos efectos principales: (1) el estómago puede expandirse y contener más alimentos y (2) el hay una mayor tolerancia al estómago lleno por lo que no se percibe como tan lleno. Ambos aspectos podrían ser relevantes para una situación de ejercicio.
Las pautas actuales recomiendan la ingesta de líquidos durante el ejercicio para evitar padecer deshidratación del 2% (2% del peso corporal). La ingesta de líquidos recomendada puede ser sustancial, especialmente en atletas entrenados y en condiciones calurosas donde las tasas de sudor son altas. Estas grandes ingestas pueden causar incomodidad y en algunos casos problemas GI. Por lo tanto, los atletas generalmente deben manejar de manera simultánea el confort GI, la hidratación y el suministro de carbohidratos. Junto con otros autores hemos recomendado realizar entrenamiento para estas elevadas ingestas con el objetivo de reducir la incomodidad y la posibilidad de alteraciones GI [3, 6, 7]. Sin embargo, muy pocos estudios han investigado directamente los efectos del "entrenamiento nutricional del estómago".
Lambert et al. [8] demostraron que los corredores entrenados eran capaces de tolerar cómodamente la ingesta de una solución de carbohidratos y electrolitos a una velocidad aproximadamente igual a su tasa de sudor durante 90 minutos de entrenamiento con un consumo de oxígeno máximo del 65% (VO2max) a ~ 25 ºC, 30% de humedad relativa (HR). Curiosamente, observaron que el confort estomacal mejoró significativamente con el tiempo al practicar estas altas ingestas. Debemos señalar que este mayor confort se produjo sin cambios mensurables en la tasa de vaciado gástrico [8]. Quizás el estómago se adaptó mediante la extensión de las paredes para permitir un mayor espacio para el líquido. Esto probablemente reduciría el malestar estomacal y reduciría el estímulo para un vaciado gástrico más rápido. El entrenamiento para el consumo de volúmenes mayores podría ser una estrategia eficaz para evitar estos problemas en las competencias, particularmente para los atletas que experimentan incomodidad GI aún cuando ingieren volúmenes relativamente pequeños.
Los estudios también han demostrado que el vaciamiento gástrico de los carbohidratos puede acelerarse aumentando la ingesta dietética de ese carbohidrato. Cunningham et al. [9] suplementaron la dieta de dos grupos de voluntarios con 400 g de glucosa por día durante 3 días. El tiempo medio de vaciado (t1/2) en el test de prueba de alimentación con glucosa fue significativamente más rápido después de que la dieta estándar había sido suplementada con glucosa en comparación con la dieta estándar sola (mediana 20,7 min [rango 4,6-36,8] vs 29,1 [rango 19,8-38,4 ]). Notablemente, el vaciado gástrico de una bebida proteica se mantuvo sin cambios (mediana 18,0 min [rango 12,5-23,6] frente a 16,1 [rango 9,6-22,7]). Los autores concluyeron que es posible que se produzca adaptación rápida y específica de los mecanismos reguladores del intestino delgado para el vaciamiento gástrico de soluciones nutritivas en respuesta a aumentos en la carga dietaria. Otro estudio demostró que la suplementación de una dieta estándar con 440 g de glucosa por día durante 4-7 días aceleró el vaciamiento gástrico tanto de glucosa como de fructosa (t1/2 82 ± 8 vs 106 ± 10 min para la glucosa y 73 ± 9 vs 106 ± 9 min para fructosa) [10]. Las concentraciones plasmáticas del péptidos insulinotrópico dependiente de glucosa (GIP) fueron mayores con la dieta suplementada con glucosa; lo que llevó a los autores a concluir que el vaciamiento gástrico de glucosa y fructosa se aceleró probablemente como resultado de una reducción de la inhibición por retroalimentación de los receptores del lumen intestinal [10].
Un estudio demostró que la ingesta diaria de 120 g de fructosa durante 3 días aceleró el vaciamiento gástrico de fructosa pero no el de glucosa [11]. Aparentemente la duración relativamente corta de la manipulación dietética (3 días) fue suficiente para provocar adaptaciones en el vaciamiento gástrico.
Tales observaciones no son específicas para los carbohidratos. Los estudios han demostrado que una dieta rica en grasas estimuló el vaciamiento gástrico. Cunningham et al. [12] demostraron que el vaciamiento gástrico de un test de alimentación se aceleró después de 7 días de una dieta con alto contenido de grasa (258 g/día). Las reducciones en t1/2 de una comida de prueba en respuesta a la intervención se volvieron estadísticamente significativas después de 14 días. Tendencias similares se observaron después de 4 días, pero las mismas no alcanzaron la significación estadística, lo que sugiere que las adaptaciones a la grasa en la dieta pueden ser más lentas que las respuestas a los carbohidratos. Castiglione et al. [13] demostraron una adaptación similar después de 14 días de una dieta rica en grasas e informaron que estos efectos eran altamente específicos para las grasas y que una comida de carbohidratos se vaciaba a la misma velocidad antes y después de una dieta rica en grasas.
Las adaptaciones pueden ser probablemente explicadas a través de la desensibilización de los receptores de nutrientes y de una menor inhibición por retroalimentación del vaciamiento gástrico. Sin embargo, también es posible que el aumento de la absorción provoque una reducción en la exposición de los receptores a los nutrientes. Las secciones 6 y 7 aportan evidencia de una mayor absorción de nutrientes en respuesta a los cambios en la dieta.
2.1 Entrenamiento del Estómago: Resumen
Algunos estudios han demostrado claramente que los desafíos nutricionales específicos producen adaptaciones del vaciamiento gástrico específicas de ese desafío. Por ejemplo, el aumento de la ingesta de glucosa en la dieta aumenta el vaciamiento gástrico de la glucosa, pero no de las proteínas, y el aumento en la ingesta de grasas produce un vaciamiento gástrico más rápido de las grasas, pero no de los carbohidratos. Muy pocos estudios han entrenado específicamente el intestino para mejorar la tolerancia y el vaciamiento gástrico durante el ejercicio, pero los resultados generalmente parecen prometedores. Se han observado efectos después de 3 días de la modificación dietética.
3 Transporte Intestinal de Azúcares
Una vez que el estomago se vacía, la mayor parte de la absorción de líquidos y azúcares se realiza en el duodeno y en el yeyuno. La glucosa y la galactosa son transportadas a través de la membrana luminal de los enterocitos por el transportador de glucosa dependiente de sodio (SGLT) -1 (Figura 1).
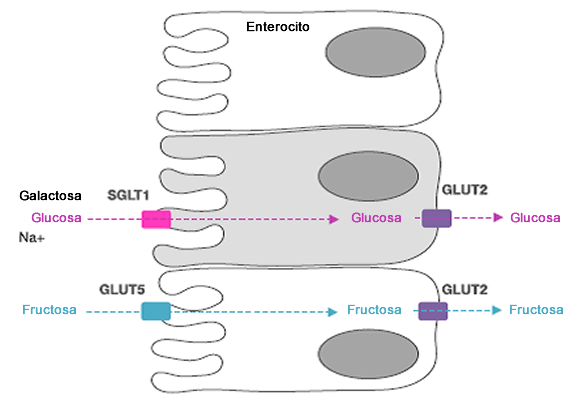
Figura 1. Absorción de glucosa y fructosa. La glucosa y la fructosa se absorben desde la luz intestinal (a la izquierda) a través del enterocito (membrana luminal y basolateral) hacia la sangre (a la derecha), a través de diferentes vías que implican SGLT1 y GLUT5, respectivamente. SGLT1= transportador de glucosa sodio-dependiente 1, GLUT5= transportador de glucosa 5 (transportador de fructosa), GLUT2= transportador de glucosa 2
3.1 Transportador de glucosa dependiente de sodio (SGLT)-1
La absorción de glucosa (y galactosa) se acopla con el transporte de sodio y el gradiente electroquímico asociado. Una bomba Na/K+ ATP-asa, localizada en la membrana basolateral, es la responsable de mantener el gradiente electroquímico. Se ha sugerido que el transportador de glucosa (GLUT)-2, otro de los transportadores, puede ser expresado en la membrana luminal cuando altas concentraciones de glucosa están presentes en el lumen [14, 15]. Esta teoría de facilidad adicional de transporte de glucosa sigue siendo controversial, y generalmente se cree que SGLT1 es el responsable de la mayor parte de la absorción de azúcares provenientes de la dieta [16].
En la mayoría de los estudios realizados con mamíferos, se ha observado que SGLT1 se expresa en el borde en cepillo de los enterocitos [17-21]. Los niveles de expresión suelen ser más altos en el yeyuno, seguidos por el duodeno y el íleon [22]. SGLT1 no se expresa en el intestino grueso [22].
3.2 Transportador de Glucosa (GLUT) -5
La fructosa utiliza un transportador diferente (GLUT-5) al de la glucosa que no depende del sodio y es altamente específico para la fructosa. La regulación de GLUT-5 es más rápida que la regulación de SGLT1. Los cambios en el transporte de fructosa son generalmente simultáneos a cambios similares en ARNm mensajeros de GLUT5 (mRNA) y a la abundancia de proteínas. En ratas, el RNAm de GLUT5 se duplica dentro de las 3 h después de la perfusión intestinal con una solución de fructosa [23]. Hay que señalar que estos efectos sólo se han demostrado en ingestas anormalmente altas de fructosa (al menos el 30% de la energía en la dieta proveniente de fructosa, mientras que una ingesta típica en la dieta occidental es de alrededor del 9%).
3.3 GLUT2
Para ir desde el enterocito hacia la circulación sistémica, los azúcares deben atravesar la membrana basolateral. Los tres monosacáridos utilizan el transportador bidireccional GLUT2, que también es independiente de sodio. Se cree que la capacidad de GLUT2 para transportar glucosa a través de un gradiente de concentración es muy grande [14, 15].
3.4 Otros transportadores
Hay poca evidencia de la existencia de otros transportadores de carbohidratos además de SGLT1 y GLUT5 en la membrana luminal y GLUT2 en la membrana basolateral. Se han sugerido otros transportadores pero aparentemente, en caso de que existan, serían poco importantes para el transporte de carbohidratos desde un punto de vista cuantitativo. Dado que GLUT2 no parece ser limitante, me centraré principalmente en SGLT1 y GLUT5.
4 Transportadores de carbohidratos y transporte de glucosa durante el ejercicio
La regulación de las proteínas de transporte de carbohidratos es esencial para la provisión de glucosa al cuerpo en condiciones de reposo. Además, durante el ejercicio, cuando la administración exógena de carbohidratos puede ser importante para el rendimiento, los transportadores serán los responsables de la administración de glucosa al músculo activo. Los estudios realizados durante ejercicios han proporcionado evidencia indirecta pero sólida de que la liberación de carbohidratos está limitada por la capacidad de transporte de SGLT1 (para revisiones, ver Jeukendrup [1, 6, 7] y Jeukendrup y McLaughlin [3]). Una revisión reciente basada principalmente en mediciones más directas realizadas en animales también concluyó que el intestino tiene la capacidad de absorber glucosa a través de los niveles basales de SGLT1, pero que esta capacidad se vuelve limitada cuando los carbohidratos en la dieta superan un cierto nivel [24].
En tasas de ingesta superiores a 60-70 gramos de carbohidratos por hora (glucosa, sacarosa, maltosa, maltodextrina, almidón), la oxidación de carbohidratos exógenos alcanza un máximo en una velocidad de alrededor de 60 g/h (Figura 2) [1, 3, 6, 7]. Incluso una ingesta a 144/h [25] o 180 g/h [26] no aumentó las tasas de oxidación exógena de carbohidratos muy por encima de 60 g/h. Debido a que esta limitación no fue causada por el vaciamiento gástrico, el consumo de glucosa muscular, o el almacenamiento de glucógeno hepático, los autores dedujeron que la absorción tenía que ser el factor limitante [27]. Cuando se ingirió fructosa además de grandes cantidades de glucosa, las tasas de oxidación de carbohidratos se elevaron por encima de 60 g/h [28]. Estos estudios sugieren fuertemente que el transporte de glucosa a través de la célula epitelial es el factor limitante, y que se habría alcanzado la máxima capacidad de transporte de SGLT1 [29]. Debido a que también habría una relación dosis-respuesta entre la ingesta de carbohidratos y el rendimiento [30-32], y a que probablemente una disminución de la capacidad del intestino junto con una mayor ingesta de carbohidratos pueda provocar alteraciones GI [2], continúa la búsqueda de la forma de aumentar la capacidad de absorción de carbohidratos.
Se ha propuesto que el entrenamiento del intestino sería una forma de aumentar la cantidad y/o la actividad de los transportadores SGLT1, pero la evidencia en los seres humanos hasta el momento es limitada [6].
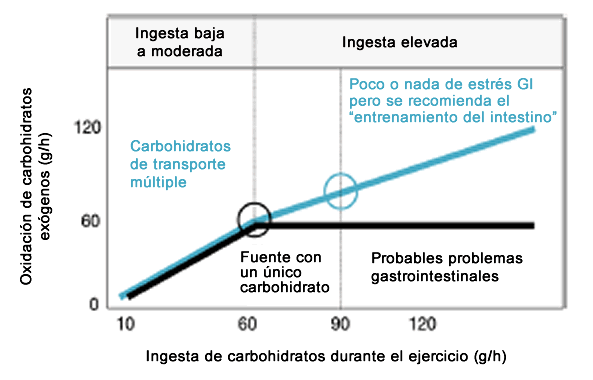
Figura 2. Esquema de la oxidación de carbohidratos exógenos a partir de un único carbohidrato (negro) y carbohidratos de transporte múltiple (azul), realizado en base a datos presentados en otros trabajos [3, 7, 51, 52]. Está claro que se pueden conseguir mayores tasas de oxidación con carbohidratos de transporte múltiple, especialmente con altas ingestas. En ingestas de hasta 60 g/h, no hay diferencia entre los carbohidratos de transporte individual y los de transporte múltiple, pero cuando la ingesta aumenta por encima de 60 g/h y el transportador de glucosa dependiente de sodio1 (SGLT1) se satura, la fructosa añadida producirá mayores tasas de oxidación de carbohidratos exógenos. La ingesta recomendada de carbohidratos de transporte simple y múltiple se indica con un círculo. Si las fuentes con un solo carbohidrato son ingeridas a tasas superiores a 60 g/h, es probable que se presenten problemas gastrointestinales. Con carbohidratos de transporte múltiple, se han observado menos síntomas, pero se recomienda "entrenar el intestino" (y acostumbrarse a las altas ingestas).
Utilizando una técnica de perfusión segmentaria, Shi et al. [33] observaron una estrecha relación entre la absorción de agua y absorción de solutos en el duodeno-yeyuno, especialmente cuando están presentes múltiples sustratos transportables (es decir, glucosa, sacarosa, glicina, Na+). Confirmamos esta observación en estudios realizados con seres humanos durante el ejercicio: los carbohidratos de transporte múltiple aumentan la absorción y la oxidación de carbohidratos y esto se asocia con un aumento en la absorción de líquidos [34]. Por lo tanto, otro beneficio de aumentar la capacidad de transporte de carbohidratos es que probablemente también se mejore la ingesta de líquidos (para una ingesta dada de carbohidratos). La mejora de la absorción de líquidos puede ayudar a prevenir la deshidratación (y la reducción del rendimiento inducida por deshidratación), pero una absorción más completa también podría reducir las posibilidades de sufrir incomodidad GI [2].
Para plantear y elaborar recomendaciones prácticas, es importante comprender la regulación del transporte intestinal de glucosa. Por lo tanto, a continuación discutiré la regulación mas detalladamente antes de aportar sugerencias para las implicancias prácticas.
5 Regulación del Transporte de Glucosa Intestinal
Se ha demostrado que la regulación de la absorción de glucosa está directamente relacionada con la expresión de la proteína SGLT1. Bob Crane propuso la existencia de un cotransporte de Na+/glucosa en 1960 en el Simposio sobre Transporte de Membranas y Metabolismo realizado en Praga [35], pero el transportador real no fue identificado hasta los años ochenta [36]. Estudios realizados en los años 60 también observaron que la ingesta de carbohidratos en la dieta podía influir en la capacidad de absorber glucosa [37]. En 1983, se demostró que los transportadores intestinales eran estimulados o inhibidos en función de la composición de la dieta [38]. Al menos en ratas, parece que los cambios en la dieta no tienen que ser extremos para poder observar los efectos sobre la absorción, y estos efectos se han observado no sólo para los azúcares, sino también para aminoácidos [38]. Aumentos en la absorción se han observado en tan sólo 0,5 días en ratas [38]. Además se observó que las enzimas digestivas eran reguladas hacia el alza en respuesta a la composición dietética. Por ejemplo, Deren et al. [39] demostraron en 1967 que las ratas que habían ayunado durante 3 días experimentaron aumentos de cuatro veces en la actividad de la sacarasa y la maltasa en respuesta a una dieta de sacarosa en comparación con una dieta con caseína [39]. Esto se correlacionó con aumentos en la hidrólisis de sacarosa y en la absorción de fructosa.
Cuando en los años ochenta se identificaron los transportadores de azúcares en el intestino, los estudios comenzaron a medir los cambios en el contenido y en la actividad de SGLT1 en respuesta a la dieta. Varios modelos con roedores [18, 40] permitieron demostrar que tanto la actividad como la abundancia de SGLT1 están reguladas por la ingesta de carbohidratos en la dieta. Está claro que la proteína SGLT1 responde a las concentraciones de glucosa en el lumen. Sin embargo, se observó el mismo nivel de estimulación de SGLT1 cuando se utilizaron análogos de glucosa para los cuales la membrana era impermeable [41], lo que sugiere que un sensor de glucosa detecta glucosa o sus análogos, y desencadena la regulación por incremento de los transportadores SGLT1.
5.1 Mecanismo de detección
Se ha demostrado que células especializadas (células L y células K) de la membrana luminal intestinal expresan células receptoras de sabor. En particular, se ha demostrado que los receptores T1R2 y T1R3 detectan el sabor dulce. Las células T1R2 y T1R3 están acopladas a través de una proteína G (alfa-gustducina) con una cascada de eventos celulares descendentes que finalmente conducen a una regulación por incremento de SGLT1. En las siguientes secciones se ofrece un análisis más detallado de las vías potenciales involucradas.
5.2 Edulcorantes y otros análogos
SGLT1 es estimulado en respuesta, no sólo, frente los carbohidratos de la dieta sino que también frente a los edulcorantes. Margolskee et al. [17] confirmaron hallazgos previos de que la expresión de proteína SGLT1 en ratones de tipo salvaje que consumían una dieta suplementada con carbohidratos casi se duplicaba en comparación con ratones que recibían una dieta baja en carbohidratos. Sin embargo, la expresión de SGLT1 también se duplicó cuando la dieta baja en carbohidratos era suplementada con los edulcorantes sucralosa, acesulfame K o sacarina, pero no cuando se suplementaba con aspartame. La observación de que el aspartame no tenía ningún efecto no es sorprendente porque se sabe que los ratones no perciben el aspartame como dulce.
5.3 Otros componentes dietéticos que regulan el transporte intestinal de glucosa
Una serie de componentes de la dieta han sido relacionados con la regulación del transporte de glucosa. El consumo de cloruro de sodio parece modular el transporte intestinal de glucosa. Los estudios sugieren que la concentración luminal crónicamente elevada de glucosa y sodio produce una mayor expresión de la proteína SGLT1 [42]. Todavía permanecen sin respuesta muchas preguntas sobre los mecanismos que intervienen y si los efectos del sodio y de la glucosa son aditivos [43].
La fibra dietética es otro componente con efectos potenciales, pero los estudios no han sido concluyentes: algunos estudios observaron una disminución, algunos no observaron cambios y otros observaron un aumento en el transporte intestinal de glucosa con el aumento de la ingesta de fibra dietética. Fibra es un término amplio utilizado para describir características muy diferentes, y las fibras pueden tener efectos sobre el vaciamiento gástrico, la motilidad y la composición y estructura del tracto intestinal. Por lo tanto, no es sorprendente que los resultados de los estudios no hayan sido concluyentes.
A mi leal saber y entender, ningún estudio realizado con humanos ha investigado los efectos de los constituyentes de la dieta en la absorción intestinal de glucosa. Por lo tanto, debido a la ausencia de resultados, sería prematuro sugerir recomendaciones serias.
5.4 Mecanismos Moleculares
La proteína SGLT1 experimenta una regulación por incremento en respuesta a una serie de estímulos, entre los que se incluyen, aunque no se limitan, la glucosa y galactosa: la 3-o-metilglucosa (sustrato no metabolizable de SGLT1) y fructosa (no es sustrato de la SGLT1). La regulación por incremento de la proteína SGLT1 depende de la disponibilidad de estos azúcares, pero el metabolismo de estos azúcares no es necesario. El hecho de que la expresión de SGLT1 responda a los análogos de glucosa y azúcares no transportados por SGLT1 sugiere que hay un receptor separado que detecta estos análogos de glucosa.
Los estudios han sugerido que la regulación por incremento mediada por azúcar de SGLT1 probablemente implique una vía de segundos mensajeros acoplada a proteína G [41, 44] (Figura 3]. Más recientemente, se demostró en ratones que tanto T1R3 como la gustducina se expresan en células endócrinas del intestino y son necesarias para la expresión de SGLT1 in vivo, en respuesta a los azúcares o edulcorantes presentes en el lumen [17]. Por otra parte, la SGLT1se expresa en los enterocitos (Figura 3). Esto significa que debe existir un evento de señalización entre las células endocrinas del intestino que son quimiosensibles y los enterocitos que absorben. Se sabe que las células endócrinas del intestino pueden secretar hormonas endocrinas tales como colecistoquinina (CCK), péptido tirosina tirosina (PYY), neurotensina, péptido tipo glucagón (GLP)-1, GLP-2 y GIP. Las incretinas GLP-1 y GIP son secretadas en respuesta a los azúcares dietéticos e intervienen en el transporte, el metabolismo y la homeostasis de la glucosa. Shirazi-Beechey et al. [24] describieron una posible vía de regulación. Los receptores de dulce T1R2+T1R3, expresados en la membrana luminal de las células endocrinas con vellosidades, detectan la concentración luminal de glucosa. Cuando esta concentración de glucosa alcanza un umbral, se activa una cascada de señalización en células endocrinas que involucra los receptores T1R2+ T1R3, la gustducina y otros elementos de señalización. Esto provoca la secreción de GLP-1, GLP-2 y GIP. La unión de GLP-2 a su receptor en las neuronas entéricas provoca un potencial de acción. Este estímulo se transmite a regiones subepiteliales a través de proyecciones axonales. Esto evocará la liberación de un neuropéptido en los enterocitos de absorción. La unión de este neuropéptido a su receptor produce un aumento de las concentraciones intracelulares de adenosin monofosfato cíclico (cAMP), aumentando así la estabilidad del mRNA de SGLT1 y aumentando la concentración de proteína SGLT1.
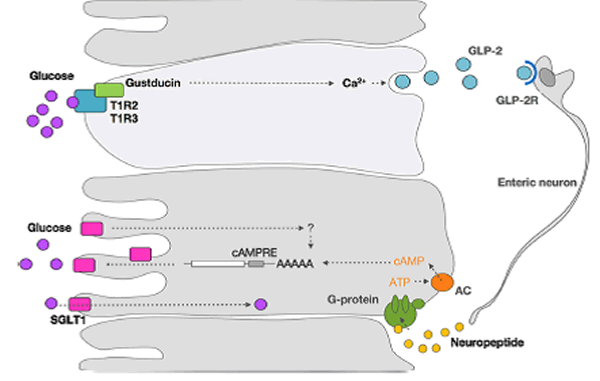
Figura 3. Mecanismo propuesto para la regulación por incremento de la proteína transportadora de glucosa dependiente de sodio 1 (SGLT1). Los receptores de sabor dulce T1R2+ T1R3, expresados en la membrana luminal de las células endocrinas con vellosidades, detectan la concentración luminal de glucosa. Cuando esta concentración de glucosa alcanza un umbral, activa una cascada de señalización en las células endocrinas que involucra los receptores T1R2+ T1R3, gustducina, y otros elementos de señalización. Esto producirá la secreción de GLP-1, GLP-2 y GIP. La unión de GLP-2 a su receptor GLP-2R en las neuronas entéricas provoca un potencial de acción. Este estímulo, a su vez, se transmite a las regiones subepiteliales por proyecciones axonales, que evocarán la liberación de un neuropéptido en los enterocitos encargados de la absorción. La unión de este neuropéptido a su receptor aumenta las concentraciones de cAMP intracelular, y aumenta de este modo la estabilidad del mRNA de SGLT1 y la concentración de proteína SGLT1.
Abreviaturas: AAAAA=Cadena de aminoácidos, AC= Adenilato ciclasa, AMPc=AMP cíclico, cAMPRE= Elemento de respuesta a AMP cíclico, GIP=Péptido insulinotrópico dependiente de glucosa, GLP=Péptido tipo glucagón, GLP-2R= Receptor para GLP-2, ARNm=ARN mensajero, SGLT1= Transportador de glucosa dependiente de sodio 1, T1R2+ T1R3= Receptor de sabores formado por un dímero de las proteínas T1R2 y T1R3. Adaptado de Shirazi-Beechey et al. [24] con autorización.
Se ha demostrado que GIP regula directamente SGLT1 y aumenta la absorción en el yeyuno del ratón. A su vez, el aumento de la absorción de glucosa también ejerce un efecto en la secreción de GIP [45]. Estudios recientes han demostrado que el bloqueo del receptor GIP tiene efectos marcados en la expresión de SGLT1, lo que sugiere que GIP desempeña un papel importante en la regulación por incremento de SGLT1 [46].
Varios aspectos de este mecanismo aún no han sido demostrados, y algunos aspectos han sido discutidos [16], pero no quedan dudas de que de alguna manera se detecta la glucosa luminal y, a través de una cascada de señalización, se incrementan los niveles de la función de la proteína SGLT1.
5.5 Evolución en el tiempo
En ratones, la expresión de la proteína intestinal SGLT1 en las vesículas con membranas de ribete en cepillo en el intestino delgado aumentó 1,9 veces después de 2 semanas de una dieta alta en carbohidratos [17]. En un estudio realizado en caballos, que se cree que tienen una adaptación lenta frente al aumento de carbohidratos en la dieta, la expresión de la proteína SGLT1 determinada en biopsias intestinales se incrementó después de sólo 1 semana de administración de una dieta alta de carbohidratos, y su abundancia se incrementó más después de 1 y 2 meses de seguir esta dieta. Lechones que recibieron una dieta muy rica en carbohidratos durante 3 días experimentaron aumentos en la proteína SGLT1 y también aumentos en la absorción de glucosa [47].
Aunque no existen estudios directos en humanos, un gran número de estudios en animales sugieren que la evolución en el tiempo de los cambios en la expresión de SGLT1 es relativamente rápida. Varios estudios han observado cambios significativos después de sólo unos pocos días de variación de la dieta [17]. Por lo tanto, parece razonable sugerir que varios días de una ingesta alta de carbohidratos pueden aumentar el contenido de SGLT1 y la capacidad de absorber glucosa, pero una exposición más prolongada en la dieta podría producir mayores adaptaciones.
6 Regulación de la absorción en atletas
Un elegante estudio de Cox et al. [48] nos aportó las pistas mas importantes obtenidas hasta la fecha, de que la manipulación de la dieta puede producir una mejor entrega de carbohidratos durante el ejercicio. En este estudio, 16 ciclistas entrenados en resistencia fueron asignados a un grupo que consumió una dieta alta en carbohidratos o a un grupo control. Durante 28 días, ambos grupos se entrenaron (16 h/semana) y su rendimiento mejoró como resultado de este entrenamiento. Ambos grupos consumieron una dieta con un contenido moderado de carbohidratos (5 g/kg/día). El grupo con elevado contenido de carbohidratos consumió un suplemento adicional de 1,5 g/kg por hora de ejercicio realizado diariamente. El suplemento de carbohidratos fue aportado principalmente en forma de bebida de glucosa. Además, recibieron alimentos ricos en carbohidratos para satisfacer las demandas horarias de ejercicio. El grupo control también recibió un suplemento nutricional, pero éste estaba compuesto por alimentos ricos en grasas y proteínas con contenido limitado en carbohidratos. Los sujetos del grupo cuya dieta era alta en carbohidratos consumieron los suplementos antes, durante e inmediatamente después del ejercicio. Los ciclistas del grupo control consumieron su suplemento después del ejercicio. En promedio, el grupo que consumió el suplemento con carbohidratos tenía una ingesta de carbohidratos diarios de 8,5 g/kg, mientras que el grupo control consumía 5,3 g/kg/día.
Antes y después del período de entrenamiento de 28 días, todos los sujetos realizaron una prueba de ejercicio en donde consumieron una solución de carbohidratos al 10%. Se utilizaron marcadores isotópicos para medir la oxidación del carbohidrato exógeno. Se observó que la oxidación exógena de carbohidratos había mejorado después de la dieta suplementada con carbohidratos. La explicación más probable es el aumento en la capacidad de absorber carbohidratos como resultado de una regulación por incremento de los transportadores SGLT1. Los autores concluyeron que, para los atletas que compiten en eventos de resistencia, en donde los carbohidratos exógenos son una fuente de energía importante y hay una gran oportunidad para ingerir carbohidratos, podría ser beneficioso aplicar esta estrategia de mayor ingesta de carbohidratos [6, 7, 48].
Está claro que un aumento en la ingesta de carbohidratos en la dieta puede aumentar la abundancia y la actividad de los transportadores SGLT1 intestinales, y que esto da lugar a una mayor capacidad para absorber carbohidratos. Lo contrario también podría ser cierto. Con la restricción de carbohidratos a partir de la reducción de la ingesta de carbohidratos, o mediante dietas altas en grasas o incluso cetogénicas, o reduciendo la ingesta total de energía, la ingesta diaria de carbohidratos puede llegar a ser muy baja. Estudios en corderos han demostrado que a medida que la dieta varía de leche a hierba se produce el desarrollo del rumen, que es donde lo carbohidratos de la dieta se fermentan en ácidos grasos volátiles. La formación del rumen evita eficazmente la llegada de monosacáridos al intestino. Como resultado, hay una marcada disminución tanto en el contenido de proteínas SGLT1 del intestino, como en la capacidad del intestino delgado para absorber los carbohidratos [49, 50].
7 Problemas gastrointestinales
Los problemas GI son muy frecuentes entre los atletas, y 30-50% de todos los atletas experimentan estos problemas con regularidad [2]. Aun se desconocen las causas, pero estos problemas podrían estar en parte determinados genéticamente y serían altamente individuales [2]. Es probable que los mecanismos que producen los problemas del tracto GI superior e inferior sean diferentes. Los síntomas tienen una mayor probabilidad de manifestarse y son exacerbados por las condiciones climáticas calurosas y por la deshidratación [2].
Aunque no siempre se puede establecer un vínculo con la ingesta nutricional, se ha observado que ciertas prácticas se correlacionan con la incidencia de problemas GI: la ingesta de fibra, la ingesta de grasas y las soluciones altamente concentradas de carbohidratos parecen aumentar la prevalencia de problemas GI.
Probablemente existen varias razones para estos problemas, pero dos de las razones importantes y mas frecuentes son la sensación de plenitud estomacal por un menor vaciamiento gástrico durante ejercicios prolongados y la diarrea como resultado de los cambios osmóticos.
Se piensa que el entrenamiento del intestino puede aliviar algunos de estos síntomas, tal vez a través de la mejora del vaciamiento gástrico y la sensación de plenitud (reducción de la hinchazón), mejorando así la tolerancia frente a volúmenes mayores y aumentando la velocidad de absorción, lo que produce un menor volumen residual y menos cambios osmóticos [2].
8 Implicaciones prácticas y conclusiones
En la Figura 4, les presentamos un resumen de las implicaciones prácticas. Aunque se necesitan algunas extrapolaciones de estudios en animales, es probable que las adaptaciones en el intestino humano sean tan rápidas como lasque se observan en otros mamíferos. Esto significa que varios días y, ciertamente 2 semanas, de una dieta con alto contenido de carbohidratos pueden producir aumentos significativos en el contenido de SGLT1 de la luz intestinal. Sobre la base de datos obtenidos en animales, un aumento en el contenido de carbohidratos dietéticos del 40 al 70% podría provocar una duplicación de los transportadores SGLT1 en un período de 2 semanas.
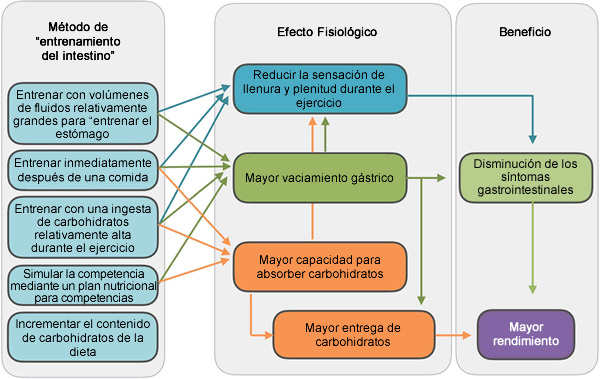
Figura 4. Resumen de los métodos disponibles para "entrenar el intestino", las adaptaciones que pueden producirse en el intestino y las implicaciones para el rendimiento
Además de una mayor capacidad de absorción, es esencial que una mayor ingesta de carbohidratos pueda ser tolerada y evacuada desde el estómago. Aunque generalmente se cree que el vaciamiento gástrico no es un factor limitante, es probable que una combinación de factores (por ejemplo, calor, alta ingesta de carbohidratos y ejercicio de alta intensidad, todos factores asociados a la inhibición del vaciamiento gástrico) actúen juntos, comprometiendo así el vaciamiento gástrico. Por lo tanto, es importante practicar una estrategia nutricional de competencia durante el entrenamiento para acostumbrarse a volúmenes más altos de ingesta o ingestas de carbohidratos más altas.
La mayoría de los atletas consumen una dieta moderada a alta en carbohidratos, por lo que se podría argumentar que los beneficios de aumentar aún más la ingesta de carbohidratos sólo serían pequeños. En la actualidad, no se conoce con detalle la relación entre la ingesta diaria de carbohidratos y la capacidad de transporte de glucosa en el intestino humano. Tal vez, el hecho de que hayamos observado poca variación en las tasas máximas de oxidación de carbohidratos exógenos en muchos años de investigación con cientos de participantes, sea un signo de que la dieta tiene efectos relativamente pequeños sobre la capacidad máxima de transporte de carbohidratos del intestino. El hecho de que la capacidad de transporte casi nunca haya superado los 60 g/h, incluso en individuos, puede ser una señal de que los aumentos no serían dramáticos. Por otro lado, investigaciones como el estudio de Cox et al. [48] sugieren que estos transportadores pueden ser regulados hacia el alza en un período de tiempo relativamente corto.
Aunque no se conoce la magnitud exacta de los efectos en los atletas que ya están consumiendo una dieta alta en carbohidratos, parece coherente concluir que los atletas que no están consumiendo una dieta alta en carbohidratos pueden beneficiarse sustancialmente. Cuando los atletas aplican restricción de carbohidratos porque están consumiendo una dieta baja en carbohidratos, alta en grasas o cetogénica; o están reduciendo la ingesta de energía para bajar de peso, la reducción de la carga diaria de carbohidratos probablemente reducirá la capacidad de absorber carbohidratos durante la competencia. Esto podría ser una de las razones por las que estos atletas anecdóticamente parecen reportar más problemas GI. A estos atletas les recomendaría que incluyeran algunos días con consumo elevado de carbohidrato en sus entrenamientos.
Las guías actuales recomiendan una ingesta de carbohidratos de hasta 60 g para un ejercicio de hasta 2 horas. Cuando el ejercicio tiene una duración mayor a 2 horas, se recomienda una cantidad ligeramente mayor de carbohidratos (90 g/h), y estos carbohidratos deben consistir en una mezcla de carbohidratos de transporte múltiple, por ejemplo, glucosa: fructosa o maltodextrina: fructosa. Para obtener una ingesta de carbohidratos de 90 g/h, los atletas podrían "mezclar y combinar" para poder adecuarse a sus preferencias personales y tener en cuenta su tolerancia [6, 7]. Dado que el intestino es tan adaptable, parece prudente incluir entrenamientos con alto consumo de carbohidratos en la rutina semanal e ingerir regularmente carbohidratos durante el ejercicio. Con estas estrategias, el intestino puede ser entrenado para absorber y oxidar más carbohidratos, lo que a su vez debería provocar menos malestar gastrointestinal y un mejor rendimiento.
Agradecimientos Este artículo fue publicado en un suplemento financiado por Gatorade Sports Science Institute (GSSI), una división de PepsiCo. El suplemento fue editado por Lawrence L. Spriet, quien asistió a una reunión del panel de expertos del GSSI en noviembre de 2015 y cobró honorarios del GSSI por su participación en la reunión. No recibió honorarios por la revisión del suplemento como invitado. El Dr. Spriet seleccionó a revisores idóneos para cada artículo y supervisó el proceso. El Dr. Asker Jeukendrup asistió a una reunión del panel de expertos del GSSI en noviembre de 2015 y recibió honorarios del GSSI por su participación en la reunión y por la redacción de este manuscrito. Las opiniones expresadas en este manuscrito son las del autor y no necesariamente reflejan la posición o política de PepsiCo, Inc.
Referencias
1. Jeukendrup A.E. (2011). Nutrition and endurance sports: running, cycling, triathlon. J. Sports Sci.29:S91–9.
2. de Oliveira E.P., Burini R.C., Jeukendrup A. (2014). Gastrointestinal complaints during exercise: prevalence, etiology, and nutritional recommendations. Sports Med.44:S79–85.
3. Jeukendrup A.E., McLaughlin J. (2011). Carbohydrate ingestion during exercise: effects on performance, training adaptations and train-ability of the gut. Nestle Nutr. Inst. Workshop Ser.;69:1–12 discussion 3–7.
4. Neufer P.D., Young A.J., Sawka M.N. (1989). Gastric emptying during exercise: effects of heat stress and hypohydration. Eur. J. Appl. Physiol. Occup. Physiol.58:433–9.
5. Rehrer N.J., Beckers E.J., Brouns F., et al. (1990). Effects of dehydration on gastric emptying and gastrointestinal distress while running. Med. Sci. Sports Exerc.22:790–5.
6. Jeukendrup A. (2013). The new carbohydrate intake recommendations. Nestle Nutr. Inst. Workshop Ser. 75:63–71.
7. Jeukendrup A. (2014). A step towards personalized sports nutrition: carbohydrate intake during exercise. Sports Med. 44:S25–33.
8. Lambert G.P., Lang J., Bull A., et al. (2008). Fluid tolerance while running: effect of repeated trials. Int. J. Sports Med.29:878–82.
9. Cunningham K.M., Horowitz M., Read N.W. (1991). The effect of short-term dietary supplementation with glucose on gastric emptying in humans. Br. J. Nutr.65:15–9.
10. Horowitz M., Cunningham K.M., Wishart J.M., et al. (1996). The effect of short-term dietary supplementation with glucose on gastric emptying of glucose and fructose and oral glucose tolerance in normal subjects. Diabetologia.39:481–6.
11. Yau A.M., McLaughlin J., Maughan R.J., et al. (2014). Short-term dietary supplementation with fructose accelerates gastric emptying of a fructose but not a glucose solution. Nutrition. 30:1344–8.
12. Cunningham K.M., Daly J., Horowitz M., et al. (1991). Gastrointestinal adaptation to diets of differing fat composition in human volunteers. Gut.32:483–6.
13. Castiglione K.E., Read N.W., French S.J. (2002). Adaptation to high-fat diet accelerates emptying of fat but not carbohydrate test meals in humans. Am. J. Physiol.282:R366–71.
14. Kellett G.L. (2001). The facilitated component of intestinal glucose absorption. J. Physiol.531:585–95.
15. Kellett G.L., Brot-Laroche E., Mace O.J., et al. (2008). Sugar absorption in the intestine: the role of GLUT2. Annu. Rev. Nutr.;28:35-54.
16. Dobbins R.L., Greenway F.L., Chen L., et al. (2015). Selective sodium-dependent glucose transporter 1 inhibitors block glucose absorption and impair glucose-dependent insulinotropic peptide release. Am. J. Physiol. 308:G946-54.
17. Margolskee R.F., Dyer J., Kokrashvili Z., et al. (2007). T1R3 and gustducin in gut sense sugars to regulate expression of Na+-glucose cotransporter 1. Proc. Nati. Acad. Sci. USA. 104:15075-80.
18. Dyer J., Al-Rammahi M., Waterfall L., et al. (2009). Adaptive response of equine intestinal Na+/glucose co-transporter (SGLT1) to an increase in dietary soluble carbohydrate. Pflugers. Arch. 458:419-30.
19. Takata K., Kasahara T., Kasahara M., et al. (1992). Immunohistochemical localization of Na(+)-dependent glucose transporter in rat jejunum. Cell Tissue Res.267:3-9.
20. Batchelor D.J., Al-Rammahi M., Moran A.W., et al. (2011). Sodium/glucose cotransporter-1, sweet receptor, and disaccharidase expression in the intestine of the domestic dog and cat: two species of different dietary habit. Am. J. Physiol. 300:R67-75.
21. Moran A.W., Al-Rammahi M.A., Arora D.K., et al. (2010). Expression of Na+/glucose co-transporter 1 (SGLT1) is enhanced by supple-mentation of the diet of weaning piglets with artificial sweeteners. Br. J. Nutr. 104:637-6.
22. Balen D., Ljubojevic M., Breljak D., et al. (2008). Revised immunolocal-ization of the Na+-D-glucose cotransporter SGLT1 in rat organs with an improved antibody. Am. J. Physiol.295:C475-89.
23. Kishi K., Takase S., Goda T. (1999). Enhancement of sucrase-isomaltase gene expression induced by luminally administered fructose in rat jejunum. J. Nutr. Biochem.10:8-12.
24. Shirazi-Beechey S.P., Moran A.W., Batchelor D.J., et al. (2011). Glucose sensing and signalling; regulation of intestinal glucose transport. Proc. Nutr. Soc.70:185-93.
25. Jentjens R.L., Jeukendrup A.E. (2005). High rates of exogenous carbohydrate oxidation from a mixture of glucose and fructose ingested during prolonged cycling exercise. Br. J. Nutr.93:485-92.
26. Jeukendrup A.E. (1999). Possible links between nutrition and overtraining. Vlaams Tijdschrift voor Sportgeneeskunde.80:37-45.
27. Achten J., Halson S.L., Moseley L., et al. (2004). Higher dietary carbohydrate content during intensified running training results in better maintenance of performance and mood state. J. Appl. Physiol.96:1331-40.
28. Jentjens R.L., Achten J., Jeukendrup A.E. (2004). High oxidation rates from combined carbohydrates ingested during exercise. Med. Sci. Sports Exerc.36:1551-8.
29. Pfeiffer B., Stellingwerff T., Zaltas E., et al. (2010). Oxidation of solid versus liquid carbohydrate sources during exercise. Med. Sci. Sports Exerc.42(ll):2030-7.
30. Vandenbogaerde T.J., Hopkins W.G (2011). Effects of acute carbohydrate supplementation on endurance performance: a meta-analysis. Sports Med.41:773-92.
31. Smith J.W., Zachwieja J.J., Peronnet F., et al. (2010). Fuel selection and cycling endurance performance with ingestión of [13C]glucose: evidence for a carbohydrate dose response. J. Appl. Physiol.108:1520-9.
32. Smith J.W., Pascoe D.D., Passe D.H., et al. (2013). Curvilinear dose-response relationship of carbohydrate (0-120 g h(-l)) and performance. Med. Sci. Sports Exerc.45:336^H.
33. Shi X., Summers R.W., Schedl H.P., et al. (1995). Effects of carbohydrate type and concentration and solution osmolality on water absorption. Med. Sci. Sports Exerc. 27:1607-15.
34. Jeukendrup A.E., Moseley L. (2010). Multiple transportable carbohydrates enhance gastric emptying and fluid delivery. Scand. J. Med. Sci. Sports. 20:112-21.
35. Kleinzeller A., Kotyk A. (eds.). (1961). Membrane Transport and Metabolism. Prague: Academy of Sciences; 1961.
36. Hosang M., Gibbs E.M., Diedrich D.F., et al. (1981). Photoaffinity labeling and identification of (a component of) the small-intestinal Na?, D-glucose transporter using 4-azidophlorizin. FEBS Lett.;130:244–8.
37. Ginsburg J.M., Heggeness F.W. (1968). Adaptation in monosaccharide absorption in infant and adult rats. J. Nutr.96:494–8.
38. Karasov W.H., Pond R.S 3rd, Solberg D.H., et al. (1983). Regulation of proline and glucose transport in mouse intestine by dietary sub-strate levels. Proc. Natl. Acad.Sci. USA.80:7674–7.
39. Deren J.J., Broitman S.A., Zamcheck N. (1967). Effect of diet upon intestinal disaccharidases and disaccharide absorption. J. Clin. Invest. 46:186–95.
40. Ferraris R.P., Villenas S.A., Hirayama B.A., et al. (1992). Effect of diet on glucose transporter site density along the intestinal crypt-villus axis. Am. J. Physiol. 262:G1060–8.
41. Dyer J., Vayro S., King T.P., et al. (2003). Glucose sensing in the intestinal epithelium. Eur. J. Biochem. 270:3377–88.
42. Bindslev N., Hirayama B.A., Wright E.M. (1997). Na/D-glucose cotransport and SGLT1 expression in hen colon correlates with dietary Na?. Comp. Biochem. Physiol. A. Physiol.118:219–27.
43. Ferraris R.P. (2001). Dietary and developmental regulation of intestinal sugar transport. Biochem. J.360:265–76.
44. Dyer J., Daly K., Salmon K.S., et al. (2007). Intestinal glucose sensing and regulation of intestinal glucose absorption. Biochem. Soc. Trans.35:1191–4.
45. Snook L.A., Nelson E.M., Dyck D.J., et al. (2015). Glucose-dependent insulinotropic polypeptide directly induces glucose transport in rat skeletal muscle. Am. J. Physiol.309:R295–303.
46. Coon S.D., Schwartz J.H., Rajendran V.M., et al. (2013). Glucose-dependent insulinotropic polypeptide regulates dipeptide absorption in mouse jejunum. Am. J. Physiol.305:G678–84.
47. Moran A.W., Al-Rammahi M.A., Arora D.K., et al. (2010). Expression of Na?/glucose co-transporter 1 (SGLT1) in the intestine of piglets weaned to different concentrations of dietary carbohydrate. Br. J. Nutr. 104:647–55.
48. Cox G.R., Clark S.A., Cox A.J., et al. (2010). Daily training with high carbohydrate availability increases exogenous carbohydrate oxida-tion during endurance cycling. J. Appl. Physiol.109:126–34.
49. Shirazi-Beechey S.P., Hirayama B.A., Wang Y., et al. (1991). Ontogenic development of lamb intestinal sodium-glucose co-transporter is regulated by diet. J. Physiol.437:699–708.
50. Dyer J., Barker P.J., Shirazi-Beechey S.P. (1997). Nutrient regulation of the intestinal Na?/glucose co-transporter (SGLT1) gene expression. Biochem. Biophys. Res. Commun.230:624–9.
51. Jeukendrup A.E. (2010). Carbohydrate and exercise performance: the role of multiple transportable carbohydrates. Curr. Opin. Clin. Nutr. Metab. Care.13:452–7.
52. Jeukendrup A.E., Jentjens R. (2000). Oxidation of carbohydrate feedings during prolonged exercise: current thoughts, guidelines and directions for future research. Sports Med. 29:407–24.
Cita Original
Asker E. Jeukendrup.(2017). Training the Gut for Athletes. Sports Med. DOI 10.1007/s40279-017-0690-6
Cita en PubliCE
Asker E. Jeukendrup (2017). Entrenamiento del Intestino para Atletas. .https://g-se.com/entrenamiento-del-intestino-para-atletas-2318-sa-r59bad8c999c43
